- Учителю
- Фосфор және оның қосылыстары ашық сабақ
Фосфор және оның қосылыстары ашық сабақ
Әуезов орта мектебі
Фосфор және оның қосылыстары
/ашық сабақ/
Химия пәні мұғалімі: Досмагамбетова Г
2013-2014оқу жылы
Сабақтың тақырыбы: Фосфор және оның қосылыстары
Сабақтың мақсаты:
Білімділік: Фосфор, оның периодтық жүйедегі орнына сипаттама
беру, ашылу тарихымен таныстыру, физикалық, хи-
миялық қасиеттері, қолданылуы жайлы айту.
Дамытушылық: Оқушыларды бағыт-бағдар бере отырып,өз бетінше
жұмыс жүргізе білуге үйрету, сөздік қорын молайту.
Тәрбиелік: Оқушыларға салауаттылық тәрбие беру, фосфордың
адам ағзасы үшін маңызын айту.
Көрнекілігі: Д.И.Менделеевтің периодтық жүйесі, интерактивті тақта.
Сабақтың әдісі: сұрақ-жауап, ізденіс, есеп шығару
Сабақтың барысы:
Ұйымдастыру кезеңі: Сәлемдесу, оқушыларды түгендеу, назар-
ларын сабаққа аудару.
Үй тапсырмасы:
ТОЛЫҚТЫРУ ТЕСТІ.
Таза азот -------, иіссіз --------.
------- өткір иісті тұншықтырғыш газ.
Азот ( IV) оксиді өткір иісті тұншықтырғыш, ------------ түсті, ------- газ.
Азот қышқылы түссіз , өзіне тән иісі бар ---------.
Азот ( II) оксиді түссіз, ------- өте аз еритін ------.
Керекті сөздер: газ, улы, аммиак, газ, сұйықтық, суда, қоңыр, түссіз.
СӘЙКЕСТЕНДІРУ ТЕСТІ.
Аммиак - а) HNO3
Азот ( IV) оксиді - ә) NH4Cl
Азот қышқылы - б)NaNO3
Аммоний гидроксиді - в) NH3
Натрий нитраты - г) NH4OH
Аммоний хлориді - д) NO2
Жаңа сабақ:
Фосфордың соңғы энергетикалық қабатында бес электрон бар, оның үшеуі жұптаспаған. Фосфор атомындағы электрондардың орналасуы:
Электрондық формуласы:1s22s22р63s23p3Фосфор косылыстарында -3, +3, +5 тотығу дөрежесін көрсетеді. Фосфордың үшқыш сутекті қосылысы фосфин РН3 мен аммиак NH3 молекулалары формасы жағынан ұқсас болғанмен, фосфин молекуласы берік емес, улы, түраксыз газ, тез тотығып кетеді. Фосфордың соңғы энергетикалық қабатында бес электрон бар, оның үшеуі жұптаспаған. Фосфор атомындағы электрондардың орналасуы:
Фосфор элементі жай зат ретінде бірнеше аллотропиялық түр өзгерісін түзеді. Оның маңыздылары - ақ және қызыл фосфор. Ақ фосфор улы жөне тез тұтанатын болғандықтан аса ұқыптылықты қажет етеді. Оның буымен демалуға болмайды. Ақ фосфорды шыны ыдыста, су астында, сыртынан құм салынған металл банкаға орналастырып сақтайды. Ақ фосфор ауасыз кеңістікте қыздырғанда қызыл фосфорға, ал жоғары қысымда к,қара фосфорға айналады. Қара фосфор аз кездеседі ақ жөне қызыл фосфордың қасиеттері салыстырмалы түрде берілген. Ақ түсті кристалл зат ρ=1,83г/см3
Қараңғыда жарқырайды
Кәдімгі жағдайда тотығады
От алғыш, су астында сақтайды
Суда ерімейді, CS2 ериді
Өте қауіпті, улы
t қай=280°С, tб=44°САморфты зат ρ=2,20г/см3
Қараңғыда жарқырамайды
260°С-та тотығады
Отқа қауіпті емес, қыздырғанда от алады
Судада, CS2 де ерімейді
Улы емес
tб=400°СҚара түсті, металдық жылтыры бар, кристалл зат
Сирек кездеседХимиялық қасиеттері жай және күрделі заттармен әрекеттеседі.
</ Фосфордың қолданылуы
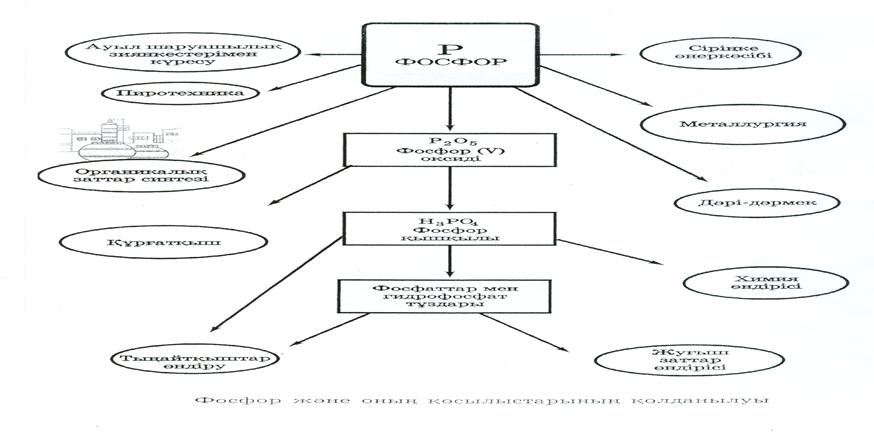
Сабақтың бекіту сұрақтары:
___ + ___ = 2 Р2 О5
___ + ___ = Cа3Р2
___ + ___ = РСІ5
___ + ___ = РН3
№7 есеп
Массасы 34,5 г бертолле тұзы фосфордың қанша зат мөлшерімен әрекеттесе алады?
Бер: Шешуі:
m(КСІО3) =34.5 г
т\к: ν ( Р) - ?
Үйге тапсырма:
&9 №5,10,13
Бағалау