- Учителю
- Нетрадиционный урок по теме Теория электролитической диссоциации
Нетрадиционный урок по теме Теория электролитической диссоциации
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ
ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ г. МЦЕНСКА
«ЛИЦЕЙ №5»
VII класс
Учитель Булгакова
Ирина Леонидовна
2016 год
Теория электролитической диссоциации
(урок на основе проблемно-исследовательской технологии)
Тип урока: Изучение нового материала
Вид урока: Проблемно-исследовательский с использованием игровой технологии
Смысл нельзя дать, его нужно найти.
В. Франкл (австрийский психолог)
Подготовительный этап: класс делится на группы, в каждой из которой выбирается главный редактор, редактор, корректор, научный консультант, химик- исследователь, художник оформитель.
Каждой группе выдается макет научно - популярной брошюры, которую группа должна создать, набор печатных картинок по теме исследования, набор реактивов, клей, ножницы.
Ребята, скажите, бывало ли у вас такое: вроде и хочется написать книгу, а с чего начинать - непонятно? Или, может, вы начинали писать книгу, но потом просто терялись и не знали, что дальше? Прежде, чем начать писать книгу, вам понадобится идея. Она - это, знаете, как зернышко, из которого вырастет дерево вашей книги. Да, придумать ее сложно, но если открыть себя новым впечатлениям, то идей у вас будет много - только выбирай!
Идеи для начала работы над книгой бывают разные. Не важно, сколь трудно будет в начале - любую идею можно превратить в прекрасную книгу. Я предлагаю вам сегодня написать научно -популярную брошюру по теме «Теория электролитической диссоциации». Она пригодится и вам при подготовке к контрольной работе, а самое главное она очень нужна девятиклассникам, которые в этом году будут сдавать основной государственный экзамен по химии.
Так как наша брошюра будет носить научный характер, то в вашу редакторскую группу входят и химик - исследователь, и научный руководитель.
Советы:
-
Не стесняйтесь обращаться за помощью - всегда полезно узнать, что думают о книге посторонние, особенно если вы сами не можете сказать, что получилось хорошо, а что - так себе.
-
Не придумывайте название до тех пор, пока не закончите. Самый лучший вариант придет вам в голову, скорее всего, уже по завершению работы.
-
Всегда держите под рукой что-то, чем можно записать внезапно посетившую вас отличную мысль. Помните, озарение может случиться где угодно и когда угодно!
-
Лучше всего читаются и запоминаются научно -популярные брошюры объёмом 7-10 листов.
Итак, дерзайте! Вы талантливы!
МБОУ г. Мценска «Лицей № 5»
Смысл нельзя дать, его нужно найти.
В. Франкл (австрийский психолог)
Мы изучаем химию- науку о превращениях веществ. Наблюдали и самостоятельно проделывали много химических экспериментов. И нас заинтересовал вопрос: «Почему__________________________________
____________________________________________________________________________________________
_____________________________________________________________________________________________
Гипотеза_____________________________________________________________________________________
_____________________________________________________________________________________________
_____________________________________________________________________________________________
Эксперимент 1. Рассмотрим процесс растворения кусочка сахара в воде
Наблюдения______________________________________________________________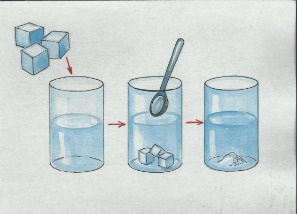
_________________________________________________________________________
_________________________________________________________________________
Эксперимент 2. Вам выданы два бюкса №1 -сульфат натрия кристаллический; бюкс № 2 - хлорид бария (кристаллический). Смешайте эти две кристаллические соли. Что наблюдаете? _____________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Почему?_____________________________________________________________________________________
_____________________________________________________________________________________________
Эксперимент 3. Смешайте растворы сульфата натрия и хлорида бария.
Что наблюдаете? ___________________________________________________________________________
__________________________________________________________________________________________
Почему?___________________________________________________________________________________
__________________________________________________________________________________________
Напишите уравнение проделанной реакции:
___________________________________________________________________________________________
Как вы думаете, можно ли и надо ли написать это уравнение по другому?____________________________
__________________________________________________________________________________________________________________________________________________________________________________________
Объясняет суть процессов, происходящих в растворах объясняет Теория электролитической диссоциации
Основные понятия: ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Авторы 


Иван Алексеевич Каблуков Сванте Аррениус Владимир Александрович Кистяковский
Д1 Электрическая проводимость дистиллированной воды
Что наблюдаете____________________________________________________________________________
Д2 Электрическая проводимость водопроводной воды
Что наблюдаете_____________________________________________________________________________
Почему?___________________________________________________________________________________
___________________________________________________________________________________________
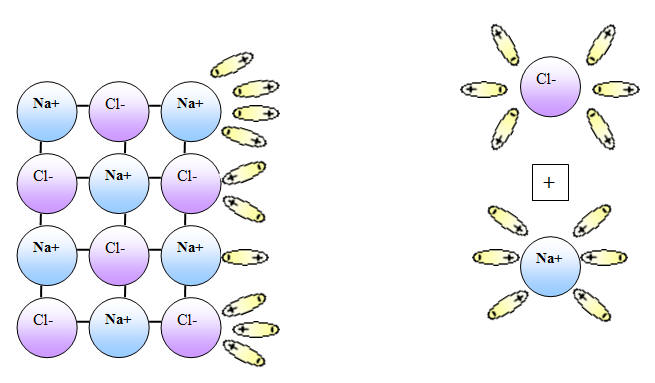
Д3 Электрическая проводимость кристаллической поваренной соли
Что наблюдаете?____________________________________________________________________________
Почему____________________________________________________________________________________
___________________________________________________________________________________________
Д3 Электрическая проводимость раствора поваренной соли
Что наблюдаете?_____________________________________________________________________________
Почему_____________________________________________________________________________________
__________________________________________________________________________________________
Вывод:____________________________________________________________________________________
____________________________________________________________________________________________
____________________________________________________________________________________________
Д4. Электрическая проводимость раствора кристаллического и раствора сахара
Что наблюдаете?______________________________________________________________________________
Почему?_____________________________________________________________________________________
_____________________________________________________________________________________________
Основные положения теории электролитической диссоциации
-
________________________________________________________________________________________________________________________________________________________________________
-
________________________________________________________________________________________________________________________________________________________________________________________________________________________________
-
________________________________________________________________________________________________________________________________________________________________________
Ещё немного о теории электролитической диссоциации
Глава2 . Справочник
-
Основные понятия
Это все вещества с ионным типом связи, а также с ковалентной
сильно полярной связью, которая легко превращается в ионную при
растворении в воде.
Это все растворимые соли, кислоты и основания (см таблицу растворимости)
Например: NaCI, HCI, NaOH
Неэлектролиты - это вещества, растворы или расплавы которых НЕ проводят электрический ток
Это все вещества с ковалентной неполярной или ковалентной связью, все органические вещества, все газы
Например: О2, NH3, CH4, N2
-
Основные положения теории
-
Электролиты в водном растворе или расплаве диссоциируют (распадаются) на ионы
NaCI ↔Na+ + CI-
HCI ↔ H+ + CI-
NaOH ↔ Na+ + OH-
-
Диссоциация - обратимый процесс (ионы вновь могут соединиться - ассоциация)
-
Ионы отличаются от атомов как по своему строению, так и по своим свойствам
Na0 2е; 8е; 1е натрий - очень активный металл, легко реагирует со многими простыми и сложными веществами
2Na + 2H2O =NaOH + H2
Na+ 2е; 8е; 0 е ион натрия имеет завершённую электронную оболочку, поэтому химически инертен
-
Сильные электролиты - практически полностью распадаются на ионы.
ЗАПОМНИ! Это - все щёлочи (растворимые в воде основания -см таблицу растворимости + Са(ОН)2) группа кислот - HNO3, H2SO4, HCI, HBr, HI, все растворимые соли.
-
Слабые электролиты - частично распадаются на ионы. Это H2S, H2CO3, H2SO3,HNO2, HF
-
Многоосновные кислоты диссоциируют ступенчато
H2SO4 ↔ H+ +HSO4- 1 ступень
HSO4-↔ H+ + SO4 2- 2 ступень
Авторский коллектив:
Главный редактор______________________
Редакторы_____________________________
______________________________________
______________________________________
Художник оформитель
______________________________________
Рецензент: Булгакова И.Л.
Приложение:
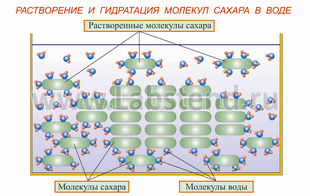
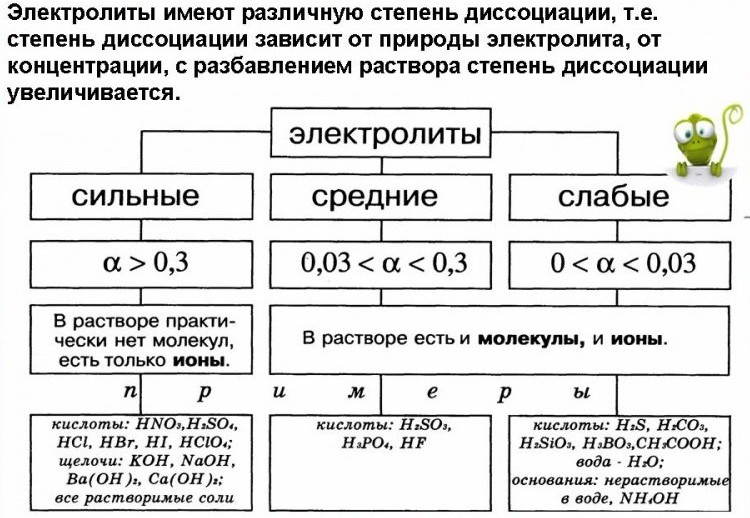

</<img src="/prepod/_bloks/pic/sgjczmq-009.jpg" align="bottom"
width="341" height="234" border="0" alt="Нетрадиционный урок по
теме Теория электролитической диссоциации">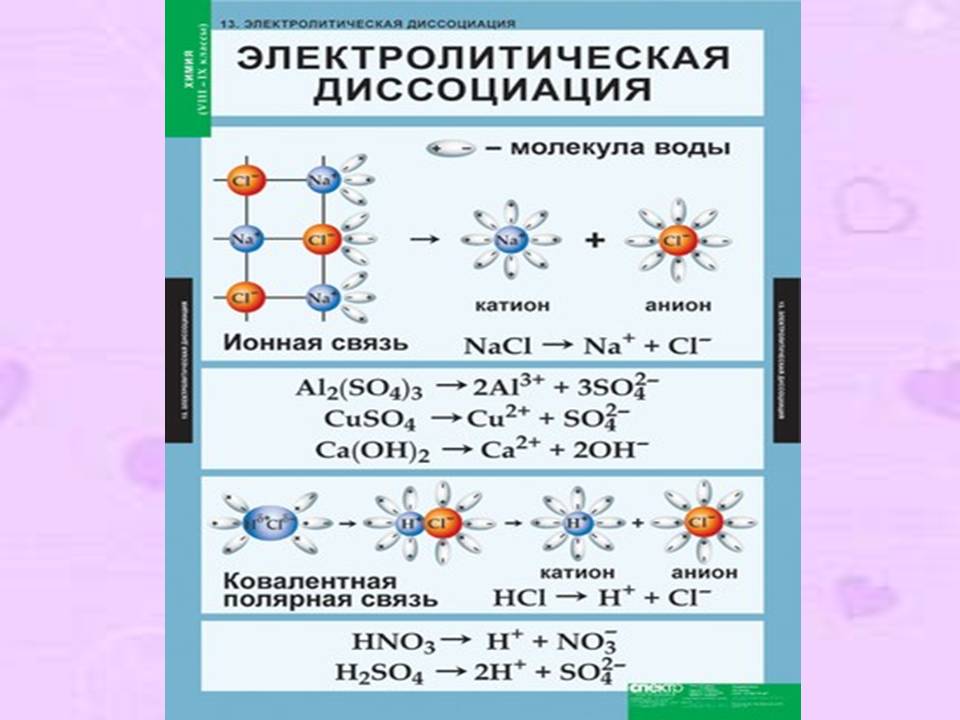

14