- Учителю
- План-конспект к уроку химии по теме: Оксиды 11 класс
План-конспект к уроку химии по теме: Оксиды 11 класс
Урок в 11 классе по теме: «Оксиды»
Цель урока:
Образовательные:
углубить, систематизировать, обобщить знания учащихся об
оксидах, способах их получения, свойствах и областях применения,
свойствах и областях применения, упражнять учащихся в выполнении
заданий ЕГЭ по химии по данной теме,
Развивающие:
развивать логическое мышление учащихся,
развивать умение анализировать, обобщать, делать выводы,
развивать правильно и последовательно излагать свои мысли,
Воспитательные:
создание комфортности присутствия на уроке,
воспитание эстетического отношения к предмету,
воспитание отстаивать свою точку зрения, подкрепляя ее имеющимися
или приобретенными знаниями
Оборудование: таблица «Оксиды», ПК с медиапроектором,
коллекция «Минералы», раздаточный материал - карточки с
заданиями;
лабораторное оборудование: спиртовка, спички, пробиркодержатель,
ложечка для сжигания веществ; вещества: медная проволока, этанол.
Ход урока
I. Организационный момент.
Сегодня на уроке рассмотрим свойства, классификацию, физические и химические свойства оксидов.
II. Изучение основного содержания:
1) Сообщение темы и цели урока.
-Сегодня на уроке рассмотрим свойства, классификацию, физические и химические свойства оксидов
1. Фронтальный опрос учащихся по вопросам:
- Вещества подразделяют на простые и сложные, укажите их
отличия?
- Перечислите классы неорганических соединений.
- Дайте определение понятию «Оксиды».
- Перечислите виды оксидов.
- Дайте определения понятий основных, кислотных, амфотерных
оксидов.
2. Классификация оксидов
</<font size="3">Классификация оксидов
Оксиды подразделяются на солеобразующие и несолеобразующие.
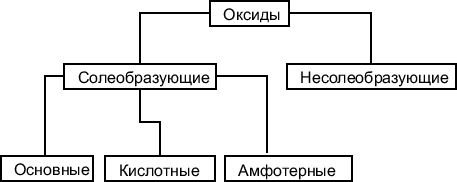
Солеобразующими называют такие оксиды, которые в результате химических реакций способны образовывать соли.
- Дайте определение понятию «Соли».
Несолеобразующие оксиды такой способностью не обладают. Примером
несолеобразующих оксидов могут служить следующие вещества: CO,
N2O, NO.
Солеобразующие оксиды, в свою очередь подразделяются на основные,
кислотные и амфотерные.
- Какие оксиды относят к основными ?
Основными оксидами называются такие оксиды, которым в качестве гидратов (продуктов присоединения воды) соответствуют основания.
Например: Основные оксиды Соответствующая гидратная
форма(основание)
Na2O → NaOH
BaO→ BaOH
СaO→ СaOH
- Дайте определение понятию «Основания».
- Какие элементы образуют основные оксиды?
Основные оксиды образуют металлы при проявлении ими невысокой валентности (обычно I или II).
Оксиды таких металлов, как Li,Na, K, Rb, Cs, Fr , Ca , Sr, Ba взаимодействуют с водой с образованием растворимых в воде оснований - щелочей. Другие основные оксиды непосредственно с водой не взаимодействуют, а соответствующие им основания получают из солей (косвенным путем).
- Какие оксиды относят к кислотными ?
Кислотными оксидами называются такие оксиды, которым в качестве
гидратов соответствуют кислоты. Кислотные оксиды называют также
ангидридами кислот.
Например: кислотные оксиды соответствующая гидратная форма (кислота)
SO3 → H2SO4
Р2О3→ H3РO4
СrО3→ H2CrO4
- Дайте определение понятию «Кислоты»
- Какие элементы образуют кислотные оксиды?
Кислотные оксиды образуют неметаллы и металлы при проявлений ими высокой валентности. Например, оксид марганца (VII) - кислотный оксид, так как в качестве гидрата ему соответствует кислота HMnO4 и это оксид металла с высокой валентностью.
Большинство кислотных оксидов могут взаимодействовать с водой непосредственно и при этом образовывать кислоты.
Например: СrО3 + H2O →
H2CrO4
Р2О3 + H2O →
H3РO4
SO3 + H2O → H2SO4
Некоторые оксиды непосредственно с водой не взаимодействуют. Такого типа оксиды сами могут быть получены из кислот. Например:
H2SiO3→ SiO2 + H2O
(температура)
Это подтверждает названия кислотных оксидов - ангидриды, то есть
"не содержащие воду".
Оксиды SO2 и CO2 реагирую с водой
обратимо: СО2 + H2O ↔
H2CO3
SО2 + H2O ↔
H2SO3
Это подтверждает названия кислотных оксидов - ангидриды, то есть "не содержащие воду".
- Назовите особенности амфотерных оксидов.
Амфотерные оксиды представляют собой оксиды, которые в зависимости от условий проявляют свойства как основных (в кислой среде), так и кислотных (в щелочной среде) оксидов.
- Какие элементы образуют амфотерные оксиды?
К амфотерным оксидам относятся только оксиды некоторых металлов.
Например: BeO, Al2O3, PbO, SnO, ZnO, PbO2, SnO2, Сr2О3
PbO + 2HNO3→ Pb(NO3)2 + H2O
а) В кислой среде PbO (оксид свинца (II)) проявляет свойства
основного оксида
б) в щелочной среде PbO проявляет свойства кислотного оксида.
t
PbO + 2NaOHтв → Na2PbO2 +
H2O
Амфотерные оксиды с водой непосредственно не взаимодействуют, следовательно, их гидратные формы получают косвенно - из солей. Несолеобразующие (индифферентные) оксиды - небольшая группа оксидов, не вступающая в химические реакции с образованием солей. К ним относятся: CO, N2O, NO , SiO2.
2. Получение оксидов.
- Назовите способы получения оксидов
1) окисление металлов: 2Cu + O2 = 2CuO
оксид меди (II) черный налет
Демонстрационный опыт - окисление меди кислородом в пламени
спиртовки
2) окисление неметаллов: C + O2 = CO2
оксид углерода (IV)
3) разложение кислот: Н2SО4 =
SО2 + Н2О
оксид серы (IV)
4) разложение солей: CaCО3 = CaО + CО2
оксид кальция (II)
5) разложение оснований: Fe(ОН)2 = FeО +
Н2О
оксид железа (II)
7) горение сложных веществ: C2H5OH +
3О2 → 2CО2 + 3Н2О
Демонстрационный опыт - горение C2H5OH
(этанол) в ложечке для сжигания веществ
3. Химические свойства оксидов.
1) Основные оксиды.
а) взаимодействие с кислотами: BaO + 2HCl = BaCl2 + H2O
оксид бария (II)
б) взаимодействие с водой: MgO + H2O =
Mg(OH)2
оксид магния (II)
в) взаимодействие с кислотным оксидом: CaO + CO2 =
CaCO3
оксид кальция (II)
г) взаимодействие с амфотерным оксидом: Na2O + ZnO =
Na2ZnO2
цинкат натрия
2) Кислотные оксиды.
а) взаимодействие с водой: SO3 + H2O =
H2SO4
оксид серы (VI)
б) взаимодействие с основанием: Ca(OH)2 + CO2
= CaCO3 + H2O
гидроксид кальция (II)
в) взаимодействие с основным оксидом: CO2 + CaO =
CaCO3
карбонат кальция
3) Амфотерные оксиды.
а) взаимодействие с кислотами: ZnO + 2HCl = ZnCl2 +
H2O
хлорид цинка
б) взаимодействие с основаниями: ZnO + 2NaOH =
Na2ZnO2 + H2O
гидроксид натрия
4. Применение оксидов:
Сообщения учащихся:
Fe2O3 - оксид железа (III) -
темно-красного цвета - гематит или красный железняк - для
изготовления красок.
Fe3O4 - оксид железа (II, III) - минерал
магнетит или магнитный железняк, хороший проводник электричества -
для получения и изготовления электродов.
CaO - оксид кальция (II) - порошок белого цвета - «негашеная»
известь, используют в строительстве.
Al2O3 - оксид алюминия (III) - минерал
твердый корунд - как полирующее средство.
SO2 - оксид серы (IV) или сернистый газ - бесцветный
газ, имеющий удушливый запах, убивает микроорганизмы, плесневые
грибки - окуривают подвалы, погреба, при перевозке и хранении
фруктов и ягод.
CO2 - оксид углерода (IV), углекислый газ. Твердый оксид
углерода - сухой лед. Для изготовления соды, сахара, газированных
напитков, в жидком виде в огнетушителях.
SiO2 - оксид кремния (IV) - твердое, тугоплавкое
вещество в природе в двух видах:
1) кристаллический кремнезем - в виде минерала кварца и его
разновидностей: горный хрусталь, халцедон, агат, яшма, кремень -
используют в силикатной промышленности, строительстве.
2) аморфный кремнезем SiO2 ∙ nH2O - минерал
опал.
Применяют соединения оксида кремния в ювелирном деле, изготовлении
химической посуды, кварцевых ламп.
Для создания цветных стекол используют следующие оксиды:
Cо2O3 - синий цвет ,
Cr2O3 - зеленый цвет, MnO2 -
розовый цвет.
5. Закрепление. Выполнение теста. (Приложение № 1)
IV. Домашнее задание:
1И.И. Новошинский, Н.С. Новошинская «Химия» (базовый уровень),
Глава VI, §22
2. Закончите уравнения химических реакций, дайте название
веществам:
а) P + O2 →
б) Al + O2 →
в) H2SO4 + Fe2O3 →
г) BaO + HCl →
д) C2H4 + O2 →
V. Закрепление:
По вопросам основного содержания:
1. Основные способы получения оксидов.
2. Химические свойства:
- основных оксидов;
- кислотных оксидов;
- амфотерных оксидов.
3. Области применения оксидов.
Приложение №1.
Характерные химические свойства: оксидов: основных, амфотерных, кислотных.
Вариант 1.
1. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) вода и соляная кислота
2) кислород и оксид магния
3) вода и медь
4) оксид кальция и гидроксид натрия
Ответ: 4, т.к. оксид серы (VI) - кислотный, взаимодействует с основаниями, основными оксидами, водой.
2. Оксид углерода (IV) реагирует с каждым из двух веществ:
1) гидроксидом натрия и оксидом кальция
2) оксидом кальция и оксидом серы (IV)
3) кислородом и водой
4) хлоридом натрия и оксидом азота (IV)
Ответ: 1, т.к. оксид углерода (IV) - кислотный, взаимодействует с основаниями, основными оксидами, водой.
3. Оксид серы (IV) взаимодействует с
1) СО2 2) Н2О 3) Na2SO4 4) НС1
Ответ:,2. т.к. оксид серы (IV) - кислотный, взаимодействует с основаниями, основными оксидами, водой.
4. Формулы кислотного, основного, амфотерного оксидов, соответственно
1)MnO2, CO2, Al2O3 2)CaO, SO2, BeO 3)Mn2O7, CaO, ZnO 4) MnO, CuO, CO2
Ответ: 3,т.к. Mn2O7 - кислотный, CaO - основный, ZnO - амфотерный
5. Способны взаимодействовать между собой
1) SiO2 и Н2О 2) СО2 и H2SO4 3) CO2 и Са(ОН)2 4) Na2O и Са(ОН)2
Ответ: 3, CO2 - кислотный оксид, Са(ОН)2 -основание, кислотные оксиды взаимодействуют с основаниями
6. Ни с водой, ни с раствором гидроксида натрия не реагирует
1) SiО2 2) SO3 3) ВаО 4) NО
Ответ: 4,т.к. NО несолеобразующий
7. Реагирует с соляной кислотой, но не с водой, оксид
1) SiО2 2) N2O3 3) Na2О 4) Fе2Оз
Ответ: 4, т.к. Fе2Оз - амфотерный оксид с большим преобладанием основных свойств, взаимодействует с кислотами, не реагирует с водой (Fе(ОН)з - не растворим в воде).
8. Амфотерность оксида свинца (II) подтверждается его способностью
1) растворяться в кислотах
2) восстанавливаться водородом
3) реагировать с оксидом кальция
4) взаимодействовать как с кислотами, так и с щелочами
Ответ: 4; т.к. амфотерные оксиды могут взаимодействовать как с кислотами, так и с щелочами
9. Верны ли следующие суждения о свойствах оксидов алюминия и хрома (III)?
А. Эти оксиды проявляют амфотерные свойства.
Б. В результате взаимодействия этих оксидов с водой
получаются гидроксиды.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Ответ: 1, т.к. оксиды алюминия и хрома (III) проявляют амфотерные
10. Между собой взаимодействуют
1) СuО и FeO 2) СО2 и ВаО 3) Р2О5 и NO 4) СгО3 и SO3
Ответ: 2, т.к. СО2 - кислотный, а ВаО - основный
Характерные химические свойства: оксидов: основных, амфотерных, кислотных.
Вариант 2.
1. Реакция возможна между
1) Н2О и А12О3 2) СО и СаО 3) Р2О3 и SO2 4) Н2О и ВаО
Ответ: 4, т.к. ВаО - основный оксид, взаимодействует с водой.
2. И с раствором гидроксида натрия, и с соляной кислотой реагирует оксид
1) SiО2 2) Al2O3 3) СО2 4) MgO
Ответ: 2; т.к. взаимодействовать с щелочами и кислотами могут амфотерные оксиды, Al2O3 - амфотерный оксид.
3. Реакция возможна между
1) ВаО и NH3 2) А12О3 и Н2О 3) Р2О5 и НС1 4) MgO и SO3
Ответ: 4; т.к. MgO - основный оксид ,а SO3 - кислотный оксид.
4. Оксид натрия не взаимодействует с
1) Н2О 2) СО2 3) CaO 4) А12О3
Ответ: 3; т.к. оксид натрия основный и CaO основный.
5. Оксид углерода (IV) реагирует с каждым из двух веществ:
1) водой и оксидом кальция
2) кислородом и водой
3) сульфатом калия и гидроксидом натрия
4) оксидом кремния (IV) и водородом
Ответ: 1; т.к. оксид углерода (IV) - кислотный, реагирует с водой, основаниями, основными оксидами. Оксид кальция - основный
6. Основные свойства наиболее выражены у оксида, формула которого
1) Fe2O3 2) FeO 3) Cr2O3 4) СrО3
Ответ: 2; т.к. Fe2O3 и Cr2O3 - амфотерные, а СrО3 - кислотный.
7. Какие из двух оксидов могут взаимодействовать между собой?
1) СаО и СrО 2) СаО и NO 3) К2O и СО2 4) SiO2 и SO2
Ответ: 3; т.к. К2O - основный ,а СО2 - кислотный оксид
8. Оксид фосфора (V)
1) не проявляет кислотно-основных свойств
2) проявляет только основные свойства
3) проявляет только кислотные свойства
4) проявляет как основные, так и кислотные свойства
Ответ: 3; т.к. оксид фосфора (V) - кислотный.
9. Между собой взаимодействуют
1) SO3 и А12Оз 2) СО и ВаО 3) Р2О5 и SCl4 4) ВаО и SO2
Ответ: 1; т.к. SO3 - - кислотный оксид, а А12Оз - амфотерный.
10. Верны ли следующие суждения об оксидах цинка и алюминия?
А. В результате взаимодействия этих оксидов с водой
получаются гидроксиды.
Б. Эти оксиды взаимодействуют как с кислотами, так и со щелочами.
1) верно толь ко А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Ответ: 2; т.к. оксиды цинка и алюминия - амфотерные.