- Учителю
- Урок химии в 11 классе «Электролиз»
Урок химии в 11 классе «Электролиз»
МБОУ «Средняя общеобразовательная школа №15
города Новоалтайска Алтайского края»
Уроки химии в 11 классе по теме «Электролиз»
Прихожая Татьяна Владимировна,
учитель химии
14 марта 2014 г
Визитная карточка урока
Предмет
Химия
Класс
11
Тема
Электролиз
Тип урока
урок усвоения нового материала
Вид урока
проблемно-исследовательский
Цель урока
Создать условия для формирования у учащихся представления об электролизе водных растворов и расплавов электролитов через применение приемов «ситуации успеха» на уроке.
В результате изучения темы учащиеся научатся
-
определять процессы, происходящие на электродах, составлять суммарное уравнение реакции электролиза;
-
составлять окислительно-восстановительные процессы;
-
понимать практического значение электролиза в природе и жизни человека;
-
развивать мышление, делать логические выводы;
-
работать с таблицами, справочным материалом, дополнительной литературой, опорными схемами.
Методы обучения
-
репродуктивный, частично - поисковый;
-
словесные (рассказ, беседа),
-
наглядные (видеоопыт, слайды презентации).
Форма организации работы в классе
-
фронтальная, индивидуальная
Оборудование
Тесты, инструкция, физическая карта России, компьютер.
Урок химии. 11 класс. Электролиз.
Этап урока
Деятельность учителя
Деятельность ученика
Примечание
Организационный этап
Постановка проблема
Наш сегодняшний урок мне хотелось бы начать с античной легенды:
«Некий мастер, имя которого история не сохранила, принес римскому императору Тиберию, правившему в начале I века н.э., чашу из металла, напоминающего серебро, но только более легкого. Подарок стоил жизни изобретателю: Тиберий приказал казнить его, а мастерскую уничтожить, поскольку боялся, что новый металл может обесценить серебро императорской сокровищницы». Согласно рассказу Плиния Старшего, этот металл, похожий на серебро, был получен из «глинистой земли».
Но история не знает безвозвратных потерь. В 1827 году немецкий ученый Фридрих Вёлер получает несколько граммов, а через несколько лет уже несколько килограммов нового легкого, прочного, блестящего металла.
Но металл стоил также дорого, как серебро.
Французы изготовили из него кирасы охранникам императора и игрушки наследнику Его Величества.
В этом ларце находиться изделие из этого металла. Оно необходимо каждому из нас. Что же находиться в ларце? (Ответивший на вопрос ученик достает из ларца алюминиевую ложку.)
Кстати, в 1852 году это чайная ложечка весом 25 грамм стоила бы 30 долларов.
Ответы учащихся (алюминий)
Найдите, пожалуйста, на географической карте России центры получения алюминия.
Учащиеся называют города Волгоград и Красноярск.
Почему же именно в этих городах расположены крупнейшие заводы по производству алюминия?
Таким образом, мы пришли к выводу, что для получения алюминия необходимы значительные затраты электроэнергии.
Учащиеся констатируют факт расположения заводов по производству алюминия вблизи крупных электростанций.
Сегодня мы вторгаемся в область электрохимии и рассмотрим такое явление, как «электролиз».
Тема нашего урока «Электролиз». Откройте тетради и запишите тему урока.
Учащиеся записывают в тетрадях тему урока.
Что же называется электролизом? «электро» - электрический ток, «лизис» - разложение.
Делается вывод, что электролиз - это процесс, в результате которого происходит разложение вещества под действие постоянного электрического тока.
Этап усвоения новых знаний
Давайте обратимся к определению в учебнике на стр.217
Электролиз - это окислительно - восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролита.
Учащиеся работаю с учебником и записывают определение в тетрадь.
Исходя из определения понятия «электролиза», на какие вопросы мы сегодня постараемся ответить на уроке?
-
Что такое окислительно-восстановительный процесс?
-
Чем раствор электролита отличается от расплава?
-
Где применяется электролиз?
Учитель фиксирует вопросы на доске.
Изучение нового материала
Отрицательно заряженный электрод называется катод и условно обозначается К(-).
Положительно заряженный электрод называется анод и обозначается А(+).
В межэлектродном пространстве находится диссоциирующий на ионы электролит.
Катионы, заряженные положительно, перемещаются в сторону катода, а анионы, заряженные отрицательно, в сторону анода.
На катоде будет происходить электрохимическое восстановление катионов или молекул воды, а на аноде электрохимическое окисление анионов или молекул воды.
Учащиеся записывают определения в тетрадь («катод», «анод», процессы «восстановления» и «окисления»).
Для написания уравнения электролиза вам поможет инструкция, которая находится у вас на столах, а также в учебнике на стр.218.
Прочитайте, пожалуйста, внимательно инструкцию и ответьте на вопрос: От чего будут зависеть процессы, протекающие на электродах (катоде и аноде)?
Процесс на катоде зависит от положения металла в электрохимическом ряду напряжений.
Процесс на аноде зависит от материала анода и от природы аниона.
1. Если анод растворимый (железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза), то всегда идёт окисление металла анода.
2. Если анод нерастворимый, т.е. инертный (уголь, графит, платина, золото), то результаты зависят от анионов кислотных остатков.
Рассмотрим примеры электролиза раствора и расплава соли хлорида натрия.
Простейшим примером электролиза является электролиз расплава.
Под действием электрического поля катионы Na+ движутся к катоду и принимают от него электроны.
Na+ +e = Na0- процесс восстановления.
Анионы Cl - движутся к аноду и отдают электроны:
2Cl - - 2e = Cl20- процесс окисления.
Суммарная реакция:
2NaCl ====2Na + Cl2
На катоде выделяется металлический натрий, а на аноде - газообразный хлор.
А теперь разберем пример электролиза раствора хлорида натрия.
NaCl → Na+ + Cl -
K(-) Na+
2H2O -2e→ 2OH - + H2↑
A(+) 2Cl - - 2e→ Cl20
H2O
2H2O + 2Cl -→2OH - + H2 + Cl2
2Na+ + 2H2O + 2Cl -→2OH + H2 + Cl20 + 2Na+
2 NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
Чем электролиз расплава соли отличается от электролиза раствора?
В растворе соли кроме ионов металла и кислотного остатка присутствуют молекулы воды и ионы Н+ и ОН- - продукты диссоциации воды. Поэтому при рассмотрении реакций на электродах необходимо учитывать возможность участия молекул воды в этом электролизе.
Вывод:
Сущность электролиза состоит в том, что за счёт электрической энергии осуществляется химическая реакция, которая не может протекать самопроизвольно.
Предлагаю вам у доски написать катодные и анодные процессы электролиза раствора соли иодида калия, используя инструкцию.
Ученик у доски разбирает пример электролиза раствора соли иодида калия.
Подтвердим или опровергнем правильность нашего решения, просмотрев видеофрагмент.
Просмотр видеофрагмента
Подведение итогов
Проверим результативность нашей совместной работы.
Сейчас, предлагаю вам на выбор написать графический диктант или тест, тексты которых, вы видите на своих столах.
Обменяйтесь заданиями и проверим правильность ваших ответов.
Прошу поднять руку тех учеников, которые справились с заданием на «хорошо» и «отлично».
Ученики заполняют бланки заданий, обмениваются заполненными бланками, выставляют друг другу оценки по оценочной шкале:
-
5 правильных ответов - оценка «5»,
-
4 правильных ответов - оценка «4»,
-
3 правильных ответов - оценка «3».
На доске открывается шаблон с правильными ответами.
Домашнее задание
-
стр.217-222, упр.23
-
индивидуальные задания для учащихся, сдающих ЕГЭ по химии
-
подготовить сообщения «Применение электролиза» (по желанию)
Заключение
Ребята, я надеюсь, что в результате нашего урока, сегодня каждый из нас познал радость открытия, чувства взаимного обогащения друг друга.
А обмен информацией в ходе урока привёл к пониманию и познанию.
Фамилия, имя_______________________________________
Графический диктант
1
2
3
4
5
![]() ДА
ДА ![]() НЕТ
НЕТ
-
Электролиз можно считать окислительно-восстановительной реакцией, происходящей под воздействием электрического тока?
-
На катоде происходит процесс электрохимического окисления?
-
Катион Na + будет восстанавливаться на катоде в водном растворе?
-
Анион Cl - будет окисляться на аноде в водном растворе?
-
При электролизе раствора NaCl можно получить щелочь NaOH и газы H2 и Cl2.
-
без ошибок - оценка «5»
-
1 ошибка - оценка «4»
-
2, 3 ошибки - оценка «3»
Оценка: _______________
Фамилия, имя_______________________________________
Тест «Электролиз»
При выполнении теста необходимо установить соответствие между вопросом и ответом (1 B; 2 А, … . )
Вопрос
Ответ
1. Электролиз - это…
A. Медь
2. При электролизе раствора бромида меди (II) образуются…
Б. Кислород и серная кислота
3. При электролизе раствора сульфата меди (II) образуются на аноде …
В. Медь, бром
4. При электролизе раствора сульфата меди (II) образуются на катоде…
Г. Процесс, выделения на электродах веществ, связанный с окислительно- восстановительными реакциями
Ответ:
_________________________________
-
без ошибок - оценка «5»
-
1 ошибка - оценка «4»
-
2, 3 ошибки - оценка «3»
Оценка: _______________
Инструкция
Для определения результатов электролиза водных растворов существуют следующие правила:
Процесс на катоде не зависит от материала катода, а зависит от положения металла в электрохимическом ряду напряжений.
1. Если катион электролита находится в начале ряда напряжений (по Al включительно), то на катоде идёт процесс восстановления воды (выделяется Н2). Катионы металла не восстанавливаются, остаются в растворе.
2. Если катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла, и молекулы воды.
3. Если катион электролита находится в ряду напряжений после водорода, то на катоде идёт только процесс восстановления ионов металла.
4. Если в растворе находится смесь катионов разных металлов, то первым восстанавливается катион того металла, который имеет наибольшее алгебраическое значение электродного потенциала.
Катодные процессы в водных растворах солей.
Электрохимический ряд напряжений металлов
Li, K, Ca, Na, Mg, Al
Mn, Zn, Fe, Ni, Sn, Pb
H2
Cu, Hg, Ag, Pt, Au
![]() - не восстанавливается
- не восстанавливается
2Н2О + 2ē = Н2↑ + 2ОН‾
![]() + nē =
+ nē = ![]()
2Н2О + 2ē = Н2↑ + 2ОН‾
![]() + nē =
+ nē = ![]()
![]()
![]()
Процесс на аноде зависит от материала анода и от природы аниона.![]()
1. Если анод растворимый (железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза), то независимо от природы аниона всегда идёт окисление металла анода.
2. Если анод нерастворимый, т.е. инертный (уголь, графит, платина, золото), то:
А) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идёт процесс окисления аниона;
Б) при электролизе растворов солей оксокислот и фторидов на аноде идёт процесс окисления воды (выделяется кислород); анион не окисляется, остаётся в растворе. При электролизе растворов щелочей идёт окисление гидроксид-ионов
Анодные процессы в водных растворах.
Анод
Кислотный остаток ![]()
бескислородный
кислородсодержащий
Растворимый
Окисление металла анода
![]() - nē =
- nē = ![]()
анод раствор
Нерастворимый
Окисление аниона
(кроме фторидов)
![]() - mē =
- mē = ![]()
В щелочной среде:
4ОН‾ - 4ē = О2↑ + 2Н2О
В кислой, нейтральной средах:
2Н2О - 4ē = О2↑ + 4Н+
Анионы по их способности окисляться располагаются в следующем порядке:
![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() , SO
, SO![]() ,
, ![]() ,
, ![]() .
.
В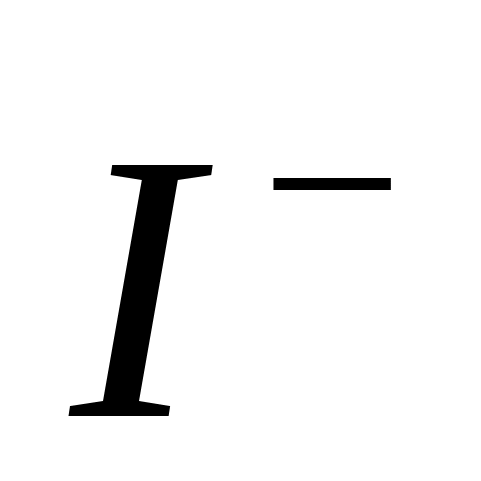 осстановительная активность уменьшается
осстановительная активность уменьшается
2