- Учителю
- Модульный урок по теме простые вещества - неметаллы
Модульный урок по теме простые вещества - неметаллы
</
Модульный урок по химии в 9 классе
по теме «Простые вещества - неметаллы»
УЭ -
учебный элемент;
Учебный материал с указанием заданий
Руководство по усвоению учебного материала
УЭ -0
Интегрирующая дидактическая цель модуля:
-
рассмотреть положение неметаллов в системе элементов Д.И. Менделеева;
-
познакомить с основными физическими свойствами неметаллов, выяснить, чем они обусловлены;
-
выяснить, чем атомы неметаллов отличаются от атомов металлов;
-
познакомиться с получением и применением неметаллов;
-
развить учебные навыки работы с текстом, с химическими веществами и оборудованием; развить творческие способности школьников и желание продолжить самостоятельную работу; формировать универсальные учебные действия: наблюдать, сравнивать, рассуждать, анализировать, обобщать и делать выводы.
-
обучать учащихся самостоятельности при получении знаний; выработке собственного мнения; умения работать в парах, быть внимательным к себе и к окружающим.
-
профилактика умственного перенапряжения путем смены видов деятельности.
УЭ -1
Оргмомент.
Добрый день, мои юные исследователи! Я рада видеть ваши умные и любознательные лица! Сегодня у нас с вами не совсем обычная работа и я немного волнуюсь: всё ли из задуманного мы сможем осуществить. Поэтому мы должны работать слаженно, как единый организм. Итак, начинаем…
Послушайте притчу:
«Один начинающий волшебник, герой шуточной песенки, неумело обращался с заклинаниями, в результате вместо грозы у него получилась коза, а вместо утюга - слон». Умение правильно видеть и слышать - первый шаг к мудрости. Хочется, чтобы сегодня вы показали, насколько вы мудры. Я думаю, что никому не хочется оказаться на месте волшебника.
Определение темы и целей урока:
Вы, наверное, уже обратили внимание, что на столах присутствует коллекция веществ.
- Посмотрите на коллекцию и определите - что это? (Неметаллы)
- Почему вы так решили? (перечисляют физические свойства)
- Какую же тему мы сегодня начнем изучать?
Правильно, сегодня мы с вами будем говорить о неметаллах.
- А зачем нужно и важно изучать неметаллы?
- Что называется неметаллом?
- А что вы уже знаете о неметаллах из курса 8 класса?
- Зачем же мы опять изучаем неметаллы?
(углубление и расширение знаний).
Обратите внимание на цель нашего урока.
- Какие вопросы мы должны сегодня рассмотреть?
Запишите число и тему урока «Простые вещества - неметаллы».
Это первый урок по неметаллам.
Номенклатура для подготовки к ГИА:
неметаллы,
химическая связь, ковалентная связь, окислитель, восстановитель,
группа, период,
физические свойства, простые вещества,
Откройте словари Даля или Ожегова, найдите определение «неметаллы».
УЭ- 2
Положение в ПСХЭ, строение электронной оболочки.
Цель:
1)определить исходный уровень знаний о неметаллах
2) выяснить, чем атомы неметаллов отличаются от атомов металлов,
3) выяснить положение неметаллов в ПСХЭ,
-
Самостоятельная работа.
Из списка веществ выпишите в первый столбик сложные вещества, а во второй - простые:
O2, H2O, KMnO4, Mg, Mg(OH)2, MgO, H2, K, Mn, O3.
- К какой группе веществ относятся неметаллы?
(к группе простых веществ).
- Какие вещества называются простыми?
-
Работа с периодической системой химических элементов и учебником
Внимание!
- Определите, где расположены в ПСХЭ металлы, а где неметаллы.
(Если провести диагональ от элемента бора В (порядковый номер 5) до элемента астата At (порядковый номер 85), то справа вверху над этой диагональю в Периодической системе все элементы являются неметаллами,
- Каких элементов в периодической системе больше? (металлов)
- Сколько всего неметаллов?
Внимание! Заполнение схемы:
элементы
Ме нМе
- Как по периоду меняются неметаллические свойства химических элементов?
(Слева направо усиливаются).
- Как по группе меняются неметаллические свойства химических элементов?
(Сверху вниз по группе неметаллические свойства химических элементов ослабевают).
- Где в Периодической системе находятся самые активные неметаллы?
- Какой неметалл самый активный? (фтор).
- Сколько всего электронов у неметаллов на внешнем энергетическом уровне?
(на внешнем энергетическом уровне 4,5,6,7 электронов, он близок к завершению, а у атомов элементов главной подгруппы VIII группы он завершен.
- Зная, что неметаллы имеют сравнительно малые радиусы атомов и большое количество электронов на внешнем энергетическом уровне, ответьте, к чему стремятся атомы неметаллов?
(Вступая в соединения, атомы неметаллов завершают наружный электронный слой за счет принятия от атомов металлов или водорода или отдачи электрона)
Качественной характеристикой атомов неметаллов, т.е. своеобразной мерой их неметалличности, может служить электроотрицательность, т.е. свойство атомов химических элементов поляризовать химическую связь, оттягивать к себе общие электронные пары. Электроотрицательность - мера неметалличности, т.е. чем более электроотрицателен данный химический элемент, тем ярче выражены неметаллические свойства.
- Что же удерживает атомы неметаллов в единое целое?
(кристаллическая решетка).
- Что находится в узлах кристаллической решетки?
(в узлах находится атома или молекулы).
- Как называется связь между атомами и молекулами кристаллической решетке неметаллов? (Если металлы - простые вещества образованы за счет металлической связи, то для неметаллов - простых веществ характерна ковалентная неполярная химическая связь. В отличие от металлов неметаллы - простые вещества, характеризуются большим многообразием свойств. Неметаллы имеют различное агрегатное состояние при обычных условиях:
-
газы - H2, O2, O3, N2, F2, Cl2;
-
жидкость - Br2;
-
твердые вещества - модификации серы, фосфора, кремния, углерода и др.
Гораздо богаче у неметаллов и спектр цветов: красный - у фосфора, красно-бурый - у брома, желтый - у серы, желто-зеленый - у хлора, фиолетовый - у паров йода. Элементы - неметаллы более способны, по сравнению с металлами, к аллотропии.
Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества - аллотропными видоизменениями или модификациями.
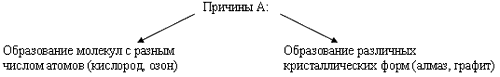
Внимание!
Проблема! Объясните, чем отличаются атомы неметаллов от атомов металлов.
(Атомы металлов имеют большой радиус - атомы неметаллов имеют малый радиус.
Атомы металлов имеют мало электронов на внешнем уровне - атомы неметаллов имеют много электронов на внешнем уровне.
Атомы металлов легко отдают электроны с внешнего уровня - атомы неметаллов легко принимают недостающие электроны на внешний уровень.
Металлы - хорошие восстановители. Неметаллы - хорошие окислители).
Проверка!
Физминутка
- А теперь пришло время поиграть. Встаньте ровно. Выпрямите спины. Внимательно смотрите на экран. На нем будут появляться знаки химических элементов. Если знак на экране - металл, вы должны поднять руки вверх и хлопнуть в ладоши. Если на экране - неметалл, вы должны потопать ногами. Внимание на экран!
Самоконтроль.
Уровень 1.
1. У какого элемента IV группы главной подгруппы углерода или азота ярче выражены неметаллические свойства.
2. Простое вещество - неметалл у элемента:
1) Au 2) Mg 3) C 4) Ag
Уровень 2.
1. Электронная формула 1s22s22p63s2p3
1) Fe 2) N 3) P 4) Cr.
2. Наибольшими неметаллическими свойствами обладает атом с электронной формулой:
1) 1s22s22p6 3s2p2 2) 1s22s22p63s2p4
3) 1s22s22p63s2p3 4) 1s22s22p63s2p5
3. Наиболее электроотрицательный неметалл
1) S 2) H 3) F 4) O
Уровень 3
-
В каком ряду ослабевают неметаллические свойства.
1) S - P - Si 2) O - S - Se
3) B - C - N 4) Si - P - S
-
Из предложенного перечня веществ определите атомы каких элементов имеют на внешнем ЭУ 4 электрона: натрий, калий, кремний, магний, углерод.
-
Длина ковалентной связи наибольшая:
-
H2Te 2) H2O 3) H2Se 4) H2S
Работа в рабочих листах.
Взаимопроверка, смотрите ответы на экране.
Откройте ПСХЭМ
(форзац учебника)
Работа в рабочих листах.
Работа с текстом,
заполнение схемы
УЭ- 3
Изучение свойств металлов.
Цель: познакомить с основными физическими свойствами неметаллов, выяснить, чем они обусловлены;
-
Твердость - Агрегатное состояние:
-
газообразное(H2, O2, Cl2 ,F2, O3)
-
твердое (Р, С)
-
жидкое (Br2)
-
-
- Пластичность, ковкость - это свойство металлов изменять свою форму при ударе.
- Ковкость у неметаллов отсутствует
-
- Металлический блеск - все металлы обладают металлическим блеском.
- Блеска у неметаллов нет
-
- Тепло- и электропроводность - металлы, характеризующиеся высокой электрической проводимостью, обладают и высокой теплопроводностью.
- Из неметаллов лишь некоторые обладают электропроводимостью (только графит и черный Фосфор.) и теплопроводимостью(графит)
-
Цвет разнообразный: желтый, желтовато-зеленый, красно-бурый.
Я еще раз подчеркиваю, что физические свойства неметаллов определяются именно их строением.
- Во что превратятся атомы неметаллов, отдавшие или принявшие электроны?
(Атомы неметаллов принявшие электроны превращаются в отрицательно заряженные ионы -анионы, принявшие - катионы).
- Чем являются неметаллы: окислителями или восстановителями?
(в зависимости от партнера и условий могут быть восстановителями и окислителями).
Смотрите на экран.
УЭ - 4
Общие способы получения неметаллов,.
Цель: познакомиться с получением и применением неметаллов;
Выбор способа получения вещества зависит от того, в каком виде встречается в природе химический элемент, который образует данное вещество. Это в полной мере относится и к выбору способа получения неметаллических простых веществ.
Некоторые неметаллы встречаются в природе в свободном виде. Такие неметаллы, как кислород O2, азотN2, инертные газы - He и др., серу S, алмаз C и графит C, можно выделить из смесей или очистить от примесей, используя физические методы.
Химически активные неметаллы встречаются в природе только в виде соединений. В первую очередь это относится к галогенам: фтору, хлору, брому и иоду.


Минералы, образованные галогенами, - флюорит CaF2 (слева) и галит NaCl.
Химически менее активные неметаллы в природе встречаются как в самородном виде, так и составе химических соединений.
Например, серу можно найти как в самородном состоянии, так и в виде соединений - сульфидов и сульфатов.



Распространение серы природе. Слева направо: самородная сера S, пирит FeS2 и гипс CaSO4⋅2H2O.
Из химических соединений неметаллические простые вещества получают химическими методами в ходе различных химических превращений.
Физические методы получения неметаллов
В качестве сырья для получения ряда неметаллов в промышленности используют воздух.
Сначала при пониженной температуре и повышенном давлении воздух сжижают. Затем, используя перегонку (дистилляцию), из жидкого воздуха получают азот N2, кислород O2 и аргон Ar. В ходе перегонки первым испаряется азот (при температуре −196°C), потом - аргон (при −186°C) и последним - кислород (при температуре −183°C).

Промышленная установка для разделения воздуха методом перегонки.
Аналогично от нелетучих примесей отделяют встречающуюся в природе самородную серу. Для этого руду нагревают выше +450°C и пары кипящей серы S конденсируют.
Химические методы получения неметаллов
Химические методы получения неметаллов связаны с проведением окислительно-восстановительных реакций, в ходе которых неметаллические химические элементы могут как повышать, так и понижать степень окисления.
Например, хлор Cl2 в промышленности получают путём электролиза раствора хлорида натрия NaCl. При пропускании постоянного электрического тока через раствор этого вещества, протекает химическая реакция:
Эл.ток
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
Для того, чтобы получить кремний Si, в промышленности в электрических печах прокаливают смесь песка SiO2 с коксом C. При этом протекает химическая реакция:
SiO2+2C→Si+2CO↑
Лабораторные способы получения неметаллов также связаны с проведением окислительно-восстановительных реакций. Чаще всего это либо реакции разложения, либо реакции замещения.
Лабораторная работа. Получение кислорода и водорода.
1. Кислород O2 в лабораторных условиях можно получить путём разложения пероксида водорода H2O2, перманганата калия или бертолетовой соли. Протекает реакция разложения:
катализатор
2 H2O2 2H2O+O2
tºϹ
2 KMnO4 K2MnO4 + MnO2 + O2
tºϹ
2 KClO3 2KCl + 3O2
2. Водород H2 в лаборатории можно получить, используя цинк Zn и соляную кислоту HCl. Протекает реакция замещения:
Zn+2HCl→ZnCl2+H2↑
Лабораторная работа.
Цель: изучить способ получения кислорода и водорода в лаборатории, выяснить как можно обнаружить эти газы.
Оборудование: штатив большой, изогнутая стеклянная трубка с пробкой, кусочек ваты, лучинка, , спиртовка, спички, стакан с водой.
Реактивы:, KMnO4 -соль кристаллическая, соляная кислота, цинк, пероксид водорода, оксид марганца(IV)
Опыт1. Получение кислорода из перманганата калия.
Порядок действий: собрать прибор как на рисунке
(доп. материал).
Порядок действий: Осторожно нагрейте всю пробирку, а затем в месте расположения KMnO4, до потрескивания вещества KMnO4, проверьте наличие кислорода тлеющей лучинкой. Наблюдайте как горит лучинка в кислороде.
Рисунок зарисуйте.
Допишите уравнение получения O2:
KMnO4 = K2MnO4 + ? + ?.
Наблюдения: при нагревании соли KMnO4 выделяется простое вещество ……………………..…….(О2), которое можно обнаружить с помощью тлеющей лучинки. Лучинка загорается.
Опыт1. Получение кислорода из пероксида водорода.
Порядок действий: Осторожно налейте 5-6 мл пероксида водорода в пробирку всю пробирку, а затем туда же насыпьте оксида марганца(IV), проверьте наличие кислорода тлеющей лучинкой. Наблюдайте как горит лучинка в кислороде.
Допишите уравнение получения O2:
?
2 H2O2 ? + ?
Опыт1. Получение водорода.
Порядок действий: в пробирку поместите 1-2 гранулы цинка, прилейте около 3 мл раствора соляной кислоты; накройте пробирку воронкой широкой частью вниз, на носик воронки наденьте чистую пробирку. Подожгите спиртовку. Поднесите пробирку с полученным водородом к пламени спиртовки для обнаружения водорода. Запишите уравнение реакции получения водорода и наблюдения в тетрадь:
Zn + HCl = ………………………….
Наблюдения: 1) при взаимодействии цинка с соляной кислотой (HCl)появились пузырьки газа это ……………………….
2)при поднесении пробирки с водородом к спиртовке появился свистящий звук следовательно там был …… (какой чистый или не чистый водород) ……………………,
если звук «п-х-х» …………… (какой чистый или не чистый водород) ……………,
3) водород … (какой легче или тяжелее воздуха) ………………………………, поэтому его собираем в перевёрнутую пробирку.
Работа с текстом, составление опорного конспекта.
Проведите лабораторный опыт, составьте уравнения реакций, выводы запишите в тетради
УЭ - 5
Применение неметаллов
Цель: рассмотреть основные области применения неметаллов.
Поскольку свойства неметаллов чрезвычайно разнообразны, эти вещества находят широкое применение в различных отраслях народного хозяйства.
Таблица. Применение неметаллов.
Такие неметаллы, как сера S, азот N2, фосфор P и хлорCl2
используются в качестве сырья для
получения кислот и другой продукции.
Сера S используется в качестве сырья
в производстве резин.
Сажа C служит пигментом в производстве
лаков и красок, а также пигментом и
наполнителем в производстве пластмасс и
резин.
Транспорт
Водород H2 используется в качестве топлива.
Важно, что продукт сгорания этого
топлива не загрязняет среду.
Сельское хозяйство
Сера S используется как эффективное
средство борьбы с вредителями и болезнями растений.
Медицина
Кислород O2 применяют в тех случаях, когда у больного затруднено дыхание.
Активированный уголь C есть почти в каждой домашней аптечке. Точно так же, как иодная тинктура - спиртовой раствор иода I2.
Мази, в состав которых входит сера S,
используются при лечении кожных
заболеваний.
Жидкий азот N2 используют не
только для хранения биологического
материала, но и в косметической медицине.
Подготовка воды
Для дезинфекции воды используют хлор Cl2 и озон O3.
Получение высоких температур
В металлургии и металлообработке
для того, чтобы, сжигая горючее вещество, создать среду с высокой температурой, используют кислород O2.
Пиротехника
В производстве спичек и другой
пиротехнической продукции используют серу S, фосфор P и уголь C.
Пищевая промышленность
Для продления срока годности
пищевых продуктов и для
создания инертной атмосферы в упаковку закачивается азот N2.
1) Вставьте слова, пропущенные в тексте.
Атомы ____ в отличие от атомов ____ легко принимают наружные
электроны, являются ____
2) Вставьте слова , пропущенные в тексте.
Неметаллические свойства элементов с увеличением порядкового номера
в периодах ____
В группах неметаллические свойства элементов ____
3) Пользуясь периодической таблицей, запишите молекулярные формулы высших кислородных соединений неметаллов III периода. Как будет изменяться кислотный характер?
4) Запишите формулы водородных соединений элементов VII А группы. Как изменяются кислотные свойства с увеличением порядкового номера элемента?
5) Водород занимает в периодической таблице два места: в I А группе и в VII А группе. Запишите молекулярные формулы водородных соединений Na, K, Cl, F.
6) Какую высшую степень окисления имеют следующие элементы?7) Определите, окислителем или восстановителем является сера в следующих реакциях:
H2+S=H2S
S -
2SO2 + O2 → 2SO3
S -
8) Наиболее ярко выраженные неметаллические свойства проявляет вещество, образованное из атомов, в которых число электронов во внешнем электронном слое равно____.
• 4 • 5 • 6 • 7
9) Наиболее электроотрицательными являются атомы
• серы • фосфора • кремния • хлора
10) Типичному неметаллу соответствует следующая схема распределения электронов по электронным слоям:
-
2, 1
-
2, 8, 2
-
2, 8, 7
Поменяйтесь тестом с соседом и проверьте тест вместе со мной.
Пользуясь учебником и доп. материалом, заполните таблицу.
УЭ - 7
Контроль
1) Вставьте слова, пропущенные в тексте.
Атомы ____ в отличие от атомов ____ легко принимают наружные
электроны, являются ____
2) Вставьте слова , пропущенные в тексте.
Неметаллические свойства элементов с увеличением порядкового номера
в периодах ____
В группах неметаллические свойства элементов ____
3) Пользуясь периодической таблицей, запишите молекулярные формулы высших кислородных соединений неметаллов III периода. Как будет изменяться кислотный характер?
4) Запишите формулы водородных соединений элементов VII А группы. Как изменяются кислотные свойства с увеличением порядкового номера элемента?
5) Водород занимает в периодической таблице два места: в I А группе и в VII А группе. Запишите молекулярные формулы водородных соединений Na, K, Cl, F.
6) Какую высшую степень окисления имеют следующие элементы?7) Определите, окислителем или восстановителем является сера в следующих реакциях:
H2+S=H2S
S -
2SO2 + O2 → 2SO3
S -
8) Наиболее ярко выраженные неметаллические свойства проявляет вещество, образованное из атомов, в которых число электронов во внешнем электронном слое равно____.
• 4 • 5 • 6 • 7
9) Наиболее электроотрицательными являются атомы
• серы • фосфора • кремния • хлора
10) Типичному неметаллу соответствует следующая схема распределения электронов по электронным слоям:
-
2, 1
-
2, 8, 2
-
2, 8, 7
Задачи.
-
Вычислите объем воздуха, который потребуется для сжигания 20 м3 сероводорода, если продуктами реакции являются вода и оксид серы (IV). Вычислите массу этого воздуха.
Дано: Решение
V(Н2S) = 20м3 20 м3 х м3
Найти: V(воздуха) 2Н2S + 3O2 = SO2 + H2O
m(воздуха) 2 моль 3 моль
V(О2) = 20·3/2 = 30 м3
т.к в воздухе всего 32% О2, то
V(воздуха) = 30·100/21 = 142, 86 м3
m(воздуха) = V/Vm·M =
142,86/22,4·29 = 184,29 г
Ответ: для сжигания 20 м3сероводорода потребуется 142,86 м3 воздуха, m(воздуха) = 184,29 г
-
Определите состав смеси азота и водорода, имеющий плотность по водороду 4,25.
Дано: Решение
DH2 = 4,25 Пусть Vсмеси = 22,4 л (n = 1 моль)
Найти: φ(N2) n (N2) = х, n (Н2) = у, тогда
φ(H2) m(N2) = 28х, г m(Н2) = 2у г,
m(Н2) = 22,4· 2/22,4 = 2 г →
DH2 = (28х + 2у)/2 = 4,25.
х + у = 1
(28х + 2у)/2 = 4,25
х = 0,25
у = 0,75
φ(N2) = 0,25/ 1 = 0,25 или 25%
φ(H2) = 0,75/1 = 0,75 или 75%
Ответ: состав смеси азота и водорода 25% и 75%
-
Вычислите объём водорода, который потребуется для восстановления 928 кг оксида вольфрама(VI), содержащего 25% примесей.
Дано: Решение
m(WO3) = 928 кг W(WO3) = 100-25=75%,
W(прим) = 25% m(WO3)чист = 928·75%/100%=696 кг.
Найти: V(Н2) WO3 + 3H2 = W + 3H2O
232 184
По реакции составляем пропорцию:
232 г WO3 восст-ся 3 х 22,4 л=67,2 л Н2
696000 г WO3 восстанавливаются Х л Н2.
Находим Х: Х=67,2 л * 696000 г/232 г
=201600 л = 201,6 м3
Составляем вторую пропорцию для
нахождения массы образовавшегося
металла:
232 г WO3 образуется 184 г W
696000 г WO3 образуется Y г W
Находим Y: Y=184 г * 696000 г/232 г
= 552000 г = 552 кг
Ответ: Для восстановления 928 кг оксида вольфрама (VI), содержащего 25% примесей, необходимо 201600 л (201,6 м3) водорода. При этом образуется 552000 г (552 кг) металла.
-
Для синтеза хлороводорода взяли 200 л водорода и 250 л хлора. Какие газы и в каком объеме останутся в сосуде после реакции?
Дано: Решение
V(Н2) = 200л H2+Cl2=2HCl
V(Cl2) = 250л
n(Cl2)=200:22.4=8.9моль
n(H2)=250:22.4=11.1моль
Найти: V(газов) соотношение 1:1,значит H2 в
избытке
11.1-8.9=2.2мольH2 избыток
V=22.4*2.2=49.28 л H2 избыток
соотношение Cl2 к HCl как 1:2
значит
n(Cl2)=2n(HCl)=8.9*2=17.8 моль
V=22.4*17.8=399.72 л
Ответ: в сосуде после реакции останется водород в объёме 49,28 л.
-
Французский химик К. Шееле получил хлор по реакции оксида марганца (IV) с соляной кислотой. В результате этой реакции образуется так же хлорид марганца(II) и вода. Составьте уравнение реакции, рассчитайте массу оксида марганца(IV) и количество хлороводорода, необходимых для получения 100 л хлора, если выход составляет 95% от теоретически возможного.
Дано: Решение
η= 95% х,г 105,26
n(Cl2) = 100л MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
Найти: m(MnO2) 1моль 1моль
m(HCl) 87г/моль 22,4л/моль
Vтеор = V(Cl2)/η= 100/ 0.95 = 105.26 л
n(НCl) = 4·n(Cl2) = 4·105,26/22,4 = 18,8
Из 87 г MnO2 образуется 22.4 л Cl2
Из х г MnO2 образуется 105,26 л Cl2
Х = 408,82 г
Ответ: масса оксида марганца(IV) необходимых для получения 100 л хлора равна 408,82 г. Количество хлороводорода, необходимых для получения 100 л хлора равно18.8 моль