- Учителю
- Химические свойства уксусной кислоты: общие свойства с минеральными кислотами и реакция этерификации
Химические свойства уксусной кислоты: общие свойства с минеральными кислотами и реакция этерификации
План урока1. Тема программы-
Карбоновые кислоты
2. Тема урока-
Химические свойства уксусной кислоты: общие свойства с минеральными кислотами и реакция этерификации.
3. Тип урока -
урок усвоения знаний, полученных ранее
4. Вид урока -
практическое занятие
5. Цели урока:
образовательная-
рассмотреть общие свойства карбоновых кислот в сравнении со свойствами минеральных кислот; рассмотреть реакцию этерификации; уметь экспериментально подтверждать указанные свойства.
развивающая -
развивать исследовательские навыки и умение записывать химические реакции с участием органических веществ;
воспитательная -
воспитывать самостоятельность мышления и аккуратность в обращении с участием органических веществ; формировать у каждого учащегося умения работать в группе.
5. Методы обучения - словесные, наглядные, практические
6. Материально-техническое обеспечение -
Интерактивная доска, компьютер, презентация «Химические свойства карбоновых кислот», инструктивные карточки.
Оборудование: штатив с пробирками, пипетки, спиртовки, держатели, делительная воронка, водяная баня. Реактивы: соляная, борная, серная и уксусная кислоты, этанол, изоамиловый спирт, раствор поваренной соли, CuSO4 , Na2CO3, CuO (II), КОН, NaОН, порошок Мg, лакмус.
7. Ход урока
ХОД УРОКА
I. Организационный момент (1 мин.) - постановка цели.
II Разминка (5 мин.)
Преподаватель. Вам уже известны общие физические свойства карбоновых кислот, знаете вы и строение функциональной группы, номенклатуру этих кислородосодержащих органических соединений. А хорошо ли вам знакомы отдельные представители этого класса соединений?
Презентация с картинками овощей, где находятся карбоновые кислоты.
1-ое вещество. Название этого вещества древними греками отождествлялось с самим представлением о кислом. Нам оно хорошо известно в жидком агрегатном состоянии, но при охлаждении ниже 17 0С превращается в бесцветные кристаллы, похожие на лед.Ответ: уксусная кислота
2-ое вещество.Этим веществом богаты шпинат, листья свеклы, репы, горчицы. Впервые данная кислота была синтезирована в 1924 г. Она входит в составы для удаления ржавчины</<font face="Times New Roman, serif"> и оксидных плёнок на металле. НООС-СООН


Ответ: щавелевая кислота
3-е вещество. Впервые было получено алхимиком Агриколой,
который наблюдал при прокаливании в янтаре похожие на соль белый
налет. Это вещество используется в медицине.

Ответ: янтарная кислота - пакетик с янтарной кислоты и табличка с формулой НООС-СН2-СН2-СООН.
Янтарная кислота - настоящий подарок для нас. Это естественное вещество, которое присутствует в организме, вырабатывается им. При приёме внутрь не вызывает привыкания и не вызывает особых побочных эффектов, укрепляет иммунитет, усиливает клеточное дыхание, способствует усвоению кислорода клетками.
Беседа по итогам мини-разминки:
- к какому классу кислородосодержащих органических соединений относятся эти вещества?
- как называется функциональная группа, содержащаяся в этих соединениях?
- как вы думаете, какие свойства данных органических соединений мы еще не рассматривали?
В ходе обсуждения ответов формулируются изучаемые вопросы:
а) какая связь существует между свойствами карбоновых кислот и их строением?
б) сходны ли по свойствам органические кислоты и минеральные и если сходны, в чем причина этого?
Затем определяются направления работы и способы их решения, заранее оговариваются формы представления результатов работы, критерии оценивания работ. Работа класса организуется в малых группах, каждая из которых выполняет собственное исследование.
III. Практическая работа - исследование (35 минут)
- Мы продолжим изучение кислот, исследуем какие химические свойства характерны для предельных одноосновных карбоновых кислот, на примере уксусной кислоты в сравнении с соляной кислотой - представителем неорганической химией.
Учащиеся работают по группам. На столах учащихся лежат инструкции. (Приложение 1).
- Внимательно прочитайте инструктивную карточку. Выполните все задания.
Соблюдайте правила техники безопасности при работе с кислотами!
Группа 1. Исследование химических свойств уксусной кислоты общих со свойствами минеральных кислот. (Взаимодействие с металлами и действие на индикатор).
Группе необходимо на основе знаний химических свойств минеральных кислот (на примере соляной кислоты) выдвинуть гипотезу о возможности переноса этих свойств на уксусную кислоту. Учащиеся самостоятельно проводят химический эксперимент и сравнивают взаимодействие соляной и уксусной кислоты с лакмусом и порошком магния, соблюдая правила техники безопасности, в ходе выполнения лабораторного опыта учащиеся должны подтвердить или опровергнуть предположение о сходстве общих химических свойств минеральных и органических кислот. Результатом работы должны стать наблюдения, оформленные в виде таблицы. Записи уравнений реакции взаимодействия магния с кислотами и вывод о причинах изменения окраски индикатора в растворах кислот, а так же указаны названия полученных веществ.
Задание для группы 1.
Практическая работа: «Свойства уксусной кислоты в сравнении со свойствами соляной кислоты на примере взаимодействие с металлами и действие на индикатор».
Цель: Изучить кислотные свойства уксусной кислоты. Сравнить химические свойства минеральных и органических кислот.
Опыт 1. В две пробирки налейте 1 - 2 мл раствора уксусной кислоты (помните о правилах техники безопасности при работе с органическими веществами и минеральными кислотами). В первую внесите 1-2 капли лакмуса (отметьте цвет индикатора). Во вторую добавьте немного порошка магния.
Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенной реакции.
Опыт 2. В две пробирки налейте 1 - 2 мл раствора соляной кислоты (помните о правилах техники безопасности при работе с кислотами). В одну пробирку 1 -2 капли лакмуса (отметьте цвет индикатора). В другую добавьте немного порошка магния.
Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенной реакции. Наблюдения оформите в виде таблицы.
опыта
Действие
Наблюдение
Уравнение реакции
Уксусная кислота
1
Взаимодействие уксусной кислоты с лакмусом
Лакмус окрасился в красный цвет
2
Взаимодействие уксусной кислоты с магнием
Выделение газа
2СH3COOH+Mg=Mg(CH3COО)2+H2
2Н+ + Mg = Mg 2+ + Н2
Соляная кислота
3
Взаимодействие соляной кислоты с лакмусом
Лакмус окрасился в красный цвет
4
Взаимодействие соляной кислоты с магнием
Выделение газа
2HCl+Mg=MgCl2+H2
2Н+ + Mg = Mg 2+ + Н2
Вывод: уксусная и соляная кислоты одинаково взаимодействуют с активным металлом магнием. Магний вытесняет водород из растворов кислот.
Группа 2. Исследование химических свойств уксусной кислоты общих со свойствами минеральных кислот. (Взаимодействие с оксидами металлов и основаниями).
Группе необходимо на основе знаний химических свойств минеральных кислот (на примере соляной кислоты) выдвинуть гипотезу о возможности переноса этих свойств на уксусную кислоту. Учащиеся самостоятельно проводят химический эксперимент и сравнивают взаимодействие соляной и уксусной кислоты с растворами щелочей и взаимодействие с оксидом магния. Результатом работы должно стать составление уравнения химических реакций взаимодействия уксусной и соляной кислот с предложенными веществами и оформление результатов эксперимента в виде таблицы.
Задание для группы 2.
Практическая работа: «Свойства уксусной кислоты в сравнении со свойствами соляной кислоты на примере взаимодействие с оксидами металлов и основаниями».
Цель. Изучить кислотные свойств уксусной кислоты. Сравнить химические свойства минеральных и органических кислот.
Опыт 1. В две пробирки налейте 1 - 2 мл раствора уксусной кислоты (помните о правилах техники безопасности при работе с органическими веществами). В первую добавьте немного порошка оксида магния. Во вторую пробирку внесите 1-2 капли лакмуса (отметьте цвет индикатора), затем нейтрализуйте кислоту раствором щелочи (гидроксида натрия).
Отметьте, какие изменения произошли.
Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенной реакции.
Опыт 2. В две пробирки налейте 1 - 2 мл раствора соляной кислоты (помните о правилах техники безопасности при работе с кислотами). В первую добавьте немного порошка оксида магния. Во вторую пробирку внесите 1-2 капли лакмуса (отметьте цвет индикатора), затем нейтрализуйте кислоту раствором щелочи.
Отметьте, какие изменения произошли.Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенной реакции. Наблюдения оформите в виде таблицы.
опыта
Действие
Наблюдение
Уравнение реакции
Уксусная кислота
1
Взаимодействие уксусной кислоты с порошком оксида магния
Наблюдаем постепенное растворение порошка магния в кислоте
2СH3COOH+MgО=Mg(CH3COО)2+H2О
2Н+ + MgО = Mg 2+ + Н2О
2
Взаимодействие уксусной кислоты с лакмусом и раствором гидроксида натрия
При добавлении лакмуса к раствору кислоты его окраска изменилась на красную, затем при внесении нескольких капель щелочи раствор обесцветился.
СH3COOH+КОН=CH3COОК+H2О
Н+ + ОН-= Н2О
Соляная кислота
3
Взаимодействие соляной кислоты с порошком оксида магния
Наблюдаем постепенное растворение порошка магния в кислоте
2HCl+MgО=MgСl2+H2О
2Н+ + MgО = Mg 2+ + Н2О
4
Взаимодействие соляной кислоты с лакмусом и раствором гидроксида натрия
При добавлении лакмуса к раствору кислоты его окраска изменилась на красную, затем при внесении нескольких капель щелочи раствор обесцветился.
HCl+КОН = КCl +H2О
Н+ + ОН-= Н2О
Вывод: уксусная и соляная кислоты одинаково реагируют с оксидами металлов и щелочами, образуя соответствующие соли и воду.
Группа 3. Изучение взаимодействия уксусной и соляной кислот с солями и нерастворимыми основаниями.
Учащиеся выдвигают предположение о сходстве химических свойств минеральных и органических кислот и самостоятельно проводят химический эксперимент, в котором сравнивают взаимодействие этих кислот с карбонатом натрия и гидроксидом меди (II). Результат исследования - запись уравнений химических реакций, оформление наблюдений.
Задание для группы 3.
Практическая работа: «Свойства уксусной кислоты в сравнении со свойствами соляной кислоты на примере взаимодействия с солями и нерастворимыми основаниями».
Цель. Изучить кислотные свойства уксусной кислоты. Сравнить химические свойства минеральных и органических кислот.
Опыт 1. Налейте в пробирку 2- 3 мл раствора сульфата меди (II) и прибавьте 1 - 2 мл раствора гидроксида калия (отметьте, что наблюдаете), затем налейте немного уксусной кислоты. Во вторую пробирку добавьте 1-2 мл раствора уксусной кислоты, затем добавьте раствор карбоната натрия.
Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенной реакции.
Опыт 2. Налейте в пробирку 2- 3 мл раствора сульфата меди (II) и прибавьте 1 - 2 мл раствора гидроксида калия (отметьте, что наблюдаете), затем налейте раствор соляной кислоты. Во вторую пробирку добавьте 1-2 мл раствора соляной кислоты, затем добавьте раствор карбоната натрия.
Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенной реакции. Наблюдения оформите в виде таблицы.
опыта
Действие
Наблюдение
Уравнение реакции
Уксусная кислота
1
Взаимодействие уксусной кислоты и нерастворимого основания (гидроксида меди (II)).
При смешивании растворов сульфата меди (II) и гидроксида натрия выпал осадок синего цвета, который растворяется при добавлении раствора уксусной кислоты
CuSO4+2KOH=Cu(OH)2+K2SO4
Cu2++2OH-=Cu(OH)2
Cu(OH)2+2СH3COOH= Cu(CH3COО)2+2H2О
Cu(OH)2+2CH3COO-= Cu2+ + 2H2O
2
Взаимодействие уксусной кислоты с раствором карбоната натрия
Выделение газа
2CH3COOH + Na2CO3= 2CH3COONa + CO2+ H2O
2H+ + CO32- = CO2 + H2O
Соляная кислота
3
Взаимодействие соляной кислоты с нерастворимым основанием (гидроксидом меди (II)).
При смешивании растворов сульфата меди (II) и гидроксида натрия выпал осадок синего цвета, который растворяется при добавлении раствора соляной кислоты
CuSO4+2KOH=Cu(OH)2+K2SO4
Cu2++2OH-=Cu(OH)2
Cu(OH)2+2HCl= CuCl2+2H2О
Cu(OH)2+2Cl-= Cu2+ + 2H2O
4
Взаимодействие раствора соляной кислоты с раствором карбоната натрия
Выделение газа
2HCl + Na2CO3= 2NaCl + CO2+ H2O
2H+ + CO32- = CO2 + H2O
Вывод: уксусная и соляная кислоты проявляют общие химические свойства, реагируют с нерастворимыми основаниями и солями.
Группа 4. Изучение взаимодействия уксусной и борной кислот со спиртами. Учащиеся выдвигают предположение о сходстве химических свойств минеральных и органических кислот и самостоятельно проводят химический эксперимент, в котором сравнивают взаимодействие этих кислот с этанолом и изоамиловым спиртами. Результат исследования - запись уравнений химических реакций, оформление наблюдений.
Группа 4.
Практическая работа: «Свойства уксусной кислоты в сравнении со свойствами борной кислоты на примере реакции этерификации»
Цель. Изучить кислотные свойства уксусной кислоты. Сравнить химические свойства минеральных и органических кислот.
Опыт 1. В пробирку налейте 2 мл изоамилового спирта, 2 мл концентрированной уксусной кислоты и 0,5-1 мл концентрированной серной кислоты. Смесь хорошо перемешайте и нагревайте несколько минут на водяной бане до пожелтения жидкости (но не до кипения).Дайте смеси остыть, затем вылейте в пробирку с холодной водой или с насыщенным раствором поваренной соли: эфир соберется на поверхности. Отделите эфир с помощью делительной воронки.
Какой ощущается запах? Сделайте соответствующий вывод. Составьте уравнения проведенной реакции.
Опыт 2. В фарфоровую чашечку поместите несколько кристалликов борной кислоты, добавьте 1 мл этилового спирта. Хорошо перемешайте смесь стеклянной палочкой. Поднесите к ней зажженную лучинку. Образовавшийся сложный эфир - триэтилборат сгорает красивым зеленым пламенем.
Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте уравнения проведенной реакции. Наблюдения оформите в виде таблицы.
опыта
Действие
Наблюдение
Уравнение реакции
Уксусная кислота
1
Взаимодействие уксусной кислоты и изоамилового спирта в присутствии серной кислоты, смесь осторожно нагревают
При смешивании растворов уксусной кислоты и изоамилового спирта образуется бесцветная подвижная жидкость (изоамилацетат) с резким фруктовым запахом, напоминающим запах груш
CH3-C(-CH3)(-CH3)-CH2OH + (H2SO4,t) CH3COOH = CH3COO-CH2-C(-CH3)(-CH3)-CH3 + H2O (реакция этерификации)
Борная кислота
2
Взаимодействие борной кислоты и этилового спирта
При поджигании, полученный раствор горит зеленым пламенем
H3В3О5 + С2Н5ОН = В(ОС2Н5)3 триэтилбромат
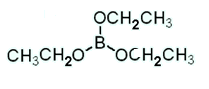
Вывод: Взаимодействие со спиртами - это реакция этерификации: спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс - гидролиз сложных эфиров).
После завершения исследования группы представляют результаты своей работы, которые оцениваются по следующим критериям:
-
Умение учащихся кратко обобщить и записать итог выполненной работы в виде химических формул, уравнений, словесных выводов.
-
Умение учащихся конкретно, полно, развернуто и научно объяснить полученные результаты исследования.
-
Использование наглядности (моделей, таблиц, схем, эксперимента) для обоснования своих теоретических выводов.
-
Участие (активность) каждого учащегося в работе группы.
-
Умение анализировать, сравнивать логически мыслить и делать выводы.
IV. Закрепление ( 4 минуты).
В качестве закрепления знаний и обобщения полученных результатов учащимся предлагается ответить на вопросы мини-теста «Пятерочка»
Тест.
№1. Уксусная кислота в растворе реагирует с веществами:а) NН3
г) ZnO
б) FeO
д) CO
в) Na2CO3
№2. Предельные одноосновные карбоновые кислоты имеют общую формулу:а) СnН2nO
г) СnН2nO3
б) СnН2nO2
д) СnН2n-2O2
в) СnН2n+2O
№3. Какие признаки верно отражают физические свойства уксусной кислоты.а) газообразное вещество
г) при комнатной температуре бесцветная жидкость
б) имеет характерный запах
д) плохо растворяется в воде
в) хорошо растворяется в воде
№4. Соли уксусной кислоты называются:а) формиаты
г) ацетаты
б) цитраты
д) оксалаты
в) пропионаты
№5. При взаимодействии уксусной кислоты с карбонатом натрия образуются вещества:а) Н2СО3
г) СН3СООNa
б) СО2
д) NaОН
в) Н2О
7. Домашнее задание: подготовка к лабораторной работе.
Приложение 1
Задание для группы 1.
Практическая работа: «Свойства уксусной кислоты в сравнении со свойствами соляной кислоты на примере взаимодействие с металлами и действие на индикатор».
Цель: Изучить кислотные свойства уксусной кислоты. Сравнить химические свойства минеральных и органических кислот.
Опыт 1. В две пробирки налейте 1 - 2 мл раствора уксусной кислоты (помните о правилах техники безопасности при работе с органическими веществами и минеральными кислотами). В первую внесите 1-2 капли лакмуса (отметьте цвет индикатора). Во вторую добавьте немного порошка магния.
Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенной реакции.
Опыт 2. В две пробирки налейте 1 - 2 мл раствора соляной кислоты (помните о правилах техники безопасности при работе с кислотами). В одну пробирку 1 -2 капли лакмуса (отметьте цвет индикатора). В другую добавьте немного порошка магния.
Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенной реакции. Наблюдения оформите в виде таблицы.
опыта
Действие
Наблюдение
Уравнение реакции
Уксусная кислота
1
Взаимодействие уксусной кислоты с лакмусом
2
Взаимодействие уксусной кислоты с магнием
Соляная кислота
3
Взаимодействие соляной кислоты с лакмусом
4
Взаимодействие соляной кислоты с магнием
Вывод:
Задание для группы 2.
Практическая работа: «Свойства уксусной кислоты в сравнении со свойствами соляной кислоты на примере взаимодействие с оксидами металлов и основаниями».
Цель. Изучить кислотные свойств уксусной кислоты. Сравнить химические свойства минеральных и органических кислот.
Опыт 1. В две пробирки налейте 1 - 2 мл раствора уксусной кислоты (помните о правилах техники безопасности при работе с органическими веществами). В первую добавьте немного порошка оксида магния. Во вторую пробирку внесите 1-2 капли лакмуса (отметьте цвет индикатора), затем нейтрализуйте кислоту раствором щелочи (гидроксида натрия).
Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенной реакции.
Опыт 2. В две пробирки налейте 1 - 2 мл раствора соляной кислоты (помните о правилах техники безопасности при работе с кислотами). В первую добавьте немного порошка оксида магния. Во вторую пробирку внесите 1-2 капли лакмуса (отметьте цвет индикатора), затем нейтрализуйте кислоту раствором щелочи.
Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенной реакции. Наблюдения оформите в виде таблицы.
опыта
Действие
Наблюдение
Уравнение реакции
Уксусная кислота
1
Взаимодействие уксусной кислоты с порошком оксида магния
2
Взаимодействие уксусной кислоты с лакмусом и раствором гидроксида натрия
Соляная кислота
3
Взаимодействие соляной кислоты с порошком оксида магния
4
Взаимодействие соляной кислоты с лакмусом и раствором гидроксида натрия
Вывод:
Задание для группы 3.
Практическая работа: «Свойства уксусной кислоты в сравнении со свойствами соляной кислоты на примере взаимодействия с солями и нерастворимыми основаниями».
Цель. Изучить кислотные свойства уксусной кислоты. Сравнить химические свойства минеральных и органических кислот.
Опыт 1. Налейте в пробирку 2- 3 мл раствора сульфата меди (II) и прибавьте 1 - 2 мл раствора гидроксида калия (отметьте, что наблюдаете), затем налейте немного уксусной кислоты. Во вторую пробирку добавьте 1-2 мл раствора уксусной кислоты, затем добавьте раствор карбоната натрия.
Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенной реакции.
Опыт 2. Налейте в пробирку 2- 3 мл раствора сульфата меди (II) и прибавьте 1 - 2 мл раствора гидроксида калия (отметьте, что наблюдаете), затем налейте раствор соляной кислоты. Во вторую пробирку добавьте 1-2 мл раствора соляной кислоты, затем добавьте раствор карбоната натрия. Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенной реакции. Наблюдения оформите в виде таблицы.
опыта
Действие
Наблюдение
Уравнение реакции
Уксусная кислота
1
Взаимодействие уксусной кислоты и нерастворимого основания (гидроксида меди (II)).
2
Взаимодействие уксусной кислоты с раствором карбоната натрия
Соляная кислота
3
Взаимодействие соляной кислоты с нерастворимым основанием (гидроксидом меди (II)).
4
Взаимодействие раствора соляной кислоты с раствором карбоната натрия
Вывод:
Задание для группы 4.
Практическая работа: «Свойства уксусной кислоты в сравнении со свойствами борной кислоты на примере реакции этерификации»
Цель. Изучить кислотные свойства уксусной кислоты. Сравнить химические свойства минеральных и органических кислот.
Опыт 1. В пробирку налейте 2 мл изоамилового спирта, 2 мл концентрированной уксусной кислоты и 0,5-1 мл концентрированной серной кислоты. Смесь хорошо перемешайте и нагревайте несколько минут на водяной бане до пожелтения жидкости (но не до кипения). Дайте смеси остыть, затем вылейте в пробирку с холодной водой или с насыщенным раствором поваренной соли: эфир соберется на поверхности. Отделите эфир с помощью делительной воронки.
Какой ощущается запах? Сделайте соответствующий вывод. Составьте уравнения проведенной реакции.
Опыт 2. В фарфоровую чашечку поместите несколько кристалликов борной кислоты, добавьте 1 мл этилового спирта. Хорошо перемешайте смесь стеклянной палочкой. Поднесите к ней зажженную лучинку.
Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте уравнения проведенной реакции. Наблюдения оформите в виде таблицы.
опыта
Действие
Наблюдение
Уравнение реакции
Уксусная кислота
1
Взаимодействие уксусной кислоты и изоамилового спирта в присутствии серной кислоты, смесь осторожно нагревают
Борная кислота
2
Взаимодействие борной кислоты и этилового спирта, смесь осторожно поджигают
Вывод: