- Учителю
- Закон сохранения массы веществ. Химические уравнения.
Закон сохранения массы веществ. Химические уравнения.
Урок №16: Закон сохранения массы веществ. Уравнения химических реакций.
Цель урока:
1. Познакомить учащихся с законом сохранения массы веществ и историей его открытия. Опыт Ломоносова.
2. Познакомить учащихся с химическим уравнением - графическим отображением закона сохранения массы веществ.
3. Научить учащихся ставить коэффициенты в уравнении химической реакции.
Ход урока:2. Объяснение нового материала.
1. Постановка проблемы:
-
Свеча, уравновешенная на весах, постепенно поднимается вверх.
-
При смешивании предварительно взвешенных кусочков мрамора и раствора соляной кислоты наблюдается химическая реакция, и происходит уменьшение массы.
-
При сливании растворов сульфата натрия и хлорида бария масса не меняется.
2. Как объяснить результаты экспериментов?
Учитель выслушивает мнение учеников. Возможные вариант ответов:
-
В одних химических реакциях масса уменьшается, в других остается постоянной.
-
Мы неверно замерили массу исходных веществ или продуктов реакции.
-
Продукты реакции улетучились
3. Учитель подводит учеников к тому, что продукты реакции улетучились, а мы не придумали способ зафиксировать их массу. Просит учеников предложить способ изменения эксперимента таким образом, чтобы результат доказывал, что масса продуктов РАВНА массе исходных веществ.
4. Проводим опыт для подтверждения гипотезы:
На весах уравновешены два сосуда Ландольта, закрыте пробками:
-
В одном кусочки мрамора и раствор соляной кислоты
-
В другом - растворы сульфата натрия и хлорида бария.
При соединении реагентов в обоих сосудах начинается химическая реакция. Но весы остаются в равновесии.
Вывод: Мы опытным путем подтвердили, что масса исходных веществ равна массе продуктов реакции. (Учащиеся записывают вывод в тетрадь)
История открытия закона сохранения массы веществ:
В 18 веке независимо друг от друга французский химик Антуан Лоран Лавуазье и русский ученый Михаил Васильевич Ломоносов установили:
В результате химических превращений масса веществ остается неизменной - общая масса всех исходных веществ равна общей массе всех продуктов реакции. Это Закон сохранения массы веществ при химических реакциях.
2. Ранние заблуждения -
-
теория флогистона- «огненной материи» - которая содержится в любом веществе. (Р. Бойль - прокаливание металлов на открытом воздухе - увеличение массы)
-
«исчезание» свечи при сгорании.
6. Опыт Ломоносова - прокаливание вещества в запаянной реторте, предварительно взвешенной на весах - масса не изменяется.
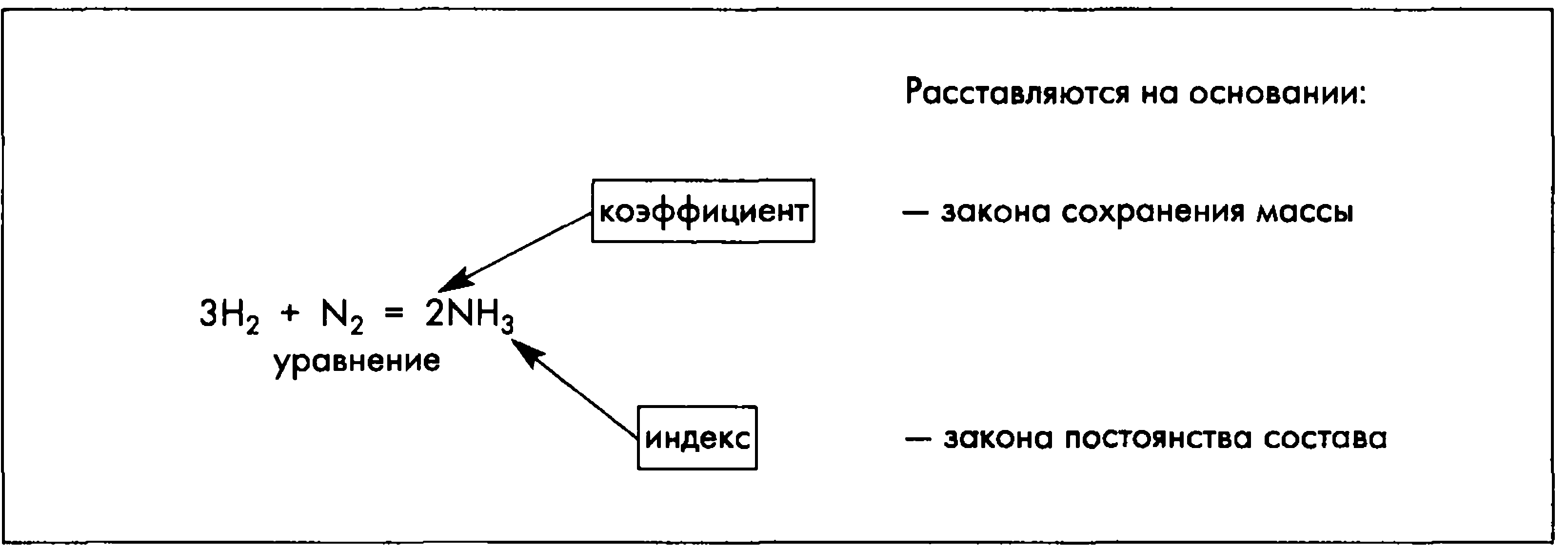
7. Химическое уравнение - графическое отображение закона сохранения массы веществ:
Схема химической реакции - показывает качественный состав реакции (т.е. состав исходных веществ и состав продуктов реакции)
а) Схемы химических реакций:
![]()
S + O2 ![]() SO2. CaCO3
SO2. CaCO3 ![]() CaO +
CO2.
CaO +
CO2.![]()
б) Уравнения химических реакций:
1S + 1O2 = 1SO2, или S + O2 =
SO2;
4P + 5O2 = 2P2O5, или 4P +
5O2 = 2P2O5;
1CaCO3 = 1CaO + 1CO2, или CaCO3 =
CaO + CO2;
1PCl5 + 4H2O = 1H3PO4 +
5HCl, или PCI5 + 4H2O =
H3PO4 + 5HCI.
в) Расставление коэффициентов в уравнениях химических реакций.
KClO3 ![]() KСl +
О2.
KСl +
О2.
Число атомов калия и хлора одинаково, а кислорода - разное. Уравняем их:
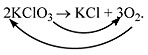
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
![]()
Наконец, между правой и левой частями уравнения можно поставить знак равенства:
2KClO3 = 2KСl + 3О2.
Полученная запись показывает, что при разложении сложного вещества KClO3 получаются два новых вещества - сложное KСl и простое - кислород O2. Числа перед формулами веществ в уравнениях химических реакций называют коэффициентами.
Демонстрация:
1. Горение свечи на весах
2. Реакция мела и соляной кислоты на весах.
3. Сливание растворов сульфата натрия и хлорида бария.
Демонстрация:
1. В сосудах ландольта мрамор и соляная кислота в разных коленах,
3. Отработка навыка расстановки коэффициентов в уравнении химической реакции.
1. Расставьте коэффициенты в уравнениях химических реакций:
а) Mg + O2 ![]() MgO;
MgO;
б) Al + CuCl2 ![]() AlCl3
+ Cu;
AlCl3
+ Cu;
в) NaNO3 ![]() NaNO2
+ O2;
NaNO2
+ O2;
г) AgNO3 + BaCl2 ![]() AgCl +
Ba(NO3)2;
AgCl +
Ba(NO3)2;
д) Al + HCl ![]() AlCl3
+ H2;
AlCl3
+ H2;
е) KOH + H3PO4 ![]() K3PO4
+ H2O;
K3PO4
+ H2O;
ж) CH4 ![]() C2H2
+ H2.
C2H2
+ H2.
З) Fe + Cl2FeCl3
и) H2O2H2O + O2
-
При разложении 24,5 г бертолетовой соли, (KCIO3) образовалось твердое вещество, массой 14,9 г и газ, масса которого составила ______________ г.
-
При разложении оксида ртути образовалось 16 г кислорода и 201 г ртути. Какая масса оксида ртути была подвергнута разложению?
12 минут-
1)на доске заранее написаны уравнения химических реакций. Ученики ставят коэффициенты у доски.
2) На доске записана таблица - ученики составляют формулы веществ по указанным валентностям и дают названия по правилам.
4. Домашнее задание:
1)§14-15, упр.1-4 на стр.47.
2) Карточка - расставить коэффициенты в схемах химических реакций.
Na + Cl2 ![]() NaCl,
NaCl,
NaHCO3 ![]() Na2CO3
+ CO2 + H2O,
Na2CO3
+ CO2 + H2O,
Fe + AgNO3 ![]() Fe(NO3)2
+ Ag,
Fe(NO3)2
+ Ag,
Fe(OH)3 + HCl ![]() FeСl3
+ H2O.
FeСl3
+ H2O.
Al+O2Al2O3
Na+H2O NaOH + H2
Fe(OH)3 ![]() Fe2O3
+ H2O,
Fe2O3
+ H2O,
Al + H2SO4 ![]() Al2(SO4)3
+ H2,
Al2(SO4)3
+ H2,
HNO3 + Cu(OH)2 ![]() Cu(NO3)2
+ H2O,
Cu(NO3)2
+ H2O,
P + O2 ![]() P2O5.
P2O5.
3) Сравнить массовую долю кислорода в углекислом газе - оксиде угдерода (IV) и в угарном газе - оксиде углерода (II).
</