- Учителю
- Разработка урока по химии 9 класс на тему 'Свойства солей в свете теории электролитической диссоциации, их классификация и свойства'
Разработка урока по химии 9 класс на тему 'Свойства солей в свете теории электролитической диссоциации, их классификация и свойства'
Егорина Е.К.
Учитель химии высшей категории
Свойства солей в свете теории электролитической диссоциации,
их классификация и свойства
Цель урока: привести в систему знания учащихся о свойствах кислот, оснований, солей с точки зрения электролитической диссоциации.
I. Образовательные:
а) добиться, понимания понятия соли в свете теории электролитической диссоциации;
б) ознакомить учащихся с классификацией солей.
II. Развивающие:
а) развивать предметные компетенции: умение выделять главное, существенное;
б) развитие умений писать полные и сокращенные ионные уравнения;
в) развитие практических навыков при выполнении лабораторных опытов.
III. Воспитательные:
а) воспитывать культуру учебного труда
Оборудование урока: карбонат натрия и соляная кислота; сульфат меди (II) и гидроксид натрия; хлорид бария и сульфат меди (II); железный гвоздь и сульфат меди (II).
-
Таблица: «Классификация солей».
-
Интерактивная доска
-
Презентация «Химические свойства солей»
-
Таблица «Растворимость солей, кислот и оснований в воде»
Ход урока
I. Организационный момент.
II.Актуализация знаний:
1. Дать понятие, что такое кислота в свете теории электролитической диссоциации;
2. какие химические свойства кислот вам известны?
Выполнение заданий у доски (по карточкам).
1-му ученику задание: составить химическое уравнение взаимодействия цинка с соляной кислотой и рассмотреть в свете теории электролитической диссоциации.
Дополнительный вопрос: к какому типу относится эта реакция? Дать понятие.
2-му ученику задание: составить уравнение реакции взаимодействия соляной кислоты и гидроксида натрия.
Дополнительный вопрос: к какому типу относится эта реакция? Дать понятие.
Работа с классом (на экране).
Дано: HCl, H2SiO3, H2SO4, HNO3, H2CO3, H2SO3
Вариант 1.
А) выписать одноосновные кислоты;
Б) выписать сильные кислоты;
В) выписать кислородсодержащие кислоты.
Вариант 2.
А) выписать двухосновные кислоты;
Б) выписать слабые кислоты;
В) выписать бескислородные кислоты.
Ответы проверяем на экране.
Вариант 1
1) HCl, HNO3; 2) HNO3, HCl, H2SO4; 3) HNO3, H2SO4, H2SiO3, H2CO3, H2SO3.
Вариант 2
1) H2SO4, H2SiO3, H2CO3, H2SO3; 2) H2SiO3, H2CO3, H2SO3; 3) HI, HCl.
Записать какие гидроксиды соответствуют следующим кислотам:
SO3 → ; N2O5 → ; SiO2 → ; P2O5 → ; CO2 → ; SO2 → ;
III. Изучение нового материала.
Вопрос. При диссоциации каких веществ в растворе образуются анионы кислотного остатка?
Вопрос. Как можно из кислоты получить соль?
Записываем тему урока.
Вопрос. Что такое соль в свете теории электролитической диссоциации?
Соль - электролит, который образует при диссоциации катионы металла и анионы кислотного остатка.
NaCl = Na+ + Cl-
CuSO4 = Cu2+ + SO42-
Ca(NO3)2 = Ca2+ + 2NO3-
Рассмотрим классификацию солей.
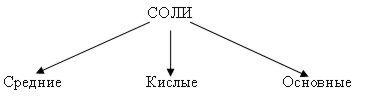
Вопрос. Как образовались средние соли?
Средние соли - продукт полного замещения атомов водорода на металл.
Давайте вспомним название солей образованных кислотами.
-
Название солей азотной кислоты.
-
Название солей угольной кислоты.
-
Название солей сернистой кислоты.
-
Название солей фосфорной кислоты.
-
Название солей бромоводородной кислоты.
-
Название солей соляной кислоты.
-
Название солей сероводородной кислотыты.
Составить формулы средних солей, образованные:
Вариант 1 -натрием;
Вариант 2 - магнием; и следующими кислотами: HNO3, HCl, H2CO3, H2SO4.
Ответы на экране:
Вариант 1. NaNO3, NaCl, Na2CO3, Na2SO4.
Вариант 2. Mg(NO3)2, MgCl2, MgCO3, MgSO4.
Рассмотрим диссоциацию многоосновных кислот на примере серной кислоты.
H2SO4 = H+ + HSO4-
HSO4- = H+ + SO42-
Названия кислых солей образуются из названий солей с добавлением слова "гидро".
NaHCO3 - гидрокарбонат натрия
KHSO4 - гидросульфат калия
Ca(HCO3)2 - гидрокарбонат кальция
Кроме средних и кислых солей, существуют и основные соли.
Основные соли - продукт неполного замещения гидроксогруппы в основании на кислотный остаток. Название солей образуется от названия соли с добавлением слова "гидроксо".
CaOHCl - гидроксохлорид кальция, MgOHNO3.
IV.Закрепление.
KNO3, KHSO4, Ba(NO3)2, BaOHNO3, Ba(NO3)2, (BaOH)2SO3, Ba(HSO3)2
Перейдем к изучению химических свойств солей в свете теории электролитической диссоциации.
V. Лабораторные опыты. Инструктаж по технике безопасности.
Опыт №1. Взаимодействие соли с кислотой.
Na2CO3 + 2HCl = 2NaCl + H2O + CO2 ↑
2Na+ + CO3- + 2H+ + 2Cl- = 2Na+ + 2Cl- + H2O + CO2 ↑
CO32- + 2H+ = H2O + CO2 ↑
Вопросы.
К какому типу относится эта реакция?
Почему реакция идет до конца?
Опыт №2. Взаимодействие соли со щелочами.
CuSO4 + 2NaOH = Cu (OH)2 ↓+ Na2SO4
Cu2+ + SO42- + 2Na+ + 2OH- = Cu (OH)2 ↓ + 2Na+ + SO4-
Cu2+ + 2OH- = Cu (OH)2↓
Вопросы.
Произошла ли реакция?
Назовите признаки химической реакции?
Опыт №3. Взаимодействия соли с солями.
CuSO4 + BaCl2 = CuCl2 + BaSO4 ↓
Cu2+ + SO42- + Ba2+ + 2Cl- = Cu2+ + 2Cl- + BaSO4 ↓
Ba2+ + SO42- = BaSO4↓
Вопросы.
Произошла ли химическая реакция?
Какие произошли изменения в результате химической реакции?
Опыт №4. Взаимодействие соли с металлами (на примере железного гвоздя).
CuSO4 + Fe = FeSO4 + Cu
Cu2+ + SO42- + Fe0 = Fe2+ + SO42- + Cu
Cu2+ + Fe0 = Fe2+ + Cu0
Вопросы.
К какому типу относится эта химическая реакция?
Какие изменения Вы наблюдаете на поверхности гвоздя?
VI. Закрепление.
Даны: гидроксид калия, ртуть, нитрат серебра, железо, гидроксид железа (II).
Какие из перечисленных веществ будут взаимодействовать с хлоридом меди (II)?
Составить уравнения возможных реакций, идущих до конца?
Ответы (ответы спроецированы на доске)
CuCl2 + 2KOH = 2KCl +Cu(OH)2 ↓
Cu2+ + 2OH- = Cu(OH)2 ↓
CuCl2 + Hg ≠
CuCl2 + 2AgNO3 = Cu(NO3)2 + 2AgCl ↓
Ag+ + Cl- = AgCl ↓
CuCl2 + Fe = FeCl2 + Cu
Fe0 + Cu2+ = Cu0 + Fe2+
VII. Домашнее задание: учебник Нурахметов Н.Н. § 7, стр. 27упр №7,10.
Рефлексия.