- Учителю
- План конспект урока 9 класс
План конспект урока 9 класс
Муниципальное бюджетное общеобразовательное учреждение
средняя общеобразовательная школа № 46
с углубленным изучением отдельных предметов
ПЛАН - КОНСПЕКТ
УРОКА ХИМИИ В 9 КЛАССЕ ПО ТЕМЕ
«АММИАК»
Учитель химии:
Дикопольцев Сергей Андреевич
г. Сургут
2014
ПЛАН-КОНСПЕКТ УРОКА ПО ХИМИИ (9 класс)
Тема урока: Аммиак.
Цель урока: изучение строения молекулы аммиака, его физических и химических свойств, роли аммиака и его применения в жизни человека.
Задачи урока:
-
обучающие: изучить состав и строение молекулы аммиака, его физические и химические свойства; научить учащихся получать аммиак в лабораторных условиях; дать представление о роли аммиака и его производных в жизни человека;
-
развивающие: развивать умения работать с опорными конспектами, учебно - инструктивными картами, продолжить развитие умений и навыков проведения химического эксперимента, а также умения анализировать, сравнивать, обобщать, делать выводы, применять теоретические знания для объяснения различных явлений;
-
воспитательные: формировать бережное отношение к окружающей среде, чувства ответственности, уверенности и требовательности к себе, продолжить воспитание толерантности при работе в группе.
Тип урока: Изучение нового материала с элементами повторения и закрепления ранее изученного.
Методы работы: словесный, наглядный, проблемно-поисковый, практический.
Используемые технологии: технологии развивающего обучения.
Форма организации учебной деятельности: индивидуальная, групповая, общеклассная.
Ожидаемые результаты урока:
знать строение молекулы аммиака, способы его получения, физические и химические свойства, области применения аммиака и его производных; уметь производить поиск необходимой информации, анализировать и оценивать ее.
План урока:
1. Организационный момент (2 мин.)
2. Мотивационно - ориентировочный этап: актуализация знаний, полученных на предыдущем уроке; постановка целей урока (10 мин.)
3. Операционно - исполнительский этап: способы получения аммиака, изучение физических и химических свойств аммиака, знакомство с солями аммония, области применения аммиака и его производных (18 мин.)
4. Оценочно - рефлексивный этап: контроль и самоконтроль: работа с тестами, с опорным конспектом, домашнее задание, рефлексия (10 мин.)
Оборудование:
-
Таблица растворимости веществ.
-
Периодическая система Д.И. Менделеева.
-
Раствор аммиака.
-
Соляная кислота.
-
Индикатор фенолфталеин.
-
Серная кислота.
-
Презентация «Роль аммиака и его применение в жизни человека».
-
Лабораторная посуда.
Этапы урока.
I. Организационный момент (2 мин.)
Приветствие. Создание позитивной психологической обстановки, оптимального климата и мотивации учения.
II. Мотивационно - ориентировочный этап (10 мин.)
Задача этапа: актуализация знаний, создание проблемной ситуации
Вводное слово учителя
Эта история произошла во время I мировой войны. Английский крейсер вел преследование поврежденного в бою немецкого эсминца. Цель была почти достигнута, как вдруг между кораблями появилось плотное белое облако дыма. Экипаж крейсера почувствовал удушливый запах, раздражающий горло и легкие. Крейсер был вынужден дать задний ход и выйти из дымового облака. Уже после обнаружили, что пострадали не только люди, но и металлические части корабля.
Сегодня я хочу познакомить вас с этим удивительным веществом, имеющим необыкновенные свойства. Запах этого газа знаком каждому - даже тем, кто совсем далёк от химии. Кое - что о его свойствах тоже всем известно.
Итак, вещество, о котором пойдёт речь на нашем уроке - аммиак.
Давайте попробуем частично воспроизвести картину давних лет.
Это вещество имеет древнюю историю. Арабские алхимики получали из оазиса Амон, находившегося около храма, бесцветные кристаллы. Они звали вещество «нушадир», его растирали в ступках, нагревали - и всякий раз получался едкий газ. Сначала его именовали аммониак, а потом сократили название до «аммиак».
В средние века этот газ называли почему-то «щелочной воздух», а его раствор и поныне называется «нашатырный спирт».
Давайте, ребята, проведем небольшое исследование и решим, откуда у этого газа столь необычные свойства и названия, но для этого нам надо вспомнить материал о строении и свойствах азота, поэтому проверку знаний проведем через выполнение тестовых заданий и взаимопроверку. (Приложение № 1).
III. Операционно - исполнительский этап (18 мин.)
Задача этапа: прогнозирование свойств аммиака, получение аммиака и исследование его свойств.
На этом этапе учащиеся по ходу объяснения нового материала заполняют «Рабочую карту урока по теме «Аммиак» (Приложение № 2)
Формула аммиака - NH3, т.е. это водородное соединение азота.
Объяснение:
Атом азота образует с атомами водорода 3 ковалентные полярные связи (т.к. электроотрицательность азота больше, чем у водорода) за счет своих трех неспареных электронов; Неподеленная электронная пара атома азота способна участвовать в образовании четвертой ковалентной связи по донорно-акцепторному механизму с атомами, имеющими вакантную орбиталь;
Механизм донорно-акцепторной связи:
H
 3N: + H+ = [NH4]+ образуется ион аммония
3N: + H+ = [NH4]+ образуется ион аммония
Для молекул аммиака характерно связывание их между собой в ассоциации за счет водородных связей

Моделирование молекулы аммиака (из стержневых шариков)
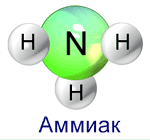
Ответьте на вопрос:
-
Какую пространственную форму имеет молекула аммиака? (Молекула аммиака имеет форму правильной пирамиды: в углах треугольника находятся атомы водорода, а в вершине пирамиды - атом азота. Угол между связями Н-N-Н равен 107.)
Лабораторная работа: получение аммиака, растворение аммиака в воде, взаимодействие с кислотами (Приложение № 3)
Беседа по вопросам (после проведения лабораторной работы):
1.Легче или тяжелее аммиак воздуха?
2.Растворяется ли он в воде?
3. Как вы думаете, почему аммиак имеет такой едкий запах?
4. Где может использоваться это свойство аммиака?
5. Раньше барышни, склонные к обморокам, носили с собой «нюхательную соль».
Как вы думаете, что это за вещество?
6. Охарактеризуйте физические свойства аммиака по плану:
- агрегатное состояние;
- цвет;
- запах
- растворимость в воде;
- плотность.
7. Переходим к характеристике химических свойств аммиака.
Вы увидели, что аммиак хорошо растворяется в воде, имеет резкий запах, вспомнили, что еще в средние века его называли «щелочной воздух».
Работа с материалом учебника и беседа по вопросам:
1.Как образуется донорно-акцепторная связь, какие частицы предоставляют пустую атомную орбиталь (АО)?
2.Каковы валентные возможности азота?
3. Откуда в растворе аммиака появились ионы OH-?
4. Почему аммиак реагирует с кислотами?
Демонстрационный эксперимент:
Проводят опыт, потирая друг о друга стеклянные палочки, одна смочена раствором аммиака, а другая - раствором соляной кислотой. Что вы наблюдаете? (Дым.)
Теперь бы вы смогли объяснить англичанам, почему между кораблем и судном противника появился едкий «дым», образовался хлорид аммония.
(записываем в опорный конспект и оформляем на доске химическое уравнение между соляной кислотой и аммиаком)
 NН3 +НСI NН4 СI (образование солей аммония, удобрения)
NН3 +НСI NН4 СI (образование солей аммония, удобрения)
-
Взаимодействие с оксидами ( Н2О) Оформление в опорном конспекте и оформление на доске.
 NН3 +НОН NН4 ОН Нашатырный спирт
NН3 +НОН NН4 ОН Нашатырный спирт
-
Взаимодействие с серной кислотой (оформление опорного конспекта и оформление на доске)
N
 Н3 + Н2SО4N Н4 НSО4 Недостаток гидросульфат аммония
Н3 + Н2SО4N Н4 НSО4 Недостаток гидросульфат аммония
-
Аммиак горит в кислороде (оформление опорного конспекта и оформление на доске)
-
 NН3 + 3О2 2N2 + 6Н2О
NН3 + 3О2 2N2 + 6Н2О
Презентация «Роль аммиака и его применение в жизни человека»:
-
производство азотной кислоты;
-
для получения аммиачной воды;
-
производство азотных удобрений;
-
в медицине, в быту;
-
в холодильных установках;
-
для паяния;
-
взрывчатых веществ.
IV. Оценочно - рефлексивный этап (10 мин.)
Проверка усвоения знаний - проверка усвоения нового материала через проведение самостоятельной работы (на выбор учащихся):
Вариант 1
-
При синтезе аммиака промышленным способом, азот объёмом 50 л. (н. у.) прореагировал с водородом, взятом в избытке. Выход продукта составил 50%. Рассчитайте объём и массу полученного аммиака.
-
Какая масса хлорида аммония получится при взаимодействии 3 моль аммиака с соляной кислотой?
-
Какой объём кислорода потребуется для сжигания 34 г. аммиака?
4



 . Азот аммиак оксид азота (II ) нитрат аммония аммиак азот
. Азот аммиак оксид азота (II ) нитрат аммония аммиак азот
5. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
6. Составьте уравнения следующих реакций и назовите продукты:
-
2NH3 + H2SO4 →
-
NH3 + H2SO4 →
-
NH3 + H3PO4 →
-
2NH3 + H3PO4 →
-
3NH3 + H3PO4 →
Ответ:
-
2NH3 + H2SO4 →(NH4)2SO4
сульфат аммония
-
NH3+ H2SO4 →NH4НSO4
гидросульфат аммония
-
NH3 + H3PO4 →NH4Н2РO4
дигидрофосфат аммония
-
2NH3 + H3PO4 →(NH4)2НРO4
гидрофосфат аммония
-
3NH3 + H3PO4 →(NH4)3РO4
Вариант 2
Тестовые задания (Приложение № 4)
Подведение итогов урока. Домашнее задание. Рефлексия.
Учитель организует фронтальную беседу по рефлексии итогов урока.
Объясняет домашнее задание: §25, упр. 1-5.; дает индивидуальное опережающее задание отдельным ученикам.
Приложение № 1.
Вводный контроль, тест - 5 мин.
Цель: закрепить знания о строении и свойствах азота.
Оценивание до 5 баллов при взаимопроверке.
-
Как изменяются неметаллические свойства элементов подгруппы азота с увеличением порядкового номера элемента?
-
увеличиваются;
-
уменьшаются;
-
остаются без изменения;
-
сначала увеличиваются, потом уменьшаются.
2.На каких энергетических подуровнях не могут располагаться валентные электроны атома азота?
-
2S;
-
3D;
-
2P;
-
3P.
3. Формула вещества, в котором азот проявляет свою высшую степень окисления?
-
NO2;
-
Ca3N2;
-
HNO3;
-
Ca(NO3)2.
4.Укажите формулы веществ, в которых азот проявляет свою минимальную степень окисления?
-
NH3;
-
HNO2;
-
Na3N;
-
N2O.
5. Азот проявляет восстановительные свойства, реагируя с:
-
водородом;
-
кислородом;
-
магнием;
-
фтором.
Приложение № 2.
Рабочая карта урока по теме «Аммиак»
План
Вопросы и задания
Конспект урока
(заполняется учеником по ходу урока)
1.
Состав
молекулы
1.Запишите молекулярную формулу аммиака.
2.Укажите степень окисления элементов.
3.Дайте химически верное название и запись формулы аммиака.
2.
Строение
молекулы
1.Запишите молекулярную, электронную, структурную формулы молекулы аммиака.
2.Укажите вид химической связи в молекуле и способы образования.
3.Укажите смещение электронной плотности к более электроотрицательному элементу.
3.
Водородная связь
Отметьте особенности водородной связи:
-
между какими атомами возникает связь;
-
силу связи по сравнению с другими видами связи;
-
условное обозначению водородной связи;
-
следствие образования водородной связи в соединении.
4.
Физические свойства
1) Изучите физические свойства аммиака по учебнику.
2) Рассчитайте его плотность по воздуху Dвозд = 29/МNН3
3) Предложите способ собирания газа в лабораторных условиях
5.
Химические свойства
1.Запишите уравнение реакции взаимодействия аммиака с водой:
аммиак + вода = гидроксид аммония.
2.Отметьте слабые основные свойства аммиака.
1.Запишите уравнение реакции взаимодействия аммиака с соляной кислотой
Аммиак + соляная кислота = хлорид аммония,
2.Рассмотрите механизм реакции.
3.Отметьте особенности иона аммония и образование ковалентной полярной связи по донорно-акцепторному механизму.
1.Запишите уравнение реакции горение аммиака:
аммиак + кислород = азот + вода
2.Составьте электронный баланс к этому уравнению.
1.Запишите уравнение реакции каталитического окисления аммиака:
аммиак + кислород = оксид азота (II) + вода
2.Составьте электронный баланс к этому уравнению.
6.
Получение
аммиака
1.Запишите уравнение реакции получение аммиака:
-
в промышленности (дайте классификацию реакции по всем известным признакам и предложите оптимальные условия проведения реакции);
-
в лаборатории (отметьте способы распознавания аммиака)
а) в промышленности
б) в лаборатории
7.
Применение аммиака
1. Ознакомьтесь с презентацией
Применение:
1)
8.
Домашнее
задание
Запиши домашнее задание в дневник
9.
Вывод
В чем заключается уникальность аммиака?
Отметь особенности этого газа.
Приложение № 3
Лабораторная работа по теме «Аммиак
Внимание: соблюдайте правила техники безопасности при работе с нагревательными приборами и летучими веществами!
1. Получение аммиака.
-
Пробирку с насыпанной смесью хлорида аммония NH4Cl и гидроксида кальция Са(ОН)2 закрепите в держателе на штативе и вставьте в нее газоотводную трубку. Конец газоотводной трубки поместите в другую сухую пробирку, установленную горлышком вниз.
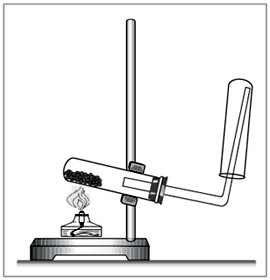
-
Зажгите спиртовку и начинайте нагревать смесь. Вы почувствуете резкий запах (нюхать осторожно!), заполнение пробирки проверьте с помощью универсального индикатора, заранее смочите его в стакане с водой. Поднесите смоченный индикатор к отверстию пробирки. По изменению окраски индикатора судите о полноте заполнения пробирки аммиаком.
-
Изучение свойств аммиака. Растворение аммиака в воде:
Осторожно снимите пробирку с аммиаком. Не переворачивая ее, закройте отверстие большим пальцем. Затем погрузите пробирку в посуду с водой и только потом уберите палец. Держите пробирку, покачивая в воде до тех пор, пока пробирка на 1/4 заполнится водой. После чего опять под водой закройте пальцем отверстие пробирки и выньте ее из воды. В полученный раствор аммиака добавьте несколько капель фенолфталеина.
Задания:
-
Как изменилась окраска индикаторов? На какую среду нам указывает эта окраска?
-
Опишите физические свойства аммиака (агрегатное состояние, цвет, запах, растворимость в воде).
-
Составьте уравнение реакции получения аммиака из NH4Cl и Са(ОН)2.
-
Взаимодействие аммиака с кислотами: Смочите одну полоску бумаги в соляной кислоте HCl, а другую - в растворе аммиака NH4OH. Соедините эти две полоски бумаги вместе.
Задания:
-
Что наблюдаете?
-
Составьте уравнение реакции взаимодействия NH3 с HCl. Назовите продукт реакции.
-
Качественная реакция на аммиак. Цель: научиться распознавать аммиак химическим путем. К раствору аммиака в воде прилить несколько капель медного купороса (сульфат меди (II).
Появляется васильковое окрашивание. Сделай вывод о чуткости реакции.
Приложение № 4
Закрепление новых знаний. Тест
Вариант 1.
1.Азот при обычных условиях - это:
а) тяжелый металл;
б) бесцветная маслянистая жидкость;
в) одноатомный инертный газ;
г) газ без цвета и запаха, молекула двухатомная.
2.Реакция между хлоридом аммония и гидроксидом кальция идет потому, что
а) выпадает осадок;
б) выделяется газ - аммиак;
в)образуется растворимая соль;
г) реакция не идет.
3.Аммиак горит в кислороде в присутствии катализатора с образованием?
а) азота;
б) оксида азота (II);
в) оксида азота (III);
г) образуется азотная кислота.
4. Степень окисления азота в молекуле аммиака?
а) 0; б) +3; в) -3; г)+5.
5.Нашатырь - это:
А) раствор аммиака в воде;
б) раствор аммиака в спирте;
в) хлорид аммония;
г) поваренная соль.
Вариант 2.
1.Азот входит в главную подгруппу:
а) IV группы;
б) V группы;
в) VI группы;
г) VII группы.
2.Раствор аммиака в воде окрашивает фенолфталеин в:
а) желтый цвет;
б) синий цвет;
в) фиолетовый цвет;
г) малиновый цвет.
3.Аммиак горит в кислороде без катализатора с образованием:
а) азота;
б) оксида азота (II);
в) оксида азота (III);
г) азотной кислоты.
4.Валентность азота в молекуле аммиака:
а) V;
б) III;
в)II;
г)IV
5.Нашатырный спирт - это:
-
раствор аммиака в воде;
б) раствор аммиака в спирте;
в) хлорид аммония;
г) медицинский спирт.
Приложение № 2/1
Проверка «Рабочей карты урока по теме «Аммиак»
План
Вопросы и задания
Конспект урока
(заполняется учеником по ходу урока)
1.
Состав
молекулы
1.Запишите молекулярную формулу аммиака.
2.Укажите степень окисления элементов.
3.Дайте химически верное название и запись формулы аммиака.
Гидрид азота NH3 = H3 +1N-3нитрид водорода
2.
Строение
молекулы
1.Запишите молекулярную, электронную, структурную формулы молекулы аммиака.
2.Укажите вид химической связи в молекуле и способы образования.
3.Укажите смещение электронной плотности к более электроотрицательному элементу.
NH3 - молекулярная формула ковалентная полярная связь, одинарная, по обменному механизму
Н: N: Н электронная формула
Н
Н+б- N-б- Н+б структурная формула ![]()
Н+б
3.
Водородная связь
Отметьте особенности водородной связи:
-
между какими атомами возникает связь;
-
силу связи по сравнению с другими видами связи;
-
условное обозначению водородной связи;
-
следствие образования водородной связи в соединении.
--Водородной называется связь между атомами водорода и атомами очень ЭО элементов, имеющих свободные электронные пары;
--слабее ковалентной связи в 10 - 20 раз;
-- обозначается тремя точками;
-- с водородной связью обладают хорошей растворимостью в воде, повышается их температура кипения и плавления.
4.
Физические свойства
1) Изучите физические свойства аммиака по учебнику.
2) Рассчитайте его плотность по воздуху Dвозд = 29/МNН3
3) Предложите способ собирания газа в лабораторных условиях
NH3 - газ без цвета, с резким запахом, почти в два раза легче воздуха, при охлаждении до -33,6оС он сжижается, а при температуре -77,8оС превращается в твердое белое вещество, хорошо растворим в воде.
5.
Химические свойства
1.Запишите уравнение реакции взаимодействия аммиака с водой:
аммиак + вода = гидроксид аммония.
2.Отметьте слабые основные свойства аммиака.




 NH3 + H2O NH3 * H2O NH4+ + OH-
NH3 + H2O NH3 * H2O NH4+ + OH-
Водный раствор аммиака окрашивает раствор фенолфталеина в малиновый цвет, что указывает на его слабощелочные свойства.
1.Запишите уравнение реакции взаимодействия аммиака с соляной кислотой
Аммиак + соляная кислота = хлорид аммония,
2.Рассмотрите механизм реакции.
3.Отметьте особенности иона аммония и образование ковалентной полярной связи по донорно-акцепторному механизму.

1.Запишите уравнение реакции горение аммиака:
аммиак + кислород = азот + вода
2.Составьте электронный баланс к этому уравнению.

1.Запишите уравнение реакции каталитического окисления аммиака:
аммиак + кислород = оксид азота (II) + вода
2.Составьте электронный баланс к этому уравнению.

6.
Получение
аммиака
1.Запишите уравнение реакции получение аммиака:
-
в промышленности (дайте классификацию реакции по всем известным признакам и предложите оптимальные условия проведения реакции);
-
в лаборатории (отметьте способы распознавания аммиака).
а) в промышленности
3H2 + N2![]() 2NH3 + Q
2NH3 + Q
Р соединения, экзотермическая, гомогенная, обратимая, окислительно -восстановительная, каталитическая.
б) в лаборатории
NH4+ + OH- = NH3 + H2O
Собирание - в перевернутую кверху дном пробирку.
Распознавание:
а) по запаху;
б) по посинению влажной лакмусовой бумажки
в) по появлению белого дыма от поднесенной стеклянной палочки, смоченной HCl конец.
7.
Применение аммиака
1. Ознакомьтесь с презентацией
Применение:
1) в холодильных установках;
2) в медицине;
3) для производства азотной кислоты, солей аммония;
4) как удобрение.
8.
Домашнее
задание
Запиши домашнее задание в дневник
Задание по выбору
9.
Вывод
В чем заключается уникальность аммиака?
Отметь особенности этого газа.