- Учителю
- Урок химии Карбоновые кислоты
Урок химии Карбоновые кислоты
9 класс
Тема урока: «Кислородсодержащие органические соединения: Карбоновые кислоты».
Цели урока: дать понятие о кислородсодержащих органических соединениях и их классификации,
рассмотреть карбоновые кислоты, изучить номенклатуру, изомерию, способы их получения; химические свойства.
Оборудование: ИКТ, ЭОР.
Ход урока:
-
Организационная часть урока.
-
Проверка знаний учащихся.
Задания на карточках:
-
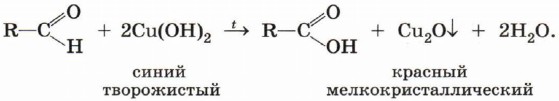
Закончите уравнения реакций:
![]()
![]()
![]()
-
Выберите верные утверждения. Уксусный альдегид реагирует с:
-
гидроксидом меди (II);
2) оксидом меди (II);
3) этиленом;
4) водородом;
5) хлороводородом;
6) аммиачным раствором оксида серебра.
Напишите уравнения возможных реакций.
-
Изучение программного материала.
Карбоновые кислоты
Строение карбоновых кислот

Группа атомов 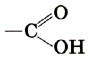 называется карбоксильной группой
или карбоксилом.
называется карбоксильной группой
или карбоксилом.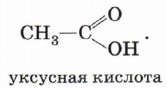
Общая формула этих кислот СnН2n + 1СООН, например
В зависимости от природы углеводородного радикала карбоновые
кислоты делятся на предельные, непредельные и
ароматические.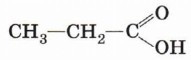
Предельными (насыщенными) являются, например, пропановая (пропионовая) кислота
В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным, непредельным углеводородным радикалом, например в молекулах акриловой (пропеновой)
СН2=СН-СООН
Как видно из формулы, бензойная кислота является ароматической,
так как содержит в молекуле ароматическое (бензольное)
кольцо: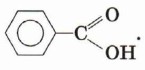
Номенклатура
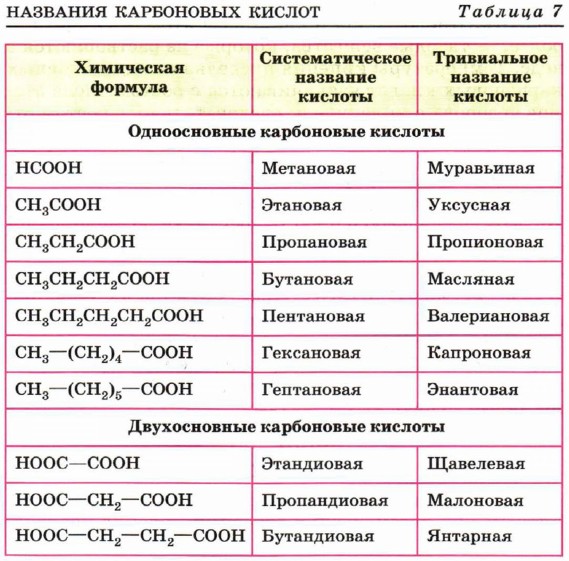
Физические свойства предельных одноосновных карбоновых кислот
Низшие кислоты, т. е. кислоты с относительно небольшой молекулярной массой, содержащие в молекуле до четырёх атомов углерода, - жидкости с характерным резким запахом (вспомните запах уксусной кислоты).
Кислоты, содержащие от 4 до 9 атомов углерода, - вязкие маслянистые жидкости с неприятным запахом.
Кислоты, состоящие из 9 атомов углерода и более, - твёрдые вещества, которые не растворяются в воде.
Карбоксильная группа притягивается молекулами воды, образуя с
ними водородные связи.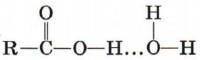
Муравьиная и уксусная кислоты растворимы в воде неограниченно. Очевидно, что с увеличением числа атомов в углеводородном радикале растворимость карбоновых кислот снижается.
Химические свойства карбоновых кислот
Общие свойства, характерные для класса кислот (как органических, так и неорганических), обусловлены наличием в молекулах гидроксильной группы, содержащей сильно полярную связь между атомами водорода и кислорода. Эти свойства вам хорошо известны.
Рассмотрим их ещё раз на примере растворимых в воде органических кислот.
1. Диссоциация с образованием катионов водорода и анионов кислотного остатка:
![]()
2. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода:
2СН3-СООН + Fe → (CH3COO)2Fe + Н2↑
3. Взаимодействие с основными оксидами с образованием соли и воды:
2 СН3СООН + СаО → (СН3СОО)2Са + Н2O.
4. Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации):
СН3СООН + NaOH → СН3COONa + Н2O
5. Взаимодействие с солями более слабых кислот, с образованием
последних.
2СН3СООН + К2СO3 →
2СН3СООК + Н2O + CO2↑.
6. Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров - уже известная вам реакция этерификации (одна из наиболее важных реакций, характерных для карбоновых кислот):
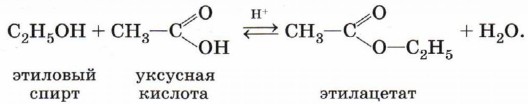
Способы получения карбоновых кислот
Реакции окисления
1) аммиачным раствором оксида серебра (I) - реакция «серебряного зеркала»:
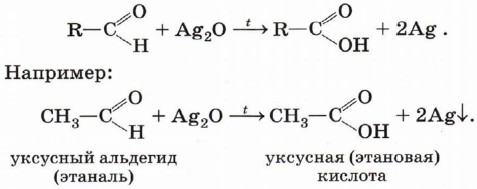
2) свежеосаждённым гидроксидом меди (II).
Отдельные представители карбоновых кислот и их значение
Муравьиная (метановая) кислота НСООН - жидкость с резким запахом и температурой кипения 100,8 °С, хорошо растворима в воде.
Муравьиная кислота при попадании на кожу вызывает ожоги. Жалящая
жидкость, выделяемая муравьями, содержит эту кислоту. Муравьиная
кислота обладает дезинфицирующим свойством и поэтому находит
применение в пищевой, кожевенной и фармацевтической промышленности,
медицине. Она также используется при крашении тканей и бумаги (рис.
48).
Уксусная (этановая) кислота СН3СООН (рис. 49) - бесцветная жидкость с характерным резким запахом, смешивается с водой в любых отношениях. Водные растворы уксусной кислоты поступают в продажу под названием уксуса (3- 5% -й раствор) и уксусной эссенции (70-80%-й раствор) и широко используются в пищевой промышленности.
Уксусная кислота - хороший растворитель многих органических
веществ и поэтому используется при крашении, в кожевенном
производстве, в лакокрасочной промышленности. Кроме этого, уксусная
кислота - сырьё для получения многих важных в техническом отношении
органических соединений: например, на её основе получают вещества,
используемые для борьбы с сорняками, - гербициды (рис.
50).
-
Закрепление: задания и упражнения
-
Задание на дом: записи в тетрадях
Упражнения и задания к теме «Карбоновые кислоты»:
1. Пятна ржавчины можно удалить раствором уксусной кислоты. Составьте молекулярные и ионные уравнения происходящих при этом реакций, учитывая, что ржавчина содержит оксид и гидроксид железа (III) - Fe2O3 и Fe(OH)3. Почему такие пятна не удаляются водой? Почему они исчезают при обработке раствором кислоты?
2. Добавляемую в бездрожжевое тесто пищевую соду NaHCO3 «гасят» уксусной кислотой. Проделайте дома эту реакцию и составьте её уравнение, зная, что угольная кислота слабее уксусной. Объясните, чем вызвано образование пены.
3. Чем можно объяснить, что муравьиная кислота вступает в реакцию «серебряного зеркала»? Составьте уравнение этой реакции.
4. При взаимодействии уксусной кислоты с магнием выделилось 5,6
л (н. у.) водорода. Определите массу магния, вступившего в реакцию.
Упражнения и задания к теме «Карбоновые кислоты»:
1. Пятна ржавчины можно удалить раствором уксусной кислоты. Составьте молекулярные и ионные уравнения происходящих при этом реакций, учитывая, что ржавчина содержит оксид и гидроксид железа (III) - Fe2O3 и Fe(OH)3. Почему такие пятна не удаляются водой? Почему они исчезают при обработке раствором кислоты?
2. Добавляемую в бездрожжевое тесто пищевую соду NaHCO3 «гасят» уксусной кислотой. Проделайте дома эту реакцию и составьте её уравнение, зная, что угольная кислота слабее уксусной. Объясните, чем вызвано образование пены.
3. Чем можно объяснить, что муравьиная кислота вступает в реакцию «серебряного зеркала»? Составьте уравнение этой реакции.
4. При взаимодействии уксусной кислоты с магнием выделилось 5,6
л (н. у.) водорода. Определите массу магния, вступившего в реакцию.
Упражнения и задания к теме «Карбоновые кислоты»:
1. Пятна ржавчины можно удалить раствором уксусной кислоты. Составьте молекулярные и ионные уравнения происходящих при этом реакций, учитывая, что ржавчина содержит оксид и гидроксид железа (III) - Fe2O3 и Fe(OH)3. Почему такие пятна не удаляются водой? Почему они исчезают при обработке раствором кислоты?
2. Добавляемую в бездрожжевое тесто пищевую соду NaHCO3 «гасят» уксусной кислотой. Проделайте дома эту реакцию и составьте её уравнение, зная, что угольная кислота слабее уксусной. Объясните, чем вызвано образование пены.
3. Чем можно объяснить, что муравьиная кислота вступает в реакцию «серебряного зеркала»? Составьте уравнение этой реакции.
4. При взаимодействии уксусной кислоты с магнием выделилось 5,6
л (н. у.) водорода. Определите массу магния, вступившего в реакцию.
</ Проверочная работа по темам: «Спирты. Альдегиды»:
______________________________________________________________
-
Закончите уравнения реакций:
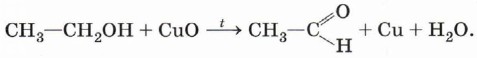
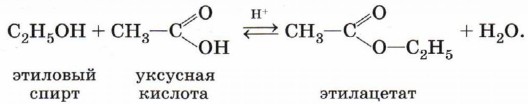
![]()
-
Выберите верные утверждения. Уксусный альдегид реагирует с:
1) гидроксидом меди (II);
2) оксидом меди (II);
3) этиленом;
4) водородом;
5) хлороводородом;
6) аммиачным раствором оксида серебра.
Напишите уравнения возможных реакций.