- Учителю
- Конспект урока на тему: Положение металлов в Периодической системе Д. И. Менделеева.
Конспект урока на тему: Положение металлов в Периодической системе Д. И. Менделеева.
Конспект урока на тему:
Положение металлов в Периодической системе Д.И. Менделеева.
Цель урока: формирование системы знаний о положение металлов в Периодической системе и их общих свойствах.
Задачи урока:
Обучающая - рассмотреть положение металлов в системе элементов Д.И. Менделеева, познакомить обучающихся с основными свойствами металлов, выяснить, чем они обусловлены, познакомить с понятием коррозия металлов
Развивающая - уметь находить в таблице ПСХЭ металлы, уметь сравнивать металлы и неметаллы, объяснять причины химических и физических свойств металлов, развивать теоретическое мышление учащихся и их умение прогнозировать свойства металлов на основе их строения.
Воспитывающая - способствовать развитию познавательного интереса учащихся к изучению химии
Тип урока: урок изучения нового материала.
Методы обучения: словесные и наглядные
Ход урока:
Хронометраж урока.
-
Организационный момент (1 мин.)
-
Актуализация знаний(3 мин)
-
Изучение нового материала
1. Характеристика элемента-металла.
-
1.1. Положение в периодической системе. (10 мин)
-
1.2. Особенности электронного строения атомов.(10 мин)
-
1.3. Восстановительные свойства металлов. (10 мин)
2. Характеристика простого вещества.
-
2.1. Металлическая связь. (5 мин)
4. Эмоциональная разгрузка 2 мин
-
2.2. Физические свойства.( 10 мин)
-
3. Химические свойства. (17 мин)
-
4. Коррозия металлов.( 5 мин)
-
Закрепление (15 мин)
-
Задание на дом (3 мин)
-
Итог урока (1мин)
-
Организационный момент
(Взаимное приветствие, фиксация присутствующих).
-
Актуализация знаний. В начале урока учитель акцентирует внимание учащихся на значимости новой темы, определяемой той ролью, которую металлы играют в природе и во всех сферах деятельности человека. Промышленность
Учитель читает загадку:
Я твердый, ковкий и пластичный,
Блестящий, нужный всем, практичный.
Я вам уже подсказку дал,
Так кто же я такой…? и предлагает записать отгадку в тетрадь в виде темы урока?
-
Изучение нового материала
План лекции.
1. Характеристика элемента-металла.
1.1. Положение в периодической системе.
1.2. Особенности электронного строения атомов.
1.3. Восстановительные свойства металлов.
2. Характеристика простого вещества.
2.1. Металлическая связь.
2.2. Физические свойства.
3. Химические свойства.
4. Коррозия металлов.
1.1. Положение в периодической системе.
Условная граница между элементами-металлами и элементами-неметаллами проходит по диагонали В (бор) - (кремний) - Si (мышьяк) - Те (теллур) - Аs (астат) (проследите ее в таблице Д. И. Менделеева)..
Начальные элементы образуют главную подгруппу I группы и называются щелочными металлами. Свое название они получили от названия соответствующих им гидроксидов, хорошо растворимых в воде, - щелочей.
Из элементов главных подгрупп следующих групп к металлам относят: в IV группе германий, олово, свинец(32,50,82) (первые два элемента - углерод и кремний - неметаллы), в V группе сурьма и висмут(51,83) (первые три элемента - неметаллы), в VI группе только последний элемент - полоний(84) - явно выраженный металл. В главных подгруппах VII и VIII групп все элементы - типичные неметаллы.
Что касается элементов побочных подгрупп, то все они металлы.
Атомы щелочных металлов содержат на внешнем энергетическом уровне только один электрон, который они легко отдают при химических взаимодействиях, поэтому являются сильнейшими восстановителями. Понятно, что в соответствии с ростом радиуса атома восстановительные свойства щелочных металлов усиливаются от лития к францию.
Следующие за щелочными металлами элементы, составляющие главную подгруппу II группы, также являются типичными металлами, обладающими сильной восстановительной способностью (их атомы содержат на внешнем уровне два электрона). Из этих металлов кальций, стронций, барий и радий называют щелочноземельными металлами. Такое название эти металлы получили потому, что их оксиды, которые алхимики называли «землями», при растворении в воде образуют щелочи.
К металлам относятся и элементы главной подгруппы III группы, исключая бор.
к 3 группе относятся металлы называемые подгруппой алюминия.
1.2 Особенности электронного строения металлов.
Учащиеся на основе полученных знаний формулируют сами определение «металл»
Металлы - это химические элементы, атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя, превращаясь в положительные ионы. Металлы - восстановители. Это обусловлено небольшим числом электронов внешнего слоя, большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром. Атомы металлов имеют сравнительно большие размеры (радиусы), поэтому и их внешние электроны значительно удалены от ядра и слабо с ним связаны. И вторая особенность, которая присуща атомам наиболее активных металлов, - это наличие на внешнем энергетическом уровне 1-3 электронов.
Атомы металлов имеют сходство в строении внешнего электронного слоя, который образован небольшим числом электронов (в основном не больше трех).
Это утверждение можно проиллюстрировать на примерах Na, алюминия А1 и цинка Zn. Составляя схемы строения атомов, по желанию можно составлять электронные формулы и приводить примеры строения элементов больших периодов, например цинка.
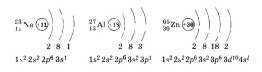
В связи с тем, что электроны внешнего слоя атомов металлов слабо связаны с ядром, они могут быть «отданы» другим частицам, что и происходит при химических реакциях:
![]()
Свойство атомов металлов отдавать электроны является их характерным химическим свойством и свидетельствует о том, что металлы проявляют восстановительные свойства.
1.3 Восстановительные свойства металлов.
Далее учитель просит учащихся сравнить восстановительную способность металлов, принадлежащих одному периоду и одной подгруппе.
-
Как изменяется окислительная способность элементов III периода?
( окислительные свойства в периодах усиливаются, а восстановительные - ослабевают. Причиной изменения этих свойств- увеличение количества электронов на последней орбитале.)
-
Как изменяются окислительные свойства у элементов 4 группы главной подгруппы? (снизу вверх окислительные свойства усиливаются. Причиной изменения этих свойств является уменьшение радиуса атома(легче принять чем отдать)
-
Исходя из положения металлов в Периодической системе какой можно сделать вывод об окислительно-восстановительных свойствах элементов- металлов?
(Металлы являются восстановителями в химических реакциях, т.к. отдают свои валентные электроны)
Учащиеся отвечают, что прочность связи валентных электронов с ядром зависит от двух факторов: величины заряда ядра и радиуса атома. .
(запись вывода в тетрадях учащихся)в периодах с увеличением заряда ядра восстановительные свойства уменьшаются.
У элементов - металлов побочных подгрупп свойства чуть-чуть другие.
Учитель предлагает сравнить активность элементов побочной подгруппы. Cu, Ag, Au - активность элементов - металлов падает. Эта закономерность наблюдается и у элементов второй побочной подгруппы Zn, Cd, Hg.Увеличение электронов на внешнем уровне поэтому восстановительные свойства ослабевают
У элементов побочных подгрупп - это элементы 4-7 периодов 31-36, 49-54 - с увеличением порядкового элемента радиус атомов изменятся мало, а величина заряда ядра увеличивается значительно, поэтому прочность связи валентных электронов с ядром усиливается, восстановительные свойства ослабевают.
2.1. Металлическая связь.
Металлическая связь осуществляется посредством взаимного притяжения атом-ионов и относительно свободных электронов.

Рисунок 1.
Строение кристаллической решетки металлов
В металлах валентные электроны удерживаются атомами крайне слабо и способны мигрировать. Атомы, оставшиеся без внешних электронов, приобретают положительный заряд. Они образуют металлическую кристаллическую решётку.
Совокупность обобществлённых валентных электронов (электронный газ), заряженных отрицательно, удерживает положительные ионы металла в определённых точках пространства - узлах кристаллической решётки, например, металла серебро.
Внешние электроны могут свободно и хаотично перемещаться, поэтому металлы характеризуются высокой электропроводностью (особенно золото, серебро, медь, алюминий).
Химическая связь предполагает определенный вид кристаллической решетки. Металлическая химическая связь способствует образованию кристаллов с металлической кристаллической решеткой. В узлах кристаллической решетки находятся атом-ионы металлов, а между ними свободно движущиеся электроны. Металлическая связь отличается от ионной, т.к. нет анионов, хотя есть катионы. Отличается она и от ковалентной, т.к. не образуются общие электронные пары.
Таким образом, кристаллическая решетка зависит и определяется видом химической связи, но в то же время является причиной для физических свойств.
-
Эмоциональная разгрузка
Отсутствие какого металла описал академик А. Е. Ферсман?
На улицах стоял бы ужас разрушения: ни рельсов, ни вагонов, ни паровозов, ни автомобилей не оказалось бы, даже камни мостовой превратились бы в глинистую труху, а растения начали бы чахнуть и гибнуть без этого металла. Разрушение ураганом прошло бы по всей Земле, и гибель человечества сделалась бы неминуемой. Впрочем, человек не дожил бы до этого момента, ибо лишившись трех граммов этого металла в своем теле и в крови, он бы прекратил свое существование раньше, чем развернулись бы нарисованные события (Ответ: Все люди бы погибли, лишившись железа в крови)
Назовите металл фальшивомонетчиков
Название металлу было дано испанскими конкистадорами, которые в середине XVI в. впервые познакомились в Южной Америке (на территории современной Колумбии) с новым металлом, внешне похожим на серебро. Название металла буквально означает «маленькое серебро», «серебришко».
Объясняется такое пренебрежительное название исключительной тугоплавкостью металла, который не поддавался переплавке, долгое время не находил применения и ценился вдвое ниже, чем серебро. Они использовали этот металл для изготовления фальшивых монет.
На сегодняшний день, этот металл, используемый как катализатор и в ювелирном деле, является одним из самых дорогих.
В чистом виде ее в природе не существует. Самородная платина обычно представляет собой естественный сплав с другими благородными (палладий, иридий, родий, рутений, осмий) и неблагородными (железо, медь, никель, свинец, кремний) металлами. Для ее получения самородки разогревают в котлах с "царской водкой" (смесь азотной и соляной кислоты) и затем "доводят" многочисленными химическими реакциями, нагревом и плавкой.
Таким образом, кристаллическая решетка зависит и определяется видом химической связи, но в то же время является причиной для физических свойств.
2.2. Физические свойства.
Учитель подчеркивает, что физические свойства металлов определяются именно их строением.
а) твердость - все металлы кроме ртути, при обычных условиях твердые вещества. Самые мягкие - натрий, калий. Их можно резать ножом; самый твердый хром - царапает стекло
б) плотность. Металлы делятся на мягкие (5г/см³) и тяжелые (меньше 5г/см³).
в) плавкость. Металлы делятся на легкоплавкие и тугоплавкие.
г) электропроводность, теплопроводность металлов обусловлена их строением. Хаотически движущиеся электроны под действием электрического напряжения приобретают направленное движение, в результате чего возникает электрический ток.
При повышении температуры амплитуда движения атомов и ионов, находящихся в узлах кристаллической решетки резко возрастает, и это мешает движению электронов, и электропроводность металлов падает.
Следует отметить, что у некоторых неметаллов, при повышении температуры электропроводность возрастает, например, у графита, при этом с повышением температуры разрушаются некоторые ковалентные связи, и число свободно перемещающихся электронов возрастает.
д) металлический блеск - электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло. Попадают на узлы кристаллической рещетки. Поэтому все металлы в кристаллическом состоянии имеют металлический блеск. Для большинства металлов в ровной степени рассеиваются все лучи видимой части спектра, поэтому они имеют серебристо-белый цвет. Только золото и медь в большой степени поглощают короткие волны и отражают длинные волны светового спектра, поэтому имеют желтый цвет. Самые блестящие металлы - ртуть, серебро, палладий. В порошке все металлы, кроме Al и Mg, теряют блеск и имеют черный или темно-серый цвет.
е) пластичность
Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи, и поэтому металл характеризуется высокой пластичностью.
3. Химические свойства.
По своим химическим свойствам все металлы являются восстановителями, все они сравнительно легко отдают валентные электроны, переходят в положительно заряженные ионы, то есть окисляются. Восстановительную активность металла в химических реакциях, протекающих в водных растворах, отражает его положение в электрохимическом ряду напряжений металлов( Открыл и составил Бекетов)
Чем левее стоит металл в ряду электрохимическом ряду напряжений металлов, тем более сильным восстановителем он является, самый сильный восстановитель - металлический литий, золото - самый слабый, и, наоборот, ион золото (III) - самый сильный окислитель, литий (I) - самый слабый.
Каждый металл способен восстанавливать из солей в растворе те металлы, которые стоят в ряду напряжений после него, например, железо может вытеснять медь из растворов ее солей. Однако следует помнить, что металлы щелочных и щелочно-земельных металлов будут взаимодействовать непосредственно с водой.
Металлы, стоящее в ряду напряжений левее водорода, способны вытеснять его из растворов разбавленных кислот, при этом растворяться в них.
Восстановительная активность металла не всегда соответствует его положению в периодической системе, потому что при определении места металла в ряду учитывается не только его способность отдавать электроны, но и энергия, которая затрачивается на разрушение кристаллической решетки металла, а также энергия, затрачиваемая на гидратацию ионов.
Взаимодействие с простыми веществами
-
С кислородом большинство металлов образует оксиды - амфотерные и основные:
4Li + O2 = 2Li2O,
4Al + 3O2 = 2Al2O3.
Щелочные металлы, за исключением лития, образуют пероксиды:
2Na + O2 = Na2O2.
-
С галогенами металлы образуют соли галогеноводородных кислот, например,
Cu + Cl2 = CuCl2.
-
С водородом самые активные металлы образуют ионные гидриды - солеподобные вещества, в которых водород имеет степень окисления -1.
2Na + H2 = 2NaH.
-
С серой металлы образуют сульфиды - соли сероводородной кислоты:
Zn + S = ZnS.
-
С азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании:
3Mg + N2 = Mg3N2.
-
С углеродом образуются карбиды:
4Al + 3C = Al3C4.
-
С фосфором - фосфиды:
3Ca + 2P = Ca3P2.
-
Металлы могут взаимодействовать между собой, образуя интерметаллические соединения:
2Na + Sb = Na2Sb,
3Cu + Au = Cu3Au.
-
Металлы могут растворяться друг в друге при высокой температуре без взаимодействия, образуя сплавы.
Отношение металлов к кислотам.
Чаще всего в химической практике используются такие сильные кислоты как серная H2SO4, соляная HCl и азотная HNO3.
с HCl
Образующиеся в этом процессе ионы водорода H+ выполняют роль окислителя, окисляя металлы, расположенные в ряду активности левее водорода. Взаимодействие протекает по схеме:
Me + HCl - соль + H2↑
2 Al + 6 HCl → 2 AlCl3 + 3 H2↑
2│Al0 - 3e- → Al3+ - окисление
3│2H+ + 2e- → H2 - восстановление
«Царская водка» (ранее кислоты называли водками) представляет собой смесь одного объема азотной кислоты и трех-четырех объемов концентрированной соляной кислоты, обладающую очень высокой окислительной активностью. Такая смесь способна растворять некоторые малоактивные металлы, не взаимодействующие с азотной кислотой. Среди них и «царь металлов» - золото. Такое действие «царской водки» объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота (III), или хлорида нитрозила - NOCl:
Реакции окисления золота протекают согласно следующим уравнениям:
Au + HNO3 + 4 HCl → H[AuCl4] + NO + 2H2O
Если кислоты могут взаимодействовать с основаниями и основными оксидами, а ключевым элементом в их составе является металл, то возможно ли взаимодействие металлов с кислотами. Проверим это экспериментально.
Магний взаимодействует с кислотой при нормальных условиях, цинк - при нагревании, медь - не взаимодействует.
Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе:
-
Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) - и при взаимодействии с водой.
-
Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют.
-
При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
4. Коррозия металлов - физико-химическое или химическое взаимодействие между металлом (сплавом) и средой, приводящее к ухудшению функциональных свойств металла (сплава), среды или включающей их технической системы.
Слово коррозия происходит от латинского «corrodo» - «грызу» (позднелатинское «corrosio» означает «разъедание»).
Коррозия вызывается химической реакцией металла с веществами окружающей среды, протекающей на границе металла и среды. Чаще всего это окисление металла, например, кислородом воздуха или кислотами, содержащимися в растворах, с которыми контактирует металл. Особенно подвержены этому металлы, расположенные в ряду напряжений (ряду активности) левее водорода, в том числе железо.
В результате коррозии железо ржавеет. Этот процесс очень сложен и включает несколько стадий. Его можно описать суммарным уравнением:
4Fe + 6H2O (влага) + 3O2 (воздух) = 4Fe(OH)3
Гидроксид железа(III) очень неустойчив, быстро теряет воду и превращается в оксид железа(III). Это соединение не защищает поверхность железа от дальнейшего окисления. В результате железный предмет может быть полностью разрушен.
Для замедления коррозии на поверхность металла наносят лаки и краски, минеральные масла и смазку. Подземные конструкции покрывают толстым слоем битума или полиэтилена. Внутренние поверхности стальных труб и резервуаров защищают дешевыми покрытиями из цемента.
Для стальных изделий используют так называемые преобразователи ржавчины, содержащие ортофосфорную кислоту (Н3РО4) и ее соли. Они растворяют остатки оксидов и формируют плотную и прочную пленку фосфатов, которая способна на некоторое время защитить поверхность изделия. Затем металл покрывают грунтовочным слоем, который должен хорошо ложиться на поверхность и обладать защитными свойствами (обычно используют свинцовый сурик или хромат цинка). Только после этого можно наносить лак или краску.
-
Закрепление (15 мин)
Учитель:
Теперь, для закрепления проведем тест.
Решите тестовые задания
1.Выберите группу элементов, в которой находятся только металлы:
А) Al, As, P; Б) Mg, Ca, Si; В) K, Ca, Pb
2. Выберите группу, в которой находятся только простые вещества - неметаллы:
А) K2O, SO2, SiO2; Б) H2, Cl2, I2 ; В)Ca, Ba, HCl;
3. Укажите общее в строении атомов K и Li:
А) 2 электрона на последнем электронном слое;
Б) 1 электрон на последнем электронном слое;
В) одинаковое число электронных слоев.
4. Металлический кальций проявляет свойства:
А) окислителя;
Б) восстановителя;
В) окислителя или восстановителя в зависимости от условий.
5. Металлические свойства натрия слабее, чем у -
А) магния; Б) калия; В) лития.
6. К неактивным металлам относятся:
А) алюминий, медь, цинк; Б) ртуть, серебро, медь;
В) кальций, бериллий, серебро.
7. Какое физическое свойство не является общими для всех металлов:
А) электропроводность, Б) теплопроводность,
В) твердое агрегатное состояние при нормальных условиях,
Г) металлический блеск
8.Металлы при взаимодействий с неметаллами проявляют свойства:
а) окислительные;
б) восстановительные;
в) и окислительные, и восстановительные;
г) не участвуют в окислительно-восстановительных реакциях.
9.В периодической системе типичные металлы расположен
а) верхней части
б) нижней части
в) правом верхнем углу
г) левом нижнем углу
Часть В. Ответом к заданиям этой части является набор букв, которые следует записать
Установите соответствие.
С увеличением порядкового номера элемента в главной подгруппе II группы Периодической системы свойства элементов и образуемых ими веществ изменяются следующим образом:
1) число электронов на внешнем уровне
А) увеличивается
3) электроотрицательность
4) восстановительные свойства
Б) уменьшается
В) не изменяется
(Ответы: 1 -Г, 2 -А, 3 -В, 4-Б, 5-Г)
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Закончить уравнения практически осуществимых реакций, назвать продукты реакции
Li+ H2O =
Cu + H2O = Cu(OH)2 + H2
Ba + H2O =
Mg + H2O =
Ca + HCl=
2Na + 2H2SO4(К)= Na2SO4 + SO2 + 2H2O
HCl + Zn =
H2SO4 (к)+ Cu= CuSO4 + SO2 + H2O
H2S + Mg =MgS+H2
HCl + Cu =
-
Задание на дом : записи в тетрадях, сообщения о применении металлов.
Учитель Предлагает создать синквейн по теме.
1 строка: Существительное ( одно по теме) (Металлы)
2 строка: два прилагательных
3 строка: три глагола
4 строка: четыре слова объединённых в предложение
5 строка: слово выражающее сущность данной темы.
-
Итог урока
Учитель: И так, мы рассмотрели строение и физические свойства металлов, их положение в периодической системе химических элементов Д.И. Менделеева.