- Учителю
- Урок на тему Металлы IА группы 9 класс
Урок на тему Металлы IА группы 9 класс
Урок: Металлы главной подгруппы I группы периодической системы.
Цель занятия: Изучение физических и химических свойств щелочных металлов, основных способах их получения и областях применения.
Задачи:
1. Учебно- обучающая: дать общую характеристику щелочных металлов в свете общего,
особенного и единичного по трем формам существования химических
элементов: атомов, простых веществ и сложных веществ. Повторить
основные закономерности изменения свойств элементов в
Периодической системе (в группе), металлическую связь. Физические и
химические свойства металлов.
2. Учебно-развивающие: способствовать дальнейшему развитию логического мышления
учащихся - формировать умение сравнивать, обобщать.
Продолжить развитее навыков самообразования: умение работать
с книгой, инструкцией, тестом.
3. Учебно - воспитательные: продолжить формирование диалектико материалистического учения: подтвердить на примере изучения данной темы причин следственную зависимость, развитие от простого к сложному.
Тип урока: изучение нового материала
Метод: метод проектов, исследовательский
Методические приемы:
-
работа с презентацией
-
практическая работа
-
дискуссия
-
постановка проблемных заданий
-
рассказ
Формы работы на уроке: индивидуальная, групповая.
Технологические особенности:
1. Применение ИКТ-технологии.
2. Исследовательская деятельность.
3. Здоровьесберегающие технологии.
Оборудование:компьютер, проектор, экран, презентация Power Point, периодическая система периодических элементов Д.И. Менделеева, химическая посуда, натрий, кристаллизатор с водой, фенолфталеин, кристаллизатор с раствором хлорида алюминия тигельные щипцы, газовая горелка.
Участники: Учащиеся поделены на 6 групп:
Роль учителя: помощник-наблюдатель.
Подготовительная работа к уроку: Заранее учащиеся делятся на группы, и дается опережающее задание: найти информацию «Об открытии щелочных металлов», «О применении щелочных металов», « О роли щелочных металлов в живых организмах»
Класс до урока разделить на 6 групп. Со звонком ученики рассаживаются уже в группы. На столах ученикам:
Правила ТБ
Критерий оценки.
Задание №2-4 для каждой группы.
Энциклопедия "Химия"
Реактивы и оборудование для задания №2.
План урока
-
Организационный момент. Мотивация учебной деятельности.
-
Активизация мыслительной деятельности учащихся.
-
Организация учебной деятельности учащихся
-
Этап рефлексии
-
Итог урока. Выставление оценок.
-
Домашнее задание.
Ход урока:
1. Организационный момент. Мотивация учебной деятельности. (5 мин)
Учитель: Предлагаю следующее задание. (Задание 1) Сейчас вашему вниманию будет представлено несколько слайдов. Вы, просматривая слайды, выпишите в тетради формулы всех представленных минералов.
Демонстрация презентации "Минералы".<Презентация> (2 мин)
Учитель: Ребята, соли каких металлов входят в состав перечисленных выше горных пород?
Учащиеся перечисляют: Каменная соль- соль натрия, Сильвинит- соль натрия и калия,Поллуцит- соль натрия и цезия, сподумен -соль лития.
Учитель: Скажите, какие это металлы, к какой группе периодической системы они относятся?
Учащиеся: Щелочные металлы составляют главную подгруппу I-ой группы периодической системы.
Учитель: На основании выше сказанного давайте вместе с вами сформулируем тему нашего сегодняшнего урока.
Учащиеся: Металлы главной подгруппы I группы периодической системы. ( Записывают втетради, а учитель на доске)
Учитель:Итак, тема урока: "Металлы главной подгруппы I группы периодической системы". Что же ам необходимо выяснить сегодня и щелочных металлах? Сформулируйте цель урока.
Ученики:.(формулируют цель)
Учитель:да, ребята я с вами согласна.
Затем идет работа в группах:
1. Дайте характеристику металлам по положению их в таблице.
2. Каковы особенности строения атомов? Составьте схемы строения
атомов ( Li, Rb)
3. Проанализируйте положения металлов в электрохимическом ряду
напряжения .
Заполните таблицу( Задание №2)
Название элемента
Знак
Порядковый номер
Относительная атомная масса,
Аr
Количество электронов на внешнем уровне
Степень окисления
ЛИТИЙ НАТРИЙ КАЛИЙ РУБИДИЙ ЦЕЗИЙ ФРАНЦИЙ
Ученики делают вывод: Общая черта в строении этих атомов - один электрон на внешней оболочке, который они легко отдают, являются при этом восстановителями, степень окисления + 1. Это активные металлы, так как ряд напряжений начинается с щелочных металлов. Поэтому можно предположить ,что они самые активные металлы.
Учитель: Так ли это на самом деле?
Вместе с учениками определяем название нашего будущего проекта: «Химические свойства элементов I- ой группы главной подгруппы в периодической таблице».
2. Активизация мыслительной деятельности учащихся. (10 мин)
Учитель: Правила ТБ лежат у вас на столах, повторите их. Когда будете презентовать результат своей работы, должны написать уравнения реакций на доске и продемонстрировать опыт.
Работа в группах
Ребята выполняют задания. Готовятся к выступлению. Оформляют в тетрадях таблицу
Протокол сследования
Лабораторные работы "Изучение свойств щелочных металлов".
( Задание №3)
1 группа: работая с материалами учебника исследуйте нахождение щелочных металлов в природе. Сделайте вывод об их химической активности.
2 группа: Изучите физические свойства щелочных металлов. Сравните физические показатели плотности металлов и температуры плавления. Сделайте вывод о зависимости температуры плавления от плотности металла.
3, 6 группа: Изучите взаимодействие натрия с водой. Составьте рекомендации.
4 группа: Изучите взаимодействие натрия с раствором хлорида алюминия. Составьте рекомендации.
5 группа: Изучите горение щелочных металлов на воздухе. Составьте рекомендации.
Примечание. Щелочные металлы хранятся в специальной таре. В данном случае склянки с металлами уже приготовлены для опыта.
Инструктивная карточка для группы №1
Работая с материалами учебника исследуйте нахождение щелочных металлов в природе. Сделайте вывод об их химической активности.
Протокол исследования группы №1
Работая с учебником, найдите решение проблемы
Проблема
Гипотеза
Проверка гипотезы. Уравнения реакций
Наблюдения
Вывод
Почему в земной коре не могут встречаться в свободном состоянии щелочные металлы, их оксиды и гидроксиды?
Инструктивная карточка для группы №2
Изучите физические свойства щелочных металлов. Сравните физические показатели плотности металлов и температуры плавления. Сделайте вывод о зависимости температуры плавления от плотности металла.
Проблема
Гипотеза
Проверка гипотезы. Уравнения реакций
Наблюдения
Вывод
Почему щелочные металлы режутся ножом? Почему в лабораториях они хранятся в запаянных ампулах, под слоем керосина, а вот литий под слоем вазелина?
Инструктивная карточка для групп №3, 6
Прежде чем приступить к опыту ознакомьтесь с ИНСТРУКЦИЯ № 12
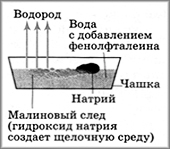
Лабораторный опыт "Взаимодействие щелочных металлов с водой".
Проведите опыт: Для опыта возьмём образец активного металла (см.ряд активности металлов): Na. В кристаллизатор с водой прильем 2-5 капель фенолфталеина и поместим небольшой, очищенный (скальпелем) от перекиси и предварительно подсушенный (сухой фильтровальной бумагой) от керосина кусочек Na, (под наблюдение учителя). Запишите наблюдения, сделайте выводы, составьте химическое уравнение.

![]()
Проблема
Гипотеза
Проверка гипотезы. Уравнения реакций
Наблюдения
Вывод
Почему щелочные металлы нельзя тушить водой и как удалять их остатки после работы?
Инструктивная карточка для группы №4.
Прежде чем приступить к опыту ознакомьтесь с ИНСТРУКЦИЯ № 12
Лабораторный опыт "Взаимодействие щелочных металлов с хлоридом алюминия".
В кристаллизатор с раствором хлорида алюминия и несколькими каплями фенолфталеина поместить небольшой кусочек натрия (работаем под наблюдением учителя). Запишите наблюдения, сделайте выводы, составьте химическое уравнение.
Проблема
Гипотеза
Проверка гипотезы. Уравнения реакций
Наблюдения
Вывод
Почему щелочные металлы не вытесняют алюминий из растворов его солей?
Инструктивная карточка для группы №5
Прежде чем приступить к опыту ознакомьтесь с ИНСТРУКЦИЯ № 12</</p>
Лабораторный опыт "Окрашивание пламени ионами щелочных металлов".
Инструкция:
1. Нихромовую проволоку с ушком (от электроспирали), предварительно очистить в растворе соляной кислоты и прокалить над спиртовкой до бесцветного пламени. Поместить в ушко немного кристаллической соли и внести в пламя. Перед каждым опытом проволоку обрабатывают в соляной кислоте и прокаливают
Результаты эксперимента оформите в тетради.
Проделайте аналогичные опыты с остальными металлами, отметьте цвет пламени при их сгорании.
Презентация групп (обсуждение результатов работы)
Проблема
Гипотеза
Проверка гипотезы. Уравнения реакций
Наблюдения
Вывод
Как можно распознать ионы щелочных металлов?
Результаты работы группы №3 и 6
Наблюдения:
- Натрий «бегает» по поверхности воды и быстро реагирует с ней, полностью исчезнув, выделяется газ, а вода окрашивается в розовато-малиновый цвет;
2Na + 2 H2O = 2 NaOH + H2 ^
Работая с литературой мы обратили внимание, что это активные металлы хранят под слоем керосина, так как он мгновенно начнет реагировать с кислородом воздуха.
Вывод: Натрий активно реагирует с водой при обычных условиях
Результаты работы группы №4
Наблюдения показали , что в ходе реакци выделяются пузырьки газа, розово-малиновое окрашивание раствора и образование белого осадка. Почему?
Учащиеся: Натрий (активный металл) активно реагирует с водой растворяющей хлорид алюминия по уравнению:
2Na + 2 H2O = 2 NaOH + H2^. Таким образом, мы объясняем выделение газа (водорода).
Учитель: Как объяснить выделение осадка? Обратимся к таблице растворимости (растворимость исходных и продуктов).
Учащиеся: Все исходные вещества и предполагаемые продукты реакции растворимы в воде.
Учитель: Какие ионы имеются в предложенном растворе?
Учащиеся: Ионы Na+, OH-, Al3+,
Cl--
Мы предположили, что между этими ионами возможно протекания
реакций.
Запишем возможные уравнения реакций взаимодействия между этими
ионами:
Na+ + OH- = NaOH;
Na+ + Cl- = NaСl;
Al3+ + 3Cl- = AlСl3;
Al3+ + 3OH- =Al(OH)3v .
Таким образом, все вещества находятся в одной пробирке, следовательно, вступать во взаимодействие могут не только исходные вещества, но и продукты их взаимодействия.
Запишем оба уравнения и суммируем их:
2Na + 2H2O = 2NaOH + H2^
3NaOH + AlCl3 = Al(OH)3v + 3NaCl
Вывод: согласно ряду напряжения щелочные металлы активные и они должны вытеснять алюминий из раствора солей. Но этого не происходит, исключение: щелочные и щелочноземельные металлы: они реагируют с водой, растворяющей соли.
Результаты работы группы №5
Наблюдения: Щелочные металлы горят и окрашивают пламя горелки
Li + -темно-красный; Na +- желтый; K+, Rb+, Cs+- сине-фиолетовый.
Вывод: Значит - это качественная реакция на определение катионов щелочных металлов. По окрашиванию пламени горелки можно предположить, катион какого металла входит в состав выданной соли. Щелочные металлы мягкие, серебристо-белого цвета имеют металлический блеск.
3 Закрепление изученного материала
1. Определите "лишний" элемент в ряду
а) Fr, K, Cu, Na;
б) P, Li, O, Cl;
в) Al, Ag, Ra, Cs.
Объясните свой выбор.
Игра «Крестики-нолики»
1. Какой металл при взаимодействии с водой образует щелочь?
Si Na Fr Cu Li Pb Cs Zn K
2. Определите электронные формулы щелочных металлов
4s2 1s1 2s2 3s1 6s1 2s1 3s2 3p1 4s1 6s2
Учитель: А теперь послушаем краткие сообщения, которые были подготовлены заранее.
1. Применение щелочных металлов и их соединений.
4. Этап контроля знаний
Вариант 1
1.Соединение NaCl называется
1) каустическая сода, 2) кристаллическая сода,
3) питьевая сода, 4) галит.
2.Используется в производстве стекла, бумаги, мыла
1) Na2CO3*10 H2O 2) Na2SO4*10H2O
3) NaCl 4) NaOH
3. Продукт взаимодествия лития с кислородом
1) Li2O 2) Li2O2
3) LiOH 4) LiO
4. Цвет пламени, в который его окрашивают ионы натрия
1) желтый 2) фиолетовый
3) красный 4) зеленый
5. В 100 г фасоли содержится 1,075 г калия.
Сколько фасоли нужно съесть, чтобы получить суточную норму калия (5 г/сутки)?
1) 465 г 2)0,053 г 3)107 г 4)21,5 г
Вариант 2
1.Соединение Na2SO4 *10H2O называется
1) глауберовая соль 2) поваренная соль
2) пищевая сода 4) поташ
2. Разъедает ткани и бумагу. Используется при производстве мыла и волокон
1) Na2CO3*10 H2O 2) Na2SO4*10H2O
3) NaCl 4) NaOH
3. Продукт взаимодействия натрия с кислородом
1) Na2O 2) Na2O2
3) NaOH 4) NaO
4. Цвет пламени, в который его окрашивают ионы калия
1) желтый 2) фиолетовый
3) красный 4) зеленый
5. В 100 г изюма содержится 3,055 г калия.
Сколько изюма нужно съесть, чтобы получить суточную норму калия (5 г/сутки)?
1) 0,15 г 2) 164 г 3) 61,5 г 4) 305 г
Этап рефлексии (3мин)
Внутренняя оценка деятельности участников группы
Ф.И. обучающихся
Работа с литературой
Проведения эксперимента
Выдвижение гипотез, формирование вывода
5. Итог урока. Выставление оценок. Учитель ставит оценки, комментируя.(5 мин)
6.Домашнее задание.( 2 мин)
1 Изучите параграф 50. Ответь на вопросы, которые поставлены в параграфе .
2. Подготовить кроссворд по теме: «Распространение щелочных металлов в природе и биологическое значение щелочных металлов»
.
ИНСТРУКЦИЯ № 12
ТЕХНИКА БЕЗОПАСНОСТИ
ПРИ РАБОТЕ С ЩЕЛОЧНЫМИ МЕТАЛЛАМИ
Из щелочных металлов, применяющихся в школе, наибольшей осторожности в обращении требует натрий. Литий обладает меньшей химической активностью. Калий в школе применяться не должен!
Хранят щелочные металлы и работают с ними вдали от воды, водных растворов и галоидированных жидкостей. Куски металлов хранят в фабричной упаковке. На банке и металлическом кожухе делают полоски-наклейки красного и зеленого цветов. Слой изолирующей жидкости (керосина) в банке над поверхностью металла должен быть не менее 10-15мм. Банку закрывают пропарафиненной пробкой или пластмассовой навинчивающейся крышкой.
При опытах с щелочными металлами их поверхность предварительно очищают от пероксидов. Пинцетом вынимают из банки кусок металла, помещают его в заполненную керосином чашку с плоским дном и в ней, очистив от налета, нарезают на порции необходимой величины. Непосредственно перед опытом очищенные кусочки достают пинцетом из керосина, быстро и тщательно осушают фильтровальной бумагой и используют по назначению. Если после опыта остается немного металла, кусочки полностью растворяют в этиловом спирте и выливают в канализацию.
Все работы с щелочными металлами проводятся с применением средств индивидуальной защиты, т.к. при попадании на кожу или влажную одежду кусочков металлов возможны химические ожоги и даже воспламенение.
Первая помощь заключается в как можно более быстром удалении кусочков металла с поверхности кожи. Затем следует обмыть пораженное место под струёй воды (10-15 мин.). После промывания для нейтрализации надо наложить повязку из марли или ватный тампон, пропитанные 5%-м раствором уксусной кислоты. Через 10 мин. повязку снять, осторожно удалить остатки влаги с кожи фильтровальной бумагой или мягкой тканью и смазать поверхность кожи глицерином для уменьшения болевых ощущений.
Хранят щелочные металлы в переносном металлическом ящике-сейфе, который при пожаре подлежит выносу в первую очередь.
Опыты с щелочными металлами проводит только учитель.
Группа хранения № 2 - вещества, выделяющие при взаимодействии с водой легковоспламеняющиеся газы.