- Учителю
- Гидролиз солей.Урок химии в 9 классе
Гидролиз солей.Урок химии в 9 классе
Тема урока: « Гидролиз солей».
Предмет химия
Класс 9
Учитель Гуриева Лариса Тепсарикоевна
Муниципальное бюджетное образовательное учреждение средняя общеобразовательная школа №3 г.Владикавказа
Тип урока: изучение новых знаний и способов действия с использованием ИКТ технологии.
Цели урока:
-
Образовательная: сформировать у учащихся понятие о гидролизе солей, как реакции ионного обмена, рассмотреть механизм ее с точки зрения ТЭД, обобщить и углубить знания об обратимых химических реакциях.
-
Развивающая: развивать внимание, познавательный интерес, трудолюбие, логическое мышление, развивать общеучебные умения и навыки.
-
Воспитывающая: формировать материалистическое представление об окружающем мире, воспитывать осознанное представление о химии как производительной силе общества, воспитывать чувство ответственности за сохранение окружающей среды.
Задачи:
-
совершенствовать умение работать с учебным материалом, научить составлять уравнения гидролиза в молекулярном и ионном виде.
-
Сравнивать состав и свойства солей, прогнозировать реакцию среды раствора соли на основе анализа её состава, уметь строить аналогию и самостоятельно делать выводы по результатам проведенных опытов.
-
Сформировать понимание практического значения гидролиза в природе и жизни человека.
Оборудование и реактивы:
-
Компьютер, мультимедийный проектор, презентация «Гидролиз солей», таблицы: «Растворимость солей, кислот и оснований в воде»,
-
Лабораторное оборудование: универсальный индикатор или раствор лакмуса, набор растворов солей, кислот, щелочей.
Ход урока:
I. Организационный момент.
Объявляю тему и задачи урока.
II.Актуализация знаний учащихся
-
Какие вещества называются электролитами
-
Назовите формулы сильных оснований.
-
Назовите формулы слабых оснований.
-
Назовите формулы сильных кислот.
-
Назовите формулы слабых кислот.
III Изучение нового материала
Используется создание проблемной ситуации для решения образовательной задачи, которая определяет мотивацию учебной деятельности учащихся на основе их конкретного опыта.
IV.1. Проведение лабораторных опытов :
На демонстрационном столе растворы кислоты, щелочи, хлорида цинка и карбоната калия, хлорида натрия, ацетата аммония
Учащимся предлагается определить среду растворов с помощью индикатора лакмуса.
Лакмус окрасился в красный цвет в растворах кислоты и хлорида меди
В растворах щелочи и карбоната натрия лакмус окрасился в синий цвет.
Лакмус не изменяет окраску, остаётся фиолетовым в растворе хлорида натрия
Учащиеся в тетрадях записывают уравнения диссоциации данных веществ:
HCl↔ H+ + Cl- ; NaOH↔ Na+ + OH- ; ZnСI2↔Zn2++ 2СI-; Να2СО3 ↔ 2Na+ + CO32- NaCl ↔ Na+ + СI-;
Вполне понятно, что в пробирках №1 и №2 изменение окраски индикатора обусловлено наличием ионов Н+ и ОН-.
Проблемная ситуация: почему в растворах солей, находящихся в пробирках №3 и №4 индикатор также поменял окраску? Из уравнения диссоциации этих солей мы не видим, что образуется свободные ионы Н+ и ОН- которые изменяют окраску индикатора. Как вы объясните этот факт? Перед учащимися поставлена проблема, которую они не могут решить на данном этапе, так как не обладают необходимыми знаниями. Объясняю, что при растворении солей в воде происходит не только процесс диссоциация, но и гидролиз.
IV. Изучение процесса гидролиза солей.
Гидролиз (от греч. Hydro - вода, lysis - разложение) означает разложение веществ водой.
Гидролиз соли -это обратимое взаимодействие соли с водой, приводящее к образованию слабого электролита
Рассмотрим подробнее процесс гидролиза солей. Соль можно рассматривать как продукт взаимодействия кислоты и основания. В зависимости от вида кислоты и вида основания выделяют четыре типа солей:
1.Соль, образованная сильным основанием и сильной кислотой.
2.Соль, образованная слабым основанием и слабой кислотой.
3.Соль, образованная сильным основанием и слабой кислотой.
4.Соль, образованная слабым основанием и сильной кислотой
Составление уравнений гидролиза соли.
Для более успешного и лучшего понимания механизма гидролиза солей, необходимо составить алгоритм записи уравнений реакций гидролиза:
1.Записать уравнение диссоциации соли
2.Записать слабый ион
3.Записать его взаимодействие с водой
4.Определить среду раствора
К какому типу солей относится хлорид натрия? Соль, образованная сильным основанием и сильной кислотой.
ΝαCl ↔ Να+ + Cl- ; HOH↔H+ + OH-
В данном случае при диссоциации соли не образуются слабые ионы и, следовательно, не образуется слабый электролит.
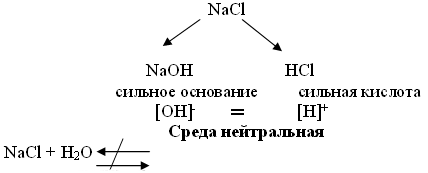
Вывод: ΝαCl не подвергается гидролизу, так как соль образована сильным основанием и сильной кислотой, среда нейтральная
К какому типу солей относится хлорид цинка? Соль, образованная слабым основанием и сильной кислотой.
ZnCl2 ↔ Zn2+ + 2Cl-
Для того, чтобы записать уравнение гидролиза, воспользуемся памяткой.
1. Определим состав соли:
ZnCl2
Слабое основ Сильная к-та
2.Возьмем ион слабого электролита и напишем уравнение его взаимодействия с составными частями воды:
Zn2+ + HOH ↔ ZnOH+ + H+
Сформулируем вывод:
Раствор соли, образованной слабым основанием и сильной кислотой, имеет кислотную реакцию, так как в растворе избыток катионов водорода.
![]()
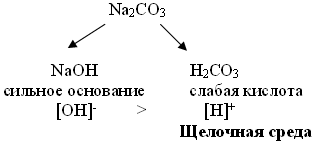
К какому типу солей относится карбонат натрия? Соль, образованная сильным основанием и слабой кислотой.
![]()
Карбонат-ионы прочно связывают катионы водорода, так как угольная кислота слабая.
Катионы натрия не могут быть связаны гидроксид-ионами, так как гидроксид натрия - сильное основание и диссоциирует полностью.
![]()
В результате в растворе избыток гидроксид-ионов, вследствие чего среда щелочная.
Воспользовавшись памяткой, самостоятельно составьте молекулярное уравнение гидролиза карбоната натрия.
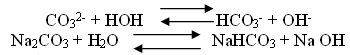
Одним из продуктов данной обменной реакции является кислая соль.
Сформулируем вывод:
Раствор соли, образованной сильным основанием и слабой кислотой, имеет щелочную реакцию, так как в растворе избыток гидроксид-ионов.
К какому типу солей относится ацетат аммония? Соль, образованная слабым основанием и слабой кислотой.
СН3СООΝН4 ↔ СН3СОО- +ΝН4+
HOH ↔H+- + OH-
Слабым ионом будут катион и анион. Гидролиз будет идти одновременно по катиону и аниону СН3СООΝН4+ HOH ↔ СН3СООН+ ΝН4 ОН среда будет нейтральная.
В 11 классе мы покажем, что среда раствора соли, образованной слабой кислотой и слабым основанием, слабокислая или слабощелочная в зависимости от Кд кислоты или основания.
Вывод: Соль CH3 COONH4 подвергается гидролизу по катиону и аниону, так как образована слабой кислотой и слабым основанием.
Отмечу лишь, что зачастую гидролиз в данном случае идет необратимо, соль полностью разлагается водой.
Думаю, теперь мы сможем сформулировать определение понятия "гидролиз"
Проанализируйте записи молекулярных уравнений рассмотренных процессов:
К какому типу мы отнесем данные реакции?
Какие вещества в них участвуют?
В чем заключается сущность гидролиза? Какие продукты данных взаимодействий с точки зрения теории электролитической диссоциации мы получили?
Итак, гидролиз - это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита.
V. Первичная проверка новых знаний и способов деятельности.
На данном этапе проверяется полнота и осознанность усвоения учащимися механизма протекания гидролиза различных типов солей.
Вопросы к учащимся:
1. Какие типы солей различают? 2. Какими способами можно определить предполагаемую среду раствора соли?
3. Можно ли по формуле соли определить ее реакцию среды при гидролизе? 4.К какому виду реакций относится гидролиз?
VI. Закрепление новых знаний и способов действий.
VШ.Подведение итогов урока.