- Учителю
- План-конспект урока по химии для 9 класса по теме: «Аммиак: его состав, строение и свойства»
План-конспект урока по химии для 9 класса по теме: «Аммиак: его состав, строение и свойства»
План - конспект урока по химии в 9 классе
Тема: Аммиак: его состав, строение и свойства
Тип урока: изучение нового материала
Цели урока:
Образовательные:
-
изучить строение, физические, химические свойства аммиака; использование аммиака в народном хозяйстве;
Развивающая:
-
углубить и конкретизировать ранее приобретенные теоретические знания: строение атома, химическая связь, закономерности протекания химических реакций, окислительно-восстановительные реакции;
Воспитательная:
-
воспитание экологической культуры, формирование культуры здоровья на уроке.
Оборудование:
-
Периодическая таблица Д.И.Менделеева;
-
Мультимедиапроектор;
-
Набор лабораторного оборудования и химических реактивов для получения аммиака и проведения опытов с ним;
-
Опорные схемы.
Ход урока:
I. Организационный момент.
Учитель знакомит учащихся с планом проведения урока, который записан на доске.
План урока:
-
Состав и строение молекулы аммиака.
-
Способы получения аммиака.
-
Физические свойства аммиака.
-
Химические свойства аммиака.
5. Использование аммиака в народном хозяйстве.
6. Закрепление знаний.
II. Актуализация знаний.
Учитель: Эта история произошла во время I мировой войны. Английский крейсер вел преследование поврежденного в бою немецкого эсминца. Цель была почти достигнута, как вдруг между кораблями появилось плотное белое облако дыма. Экипаж крейсера почувствовал удушливый запах, раздражающий горло и легкие. Крейсер был вынужден дать задний ход и выйти из дымового облака. Уже после обнаружили, что пострадали не только люди, но и металлические части корабля.
Попробуем частично воспроизвести картину давних лет.
Демонстрационный опыт: «Дым без огня» (просмотр видеофрагмента).
Учитель: Это вещество имеет древнюю историю. Арабские алхимики получали из оазиса Амон, находившегося около храма, бесцветные кристаллы. Они звали вещество «нушадир», его растирали в ступках, нагревали - и всякий раз получался едкий газ. Сначала его именовали аммониак, а потом сократили название до «аммиак».
В средние века этот газ называли почему-то «щелочной воздух», а его раствор и поныне называется «нашатырный спирт».
Давайте, ребята, проведем небольшое исследование и решим, откуда у этого газа столь необычные свойства и названия.
-
Изучение нового материала.
-
Состав и строение молекулы аммиака.
а) Формула аммиака - NH3, т.е. это водородное соединение азота.
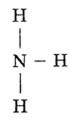
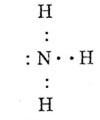
электронная структурная
формула формула
-
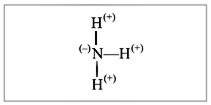
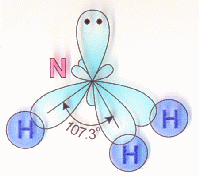
Схема строения полярной ковалентной связи в молекуле аммиака NH3
-
Получение аммиака (опорная схема).
а) в лаборатории:
-
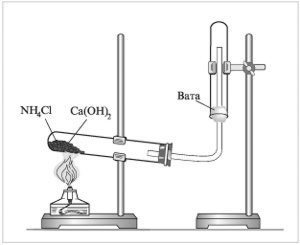
Ca(OH)2(тв) + 2 NH4Cl(тв) = CaCl2 + 2NH3↑ +2H2O
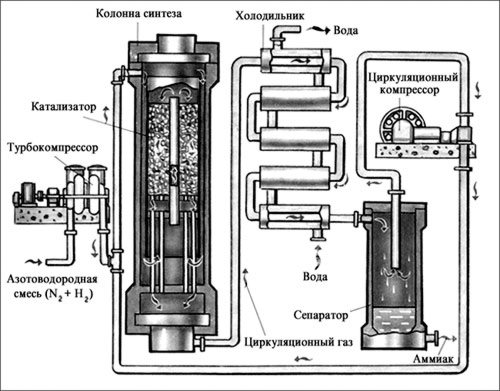
б) в промышленности: N2 + 3H2 = 2NH3
1v 3v 2v
Условия смещения равновесия в сторону выхода аммиака:
+Q, уменьшение температуры (400 С)
-V, увеличение давления.
Характеристика реакции: (экзотермическая, с уменьшением объема, обратимая, гетерогенная, каталитическая - катализатор Fe.)
3. Физические свойства аммиака.
а) NH3 - газ;
б) М (NH3) =17г/моль; М(NH3)<M(возд.)
(М(воздуха) = 29г/моль, легче воздуха).
в) хорошо растворим в воде: 1л.(Н2О) до 700л. (NH3), при комн. tº
г) имеет резкий специфический запах.
4. Химические свойства аммиака.
А. Реакции окисления аммиака: NH3 - восстановитель.
1) 4NH3 + 3O2 → 4N2 + 6H2O
2) 4NH3 + 5O2 →4NO + 6H2O
3) 8NH3 + 3Br2 →N2 + 6NH4Br
Б. Реакции аммиака с водой (опорная схема).
4) NH3 + H2O = NH4ОН (гидроксид аммония)
NH4ОН - слабое основание, среда щелочная, рН>7, окраска фенолфталеина -малиновая.
Учитель: Мы уже заметили, что аммиак хорошо растворяется в воде, что он имеет очень резкий запах, наконец, вспомните, ведь его ещё в средние века называли «щелочной воздух».
В. Реакция аммиака с кислотами (опорная схема).
5) NH3 + HCl = NH4Cl (хлорид аммония)
Учитель: Теперь бы вы смогли объяснить англичанам, почему между их кораблем и судном противника появился едкий «дым»? (Конечно, это была реакция образования хлорида аммония).
Учитель: Химики всегда советуют держать дома склянку с нашатырным спиртом: как средство от обморока, для нейтрализации кислот, для выведения жирных пятен и в качестве самого дешёвого и верно действующего огнетушителя.
А где ещё находит своё применение аммиак?
-
Использование аммиака в народном хозяйстве.
Аммиак жидкий применяется для производства азотной кислоты, для азотирования, в качестве хладагента, для создания защитных атмосфер, для переработки на удобрения и для использования в сельском хозяйстве в качестве азотного удобрения.
-
Закрепление знаний.
Вопросы для закрепления темы:
-
Почему аммиак реагирует и с кислотами и с водой?
-
В молекуле аммиака связь между атомами азота и водорода:
а) ионная;
б) ковалентная полярная;
в) ковалентная неполярная.
-
Дано уравнение реакции:
N2 + 3H2 = 2 NH3 + Q
В какую сторону сместится равновесие при:
а) понижение температуры
б) понижение давления
в) уменьшение концентрации водорода.
Задание на закрепление материала:
Даны уравнение реакции:
1) 4NH3 + 3O2 → 4N2 + 6H2O
2) 4NH3 + 5O2 →4NO + 6H2O
Составьте электронный баланс.
-
Подведение итогов урока.
Домашнее задание:
Сделать сообщение по теме: «Влияние нитратов, нитритов на организм человека» (форма представления - презентация, буклет, доклад и.т.п.).
Опорные схемы
-
Получение аммиака в лаборатории.
Реактивы и оборудование: штатив, пробирки, газоотводная трубка, фарфоровая ступка, фарфоровая чашка, фенолфталеин.
Вопросы:
1. Из каких веществ получают аммиак в лаборатории?
2. Как обнаружить выделение аммиака?
3. Для получения аммиака как следует держать пробирку? Почему?
-
Можно ли собрать аммиак методом вытеснения воды?
-
Получение аммиака в промышленности.
-
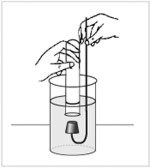
Реакции аммиака с водой.
Вопросы для самоконтроля
-
Как определить герметичность прибора для получения газов?
-
С какой целью вставляется вата в прибор при получении аммиака?
-
Как определить начало выделения аммиака из смеси веществ?
-
Что представляет собой «дым», который образуется при взаимодействии аммиака с летучими кислотами?
-
Взаимодействие аммиака с соляной кислотой.

Вопрос: Что наблюдаем?
-
Использование аммиака в народном хозяйстве.



удобрения взрывчатые вещества для паяния



холодильные производство нашатырный
установки азотной кислоты спирт