- Учителю
- Программа эективного курса по химии На перекрёстках естественнонаучных дисциплин (10 класс)
Программа эективного курса по химии На перекрёстках естественнонаучных дисциплин (10 класс)
Администрация Красногорского района
МБОУ «Красногорская СОШ»
«РАССМОТРЕНО»
на заседании школьного методического объединения
Протокол № 1
от 28.08. 2016г
«СОГЛАСОВАНО»
на заседании Методического совета школы
Протокол № 1
от 30. 08. 2016 г
«ПРИНЯТО»
на заседании Педагогического совета школы
Протокол № 1
от 30.08. 2016г
«УТВЕРЖДЕНО»
Приказ МБОУ «Красногорская СОШ»
№ 40/1 от 31.08.2016
Рабочая программа среднего общего образования
Элективный курс
по химии «На перекрёстках естественнонаучных дисциплин»
10 класс

Автор: Афонина Раиса Фёдоровна, учитель
химии высшей квалификационной
категории
2016г.
Пояснительная записка
Программа элективного курса «На перекрёстках естественнонаучных дисциплин» включает материал двух блоков: для предпрофильного обучения в 9 классе и профильного - в 10-11 классах (см. таблицу 1.)
Таблица 1
Элективный курс «На перекрёстках естественнонаучных дисциплин»
10 класс
Новизна программы элективного курса заключается в том, что при её составлении использованы выявленные и ранжированные по принципу «причина - проблема» результаты педагогического исследования «Нейродинамические особенности нервной системы учащихся и трудности в учении».
Элективный курс для 10 класса рассчитан на 35 ч (1 ч в неделю), включает теоретический блок материала, который изучается с использованием фундаментальных законов природы - законов сохранения, периодичности и практический блок. Основной принцип формирования элективного курса - соответствие методологическим принципам современного познания, на основе которого у ученика должна сформироваться целостная научная картина мира.
Курс актуален, так как общие законы, изучаемые различными науками естественнонаучного цикла, составляют знания необходимые любому образованному человеку на общекультурном уровне. Это позволяет сформировать единый взгляд на мир у школьника, создать условия для успешной социализации выпускника школы.
Элективный курс выполняет следующие функции:
-
расширяет содержание базисного курса химии на основе интеграции знаний, полученных на уроках физики, химии, биологии, вокруг основополагающих законов этих наук, которые входят в «золотой» фонд естественнонаучного образования;
-
позволяет школьникам удовлетворить свои познавательные потребности и получить дополнительную подготовку, подготовиться к сдаче ЕГЭ по химии.
Цели элективного курса:
- воспитание личности, имеющей развитое естественнонаучное восприятие природы;
- развитие творческого потенциала учащихся;
- конкретизация химических знаний по основным разделам органической химии на основе фундаментальных законов природы - законы сохранения, периодичности.
Задачи элективного курса:
1. Развивать абстрактно-логическое мышление на основе использования и совершенствования предметных и метапредметных компетенций в ходе познания через мир мыслей, идей (объясняю, оцениваю, анализирую, делаю выводы, выбираю…)
2. Предоставить учащимся возможность углубления и расширения знаний об органических веществах как формы существования материи, её свойствах, видах движения (химических реакциях) на основе законов сохранения, периодичности.
Предпочтительными являются следующие виды работы на основе использования и совершенствования предметных и метапредметных компетенций в ходе познания через мир мыслей, идей (объясняю, оцениваю, анализирую, делаю выводы, выбираю…):
- самостоятельная работа учащихся над теоретическим материалом курса;
- ученическая исследовательская работа в ходе химического эксперимента;
- консультация с учителем;
- защита творческих работ, публичное представление полученных результатов в ходе самостоятельной, ученической исследовательской работ;
- работа в малых группах.
В качестве основных методов обучения используются:
-
методы обучения по источникам получения информации (словесные - лекция, работа с различными источниками информации; практические - практические работы, лабораторные работы, моделирование объектов);
-
методы обучения по уровням познавательной деятельности (частично-поисковый, исследовательский);
-
когнитивные методы - методы учебного познания;
-
оргдеятельные методы (методы ученического целеполагания, ученического планирования, нормотворчества, самоорганизации обучения, взаимообучения, рецензий, контроля, рефлексии, самооценки).
Формы контроля индивидуальных достижений учащихся соответствуют компонентам содержания программы, особенностям предъявляемых требований к предметным и метапредметным компетенциям. Работа каждого ученика в рамках курса оценивается комплексно по следующим компонентам:
-
включённость ученика в учебно-познавательную деятельность и его личностный рост;
-
оценка учащимися друг друга при коллективно-распределительной деятельности в группах;
-
содержание и форма представленной творческой работы; уровень публичной защиты образовательного продукта.
Срок реализации программы 2016-2017гг.
Основное содержание курса
Введение (1 час)
Знакомство с целями и задачами курса, его структурой. Органические вещества - одна из форм существования материи. Отличительные признаки органических веществ от веществ неорганических.
Тема 1. Теоретические основы химии (1ч)
Законы сохранения, периодичности - фундаментальные законы природы. Теория строения органических веществ
Тема 2. Предельные углеводороды (алканы) (4 ч)
Алканы - форма материи, дискретность в строении их молекул. Периодичность в строении их гомологов, изомерии, номенклатура. Свойства: физические, химические - форма движения материи на основе законов сохранения, периодичности.
Лабораторная работа 1. Определение качественного состава алканов
Тема 3. Непредельные углеводороды (6 ч)
Алкены, алкадиены, алкины - формы материи, дискретность в строении их молекул. Периодичность в строении гомологов алкенов, алкадиенов, алкинов, их изомерия, номенклатура. Свойства: физические, химические - форма движения материи на основе законов сохранения, периодичности.
Лабораторная работа 2. Получение этилена, качественные реакции.
Тема 4. Ароматические углеводороды (арены) (4ч)
Арены - форма материи, дискретность в строении их молекул. Периодичность в строении гомологов аренов, их изомерия, номенклатура. Свойства: физические, химические - форма движения материи на основе законов сохранения, периодичности.
Тема 5. Кислородосодержащие органические соединения (12 ч)
Спирты, альдегиды, карбоновые кислоты, эфиры, углеводы - форма материи, дискретность в строении их молекул. Периодичность в строении гомологов (спиртов, альдегидов, карбоновых кислот), их изомерия, номенклатура. Свойства: физические, химические - форма движения материи на основе законов сохранения, периодичности.
Лабораторная работа 3. Свойства глицерина.
Лабораторная работа 4. Свойства фенола
Лабораторная работа 5.Получение этаналя окислением этанола, характерные свойства этаналя.
Лабораторная работа 6. Получение и свойства карбоновых кислот. Отношение одноосновных карбоновых кислот к окислителям.
Тема 6. Практикум (7 ч)
-
Имитационная игры. Воздействие этанола на организм человека: проблемы и последствия (2 ч.)
-
Многоатомные спирты - структурные компоненты жиров, кремов, мазей, жевательных резинок (2 ч.)
-
Решение экспериментальных задач по распознаванию органических веществ (1 ч.)
-
Творческая мастерская (2 ч.)
Межпредметные связи
Химия - органические и неорганические вещества, дискретность веществ, физические и химические свойства веществ, способы получения веществ, химический эксперимент, зависимость свойств веществ от строения и состава
Физика - вещество, атом, молекула, физические явления, диффузия, проницаемость, закон сохранения массы веществ и превращения энергии.
Биология - дискретность клетки, химический состав клеточной мембраны.
Обществознание - материя, свойства материи, виды движения материи.
Методические рекомендации
Элективный курс рассчитан на 35 ч. Содержание курса сочетается с основным курсом органической химии, не противоречит ему во времени и включает теоретический и практический блоки.
В инструкциях для проведения лабораторных и практических работ дана методика и техника их проведения, структура творческой мастерской (приложение 1, 2.)
Содержание химической компетенции
Результаты обучения
Мотивационный компонент:
-
стремление к самовыражению и индивидуальности;
-
потребность к целеполаганию и рефлексии «Я», «Мы», «Дело».
Знаниевый компонент
Ученик научиться раскрывать смысл
- понятий: органические вещества (алканы, алкены, алкадиены, алкины, арены, спирта, альдегиды, карбоновые кислоты, эфиры, углеводы) - одна из форм существования материи; гомологи и изомеры; химическая связь (ковалентная связь, сигма-, пи- связь, ароматическая связь); радикалы; возбуждённое состояние атома; гибридизация (sp3- , sp2- , sp- гибридизация); генетическая связь основных классов веществ органической химии;
- основных положений теории химического строения органических веществ;
- законов сохранения, периодичности - фундаментальных законов природы;
- дискретности в строении молекул органических молекул;
- химических свойств органических веществ и области практического применения;
- последних достижений в области химии, их взаимосвязь с другими областями знаний.
Деятельностный компонент
Ученик научиться
1. Определять по формулам гомологи, изомеры разных классов органических веществ как форм существования материи.
2. Составлять формулы органических веществ разных классов.
3. Называть органические вещества разных классов по международной номенклатуре.
4. Составлять на основе законов сохранения, периодичности уравнения реакций, характеризующие химические свойства органических веществ разных классов.
5. Объяснять зависимость свойств органических веществ разных классов от их состава и строения.
6. Владеть химической терминологией.
7. Прогнозировать и интерпретировать результаты химического эксперимента.
8. Использовать методы химического анализа при проведении исследовательской деятельности.
9. Устанавливать межпредметные связи химии с другими областями знаний.
10. Проводить поиск информации с использованием различных источников, критически её осмысливать, использовать компьютерные технологии для обработки, передачи информации и представление в различных формах.
11. Вести конструктивный диалог.
12. Работать в команде: подчиняться, руководить, делиться знаниями, полномочиями, сохранять в команде способность к творчеству и др.
Выпускник получит возможность научиться:
выдвигать и проверять экспериментально гипотезы о химических свойствах веществ на основе их состава и строения, их способности вступать в химические реакции, о характере и продуктах различных химических реакций как форм движения материи;
характеризовать вещества по составу, строению и свойствам, устанавливать причинно-следственные связи между данными характеристиками вещества на основе законов сохранения и периодичности;
прогнозировать способность органического вещества как формы существования материи проявлять окислительные или восстановительные свойства с учетом степеней окисления элементов, входящих в его состав;
составлять уравнения реакций, соответствующих последовательности превращений органических веществ различных классов;
выдвигать и проверять экспериментально гипотезы о результатах воздействия различных факторов на изменение скорости химической реакции как формы движения материи;
использовать приобретенные знания для экологически грамотного поведения в окружающей среде;
использовать приобретенные ключевые компетенции при выполнении проектов и учебно-исследовательских задач по изучению свойств, способов получения и распознавания веществ;
объективно оценивать информацию о веществах и химических процессах;
критически относиться к псевдонаучной информации, недобросовестной рекламе в средствах массовой информации;
осознавать значение теоретических знаний по химии для практической деятельности человека;
создавать модели и схемы для решения учебных и познавательных задач; понимать необходимость соблюдения предписаний, предлагаемых в инструкциях по использованию лекарств, средств бытовой химии и др.
Тематическое планирование учебного материала
1
Лекция - диалог
Конспект - сравнительная таблица
План проектной деятельности «Формы существования материи - неорганические и неорганические вещества»
Тема 1. Теоретические основы химии (1ч)
1(2)
Законы сохранения, периодичности - фундаментальные законы природы. Теория строения органических веществ.
1
Работа в группах
Презентация «Явление периодичности в органической химии»
Тема 2. Предельные углеводороды (алканы) (4 ч)
1(3)
Алканы - форма материи, дискретность их молекул. Периодичность в строении молекул гомологов, изомерия, номенклатура алканов.
1
Лекция с мультимедийной поддержкой
Опорный конспект
Подготовка
презентации
с анимацией к творческой мастерской
2(4)
3(5)
Свойства: физические,
химические - форма движения материи на основе законов сохранения, периодичности.
2
Работа в парах с гипер-текстами
Лабораторная работа 1. Определение качественного состава алканов
Конспект-таблица
Отчёт о результатах лабораторной работы
4(6)
Текущий контроль. Тестирование
1
Самостоятельная оценка уровня знаний по теме
Результаты тестирования
Тема 3. Непредельные углеводороды (6 ч)
1(7)
2(8)
3(9)
4(10)
5(11)
6(12)
Алкены, алкадиены, алкины - форма материи, дискретность их молекул. Периодичность в строении гомологов алкенов, алкадиенов, алкинов, их изомерия, номенклатура. Свойства: физические, химические - форма движения материи на основе законов сохранения, периодичности.
Текущий контроль. Тестирование
4
1
Лекция с использованием мультимедиаресурсов
Работа в парах с гипер-текстами
Лабораторная работа 2. Получение этилена, качественные реакции
Самостоятельная оценка уровня знаний по теме
Опорный конспект
Конспект-таблица
Отчёт о результатах лабораторных работ
Подготовка
презентации с анимацией к творческой мастерской
Результаты тестирования
Тема 4. Ароматические углеводороды (арены) (4 ч)
1(13)
2(14)
3(15)
4(16)
Арены - форма материи, строение молекул. Периодичность в строении гомологов аренов, их изомерия, номенклатура. Свойства: физические, химические - форма движения материи на основе законов сохранения, периодичности.
4
Лекция-диалог
Самостоятельная работа - практикум
Опорный конспект, презентация «Особенности строения и свойств аренов»
Тема 5. Кислородосодержащие органические соединения (12 ч)
1(17)
2(18)
3(19)
Спирта, фенолы, альдегиды, карбоновые кислоты, эфиры, углеводы - формы материи, периодичность в строении молекул. Степень окисления в молекулах кислородосодержащих органических веществ.
3
Проблемная лекция
Семинар - практикум
Конспект, презентация
4(20)
5(21)
Гомологи, изомеры, номенклатура кислородосодержащих органических веществ.
2
Практикум: создание анимацией к творческой мастерской
Результаты работы
6 (22)
7 (23)
8 (24)
9 (25)
10(26)
Свойства кислородосодержащих органических веществ: физические, химические - форма движения материи на основе законов сохранения, периодичности.
5
Семинар-практикум
Лабораторная работа
3. Свойства глицерина.
4. Свойства фенола
5.Получение этаналя окислением этанола, характерные свойства
6. Получение и свойства карбоновых кислот. Отношение одноосновных карбоновых кислот к окислителям.
Результаты работы
Отчёт о результатах лабораторных работ
11(27)
12(28)
Промежуточный контроль. Тестирование
2
Зачет
Результаты работы
Тема 6. Практикум ( 7 ч)
1(29)
2(30)
Имитационная игры. Воздействие этанола на организм человека: проблемы и последствия
2
Практическая работа 1
Отчет
3(31)
4(32)
Многоатомные спирты - структурные компоненты жиров, кремов, мазей, жевательных резинок
2
Практическая работа 2
5(33)
Решение экспериментальных задач по распознаванию органических веществ
1
Практическая работа 3
Отчет
Отчет
6(34)
7 (35)
Творческая мастерская в рамках фестиваля естественнонаучных дисциплин
Научно - методический ресурс
Учебно - методический комплект:
Для учителя
-
Аликберова Л.Ю., Рукк Н.С. Полезная химия: задачи и истории.- М.: Дрофа. 2008.
-
2. Березин Б.Д., Березин Д.Б. Курс современной органической химии. - М., Высшая школа, 1999
-
Реутов О.А. Органическая химия. Т. 1-4. - М.: Бином, 2004.
-
Тюкавкина Н.А. Органическая химия.- Дрофа, 2002
-
Химия в школе: научно-методический журнал. - М.: Российская академия образования. Центрхимпресс. - 2004-2016
-
Фримантл М. Химия в действии. - М.: Мир, 1991.
Для учащихся
-
Зуева М.В, Н.Н.Гара Контрольные и проверочные работы по химии 10 - 11 классы. - М.: Дрофа, 2007
-
Ковалевская Н.Б. Химия в таблицах и схемах. 10 - 11 класс. - М. Издат-школа, 2008.
-
Радецкий А.М. Дидактический материал по химии 10 - 11 классы. - М.: Просвещение, 2005
-
Рудзитис Г.Е. , Ф.Г.Фельдман Химия: учебник для 10 класса общеобразовательных учреждений.- М.: Просвещение, 2009
Интернет - ресурсы
-
Мир химии. www.chemistry.narod.ru/
-
Опорные конспекты по химии. Поурочные конспекты для учащихся 8 - 11-го классов. khimia.ril.ru/
-
Репетитор по химии. chemistry.nm.ru/
-
Химия для всех. Электронный справочник за полный курс химии.
www.informika.ru/text/database/chemy/START.html
-
Школьная химия - справочник. www.schoolchemistry.by.ru
МБОУ «Красногорская СОШ»
-
Пояснение к приложению программы элективного курса
«На перекрёстках естественнонаучных дисциплин»
В приложении предложен материал, с помощью которого задаётся направление работы по организации качественного образовательного процесса на занятиях элективного курса.
с. Красногорское
2016г.
Приложение 1
Пояснение к методическому руководству
Внимательно изучив инструкции, учащиеся самостоятельно ставят цель, определяют объект, предмет исследования, выдвигают гипотезу, задачи необходимые для достижения цели (выделены в инструкции курсивом) и приступают к выполнению исследовательских работ. В инструкции включены вопросы, задачи и упражнения для организации самостоятельной работы учащихся, ответы для самопроверки и самооценки (ответы для самопроверки и самооценки проецируются с помощью интерактивной доски).
Лабораторные работы
Лабораторная работа 1. Определение качественного состава алканов
Прежде чем приступить к работе, внимательно прочитайте содержание инструкции. Поставьте цель, определите объект, предмет исследования, выдвинете гипотезу, поставьте задачи для достижения цели.
Помните про средства индивидуальной защиты: халаты, резиновые перчатки, защитные очки.
Цель. Выявление качественного состава парафина.
Объект исследования. Парафин.
Предмет исследования. Качественный состав парафина.
Гипотеза. В состав парафина входят атомы углерода и водорода.
Задача. Определить с помощью химического анализа входят ли атомы углерода и водорода в состав парафина.
Инструкция к работе
Поместите в пробирку кусочек парафина (величиной с горошину) и примерно такое же количество порошка оксида меди (II). Пробирку нагрейте до плавления парафина и содержимое её встряхните, чтобы вещества хорошо перемешались. Пробирку закрепите в горизонтальном положении (рис. 1) и поместите в неё недалеко от открытого конца немного безводного сульфата меди (II) .
Пробирку закройте пробкой с газоотводной трубкой, конец которой опустите в другую пробирку с известковой водой. Содержимое пробирке слегка нагрейте, соблюдая правила нагревания веществ в пробирках, и наблюдайте за происходящими изменениями.
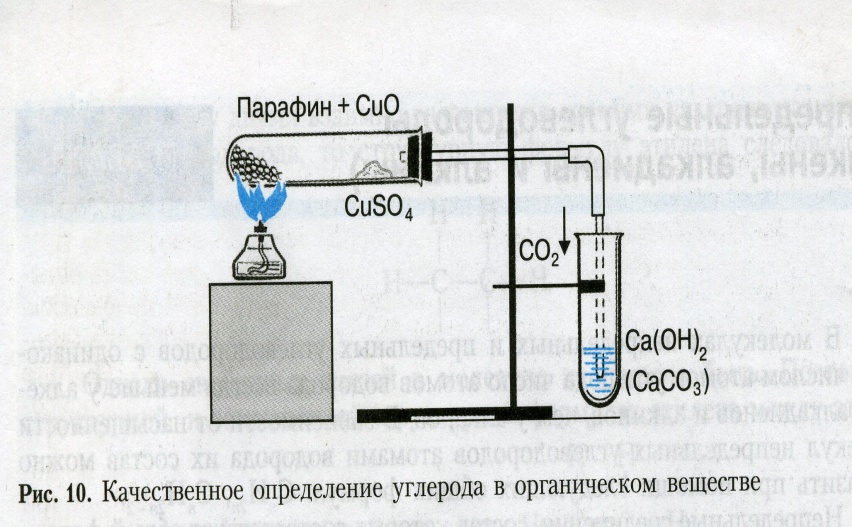
Рис. 1.Качественное определение углерода и водорода в парафине
Задания для самостоятельной работы
-
Что вы наблюдаете?
-
Почему изменяется цвет сульфата меди(II)? О содержании, какого элемента в парафине это свидетельствует?
-
Почему происходит помутнение известковой воды? Какой можно сделать вывод?
-
Что образовалось из оксида меди (II)? Какие наблюдения это подтверждают?
-
Напишите уравнения происходящих реакций, используя для парафина усредненную формулу С23Н48.
-
Сделайте вывод.
Ответы для самопроверки
-
Безводный сульфат меди (II) становится синим, известковая вода мутнеет.
-
Цвет безводного сульфат меди (II) изменяется на синий, т.к. образуется водный сульфат меди (II) в ходе присоединении воды. Это свидетельствует о содержании в парафине элемента водорода.
-
Помутнение известковой воды происходит в результате взаимодействия углекислого газа с известковой водой с образованием карбоната кальция. Это свидетельствует о содержании в парафине элемента углерода.
-
Из оксида меди (II) образуется медь красного цвета.
-
С23Н48 + 70СиО → 23СО2 + 24Н2О + 70Си
СиSО4 + Н2О → СиSО4 ∙ 5Н2О
СО2 + Са(ОН)2 → СаСО3↓+ Н2О
-
В состав парафина входят элементы: углерод и водород.
Лабораторная работа 2. Получение этилена, качественные реакции
Прежде чем приступить к работе, внимательно прочитайте содержание инструкции. Поставьте цель, определите объект, предмет исследования, выдвинете гипотезу, поставьте задачи для достижения цели.
Помните про средства индивидуальной защиты: халаты, резиновые перчатки, защитные очки.
Цель. Получение этилена, проведение качественных реакций.
Объект исследования. Органическое вещество - этилен.
Предмет исследования. Лабораторный способ получения этилена. Свойства этилена.
Гипотеза. Этилен - непредельный углеводород.
Задачи:
-
Получить из выданных реактивов этилен.
-
Доказать с помощью качественных реакций, что этилен - это алкен.
Инструкция к работе
Соберите прибор согласно рисунку 2. Проверьте его на герметичность. Поместите в
пробирку кусочек (для равномерности кипения), налейте 0,5 мл этанола и добавьте
Отметьте характер пламени. Прекратите нагревание прибора, дайте ему остыть и затем разберите.
Задания для самостоятельной работы
-
Что вы наблюдаете?
-
По какому уравнению протекает реакция получения этилена в лабораторных условиях?
-
Почему серная кислоты, применяющаяся в опыте должна быть концентрированной?
-
Почему этилен легко обесцвечивает бромную воду и перманганат калия, а метан нет?
-
Чем отличается пламя этилена от пламени метана? Почему?
-
Напишите уравнения происходящих реакций.
-
Сделайте вывод.
Контрольный вопрос. 8. Какое количество 96% раствора этанола подверглось разложению при получении этилена, если при пропускании через бромную воду полученного этилена образовалось 18,8 г дибромэтана?
Ответы для самопроверки
-
Бромная вода и раствор перманганата калия легко обесцвечиваются.
to, Н2SO4
-
С2Н5ОН С2Н4 + Н2О
-
В процессе реакции выделяется вода, которую необходимо удалить, концентрированная серная кислота активно поглощает воду.
-
В молекуле этилена имеется двойная связь, которая легко поляризуется, поэтому этилен легко вступает в реакцию присоединения брома и окисления перманганатом калия. Метан как алкан двойных связей не имеет и поэтому ему характерны реакции замещения.
-
Содержание углерода в молекуле метана меньше, чем в молекуле этилена, поэтому пламя этилена светящееся от раскалённых частиц углерода, а пламя метана бесцветное, т.к. весь углерод быстро и полностью успевают сгореть.
-
Н2С == СН2 + Br2 → СН2Вг СН2Вг
3Н2С == СН2 + 2КМпО4 + 4Н2О → 3СН2ОН СН2ОН + 2МпО2 + 2КОН
7. Вывод надо сделать исходя из гипотезы.
8. 4,8 г С2Н5ОН
Лабораторная работа 3. Свойства глицерина.
Прежде чем приступить к работе, внимательно прочитайте содержание инструкции. Поставьте цель, определите объект, предмет исследования, выдвинете гипотезу, поставьте задачи для достижения цели.
Помните про средства индивидуальной защиты: халаты, резиновые перчатки, защитные очки.
Цель. Изучение свойств глицерина.
Объект исследования. Органическое вещество - глицерин
Предмет исследования. Свойства глицерина
Гипотеза. Характерные свойства глицерина обусловлены функциональной группой.
Инструкция к работе
Налейте в пробирку 2 капли раствора сульфата меди (II) и добавьте 5 капель 10% раствора гидроксида натрия. Добавьте в эту же пробирку каплю глицерина. И тщательно перемешайте содержимое.
Проделайте аналогичный опыт с этанолом.
Задания для самостоятельной работы
-
По какому уравнению протекает реакция между сульфатом меди (II) и гидроксидом натрия? Что выпадает в осадок? Какого цвета образовавшийся осадок?
-
Что произошло с осадком при добавлении к нему глицерина?
-
Как изменилась окраска?
-
Напишите уравнение протекающей реакции.
-
Есть ли разница в процессе образования алкоголята одноатомными и многоатомными спиртами? Если есть, то почему?
-
Сделайте вывод.
Ответы для самопроверки
-
СиSО4 + 2NаОН → Си(ОН)2↓ + Nа2SО4 ; Си(ОН)2 - осадок синего цвета
-
Осадок при добавлении к нему глицерина исчезает.
-
Образуется раствор глицерата меди ярко синего цвета.
-
СН2- СН- СН2 + Си(ОН)2 → СН2- СН- СН2 + 2Н2О
│ │ │ │ │ │
ОН ОН ОН ОН О О
\ /
Си
-
Разница есть. Причина заключается во взаимном влиянии друг на друга гидроксогрупп. Присутствие в молекуле нескольких гидроксогрупп усиливает подвижность водородных атомов этих групп, это выражается в том, что образование алкоголятов из многоатомных спиртов идёт даже с нерастворимыми основаниями.
-
Вывод надо сделать исходя из гипотезы.
Лабораторная работа 4. Свойства фенола
Прежде чем приступить к работе, внимательно прочитайте содержание инструкции. Поставьте цель, определите объект, предмет исследования, выдвинете гипотезу, поставьте задачи для достижения цели.
Помните про средства индивидуальной защиты: халаты, резиновые перчатки, защитные очки.
Цель. Изучение свойств фенола
Объект исследования. Органическое вещество - фенол
Предмет исследования. Свойства фенол
Гипотеза. Характерные свойства фенол обусловлены взаимным влиянием группы
- ОН и бензольного кольца.
Инструкция к работе
Опыт 1. Получение фенолята натрия. К 10 каплям концентрированного раствора фенола добавьте каплю разбавленной щелочи (не приливайте избыток!).
Задания для самостоятельной работы
-
Как меняется внешний вид раствора?
-
Почему раствор стал прозрачным? Напишите уравнение реакции.
-
Какая разница в отношении к щелочам фенола и одноатомного спирта? Чем вы объясните эту разницу?
Ответы для самопроверки
-
Раствор стал прозрачным.
-
Раствор стал прозрачным, потому что плохо растворимый в воде фенол вступил в реакции со щелочью и превратился в хорошо растворимый фенолят натрия:
С6Н5ОН + NаОН → Н2О + С6Н5ОNа
-
Одноатомный спирт при обычных условиях со щелочами в реакцию не вступает, а фенол с ними реагирует, т.к. его гидроксил становится более подвижным под влиянием бензольного кольца.
Опыт 2. Качественная реакция на фенол. Налейте 10 капель раствора фенола и добавьте каплю раствора хлорида железа (III).
Задание для самостоятельной работы
-
Как меняется окраска раствора? Сделайте вывод о том, какое вещество является реактивом на фенол.
-
Сделайте вывод исходя из опытов 1, 2.
Ответы для самопроверки
-
При добавлении к раствору фенола раствора хлорида железа (III) появляется фиолетовое окрашивание. Это качественная реакция на фенол.
3С6Н5ОН + FeCl3 → (С6Н5О)3Fe + 3НCl
-
Вывод надо сделать исходя из гипотезы.
Лабораторная работа 5. Получение этаналя окислением этанола, исследование его характерных свойств
Прежде чем приступить к работе, внимательно прочитайте содержание инструкции. Поставьте цель, определите объект, предмет исследования, выдвинете гипотезу, поставьте задачи для достижения цели.
Помните про средства индивидуальной защиты: халаты, резиновые перчатки, защитные очки.
Цель. Получение этаналя, проведение характерных реакций.
Объект исследования. Органическое вещество - этаналь
Предмет исследования. Лабораторный способ получения этаналя. Свойства этаналя.
Гипотеза. Характерные свойства этаналя обусловлены функциональной группой.
Задачи:
-
Получить из выданных реактивов этаналь
-
Доказать с помощью качественных реакций, что этаналь - это альдегид.
Инструкция к работе
В пробирку налейте 1 мл этанола и погрузите в него раскалённую медную проволоку (опыт повторите несколько раз). Что вы наблюдаете?
Налейте в пробирку 2 капли раствора нитрата серебра, добавьте каплю раствора аммиака, а затем 2 капли этаналя. Полученную смесь быстро нагрейте (не доводя до кипения!). Что вы наблюдаете?
Налейте в пробирку 5 капель этаналя, добавьте 2 капли раствора сульфата меди (II) и 5 капель 10% раствора гидроксида натрия. Нагрейте смесь веществ. Что вы наблюдаете?
Задания для самостоятельной работы
-
По какому уравнению протекает реакция получения этаналя в лабораторных условиях?
-
Какая реакция произошла при добавлении к аммиачному раствору нитрата серебра раствора этаналя?
-
По какому уравнению протекает реакция этаналя с гидроксидом меди (II)? Откуда берётся в данном опыте гидроксид меди (II)?
-
Почему образующийся осадок имеет сначала желтую окраску?
-
Что представляет собой красный осадок?
-
В какое вещество переходит этаналь при окислении?
-
Сделайте вывод об отношении альдегидов к окислению.
Ответы для самопроверки
-
С2Н5ОН + СиО → СН3СОН + Си + Н2О
-
Произошло восстановление аммиачного раствора нитрата серебра этаналем.
СН3СОН + 2 [Ag(NО3)2]ОН→2 Ag↓ + СН3СООNН4 + 3NН3 + Н2О
-
Гидроксид меди (II) образуется в результате взаимодействия сульфата меди (II) и гидроксида натрия.
СиSО4 + 2NаОН → Си(ОН)2↓ + Nа2SО4
СН3СОН + 2Си(ОН)2 → СН3СООН + 2СиОН↓ + Н2О
-
Сначала образуется гидроксид меди (I) желтого цвета, который потом разлагается.
2СиОН → Си2О + Н2О
-
Красный осадок - это оксид меди (I)
-
Этаналь превращается в уксусную кислоту.
-
Вывод надо сделать исходя из гипотезы.
Лабораторная работа 6. Получение и свойства карбоновых кислот. Отношение одноосновных карбоновых кислот к окислителям.
Прежде чем приступить к работе, внимательно прочитайте содержание инструкции. Поставьте цель, определите объект, предмет исследования, выдвинете гипотезу, поставьте задачи для достижения цели.
Помните про средства индивидуальной защиты: халаты, резиновые перчатки, защитные очки.
Цель. Получение уксусной кислоты, проведение характерных реакций, выяснение отношения одноосновных карбоновых кислот к окислителям.
Объект исследования. Органические вещества - одноосновные карбоновые кислоты.
Предмет исследования. Лабораторный способ получения уксусной кислоты. Свойства уксусной кислоты, отношение одноосновных карбоновых кислот к окислителям.
Гипотеза. Характерные свойства одноосновных карбоновых кислот обусловлены функциональной группой.
Задачи:
-
Получить из выданных реактивов уксусную кислоту.
-
Провести характерные реакции для одноосновных карбоновых кислот.
Инструкция к работе
Задание для самостоятельной работы
-
Составьте уравнения реакций проделанных опытов.
Ответы для самопроверки
-
2СН3СООNа + Н2SO4 → 2СН3СООН + Nа2SO4
СН3СООН + NаОН → СН3СООNа + Н2О
2СН3СООН + Mg → (СН3СОО)2Mg + Н2↑
2СН3СООН + Nа2СО3 → 2СН3СООNа + СО2↑+ Н2О
Опыт 3. Отношение одноосновных карбоновых кислот к окислителям. Внесите в пробирку 4 капли раствора муравьиной кислоты, прибавьте 4 капли раствора перманганата калия и 2 капли раствора серной кислоты (1:5). К пробирке присоедините пробку с газоотводной трубкой, конец которой опустите в пробирку с о,5 мл известковой воды (см. рис. 3). Смесь нагрейте. Что замечаете? Как только помутнеет известковая вода, выньте газоотводную трубку и прекратите нагревание.
Внесите пробирку 4 капли раствора уксусной кислоты, прибавьте 4 капли раствора перманганата калия и 2 капли раствора серной кислоты. Смесь несильно нагрейте. Что замечаете?
Задания для самостоятельной работы
-
По каким уравнениям протекают реакции в ходе опытов?
-
Почему помутнеет известковая вода?
-
Почему муравьиная кислота окисляется, а уксусная нет?
-
Сделайте выводы.
Ответы для самопроверки
СО2↑
-
НСООН + [О] → Н2 СО3
Н2О
-
СО2 + Са(ОН)2 → СаСО3↓ + Н2О
-
Известковая вода мутнеет в результате образования карбоната кальция.
-
Муравьиная кислота одновременно является и альдегидом. Поэтому она легко окисляется, а уксусная нет.
-
Вывод надо сделать исходя из гипотезы.
Пояснение к работе 2
Цель данной работы - закрепление и углубление знаний, умений учащихся о спиртах как большой группе гидроксилсодержащих органических соединений, которые имеют большое значение в природе и жизни человека. Работа выполняется по вариантам. Такой подход позволяет тесно связать процесс обучения химии с познанием окружающей действительности и усилить интерес учащихся к этой науке. Курсивом выделен предполагаемый ответ ученика.
Работа 2. Многоатомные спирты - структурные компоненты жиров, кремов, мазей, жевательных резинок (2 ч.)
1 вариант
Инструкция к выполнению работы
Помните про средства индивидуальной защиты: халаты, резиновые перчатки, защитные очки.
Опыт 1. Доказательства того, что многоатомные спирты - структурные компоненты жиров.
Поместить в колбу мелко нарезанные кусочки жира (свиного сала), добавить к нему 20 мл 10%-ного водного раствора щёлочи. Смесь кипятить 2-3 мин., а затем профильтровать раствор. К фильтрату добавить по каплям 5%-ный раствор медного купороса. Образующийся осадок встряхните. Объясните результаты опыта, заполнив таблицу 1.
Таблица 1Вывод: При нагревании жира с водой в присутствии щёлочи происходит его гидролиз, один из продуктов которого - глицерин, который обнаруживается качественной реакцией с гидроксидом меди (II).
2 вариант
Опыт 2. Качественное обнаружение многоатомных спиртов в кремах и мазях.
Инструкция к выполнению работы
Помните про средства индивидуальной защиты: халаты, резиновые перчатки, защитные очки.
Поместить в колбу небольшое количество детского крема добавить к нему немного воды, тщательно перемешать. Добавить к полученной смеси 10%-ный раствор щёлочи, выпавшие хлопья профильтровать, а к фильтрату добавить по каплям 5%-ный раствор медного купороса. Образующийся осадок встряхните. Объясните результаты опыта, заполнив таблицу 2.
Таблица 2</ Вывод: При добавлении к крему щёлочи и раствора медного купорос образуется осадок гидроксида меди (II), который при встряхивании растворяется и образуется ярко-синий раствор глицерата меди(II). Значит, в состав крема входит многоатомный спирт, который обнаруживается качественной реакцией с гидроксидом меди (II).
3 вариант
Инструкция к выполнению работы
Помните про средства индивидуальной защиты: халаты, резиновые перчатки, защитные очки.
Опыт 3. Обнаружение многоатомных спиртов в жевательной резинке.
Поместите в колбу с водой мелко нарезанные кусочки жевательной резинки и перемешайте в течении 2-3 мин. Часть раствора полученного отлейте в пробирку, добавьте к полученной смеси 10%-ный раствор щёлочи и 5%-ный раствор медного купороса. . Образующийся осадок встряхните. Объясните результаты опыта, заполнив таблицу 3.
Таблица 3
Вывод: в состав жевательной резинки входит многоатомный спирт ксилит С5Н12О5 (обуславливает сладкий вкус). О чём свидетельствует положительная качественная реакция на многоатомные спирты.
Работа 3. Решение экспериментальных задач по распознаванию органических веществ (1 ч.)
Инструкция к выполнению работы
Помните про средства индивидуальной защиты: халаты, резиновые перчатки, защитные очки.
Справочная информация: маннитол - шестиатомный спирт, формула которого С6Н14О6. Применяют его как эффективное диуретическое средство.
В пробирках под номерами выданы растворы следующих веществ: маннитола (маннит), этанола, фенолята натрия, формалина, муравьиной кислоты. Определите, в какой пробирке находится каждое из веществ. Напишите уравнения реакций, сделайте вывод.
Работа 4. Творческая мастерская. Подведение итогов (2 ч.)
20
-