- Учителю
- Урок химии в 9 классе Аммиак
Урок химии в 9 классе Аммиак
Тема урока: «Аммиак»
Цель: научить учащихся объяснять свойства аммиака на основе знаний о строении атома азота и молекулы аммиака, формировать представление о роли аммиака в жизни человека.
Задачи:
- обучающие: конкретизировать знания учащихся о строении атома и ковалентной связи на примере строения атома азота и молекулы аммиака; рассмотреть химические и физические свойства аммиака;
- воспитывающие: воспитывать интерес к изучению темы;
- развивающие: формирование навыков сравнения на примере свойств аммиака, развитие внимания, мышления, памяти.
Тип урока: комбинированный.
Методы и приемы обучения: фронтальный опрос, объяснение.
Основные понятия: «аммиак», «нашатырный спирт», «аммиачная вода».
Ход урока:
1. Организационный момент.
2. Актуализация знаний.
Для актуализации знаний и создания проблемной ситуации проводится химическая разминка (фронтальный опрос):
Назовите возможные степени окисления азота.
В каких случаях азот будет проявлять окислительные свойства, а в каких - восстановительные?
Перечислите физические свойства азота.
При каких условиях азот вступает в реакции с другими веществами?
В каком виде азот встречается в природе?
Какова роль азота в природе?
(Один ученик класса у доски выполняет задание №209, с. 32 сборника задач)
</ 3. Формирование новых знаний.
Для неметаллов характерно существование газообразных соединений с водородом. У азота таким соединением является аммиак NH3, который состоит из атома азота и трех атомов водорода.
Молекула аммиака NH3 имеет
пирамидальное строение. Атом азота N находится в центре
незавершенного тетраэдра с тремя атомами водорода Н в вершинах, а к
четвертой вершине обращено электронное облако с парой электронов,
не участвующих в образовании химических связей.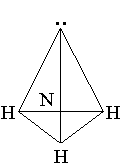
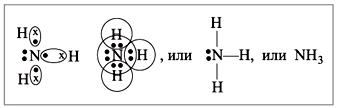
В подходящих условиях эта «неподеленная» пара
электронов может служить для присоединения катиона водорода в
реакциях аммиака с кислотами, либо для взаимодействия с водой. В
молекуле аммиака три химических связи образованны по ковалентному
полярному механизму.
Аммиак (NH3) - газ, без цвета, с резким запахом,
легче воздуха. При охлаждении до -33,6 °С он сжижается, а при
температуре - 77,8 °С превращается в твердое белое вещество.
Концентрированный водный раствор аммиака называется водным
аммиаком, или аммиачной водой, а используемый в медицине раствор
аммиака известен под названием нашатырный спирт. Нашатырный спирт -
это 5-10%-ный раствор аммиака в воде. Применяется при обморочных
состояниях (для возбуждения дыхания), для стимуляции рвоты, а также
наружно - при укусах насекомых, для обработки рук хирурга. При
неправильном применении может вызвать ожоги пищевода и желудка (в
случае приёма неразведённого раствора), рефлекторную остановку
дыхания (при вдыхании в высокой концентрации). Повышая давление,
аммиак можно легко перевести в жидкое состояние даже при обычной
температуре. Это связано с возникновением между его молекулами
особой химической связи - водородной. Водородная связь - связь
между атомами водорода одной молекулы и атомами очень
электроотрицательных элементов, имеющих свободные электронные пары
-фтор, кислород, азот - другой молекулы. Этой связью обладает вода,
HF. Поэтому они хорошо растворимы в воде. Это очень слабая связь.
Химические свойства аммиака.
Как вы думаете, аммиак будет растворятся в воде? Для подсказки можно напомнить известный принцип: подобное растворяется в подобном. (Аммиак должен растворяться в воде, так как его молекула полярна). Акцентировать внимание учащихся на щелочном характере среды раствора аммиака.
![]()
В результате растворения аммиака в воде образуются
гидроксид-ионы ОН и ионы аммония NH3. Раствор аммиака в
воде называют аммиачной водой или гидроксидом аммония.
При взаимодействии аммиака с кислотами,
образуются соли аммония.
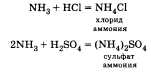
Горение в кислороде:
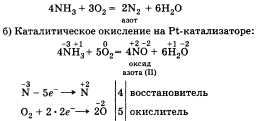
Получение и применение аммиака.
Используя аммиак, получают различные соединения,
например азотные удобрения, азотную кислоту, нашатырный спирт.
4. Закрепление знаний.
- записать уравнение реакции аммиака с серной кислотой в молекулярном, полном и сокращенном ионном виде.
- выполнить расчет: рассчитайте массу серной кислоты, которая необходима для полной нейтрализации аммиака объёмом (н. у.) 2, 24 дм3.
5. Рефлексия.
6. Домашнее задание.
§11, задания 1, 4, 6, 9.
3