- Учителю
- Неметаллы и их соединения в окружающей среде. Природные ресурсы неметаллов в Казахстане. Современные материалы и вещества на основе неметаллов и их соединений. Значение и нахождение соединения неметаллов в живой и неживой природе. Жидкие кристаллы. Поняти
Неметаллы и их соединения в окружающей среде. Природные ресурсы неметаллов в Казахстане. Современные материалы и вещества на основе неметаллов и их соединений. Значение и нахождение соединения неметаллов в живой и неживой природе. Жидкие кристаллы. Поняти
Тема: Неметаллы и их соединения в окружающей среде. Природные ресурсы неметаллов в Казахстане. Современные материалы и вещества на основе неметаллов и их соединений. Значение и нахождение соединения неметаллов в живой и неживой природе. Жидкие кристаллы. Понятие о нанохимии. Демонстрация № 2 (2,6)
Класс:9 «Б»
Дата:
Цели:
-
изучить положение неметаллов в ПС;
-
изучить особенности строения атомов неметаллов;
-
рассмотреть ЭО как меру «неметалличности»;
-
рассмотреть относительность понятий «металл-неметалл»;
-
изучить водородные соединения неметаллов.
-
развивать умение делать самостоятельные выводы.
-
воспитывать культуру умственного труда;
-
воспитывать дисциплинированность и чувство ответственности.
Оборудование и реактивы: образцы неметаллов - простых веществ
Тип урока: урок усвоения новых знаний.
Ход работы:
I. Организационный момент.
II. Актуализация знаний.
Ответьте на вопросы:
-
на какие 2 большие группы условно делятся все Х.Э.?
-
каково положение в ПС металлов?
III. Изучение
1. Положение неметаллов в ПС
Неметаллы расположены в основном в правом верхнем углу ПС, условно ограниченном диагональю бор-астат. Самым активным является фтор.
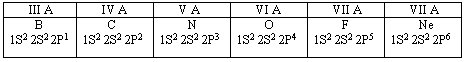
2. Особенности строения атомов неметаллов.
Во внешнем электронном слое атомов неметаллов находится от трёх до восьми электронов.
Для атомов неметаллов, по сравнению с атомами металлов характерны:
-
меньший атомный радиус;
-
четыре и более электрона на внешнем энергетическом уровне.
Отсюда и такое важнейшее свойство атомов неметаллов - тенденция к приёму недостающих до 8 электронов, т.е. окислительные свойства. Качественной характеристикой атомов неметаллов, т.е. своеобразной мерой их неметалличности, может служить электроотрицательность, т.е. свойство атомов химических элементов поляризовать химическую связь, оттягивать к себе общие электронные пары. Электроотрицательность - мера неметалличности, т.е. чем более электроотрицателен данный химический элемент, тем ярче выражены неметаллические свойства.
3. Кристаллическое строение неметаллов-простых веществ. Аллотропия.
Если металлы - простые вещества образованы за счет металлической связи, то для неметаллов - простых веществ характерна ковалентная неполярная химическая связь. В отличие от металлов неметаллы - простые вещества, характеризуются большим многообразием свойств. Неметаллы имеют различное агрегатное состояние при обычных условиях:
-
газы - H2, O2, O3, N2, F2, Cl2;
-
жидкость - Br2;
-
твердые вещества - модификации серы, фосфора, кремния, углерода и др.
Гораздо богаче у неметаллов и спектр цветов: красный - у фосфора, красно-бурый - у брома, желтый - у серы, желто-зеленый - у хлора, фиолетовый - у паров йода. Элементы - неметаллы более способны, по сравнению с металлами, к аллотропии.
Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества - аллотропными видоизменениями или модификациями.
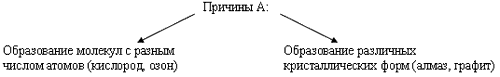
4. Сообщения.
5. Физические свойства неметаллов.
-
Ковкость отсутствует
-
Блеска нет
-
Теплопроводность (только графит)
-
Цвет разнообразный: желтый, желтовато-зеленый, красно-бурый.
-
Электропроводность (только графит и черный Фосфор.)
-
Агрегатное состояние:
-
газообразное(H2, O2, Cl2 ,F2, O3)
-
твердое (Р, С)
-
жидкое (Br2)
-
6. Химические свойства неметаллов.
Неметаллы в химических реакциях могут быть восстановителями и окислителями (фтор, кислород.)
7. Водородные соединения неметаллов.
В отличие от металлов неметаллы образуют газообразные водородные соединения. Их состав зависит от степени окисления неметаллов.Летучие водородные соединения неметаллов можно разделить на три группы:
1) Хорошо растворимые в воде (HCl, HBr, HJ, H2S, H2Se, NH3), которые диссоциируют на ионы, проявляя кислотные и основные свойства.
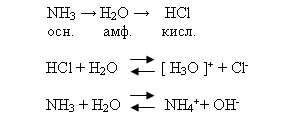
2) Соединения, разлагаемые водой:
BH3 + 3H2O = H3BO3 + 3H2↑
3) Летучие водородные соединения
CH4, PH3, которые не взаимодействуют с водой.
По периоду в ПС химических элементов с увеличением порядкового номера элемента - неметалла усиливается кислотный характер водородного соединения.
SiH4 → PH3 → H2S → HCl
Выводы:
-
Элементы-неметаллы расположены в главных подгруппах III-VIII групп ПС Д.И. Менделеева, занимая её верхний правый угол.
-
На внешнем электронном слое атомов элементов-неметаллов находятся от 3 до 8 электронов.
-
Неметаллические свойства элементов усиливаются в периодах и ослабевают в подгруппах с увеличением порядкового номера элемента.
-
Высшие кислородные соединения неметаллов имеют кислотный характер (кислотные оксиды и гидроксиды).
-
Атомы элементов-неметаллов способны как принимать электроны, проявляя окислительные функции, так и отдавать их, проявляя восстановительные функции.
IV. Закрепление изученного. Рефлексия.
1) Вставьте слова, пропущенные в тексте.
Атомы ____ в отличие от атомов ____ легко принимают наружные
электроны, являются ____
2) Вставьте слова , пропущенные в тексте.
Неметаллические свойства элементов с увеличением порядкового номера
в периодах ____
В группах неметаллические свойства элементов ____
3) Пользуясь периодической таблицей, запишите молекулярные
формулы высших кислородных соединений неметаллов III периода. Как
будет изменяться кислотный характер?
4) Запишите формулы водородных соединений элементов VII А группы. Как изменяются кислотные свойства с увеличением порядкового номера элемента?
5) Водород занимает в периодической таблице два места: в I А группе и в VII А группе. Запишите молекулярные формулы водородных соединений Na, K, Cl, F.
V. Оценки и домашнее задание.