- Учителю
- Тренировочные варианты ОГЭ по химии 2015 года
Тренировочные варианты ОГЭ по химии 2015 года
Инструкция
по выполнению тренировочной работы по химии ОГЭ.
Экзаменационная работа состоит из двух частей, включающих в себя 22 задания. Часть 1 содержит 19 заданий с кратким ответом, часть 2 содержит 3 задания с развёрнутым ответом.
На выполнение экзаменационной работы по химии отводится 2 часа (120 минут).
Ответы к заданиям 1-15 записываются в виде одной цифры, которая соответствует номеру правильного ответа. Эту цифру запишите в бланк ответов № 1.
Ответы к заданиям 16-19 записываются в виде последовательности цифр. Эту последовательность цифр запишите в бланк ответов № 1 в порядке возрастания.
К заданиям 20-22 следует дать полный развёрнутый ответ, включающий в себя необходимые уравнения реакций и расчёты. Задания выполняются на бланке ответов № 2.
При выполнении работы Вы можете пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором.
При выполнении заданий можно пользоваться черновиком. Записи в черновике не учитываются при оценивании работы.
Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Желаем успеха!
Составитель: Цыренова Р.В.
Тренировочный вариант Химия Вариант 915-1Ответом к заданиям 1-15 является одна цифра, которая соответствует номеру правильного ответа. Запишите эту цифру в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки.
1.Число протонов в ядре атома равно
-
порядковому номеру элемента
-
номеру группы
-
номеру периода
-
относительной атомной массе
2.Ряд химических элементов, в котором усиливаются металлические свойства соответствующих им простых веществ
-
натрий - магний - алюминий
-
углерод - кремний - германий
-
сурьма - мышьяк - фосфор
-
селен - сера - хлор
3. Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
-
вода и сероводород
-
бромид калия и азот
-
аммиак и водород
-
кислород и метан
4. Хлор проявляет высшую возможную степень окисления в соединении
-
HCl
-
Cl2O7
-
KClO2
-
KClO3
5.Вещества, формулы которых Ca3(PO4)2 и Na2O, являются соответственно
-
кислотой и оснόвным оксидом
-
солью и амфотерным гидроксидом
-
солью и основным оксидом
-
оснόвным оксидом и основанием
6. Признаком протекания химической реакции между хлоридом меди (II) и гидроксидом калия является
-
появление запаха
-
изменение цвета
-
выпадение осадка
-
выделение газа
7. Одинаковое число молей катионов и анионов образуется при полной диссоциации в водном растворе 1 моль
-
H2SO4
-
NH4Cl
-
Ba(NO3)2
-
K2SO4
8. Необратимо протекает реакция ионного обмена между растворами
-
хлорида аммония и нитрата калия
-
сульфата натрия и карбоната калия
-
хлорида бария и серной кислотой
-
гидроксида натрия и хлорида бария
Составитель: Цыренова Р.В.
9. Цинк реагирует с
-
оксидом алюминия
-
соляной кислотой
-
гидроксидом железа(III)
-
сульфидом железа(II)
10. С оксидом кальция взаимодействует каждое из двух веществ:
-
SO2 и O2
-
H2O и CO2
-
NaOH и SO2
-
HNO3 и BaO
11. Раствор гидроксида калия реагирует с каждым из двух веществ:
-
N2 и NO2
-
C и CO2
-
Cu и CuO
-
SO2 и H2SO4
12. Раствор нитрата меди (II) не реагирует с (со)
-
ртутью
-
железом
-
свинцом
-
цинком
13.Верны ли суждения о химическом загрязнении окружающей среды и его последствиях?
А. Повышенное содержание в атмосфере оксида углерода(II) не является угрожающим
фактором для здоровья человека.
Б. Производство цемента и других строительных материалов не относят к источникам
загрязнения атмосферы.
-
верно только А
-
верно только Б
-
верны оба суждения
-
оба суждения неверны
14. Элемент углерод является восстановителем в реакции
-
C + 4K = K4C
-
CO + 3H2 = CH4 + H2O
-
C + 2Cl2 = CCl4
-
CO2 + MgO = MgCO3
15. На какой диаграмме распределение массовых долей элементов соответствует количественному составу фосфата железа(II)
1) 2) 3) 4)
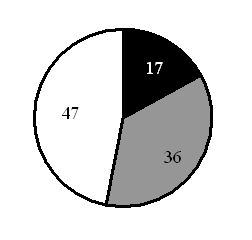
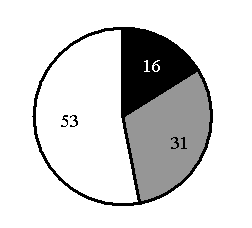
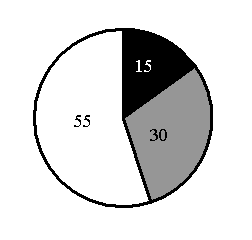
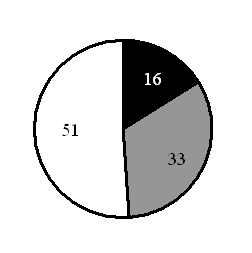
Составитель: Цыренова Р.В.
16. Для ряда химических элементов бор → углерод → азот → кислород характерны следующие закономерности:
-
уменьшается электроотрицательность
-
увеличивается число электронов во внешнем электронном слое
-
увеличивается радиус атомов
-
усиливаются неметаллические свойства простых веществ
-
ослабевает кислотный характер высших оксидов
17. Для этана верны следующие утверждения:
-
при комнатной температуре является газом
-
является непредельным углеводородом
-
атомы углерода в молекуле соединены двойной связью
-
характерны реакции замещения
-
сгорает с образованием угарного газа и водорода
18. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества.
ВЕЩЕСТВА РЕАКТИВ
А) СаCO3 и CaSiO3 1) ВаCl2
Б) р-рNaCl и р-рNaBr 2) H2SO4
В) р-р Na2SO4 и р-рNaNO3 3) AgNO3
4) K3PO4
19. Установите соответствие между веществом и реагентами, с каждым из которых оно может вступать в реакцию.
ВЕЩЕСТВО РЕАГЕНТЫ
А) Ca(OH)2 (р-р) 1) N2, O2
Б) H2SO4 (разб.) 2) CO2, HCl
В) H2 3) CuO, Fe
4) MgCl2, NaNO3
Часть 2
20.Используя метод электронного баланса, составьте уравнение реакции
Ag + HClO3 → AgCl + AgClO3 + H2O
Определите окислитель и восстановитель.
21. После пропускания через раствор гидроксида калия 1,12 л углекислого газа (н.у.) получили 138 г раствора карбоната калия. Вычислите массовую долю соли в полученном растворе.
Составитель: Цыренова Р.В.
22. Даны вещества: Na2SO4, BaCl2, растворы HCl, H2SO4 и аммиака. Используя воду и необходимые вещества только из этого списка, получите в две стадии раствор хлорида аммония. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение реакции.
Составитель: Цыренова Р.В.
Тренировочный вариант Химия Вариант 915-2Ответом к заданиям 1-15 является одна цифра, которая соответствует номеру правильного ответа. Запишите эту цифру в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки.
1.Три электрона находятся во внешнем электронном слое атома каждого из двух химических элементов:
-
Al и B
-
Mq и S
-
Al и Ca
-
N и P
2. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
-
уменьшением радиуса атомов
-
увеличением числа энергетических уровней в атомах
-
уменьшением числа протонов в ядрах атомов
-
увеличением числа валентных электронов
3. Соединение с ионной связью образуется при взаимодействии
-
CH4 и O2
-
NaOH и HCl
-
C2H6 и HNO3
-
SO3 и H2O
4. Отрицательную степень окисления сера проявляет в
-
Na2SO3
-
(NH4)2S
-
CuSO4
-
SO3
5. Оксид бериллия и карбонат кальция являются соответственно
-
оснόвным оксидом и кислотой
-
амфотерным гидроксидом и солью
-
амфотерным оксидом и солью
-
оснόвным оксидом и основанием
6. Признаком протекания химической реакции между карбонатом натрия и соляной кислотой является
-
появление запаха
-
изменение цвета
-
выпадение осадка
-
выделение газа
7.Наибольшее количество анионов образуется при диссоциации 1 моль
-
сульфата меди (II)
-
ортофосфата калия
-
нитрата натрия
-
cульфата алюминия
8.Необратимо протекает реакция ионного обмена между растворами
-
хлорида алюминия и нитрата калия
-
сульфата меди (II) и хлорида цинка
-
нитрата железа (III) и серной кислотой
-
гидроксида натрия и азотной кислотой
Составитель: Цыренова Р.В.
9. Как алюминий, так и фосфор реагируют с
-
водородом
-
натрием
-
раствором хлорида железа (III)
-
раствором нитрата цинка(II)
10. Оксид цинка взаимодействует каждое из двух веществ:
-
SO2 и Н2О
-
H2O и CO2
-
Сu(OH)2 и H2SO4
-
HNO3 и Ba(OН)2
11. С раствором гидроксида натрия реагирует каждый из двух оксидов
-
MgO и NO
-
NO2 и CuO
-
FeO и ZnO
-
CO2 и Al2O3
12. Раствор хлорида меди (II) не реагирует с
-
Na2CO3
-
Na2S
-
NaOH
-
Na2SO4
13. Верны ли следующие суждения об использовании химических реакций и правилах безопасной работы в химической лаборатории?
А. При квашении капусты используется реакция брожения.
Б. Работы с хлором следует проводить в вытяжном шкафу.
-
верно только А
-
верно только Б
-
верны оба суждения
-
оба суждения неверны
14. Азот является окислителем в реакции
-
2NO + O2 = 2NO2
-
3СuO + 2NH3 = N2 + 3Cu + 3H2O
-
4NH3 + 5O2 = 4NО + 6H2O
-
6Li + N2 = 2Li3N
15. На какой диаграмме распределение массовых долей элементов соответствует количественному составу карбоната калия?
1) 2) 3) 4)
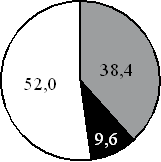
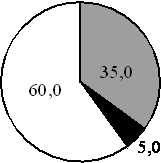
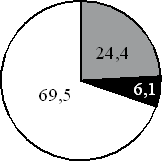
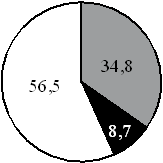
Составитель: Цыренова Р.В.
16. В главных подгруппах при увеличении порядкового номера элемента возрастает
-
высшая степень окисления
-
радиус атома
-
валентность элемента в водородном соединении
-
число заполненных электронами энергетических уровней
-
электроотрицательность элемента
17. Укажите утверждения, верные для ацетилена
-
при обычных условиях - газ
-
хорошо растворим в воде
-
состоит из трёх элементов
-
является сильной кислотой
-
горит в кислороде с выделением большого количества теплоты
18. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества.
ВЕЩЕСТВА РЕАКТИВ
А) Na2CO3 и Na2SiO3 1) NaOH
Б) К2CO3 и Li2CO3 2) HCl
В) CuSO4 и KCl 3) MgO
4) K3PO4
19.Установите соответствие между веществом и реагентами, с которыми это вещество может взаимодействовать
НАЗВАНИЕ ВЕЩЕСТВА РЕАГЕНТЫ
А) натрий 1) CO, Fe
Б) оксид алюминия 2) O2, H2O
В) гидроксид бария 3) CuSO4, CO2
4) H2SO4, NaOH
5) Cl2, Mg
Часть 2
20.Используя метод электронного баланса, составьте уравнение реакции
NaMnO4 + NaOH → Na2MnO4 + O2 + H2O
Определите окислитель и восстановитель.
21. К раствору с массовой долей гидроксида натрия 5% добавили избыток раствора сульфата меди (II). При этом образовался осадок массой 4,9г. Определите массу исходного раствора щелочи.
22. Даны вещества: Fe, H3PO4, H2SO4 (р-р), NaOH, FeCl3, H2O2. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид железа(II). Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Составитель: Цыренова Р.В.
Критерии ответов тренировочного КИМ по химии ГИА (ОГЭ)-2015
Часть1
Составитель: Цыренова Р.В.
Тренировочный вариант Химия 2015 г
Критерии оценивания заданий с развернутым ответом.
Вариант 915-1
20.Используя метод электронного баланса, составьте уравнение реакции
Ag + HClO3 → AgCl + AgClO3 + H2O
Определите окислитель и восстановитель.Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки, не искажающие его смысла)
Баллы
Элементы ответа:
1) Составлен электронный баланс
Ag0 - 1е → Ag+1 1 6
Cl+5 +6е → Cl-1 6 1
2) Расставлены коэффициенты в уравнении реакции
6Ag + 6HClO3 → AgCl + 5AgClO3 + 3H2O
3) Указано, что хлор в степени окисления +5 является окислителем, а серебро в степени окисления ноль - восстановителем
Ответ правильный и полный, включает все названные выше элементы
3
В ответе допущена ошибка только в одном элементе
2
В ответе допущены ошибки только в двух элементах
1
Все элементы ответа записаны неверно
0
Максимальный балл
3
21. После пропускания через раствор гидроксида калия 1,12 л углекислого газа (н.у.) получили 138 г раствора карбоната калия. Вычислите массовую долю соли в полученном растворе.Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки, не искажающие его смысла)
Баллы
Элементы ответа:
1) Составлен о уравнение реакции:
2КОН + СО2 = К2СО3 + Н2О
2) Рассчитаны количество вещества углекислого газа и карбоната калия, масса карбоната калия, содержащегося в исходном растворе:
по уравнению реакции n(СО2) = n(К2СО3) = V(СО2) / Vm =
= 1,12 / 22,4 = 0,05 моль
m(К2СО3) = n(К2СО3) · M(К2СО3) = 0,05 · 138 = 6,9 г
3) Вычислена массовая доля карбоната калия в исходном растворе:
ω(К2СО3) = m(К2СО3) / m(р-ра) = 6,9 / 138 = 0,05, или 5%
Ответ правильный и полный, включает все названные выше элементы
3
В ответе допущена ошибка только в одном элементе
2
В ответе допущены ошибки только в двух элементах
1
Все элементы ответа записаны неверно
0
Максимальный балл
3
Составитель: Цыренова Р.В.
22. Даны вещества: Na2SO4, BaCl2, растворы HCl, H2SO4 и аммиака. Используя воду и необходимые вещества только из этого списка, получите в две стадии раствор хлорида аммония. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение реакции.Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки, не искажающие его смысла)
Баллы
Составлены два уравнения реакции:
1) BaCl2+ H2SO4= BaSO4 ↓+ 2HCl
2) NH3 + HCl = NH4Cl
Описаны признаки протекания реакций:
3) для первой реакции: выделение белого осадка сульфата бария
4) для второй реакции: исчезновение запаха аммиака.
Составлено сокращённое ионное уравнение второй реакции:
5) NH3 + H+ = NH4+
Ответ правильный и полный, включает все названные выше элементы
5
В ответе допущена ошибка только в одном элементе
4
В ответе допущены ошибки только в двух элементах
3
В ответе допущены ошибки только в трех элементах
2
В ответе допущены ошибки только в четырех элементах
1
Все элементы ответа записаны неверно
0
Максимальный балл
5
Составитель: Цыренова Р.В.
Тренировочный вариант Химия 2015 г
Критерии оценивания заданий с развернутым ответом.
Вариант 915-2
20. Используя метод электронного баланса, составьте уравнение реакции
NaMnO4 + NaOH → Na2MnO4 + O2 + H2O
Определите окислитель и восстановитель.Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки, не искажающие его смысла)
Баллы
Элементы ответа:
1) Составлен электронный баланс
2О-2 - 4е → О20 4 1
Mn+7 +1е → Mn+6 1 4
2) Расставлены коэффициенты в уравнении реакции
4NaMnO4 + 4NaOH → 4Na2MnO4 + O2 + 2H2O
3) Указано, что марганец в степени окисления +7 является окислителем, а кислород в степени окисления -2 - восстановителем
Ответ правильный и полный, включает все названные выше элементы
3
В ответе допущена ошибка только в одном элементе
2
В ответе допущены ошибки только в двух элементах
1
Все элементы ответа записаны неверно
0
Максимальный балл
3
21. К раствору с массовой долей гидроксида натрия 5% добавили избыток раствора сульфата меди (II). При этом образовался осадок массой 4,9г. Определите массу исходного раствора щелочи.Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки, не искажающие его смысла)
Баллы
Элементы ответа:
1) Составлен о уравнение реакции:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SО4
2) Рассчитаны количество вещества гидроксида меди (II) и гидроксида натрия, масса гидроксида натрия, содержащегося в исходном растворе:
по уравнению реакции n(NaOH) = 2n(Cu(OH)2) = V(Cu(OH)2) / М(Cu(OH)2) = 2·4,9 / 98 = 0,1 моль
m(NaOH) = n(NaOH) · M(NaOH) = 0,1 · 40 = 4 г
3) Вычислена масса исходного раствора щелочи:
m(р-раNaOH) = m(NaOH) / ω = 4 / 0,05 = 80г.
Ответ правильный и полный, включает все названные выше элементы
3
В ответе допущена ошибка только в одном элементе
2
В ответе допущены ошибки только в двух элементах
1
Все элементы ответа записаны неверно
0
Максимальный балл
3
22. Даны вещества: Fe, H3PO4, H2SO4 (р-р), NaOH, FeCl3, H2O2. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид железа(II). Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Составитель: Цыренова Р.В.Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки, не искажающие его смысла)
Баллы
Составлены два уравнения реакции:
1) Fe + H2SO4= FeSO4 + H2 ↑
2) FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
Описаны признаки протекания реакций:
3) для первой реакции: выделение бесцветного газа
4) для второй реакции: выделение зеленоватого осадка
Составлено сокращённое ионное уравнение второй реакции:
5) Fe2+ + 2OH- = Fe(OH)2↓
Ответ правильный и полный, включает все названные выше элементы
5
В ответе допущена ошибка только в одном элементе
4
В ответе допущены ошибки только в двух элементах
3
В ответе допущены ошибки только в трех элементах
2
В ответе допущены ошибки только в четырех элементах
1
Все элементы ответа записаны неверно
0
Максимальный балл
5
Максимальное количество баллов, которое может получить экзаменуемый за выполнение всей экзаменационной работы- 34 балла.
Отметку «5» рекомендуется выставлять в том случае, если из общей суммы баллов, достаточной для получения этой отметки, выпускник набрал 5 и более баллов за выполнение заданий части 2.
Шкала пересчета первичного балла за выполнение экзаменационной работы в отметку по пятибалльной шкале
Составитель: Цыренова Р.В.
14