- Учителю
- Химический тренажер по теме ПЗ и ПСХЭ
Химический тренажер по теме ПЗ и ПСХЭ

Периодический закон Д.И. Менделеева. Строение
атома.
Методические особенности представления тестовых материалов, дидактических задач по теме «Периодический закон Д.И. Менделеева. Строение атома»
Учитель химии МОУ «Вейделевская СОШ»
Коваленко Е.И.
В соответствии с программой Гара Н.Н УМК Рузитис Г.Е., Фельдман Ф.Г. на тему «Периодический закон и периодическая система химических элементов Д.И.Менделеева. Строение атома» в 8 классе отводится 10 часов.
Учащиеся должны:
Знать определение понятия «химический элемент», формулировку Периодического закона.
Уметь объяснять физический смысл атомного (порядкового) номера химического элемента. Объяснять физический смысл номера группы и периода, составлять схемы строения атомов первых 20 элементов ПСХЭ Д.И. Менделеева. Объяснять закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп. Характеризовать химические элементы (от Н до Са) на основе их положения в ПСХЭ и особенностей строения их атомов.
Основные понятия: Атомы как форма существования химических элементов. Основные сведения о строении атомов. Доказательства сложности строения атомов. Опыты Резерфорда. Планетарная модель строения атома.
Состав атомных ядер: протоны и нейтроны. Относительная атомная масса. Взаимосвязь понятий «протон», «нейтрон», «относительная атомная масса».
Изменение числа нейтронов в ядре атома - образование изотопов. Современное определение понятия «химический элемент». Изотопы как разновидности атомов одного химического элемента.
Электроны. Строение электронных оболочек атомов химических элементов № 1-20 периодической системы Д. И. Менделеева. Понятие о завершенном и незавершенном электронном слое (энергетическом уровне).
Периодическая система химических элементов Д. И. Менделеева и строение атомов: физический смысл порядкового номера элемента, номера группы, номера периода.
При изучении данных вопросов предлагаю следующую систему контроля знаний и умений обучающихся:
-
Задания для актуализации опорных знаний (загадки о химических элементах, дидактические игры) приложение 1;
-
Тестовые задания, предполагающие промежуточный контроль знаний и умений учащихся, выполняются в классе (химические диктанты, дидактические игры) приложение 2;
-
Задания, предполагающие подготовку к ГИА (возможно выполнение на уроках и во внеурочное время) приложение 3;
-
Творческие задания, для повышения интереса к изучаемой теме (кроссворды, ребусы, мини- сочинения, сказки) приложение 4;
Самостоятельная работа учащихся всегда очень актуальна, т.к. без систематического повторения и закрепления изученного материала невозможно добиться глубоких и прочных знаний. Систематически выполняя разнообразные задания, учащиеся активно включаются в учебный процесс. Они приобретают умения самостоятельно мыслить, устанавливать взаимосвязи между изучаемыми понятиями, овладевают определенными навыками самообразования.
Самостоятельная работа является важным средством развития познавательной деятельности учащихся, совершенствования, закрепления, и практического применения знаний. Она является неотъемлемой частью урока, способствует формированию устойчивых и осознанных знаний, дает возможность каждому учащемуся работать в доступном ему темпе, с постепенным переходом от одного уровня развития знаний к другому.
Вопросы активизации познавательной деятельности учащихся относятся к числу наиболее актуальных проблем современной педагогической науки и практики. Реализация принципа активности в обучении имеет большое значение, т.к. обучение и развитие носят деятельностный характер, и от качества учения как деятельности зависит результат обучения, развития и воспитания учащихся. Новые технологии самостоятельного обучения имеют в виду, прежде всего повышение активности учащихся: истина, добытая путем собственного напряжения усилий, имеет огромную познавательную ценность.
АКТУАЛИЗАЦИЯ ОПОРНЫХ ЗНАНИЙ приложение 1.
Несложные, интересные загадки активизируют мысленную деятельность учащихся вначале урока.
Учитель читает стихотворения - загадки, в содержании которых назван химический элемент. Учащиеся по смыслу определяют его.
-
Металл я самый ковкий и лучший проводник,
Хоть менее активен, - порок в том не велик.
Я воду очищаю - микробы убиваю,
В медицине я помощник - для врача.
Не ставьте большего труда - вы только в зеркало взгляните
И там увидите меня. (СЕРЕБРО)
-
Я инертный газ. Отличаюсь я от вас,
Что ни с кем не соединяюсь и не в чем не растворяюсь.
Ни сильный фтор, ни жадный хлор,
Не могут покорить меня.
Электрон, пропущенный через трубку с газом
Светится, как яркая звезда. И теперь витрины многих
Магазинов светятся за счет меня.
Вот какими свойствами обладаю Я! (АРГОН).
-
Я газ, я ядовит, зеленоватый яд на вид
Хоть воздух легче - не тужу, во многом людям я служу.
Поля большие удобряю, даю вам больше урожаю,
Вредителям я злейший враг и этому я очень рад.
Дружок есть натрий у меня, дружок он закадычный
Мы друг без друга никуда, куда дружок - туда и я.
А с водородом соединюсь, то в кислоту я превращусь
А вот в какую кислоту, я вам сейчас скажу.
Соляной все зовут её, и в день происхожденья
Получила на земле большое примененье. (ХЛОР)
-
А это что за элемент?
В нем изменений нет,
Ты измени в нем только ударенье
Построишь ты сооруженье. (ПЛАТИНА)
-
Он яркой звездой загорается,
Белый и легкий металл,
Он в 13 клетке таблицы
Почетное место занял (АЛЮМИНИЙ)
-
Белы его соединения, в воде бывает иногда,
Не вызывает то сомненья, что это жесткая вода
В Финляндии и на Урале цветные карбонаты есть его,
А белоснежные в Карраре
Таким в дворцах, большая честь. (КАЛЬЦИЙ)
-
Я желтая, горючая и в кислоту вхожу, в свободном виде я
Встречаюсь и с медициною дружу.
Огонь всегда для человека играл большую роль.
А добывался очень трудно, теперь я вам дарю огонь.
И стоит лишь приблизить пламя, я сразу плавится начну.
И возгоняюсь - это значит из твердой в газ перехожу. (СЕРА)
-
Вхожу я в семью галогенов, в седьмой же группе я живу
И хоть не очень я активен, но вам похвастаться могу.
Блестящий, кристаллический - я в спирте растворяюсь,
Служу отлично в медицине, в морской капусте я встречаюсь,
Когда меня нагреют в колбе - сержусь и в пар перехожу,
А пыль остынет и на стенках свои кристаллы осажу. (ЙОД)
-
Хранят обычно в керосине
И бегает он по воде
Отныне знай - в свободном виде
В при роде нет его нигде.
В солях открыть его возможно,
Желтеет пламя от него
И получить из соли можно
Как Деви, получил его. (НАТРИЙ)
-
Не спорьте! Кто же как не я и в древности блистал в коронах.
Сейчас считаюсь ценностью в межгосударственной торговле.
Незаменим считаюсь я, прославлен всеми письменами
Металл, испытанный огнем, манил к себе людей веками. (ЗОЛОТО)
-
Агрессивнейший в команде. Всех способен окислять,
Только с кем-нибудь в комплекте сможем в деле применять.
С ним получим алюминий, вазы матовый узор,
Удалим оксид при пайке…… Безусловно это (ФТОР)
-
В воде обычно он хранится,
Свет излучает в темноте,
Искать в природе лучше не трудитесь,
Свободным нет его нигде,
Воспламеняться сам он может,
К тому же сильно ядовит,
Так отвечай без промедленья,
Коль в пятой группе он стоит (ФОСФОР)
ДИДАКТИЧЕСКИЕ ИГРЫ приложение 2.
Среди нетрадиционных форм, используемых при преподавании химии в 8-м классе, дидактические игры наиболее популярны. Дидактическая игра позволяет эффективно реализовывать все ведущие функции обучения: образовательную, воспитательную и развивающую на основе принципов педагогики сотрудничества. И одновременно достигается решение сразу нескольких задач.
-
Осуществляется более свободный, психологически благоприятный контроль знаний.
-
Исчезает болезненная реакция учащихся на неудачные ответы.
-
Подход к учащимся в обучении становится более деликатным дифференциальным.
В результате использования игрового метода стимулируется познавательная деятельность учащихся, активизируется их мышление. В ходе игры выявляются личностные черты характера учащихся, усиливается мотивация к изучению данного предмета.
Представленные игры можно использовать как командные, способствующие развитию организационных и коммуникативных умений восьмиклассников, так и индивидуальные, служащие для проверки, коррекции знаний конкретного ученика.
«Построй фигуры»
Химический диктант проводят с целью проверки знания химических знаков и их изображения. Каждому ученику выдают лист бумаги с беспорядочно расставленными точками, каждой из которых соответствует знак химического элемента (рис. 1, 2).
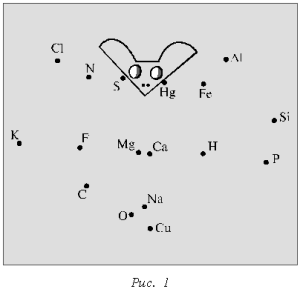
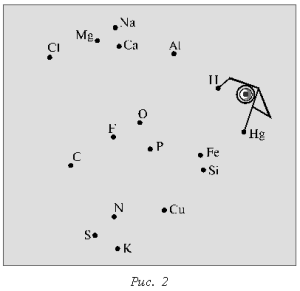
Учитель в определенной последовательности называет химические элементы (фосфор, калий, азот, сера, фтор, кислород, магний, кальций, натрий, водород, ртуть, железо, фосфор), а школьники соединяют знаки этих элементов прямыми линиями в той же последовательности. В результате должны получиться определенные фигуры (рис. 3, 4).
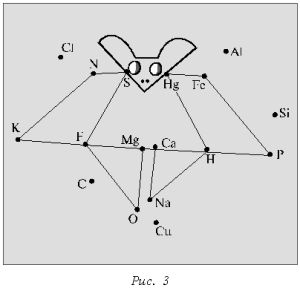
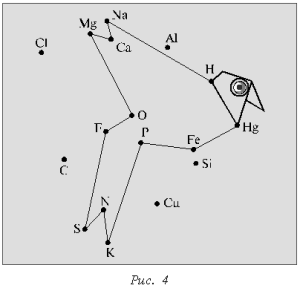
Для усложнения задачи на листе нанесены химические символы элементов, не входящих в диктант.
«Логические цепочки»
При изучении периодической системы и строения атома можно использовать задания в форме логических цепочек, в которых некоторые звенья пропущены. Каждому ученику выдают карточку с заданием.

Справа от задания ученики записывают объяснения своих ответов.
При этом можно пользоваться только периодической системой. Задания от а) до г) постепенно усложняются.
Ответы:
а) Na → Mg → Al - элементы одного периода;
б) N → P → As → Sb → Bi - элементы V группы главной подгруппы;
в) R2O → RO → R2O3 → RO2 → R2O5 → RO3 →R2O7 - формулы высших оксидов элементов главных подгрупп I-VII групп периодической системы;
г) 1s1 → 1s2 2s1 → 1s2 2s2 2p6 3s1 → 1s2 2s2 2p6 3s2 3p6 4s1 - электронные формулы элементов I группы главной подгруппы.
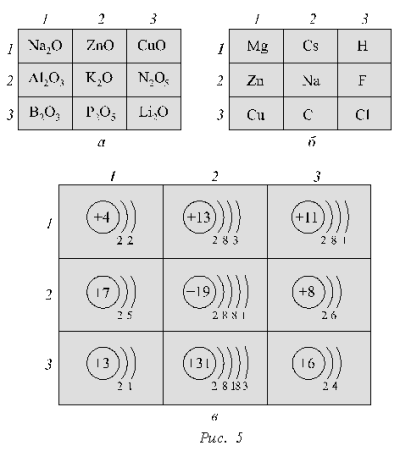
В трех квадратах (рис. 5), изображающих игровые поля, находятся оксиды (а), химические элементы (б), электронные формулы атомов (в). Для выполнения каждого задания необходимо указать связующий признак, согласно которому можно соединить три клетки поля прямой линией по вертикальному, горизонтальному рядам или диагоналям. Предварительно учащимся сообщается о наличии нескольких триад на каждом поле.
Ответы:
а) 1-й ряд по горизонтали (оксиды металлов), 1-3-й по диагонали (высшие оксиды элементов I группы главной подгруппы);
б) 1-й ряд по горизонтали (относятся к s-элементам), 1-й ряд по вертикали (металлы), 3-й ряд по вертикали (неметаллы);
в) 1-й ряд по вертикали (атомы всех элементов имеют по два электронных слоя), 3-3-й по диагонали (атомы всех элементов имеют по одному электрону на внешнем уровне).
«Морской бой»
Обобщающий урок по теме «Периодический закон и периодическая система химических элементов Д.И.Менделеева» может быть проведен в форме детской игры «Морской бой».
В игре участвуют две команды. Число игроков в каждой команде должно совпадать с числом вопросов. Каждой паре участников выдают лист с вопросами тестового типа. Рядом с ответами в скобках стоят соответствующие координаты игрового поля. Если ответ выбран правильно, то «корабль» «убит» или «ранен». Во избежание случайного попадания в игре используют только одно- и двухпалубные «корабли».
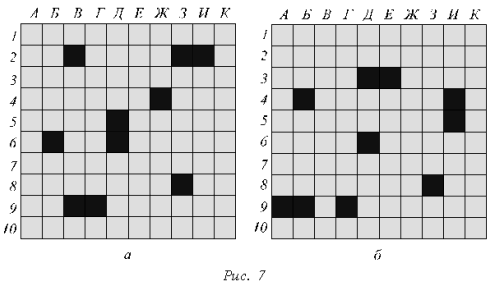
В процессе игры пары игроков команд по очереди отвечают на вопросы. Игроки зачитывают вопрос и выбирают правильный, по их мнению, ответ. Независимо от правильности ответа право хода предоставляется команде-противнику.
Обсуждение вопросов, вызвавших затруднения, происходит по ходу игры. За их разъяснением учитель обращается к классу. Если никто из игроков команды, члены которой допустили ошибку, не может ответить на вопрос, то право ответа переходит к другой команде. За правильное объяснение команда-противник получает дополнительное очко. Для проведения игры учитель заранее заготавливает на ватмане два игровых поля (размером 10 X10 клеток), записав по горизонтали ряд букв: А, Б, В, Г, Д, Е, Ж, З, И, К, а по вертикали - ряд цифр от 1 до 10.
Капитан каждой команды отмечает на соответствующих игровых полях ответы своих игроков и соперников, сообщает результаты «выстрелов» всему классу («ранен», «убит», «мимо»), регистрирует правильные ответы своей команды.
Вопросы, для игры можно разделить по содержанию на три группы:
-
периодический закон, структура периодической системы;
-
электронное строение атомов химических элементов;
-
зависимость свойств химических элементов и их соединений от положения в периодической системе.
Предлагаем следующие вопросы для проведения этой игры
Вопросы первой команды (ответы смотри на игровом поле второй команды, рис. 7, б)
1. Современная формулировка периодического закона:
«Свойства химических элементов и их соединений находятся в периодической зависимости от...»:
а) величины их атомной массы (Д-2);
б) числа нейтронов в атомном ядре (К-3);
в) числа электронов в атоме (Б-3);
г) заряда ядра атома (Б-4).
2. Число электронных уровней в атоме любого химического элемента можно определить:
а) по номеру периода (Д-3);
б) по номеру группы (Д-4);
в) по номеру ряда (Д-2);
г) по порядковому номеру элемента (Г-3).
3. Кислотным и основным оксидами являются соответственно:
а) Na2О и СаО (Д-4); в) Р2O5 и СО2 (Г-3);
б) СuО и СrО3 (Д-2); г) SО3 и СаО (E-3).
4. С увеличением заряда ядра у атомов химических элементов в периоде:
а) металлические свойства усиливаются (Ж-2);
б) неметаллические свойства усиливаются (И-4);
в) металлические свойства не изменяются (К-3);
г) неметаллические свойства не изменяются (В-1).
5. Электроотрицательность имеет наибольшее значение у химических элементов, расположенных:
а) в начале периода (З-4);
б) в середине периода (И-3);
в) в конце периода (И-5).
6. Электронная формула атома натрия:
а) 1s2 2s2 2p6 3s2 (В-2); в) 1s2 2s2 (К-2);
б) 1s2 2s1 (А-1); г) 1s2 2s2 2p6 3s1 (Д-6).
7. Конфигурацию внешнего электронного уровня 3s2 3p2 имеет атом элемента:
а) № 14 (Б-9); в) № 6 (Е-1);
б) № 12 (Ж-6); г) № 5 (Б-2).
8. Какие элементы образуют высшие оксиды с общей формулой R2О3?
а) Мg, Са, Ве (Б-8); в) В, Аl, Ga (A-9);
б) N, Р, Аs (Б-10); г) С, Si, Gе (B-9).
9. Электронная формула атома химического элемента 1s2 2s2 2p6 3s2 3p3. Формула высшего оксида данного элемента:
а) Р2О3 (З-7); в) N2О5 (З-2);
б) Al2О3 (З-5); г) P2О5 (З-8).
10. Закончите уравнение реакции, расставьте коэффициенты:
ZnO + NаОН = ? + ?
Мольное соотношение веществ, вступивших в реакцию, равно:
а) 1:1 (Г-8); в) 1:3 (Г-10); б) 1:2 (Г-9); г) 2:1 (Д-9).
Вопросы второй команды (ответы смотри на игровом поле первой команды, рис. 7, а)
1. В периодической системе в состав побочных подгрупп входят элементы:
а) как малых, так и больших периодов (Б-2);
б) только малых периодов (Г-3);
в) только больших периодов (В-2).
2. Число электронов на внешнем уровне у атомов элементов главных подгрупп можно определить:
а) по номеру периода (Д-1);
б) по номеру группы (Д-5);
в) по номеру ряда (К-2);
г) по порядковому номеру элемента (И-3).
3. Какие вещества в паре являются амфотерными гидроксидами:
а) Ва(ОН)2 и Сu(ОH)2 (Д-4);
б) Zn(ОH)2 и NаОH (Г-5);
в) Zn(ОH)2 и Аl(ОH)3 (Д-6);
г) Fe(ОH)2 и Fe(ОH)3 (E-5).
4. У элементов главных подгрупп периодической системы с увеличением заряда ядра:
а) неметаллические свойства усиливаются (Б-5);
б) металлические свойства не изменяются (Б-7);
в) неметаллические свойства ослабевают (В-9);
г) неметаллические свойства не изменяются (А-6).
5. Электронная формула атома серы:
а) 1s2 2s1 (В-8); в) 1s2 2s2 2p6 3s2 3p4 (Г-9);
б) 1s2 2s2 2p6 3s1 (Б-9); г) 1s2 2s2 2p6 3s2 3p5 (В-10).
6. Электроотрицательность увеличивается в ряду элементов:
а) Сl, S, Р, Аl (Б-3); в) B, Аl, Ga, In (Б-9);
б) Li, С, N, F (Б-6); г) Li, Nа, К, Rb (A-7).
7. Атом какого элемента имеет конфигурацию внешнего электронного уровня 3s2 3p1?
а) № 5 (Д-2); в) № 15 (А-8);
б) № 3 (К-8); г) № 13 (Ж-4).
8. Формула вещества, образующегося при взаимодействии с водой высшего оксида элемента № 6:
А) Э(ОН)4 (З-7); в) Н2ЭО3 (З-8);
б) Н4ЭО4 (З-9); г) Н2Э (З-5).
9. Элементы образуют газообразные водородные соединения с общей формулой RН3 и высшие оксиды состава R2О5. Какова электронная формула внешнего энергетического уровня их атомов?
а) ns2 np3 (И-2); в) ns2 np4 (З-9);
б) ns2 np5 (З-7); г) np3 (Ж-8).
10. Закончите уравнение реакции, расставьте коэффициенты:
Аl(ОН)3 + НСl = ? + ?
Мольное cоотношение веществ, вступивших в реакцию, равно:
а) 1:3 (З-2); в) 1:2 (И-3);
б) 1:1 (И-1); г) 2:1 (К-2).
Занимательные формы контроля знаний учащихся по химии
О.В.Репина, М.Д.Трухина,
Московский педагогический
государственный университет (МПГУ)
ТЕМАТИЧЕСКИЕ ТРЕНИРОВОЧНЫЕ ЗАДАНИЯ приложение 3.
Тематические тренировочные задания для отработки умений и навыков при выполнении заданий А1, А2,А3 ГИА по химии.
В современной школе все большее значение приобретают различные формы тестов в связи с тем, что основной формой сдачи экзаменов является тестирование. Реальность требует формировать у учащихся навык работы с тестовыми заданиями в течение года. Во время таких тренировок развиваются соответствующие психотехнические навыки саморегулирования и самоконтроля. Тестирование ставит всех учащихся в равные условия, практически исключая субъективизм преподавателя. Одним из основных достоинств тестирования является минимум временных затрат на получение надежных итогов контроля.
После изучения тем: «Строение атома» и «Периодический закон» необходимо уметь отвечать на следующие вопросы:
-
Кто и когда открыл периодический закон.
-
Какова авторская формулировка периодического закона.
-
Что является графическим выражением периодического закона.
-
Сколько периодов в периодической системе. Какие периоды являются большими и какие малыми.
-
Сколько групп в периодической таблице. Какие подгруппы являются главными, какие побочными.
-
Какие элементарные частицы входят в состав атома, чему равны их массы и заряды.
-
Из каких частиц состоит ядро атома.
-
Чему равен заряд ядра атома.
-
Что такое изотопы.
-
Как определяется понятие «химический элемент» с точки зрения строения атома.
-
Какова современная формулировка периодического закона.
-
Что называется электроны облаком, электронной орбиталью.
-
Какую геометрическую форму имеют S- и Р-орбитали.
-
В каком порядке электроны в атомах заполняют энергетические уровни и подуровни.
-
Чем объясняется периодическое изменение свойств химических элементов и их соединений.
-
Какие элементы называются S-, P-, d-, f-элементами.
-
Как изменяются радиусы атомов, металлические и неметаллические свойства, окислительные и восстановительные свойства атомов химических элементов в периодах и главных подгруппах.
В результате изучения тем «Строение атома», «Периодический закон» необходимо приобрести навыки:
-
Работы с периодической системой химических элементов Д.И. Менделеева.
-
Определения высшей валентности элемента по его положению в периодической системе.
-
Сопоставления свойств элементов данного периода, главной подгруппы, а также сравнения свойств образуемых этими соединениями оксидов и гидроксидов.
-
Составления электронных и графических формул атомов.
-
Классификации химических элементов на S-, P-, d-, f-элементы.
-
Определение числа валентных электронов в атомах различных элементов.
Задания для отработки тем «Строение атома» и «Периодический закон».
-
Чему равны заряд ядра и число электронов в атомах элементов: C, S, Cu, Ag.
-
Назовите элемент, в ядре которого 11 протонов.
-
Назовите элемент, в атоме которого содержится 26 электронов.
-
Чему равен порядковый номер элемента, атомная масса которого 31, а число нейтронов в атоме 16.
-
Сколько электронов, протонов, нейтронов входит в состав атома элемента, который находится в V периоде, в побочной подгруппе VI группы (атомная масса 96).
-
Сколько электронов, протонов и нейтронов входит в состав атома элемента, который находится в IV периоде, в главной подгруппе III группы (атомная масса 70).
-
По положению элементов в периодической системе определите число энергетических уровней и число электронов на внешнем уровне в атомах: серы, цезия, кальция, висмута, йода, ксенона. Напишите для каждого из них электронную конфигурацию внешнего уровня.
-
Укажите, к какому электронному семейству относится каждый из следующих элементов: углерод, барий, бром, рубидий, железо, хлор.
-
По электронной формуле внешнего уровня определите, какой это элемент: 3S23P4, 4S24P6, 2S22S1, 5S25S3, 6S26P2, 5S25P5, 3S23P3.
-
В каком периоде, в какой группе, в какой подгруппе находятся элементы с порядковыми номерами 14, 29, 52, 56, 78.
-
Напишите символ, название и порядковый номер элемента, который находится:
а) в третьем периоде, в главной подгруппе шестой группы, б) в пятом периоде, в побочной подгруппе второй группы, в) в шестом периоде, в главной подгруппе четвертой группы, г) в четвертом периоде, в побочной подгруппе восьмой группы.
12. Какой элемент имеет более выраженные металлические свойства: Са или Ва. Почему?
13. Какой элемент имеет более выраженные неметаллические свойства: Р или Сl? Почему?
14. Какой элемент четвертого периода является самым активным неметаллом? Почему?
15. Какой элемент пятого периода является самым активным металлом? Почему?
16. По положению элементов в периодической системе определите, какой элемент имеет большую электроотрицательность, больший радиус атома:
а) иод или бром;
б) олово или иод;
в) магний или барий;
г) ртуть или астат
ОТВЕТЫ:
-
6, 16, 29, 47
-
натрий
-
железо
-
фосфор
-
42, 42, 54
-
31, 31, 39
-
сера - 3, 6; цезий - 6, 1; кальций - 4, 2; висмут - 6, 5; йод - 5, 7; ксенон - 5, 8.
-
углерод - р - элемент, барий - s - элемент, бром - р - элемент, рубидий s - элемент, железо - d - элемент, хлор - р - элемент.
-
сера, бром, бор, сурьма, свинец, йод, фосфор
-
14 - 3 период, IV группа главная подгруппа, 29 - 4 период, I группа побочная подгруппа, 52 - 5 период, VI группа, главная подгруппа, 56 - 6 период, II группа, главная подгруппа, 78 - 6 период, VIII группа, побочная подгруппа.
-
а) S - сера, 16; б) Sr - стронций, 38; в) Pb - свинец, 82; г) Ni - никель, 28.
-
Ва ярче выражены металлические свойства, т.к. больший радиус
-
CI больше выражены неметаллические свойства, т.к больше электронов на внешнем уровне, меньший радиус атома
-
Бром - семейство галогенов
-
Рубидий - щелочной металл
-
а) иод - электроотрицательность, бром - радиус атома;
б) олово - радиус атома, иод - электроотрицательность;
в) магний - электроотрицательность, барий - радиус атома;
г) ртуть - электроотрицательность, астат - радиус атома.
Периодический закон и Периодическая система химических
элементов Д.И.Менделеева
Вариант - 1
1. Изотопы одного элемента различаются
1) числом электронов 2) числом уровней
3) массовым числом 4) зарядом ядра
2. Номер группы элемента в периодической системе соответствует
1) заряду ядра атома этого элемента
2) числу электронов на валентной оболочке атома
3) числу электронных уровней атома этого элемента
4) среднему значению массовых чисел изотопов этого элемента
3. В группе сверху вниз увеличивается
1) число уровней 2) число валентных электронов
3) высшая степень окисления 4) активность неметаллов
4. Неметаллические свойства простых веществ
1) уменьшаются в периодах и увеличиваются в группах
2) уменьшаются в периодах и уменьшаются в группах
3) увеличиваются в периодах и увеличиваются в группах
4) увеличиваются в периодах и уменьшаются в группах
5. Формула гидрида, соответствующая элементу пятой группы в его низшей степени окисления
1) ЭН3 2) ЭН4 3) ЭН 4) ЭН2
Периодический закон и Периодическая система химических элементов Д.И.Менделеева
Вариант - 2
1. Изотопы одного элемента различаются
1) числом протонов 2) числом нейтронов
3) числом электронов 4) зарядом ядра
2. Относительная атомная масса элемента в периодической системе соответствует
1) заряду ядра атома этого элемента
2) числу электронов на валентной оболочке атома этого элемента
3) числу электронных уровней атома этого элемента
4) среднему значению массовых чисел изотопов этого элемента
3. В периоде слева направо уменьшается
1) число уровней 2) число валентных электронов
3) радиус атома 4) активность неметаллов
4. Металлические свойства простых веществ
1) уменьшаются в периодах и увеличиваются в группах
2) уменьшаются в периодах и уменьшаются в группах
3) увеличиваются в периодах и увеличиваются в группах
4) увеличиваются в периодах и уменьшаются в группах
5. Формула оксида, соответствующая элементу седьмой группы в его высшей степени окисления
1) ЭО3 2) Э2О7 3) Э2О5 4) ЭО2
ОТВЕТЫ:
Вариант 1
-
- 3, 2. - 2, 3. - 1, 4. - 4, 5. - 1
Вариант 2
-
- 2, 2. - 4, 3. - 3, 4. - 1, 5. - 2.
Тема: Состояние электронов в атоме
Вариант- 1
1. Число подуровней на втором уровне равно
1) 1 2) 2 3) 3 4) 4
2. Число орбиталей на s-подуровне равно
1) 1 2) 3 3) 5 4) 7
3. Число уровней в атоме золота равно
1) 8 2) 5 3) 6 4) 7
4. Максимальное число электронов на четвертом уровне равно
1) 2 2) 8 3) 18 4) 32
5. Максимальное число электронов на d-подуровне равно
1) 2 2) 6 3) 10 4) 14
6. Наименьшую энергию имеет электрон на следующем подуровне
1) 4р 2) 4f 3) 4d 4) 4s
7. Подуровень, расположенный дальше от ядра, - это
1) 1s 2) 4s 3) 3s 4) 2s
8. Число орбиталей на первом уровне атома равно
1) 1 2) 4 3) 9 4) 16
9. Гантелеобразную форму имеет
1) s -орбиталь 2) f -орбиталь 3) р -орбиталь 4) d -орбиталь
10. Число электронов в атоме калия равно
1) 19 2) 26 3) 33 4) 24
Тема: Состояние электронов в атоме
Вариант - 2
1. Число подуровней на третьем уровне равно
1) 1 2) 2 3) 3 4) 4
2. Число орбиталей на p -подуровне равно
1) 1 2) 3 3) 5 4) 7
3. Число уровней в атоме радия равно
1) 5 2) 8 3) 6 4) 7
4. Максимальное число электронов на первом уровне равно
1) 2 2) 8 3) 18 4) 32
5. Максимальное число электронов на f-подуровне равно
1) 2 2) б 3) 10 4) 14
6. Наименьшую энергию имеет электрон на следующем подуровне
1) 2з 2) 1s 3) 3s 4) 4s
7. Подуровень, расположенный ближе к ядру, - это
1) 2s 2) 3s 3) 3р 4) 3d
8. Число орбиталей на третьем уровне атома равно
1) 1 2) 4 3) 9 4) 16
9. Сферическую форму имеет
1) f-орбиталь 2) s-орбиталь 3) d-орбиталь 4) р-орбиталь
10. Число электронов в атоме мышьяка равно
1) 19 2) 26 3) 33 4) 24
ОТВЕТЫ:
Вариант 1.
1. - 2, 2. - 1. 3. - 3, 4. - 4, 5. - 3, 6. - 4, 7. - 2, 8. - 1, 9.- 3, 10. - 1.
Вариант 2
-
- 3, 2. - 2, 3. - 4, 4. - 1, 5. - 4, 6. - 2, 7. - 1, 8. - 4, 9. - 2, 10. - 3.
КРОССВОРДЫ приложение 4.
Для того чтобы учащиеся выполняли задания с удовольствием необходимо разнообразить формы контроля. Одни из активно применяемых методов контроля - это составление и разгадывание кроссвордов, сканвордов и ребусов по изученной теме.
КРОССВОРД-1
Скрылся из глаз необычный секрет
Букв кроме «О» в поле зрения нет
Букв кроме «О» в телескопы не видно
Ах! Как досадно! Ох! Как обидно!
Элементов названья впиши ты в кружок!
Вот номера их 17, 27, 1, 50, 8, 76, 79, 7 -
удачи Дружок!!!
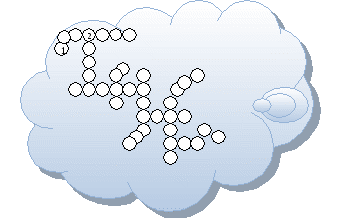
Ответы:
1.водород (№1), 2.-олово (№ 50), 3.-золото(№79), 4.- хлор (№ 17),
5.-кобальт (№ 27), 6. -азот (№ 7), 7.- кислород (№ 8), 8.-осмий (№ 76)
Кроссворд №21
10
2
3
4
5
6
7
8
9
ВОПРОСЫ:
По горизонтали:
-
Элемент, занимающий второе место по распространенности в земной коре.
-
Основной элемент в органических соединениях.
-
Газ, применяемый для заполнения рекламных трубок.
-
Элемент, занимающий первое место по распространенности в земной коре.
-
Газ, применяемый при водолазных работах.
-
Газ, применяемый для производства белильной извести.
-
Элемент, получивший свое название от греческого наименования луны.
-
Вещество, месторождение которого было открыто
академиком А.Е. Ферсманом в пустыне Каракумы.
-
Легчайший газ.
По вертикали:
-
Великий русский химик.
ОТВЕТЫ НА КРОССВОРД.
По горизонтали:
-
Кремний.
-
Углерод.
-
Неон.
-
Кислород.
-
Гелий.
-
Хлор.
-
Селен.
-
Сера.
-
Водород.
Список используемой литературы
-
Гаврусейко Г.И. Курс неорганической химии: 9 класс. - М.: Высшая школа, 1993. -176 с.
-
Городничева И.Н. Контрольные и проверочные работы по химии. М.: Аквариум, 1997; Сорокин В.В., Злотников Э.Г. Тесты по химии. М.: Просвещение, 1991.
-
Занимательные формы контроля знаний учащихся по химии под ред. О.В.Репина, М.Д.Трухина Московский педагогический государственный университет (МПГУ)
-
Научно-методический журнал "Химия: Методика преподавания в школе" 2' 2001.
-
Научно-теоретический и методический журнал "Химия в школе" 9'2001.
-
Рудзитис Г.Е., Фельдман Ф.Г. Химия: Неорган. химия: Учеб. для 8 кл. сред. шк.- М.: Просвещение, 2007.-159 с.
</