- Учителю
- Дидактический материал по химии (УМК О. С. Габриеляна) 8 класс
Дидактический материал по химии (УМК О. С. Габриеляна) 8 класс
I.
8 класс Многовариантная проверочная работа
Тема: « Кислоты, их классификация и свойства».
-
Напишите химические формулы и названия солей, образованных соляной, азотной, серной и ортофосфорной кислотами и металлом……
-
Охарактеризуйте химические свойства кислоты……
-
Даны вещества. С какими из них реагирует серная кислота. Напишите молекулярные и ионные уравнения реакций.
-
Составьте формулы солей по названиям.
№ варианта
1 вопрос
2 вопрос
3 вопрос
4 вопрос.
1
цинком
азотная кислота
медь, магний,
оксид меди( II),
оксид серы( VI)
сульфат меди( II),
нитрат кальция,
хлорид цинка.
2
алюминием
серная кислота
оксид магния, серебро,
натрий, гидроксид калия
фосфат калия,
хлорид натрия,
карбонат кальция.
3
барием
фосфорная кислота
оксид натрия, магний, соляная кислота, оксид фосфора( V).
сульфид свинца,
нитрат железа( II),
силикат натрия.
4
железом ( II)
соляная кислота
оксид алюминия, оксид азота(V), цинк,
гидроксид бария.
фосфата калия, бромида серебра,
карбоната натрия.
5
железом (III)
угольная кислота
серебро, оксид меди( II), гидроксид калия, магний.
хлорид аммония,
карбонат магния,
нитрит натрия.
6
магнием
азотная кислота
оксид кремния, барий, соляная кислота, гидроксид цинка.
хлорид лития,
сульфит натрия,
сульфат хрома (III).
7
калием
соляная кислота
оксид лития,
железо,
оксид серы(IV),
угольная кислота.
иодида натрия,
нитрата серебра,
фосфата кальция.
II. 8 класс К теме: «Решение задач по уравнениям».
-
Сколько граммов магния можно сжечь в Х л кислорода?
-
Сколько литров водорода ( при н.у) выделится при взаимодействии У граммов цинка с соляной кислотой?
-
Сколько литров водорода потребуется для восстановления металла из B граммов оксида меди(II)?
-
Сколько граммов оксида фосфора ( V) получится, если в реакцию вступает Z моль фосфора?
-
Сколько литров оксида углерода ( IV) получится при разложении D граммов карбоната кальция?
№ варианта
Значение переменных
Задание №1
X л.
Задание №2
У г.
Задание №3
В г.
Задание №4
Z моль
Задание №5
D г.
I
1,12
13
8
0,5
20
II
5,6
39
24
2
0,4
III
224
2,6
20
0,25
100
IV
8,96
3,25
3.2
3
50
V
28
6,5
40
0,1
400
III 8 класс Задание к теме: « Степени окисления». Для частицы укажите:
Вариант I
C+4
C0
C+2
C - 4
Общее число электронов
Формулу вещества с соответствующей степенью окисления
Вариант II
S+4
S0
S-2
S+6
Общее число электронов
Формулу вещества с соответствующей степенью окисления
Вариант III
Si+4
Si0
Si+2
Si - 4
Общее число электронов
Формулу вещества с соответствующей степенью окисления
Вариант IV
N+4
N0
N+2
N - 3
Общее число электронов
Формулу вещества с соответствующей степенью окисления
IV. 8 класс Проверочная работа к теме: « Вычисления по формулам».
Фамилия, имя ученика: ___________________________________ Вариант: _____________
Заполните таблицу, вычислив для вещества недостающие величины.
Напоминание М (вещества) вычисляем по ПСХЭ Д.И. Менделеева М = Мr ( на 1 моль).
№ варианта
Формула вещества
М (г/моль)
n ( моль)
m (г)
V ( л)
N (молекул, атомов)
1
SO2
3 * 10 23
2
H2
11,2
3
CH4
0,5
4
NO
3
5
HCl
8,96
6
Cl2
0,6 * 10 23
7
H2S
2
8
O2
128
V. 8 класс Проверочная работа
Фамилия, имя ученика: ___________________________________ Вариант: _____________
Вариант
А
Б
В
Г
Д
Е
1
HCl
CO2
NaOH
Cu
Na2SO4
HNO3
2
Na2O
Fe(OH)3
P
HI
CaCO3
SiO2
3
H2
Al2 (SO4)3
CuO
KOH
MgS
H3PO4
4
FeO
H2S
LiCl
Al2O3
F2
NaHCO3
5
Mg(NO3)2
ZnO
H2SO4
C
Al(OH)3
Cl2O7
Задания по теме: « Классы неорганических веществ».
-
Запишите названия веществ: А, Д.
-
Укажите класс соединения: Б.
-
Выпишите формулу бинарного соединения.
-
Определите степени окисления элементов в формулах: Е
-
Для простого вещества вашего варианта составьте формулы: оксида, гидроксида.
Задания по теме: « Вычисления по химическим формулам».
-
Вычислите массу 2 моль вещества Г
-
Вычислите количество моль вещества В, если N = 12 * 10 22 молекул.
-
Вычислите Mr вещества Б и массовые доли элементов в веществе.
VI.Проверочная работа по темам: « Электролитическая диссоциация веществ. Реакции в растворах» 8 класс
-
Напишите уравнения диссоциации следующих веществ.
-
I вариант
II вариант
III вариант
IV вариант
А
H3PO4
Al2 (SO4)3
Ba(OH)2
CaS
В
Ca(OH)2
HNO3
CuI2
Cu(OH)2
С
FeCl3
Fe(OH)2
K3PO4
HBr
D
NaCl
AgNO3
H2SiO3
Na2SO4
-
Напишите уравнения реакций ( в молекулярной, полной и сокращенной ионной формах).
-
I вариант
II вариант
III вариант
IV вариант
А
CaO + HNO3 =
Al2 (SO4)3 +Ba(OH)2 =
Ba + HBr =
Fe( NO3)3 +Na3PO4=
В
Ca(OH)2 + CO2 =
CuSO4+ Fe =
Na2O + H3PO4 =
Zn + HCl =
С
FeCl3 + NaOH =
Na2CO3 +CaCl2 =
K2SiO3+ H2SO4 =
SO3 + NaOH =
D
AgNO3 + LiCl =
N2O5 + KOH =
MgCl2 + Ba(OH)2 =
BeO + HNO3 =
VII ХИМИЯ 8 класс СХЕМА - алгоритм (к теме: « Решение задач по уравнениям).
( использую данную схему на начальном этапе обучения учащихся решению химических задач)
ИСХОДНЫЕ ВЕЩЕСТВА
У
Р
А
В
Н
Е
Н
И
Е
ПРОДУКТЫ РЕАКЦИИ
m (раствора) m р. в
(раствора) m р. в


m
 (смеси) mч. в
(смеси) mч. в
m (вещества)
(вещества)
V
 (раствора) V (вещества)
(раствора) V (вещества)
V
 (смеси) V(компонента смеси)
(смеси) V(компонента смеси)
V
 (вещества)
(вещества)
N
n
←→
←→
n
 m р.в m(р-ра)
m р.в m(р-ра)

 mч.в.mсмеси
mч.в.mсмеси
 m (вещества)
m (вещества)

 V (вещества) V (раствора)
V (вещества) V (раствора)
 V(компонента смеси) V( смеси)
V(компонента смеси) V( смеси)
 V(вещества)
V(вещества)
Задача № 1. Какая масса оксида магния получится при сжигании 6 г магния. Учитель: 1. Прочтите внимательно задачу. 2.Определите, что дано в условии задачи, что необходимо определить. 3.Запишите в тетрадях условие задачи.
Дано:
m(Mg)= 6 г.
Решение:
Составим алгоритм решения задачи ( используя схему- алгоритмов)


 m(Mg) 1n(Mg) 2 УР 3n(MgО) 4m(MgО)
m(Mg) 1n(Mg) 2 УР 3n(MgО) 4m(MgО)
-
Количество вещества магния находим по формуле: n =

n( Mg) = ![]() =0,25 моль
=0,25 моль
Найти:
m(MgО)=?
2. Запишем уравнение химической реакции:
0,25 моль х моль
2 Mg + O2 = 2 MgO
2 моль2 моль
3. Найдем количество вещества оксида магния, полученного в результате реакции.
n ( Mg) =n( MgO) ( по уравнению реакции), следовательно n ( MgO) = 0,25 моль.
4. Находим массу оксида магния по формуле: m = M*n
M ( MgO) = 40 г/моль m ( MgO) = 40*0,25 = 10 г.
Ответ: m ( MgO) = 10 г.
Задача № 2 Какой объем углекислого газа (н.у.) образуется при взаимодействии с избытком азотной кислоты 250 г известняка (карбоната кальция), содержащего 20% примесей? Каково количество углекислого газа?
Дано:
m(CaCO3)= 250 г.
ᴡприм= 20%
М(СаСО3) = 100 г/моль
Решение:
Составим алгоритм решения задачи ( используя схему- алгоритмов)
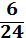

 m (смеси) 1mч.в. 2n( CaCO3 ) 3 УР 4n(CO2) 5V( СО2)
m (смеси) 1mч.в. 2n( CaCO3 ) 3 УР 4n(CO2) 5V( СО2)
1.Вычислим mч.в. по формуле: mч.в.= ᴡчист* m(CaCO3)/100% = (100 -20)* 250/100 = 200 г.
2.Находим n( CaCO3) = ![]() =
= ![]() = 2 моль
= 2 моль
Составим уравнение химической реакции:
2моль х моль
СаСО3+ 2НNO3 = Ca( NO3)2 + H2O + CO2↑
1 моль 1моль
3. Находим n( CO2)
Из уравнения следует, что n(CaCO3) = n (CO2), n (CO2) = 2 моль.
4. Находим V(СО2) по формуле: V = Vm*n
V( CO2) = 22,4*2 = 44,8 л.
Ответ: V(СО2)= 44,8 л, n(CO2)=2 моль.
Найти: V(СО2)=?
n(CO2)=?
Задача № 3 Вычислите массу соли, образующейся при взаимодействии 200 г 15%-ного раствора HNO3 с достаточным количеством оксида меди (II).
Дано:
mраствора(НNO3)= 200 г.
ᴡр.в.= 15%
М(НNO3) = 63 г/моль
M(Cu(NO3)2) =188 г/ моль
Решение: Составим алгоритм решения задачи ( используя схему- алгоритмов)
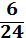



 m (раствора) 1mр.в. 2n( НNO3 ) 3 УР 4n(соли) 5m( соли)
m (раствора) 1mр.в. 2n( НNO3 ) 3 УР 4n(соли) 5m( соли)
1. Вычислим mр.в. по формуле: mр.в.= mраствора(НNO3) * ᴡр.в./100 = 200 * 15/100 = 30 г.
![]() Находим n( НNO3) =
Находим n( НNO3) = ![]() =
= ![]() = 0,476 моль ( можно округлить до 0,5 моль)
= 0,476 моль ( можно округлить до 0,5 моль)
3. Составляем уравнение химической реакции:
0,5моль х моль
СuO+ 2НNO3 = Cu( NO3)2 + H2O
2моль 1моль
4. Находим n( Cu( NO3)2)
Из уравнения следует, что n( НNO3) = ![]() n ( Cu( NO3)2), следовательно
n ( Cu( NO3)2), следовательно
n ( Cu( NO3)2)= ![]() = 0,25 моль
= 0,25 моль
5. Находим m(соли)
m(соли) = M*n = 188*0,25 = 47 г.
Ответ: m( Cu( NO3)2)= 47 г.
Найти: m(соли) =?
Задача № 4
Составьте уравнение реакции взаимодействия железа с хлором (Cl2) и вычислите массу железа и объем хлора, которые необходимы для получения 42,6 г хлорида железа (III) FeCl3.
Дано:
m (FeCl3.)= 42,6 г.
М ( FeCl3) = 162,5 г/моль
Решение: Составим алгоритм решения задачи ( используя схему- алгоритмов).
Обращаем внимание на то, что в условии задачи известна масса продукта
реакции, поэтому составлять алгоритм решения начинаем с колонки - масса
продукта реакции.
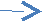
 3n(Fe) 4m( Fe)
3n(Fe) 4m( Fe)
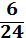
 m ( FeCl3) 1 n( FeCl3 ) 2 УР
m ( FeCl3) 1 n( FeCl3 ) 2 УР
 3
3
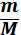 n(Cl2) 5 V( Сl2)
n(Cl2) 5 V( Сl2)
![]() Находим n( FeCl3) =
Находим n( FeCl3) = ![]() =
= ![]() = 0,26 моль
= 0,26 моль
2. Составляем уравнение химической реакции:
х моль х моль 0 ,26 моль
2 Fe + 3 Cl2 = 2 FeCl3
2моль 3моль 2моль
3. Находим n( Fe ) и n(Сl2)
Из уравнения следует:
а) что n( FeCl3) = ![]() n ( Cl2), следовательно n ( Cl2)=
n ( Cl2), следовательно n ( Cl2)= ![]() = 0,39 моль,
= 0,39 моль,
б) что n( FeCl3) = n (Fe), следовательно n (Fe) = 0,26 моль.
4. Находим m(Fe)
m(Fe) = M*n = 56*0,26 = 14,56г.
5. Находим V( Сl2) по формуле: V = Vm*n
V( Сl2) = 22,4*0,39 = 8,74 л.
Ответ: m(Fe) = 14,56 г, V( Сl2) =8,74 л.
Найти: m(Fe) =?
V( Сl2) = ?