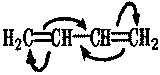- Учителю
- коеспект урока химии 10 класс 'Бензол'
коеспект урока химии 10 класс 'Бензол'
Государственное бюджетное образовательное учреждение
начального профессионального образования
Профессиональное училище № 19 г. Усть-Кута
( ГБОУ НПО ПУ № 19)
урок химии
Тема: Бензол
как представитель ароматических углеводородов.
Усть- Кут
2013
Бензол как представитель ароматических углеводородов. Урок химии. Методическая разработка предназначена для учащихся 1 курса.
Автор и составитель: Пуляева Г. М. - 1 квалификационная категория, г.Усть- Кут, ГБОУ НПО ПУ№ 19.- 12. стр.
Пуляева Г. М. , 2013 г.
ГБОУ НПО Профессиональное училище № 19.
Тип урока: изучение с нового материала.
Тема: Бензол как представитель ароматических углеводородов.
Цель: сформировать у учащихся представление об ароматических углеводородах.
Задачи:
Образовательная задача: расширить и углубить знания об образовании химических связей, структуре органических веществ.
Развивающие задачи: совершенствовать умения учащихся анализировать, сравнивать, устанавливать взаимосвязи между свойствами и строением.
Воспитательные задачи: продолжить формирование мировоззренческих понятий: о познаваемости природы, причинно-следственной зависимости между составом и свойствами.
Оборудование: интерактивное мультимедийное оборудование, карточки с заданиями, набор для составления шаростержневых моделей органических соединений.
План урока:
-
Организационный момент.
-
Тема и цель.
-
Мотивация.
-
Актуализация.
-
Основная часть.
-
Вывод.
-
Закрепление.
-
Рефлексия.
-
Подведение итогов. Домашнее задание.
Ход урока:
-
Организационный момент.
-распределение обучающихся по группам,
- знакомство с раздаточным материалом к уроку.
-
Тема и цель.
Преподаватель объявляет тему и цель урока. Обучающиеся записывают в тетради тему урока.
III. Мотивация.
Каждой из двух групп учащихся предлагается дать ответ на блиц-опрос:
I группа:
-
Натуральный каучук содержится в млечном соке тропического дерева, которое называется… (Бразильская гевея)
-
Назовите русского ученого-химика, впервые получившего синтетический каучук (С.В. Лебедев)
-
Диеновые углеводороды содержат одну или две двойные связи? (Две)
-
Процесс взаимодействия каучука с серой при высоких температурах называется…(вулканизацией)
-
Бутадиен - 1,3 обесцвечивает или не обесцвечивает бромную воду? (Обесцвечивает)
II группа:
-
Какое растение, широко распространенное в нашем регионе, содержит до 3 % натурального каучука? (Одуванчик)
-
Лебедев получил изопреновый или бутадиеновый каучук? (Бутадиеновый)
-
Назовите общую формулу алкадиенов. (СnH2n-2)
-
В процессе вулканизации происходит превращение каучука и других ингредиентов в ... (резину)
-
Раствор перманганата калия обесцвечивают предельные или непредельные углеводороды? (Непредельные)
IV. Актуализация.
*1 Задание. Пояснить образование химических связей в алканах.
*2 Задание. Пояснить образование химических связей в алкенах.
*3 Задание. Рассказать об особенностях образования сопряженной связи в диеновых углеводородах на примере дивинила.
V. Основная часть.
1 обучающийся. Историческая справка. Многие производные бензола обладают ароматом, иногда очень приятным, поэтому эти углеводороды назвали "ароматическими" (по предложению А.Кекуле-1860 г). Позднее оказалось, что большинство веществ, которые по строению и по свойствам принадлежат к этой же группе, не имеют ароматного запаха, однако исторически сложившееся название этих соединений сохранилось до наших дней. Бензол по праву можно считать родоначальником этих соединений. Современное название данного класса соединений - «Арены».
Преподаватель: Для химика сейчас термин «Ароматические» ассоциируется не с приятным запахом, а с особым строением молекул, выяснить которое мы с вами должны сегодня на уроке на примере бензола.
1 ПОЗНАВАТЕЛЬНАЯ ПРОБЛЕМА. Необходимо выяснить качественный и количественный состав вещества посредством решения задачи.
Задача: Экспериментальные данные показывают, что плотность паров вещества 3,482г/л. Его пиролиз дал 6г сажи и 5,6л водорода. Определите формулу этого вещества.
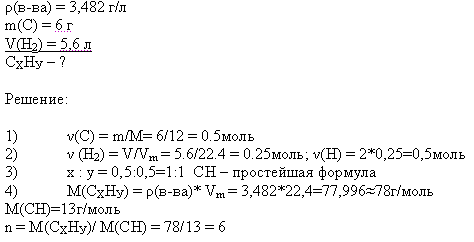
Вывод: молекулярная формула бензола С6Н6
Преподаватель: Можно ли сделать вывод о строении бензола лишь на основании знаний молекулярной формулы?
Обучающиеся: Нет, нужны дополнительные сведения.
2 ПОЗНАВАТЕЛЬНАЯ ПРОБЛЕМА. Строение молекулы бензола.
2 обучающийся. Историческая справка. Экспериментальные данные показывают, что при присоединении к 1 молю бензола 3моль водорода образуется циклогексан- углеводород циклического строения.
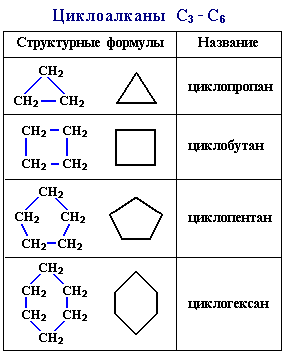
С6Н6+3Н2 С6Н12
Вывод: бензол-это углеводород циклического строения.
3обучающийся. Историческая справка. Бензол был открыт в 1825 году английским физиком Майклом Фарадеем, который выделил его из жидкого конденсата светильного газа. Уже тогда было установлено, что его молекулярная формула С6Н6.
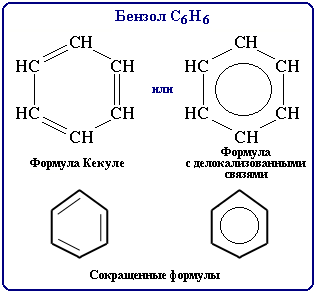
Далее обучающиеся составляют структурные формулы бензола с помощью шаростержневых моделей. После ряда рассуждений приходят к формуле Кекуле.
4обучающийся. Историческая справка. Фридрих Август Кекуле долго размышлял над структурой бензола. Однажды ему пришлось быть свидетелем в судебном процессе по делу об убийстве графини Герлиц. На этом процессе в качестве улики демонстрировалось кольцо графини в виде двух переплетённых змеек. Эти змейки врезались в память учёного.
Из воспоминаний Ф.А. Кекуле: "Моя лаборатория находилась в переулочке, и даже днём там царил полумрак. Для химика, который проводит целые дни в лаборатории, это не было помехой. Я занимался работой над своим учебником, но что-то мне мешало, и мои мысли где-то витали. Я повернул кресло к камину и задремал. Атомы углерода и водорода принялись танцевать перед моими глазами. Длинные нити очень часто сближались и свёртывались в трубку, напоминая двух змей. Но что это? Одна из них вцепилась в собственный хвост, продолжая насмешливо кружиться перед моими глазами. Я внезапно пробудился и на этот раз провёл остаток ночи, чтобы изучить следствие из моей гипотезы".
Сон оказался вещим! Кекуле сцепил все атомы углерода в шестиугольник с чередующимися двойными и одинарными связями.
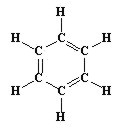
Преподаватель. Итак, состав и структуру бензола мы с вами выяснили: видим вещество, структура которого содержит чередование простых и двойных связей. В начале урока мы вспомнили, что для веществ, содержащих в своей структуре двойные связи, характерны реакции присоединения. Известный ученый Майкл Фарадей определил физические свойства бензола. Прочитаем об этих свойствах в параграфе вашего учебника. (Бензол - это бесцветная жидкость с резким характерным запахом, легче воды и нерастворима в ней. Бензол токсичен, поэтому работа с ним в условиях школы не допустима!)
Обратите внимание на последнюю прочитанную фразу: мы не сможем, экспериментально изучая химические свойства бензола, определить его принадлежность к предельным или непредельным углеводородам. Поэтому мы просмотрим видеозапись химических экспериментов с бензолом, снятых в специально оборудованной лаборатории.
Будет ли бензол обесцвечивать бромную воду и раствор перманганата калия? Смотрим первый видеофрагмент «Отношение бензола к раствору перманганата калия и бромной воды».
3 ПОЗНАВАТЕЛЬНАЯ ПРОБЛЕМА. Видим, что бензол не обесцвечивает бромную воду и раствор перманганата калия. Следовательно, возникает новая проблема: непредельность состава не согласуется с отсутствием у бензола характерных реакций непредельных соединений.
Преподаватель: Попробуем более внимательно присмотреться к экспериментальным данным, известным в настоящее время.
Углеводороды (таблица)
Предельные углеводороды
Непредельные углеводороды
Ароматические
Алканы
Циклоалканы
Алкены
Диеновые
Алкины
Арены
1.Общая формула
CnH2n
CnH2n
CnH2n
CnH2N-2
CnH2N-2
CnH2n-6
2.Строение
А) тип гибридизации
sp3 -гибридизация
sp3 -гибридизация
sp2-гибридизация
sp-гибридизация
sp-гибридизация
sp2-гибридизация
Б) угол связи
∟ 109*28'
∟ 60*, 90*, 100*, 120*
∟120*
∟ 120*
∟ 180*
∟ 120*
В) длина связи (нм)
0,154
0,154
0,134
0,134
0,12
0,142
Г) форма молекулы
тетраэдр
стремится к тетраэдру
плоская
плоская
линейная
плоская
5обучающийся. Рассмотрим строение диеновых углеводородов на примере дивинила (бутадиена-1,3). Установлено, что двойные связи в его молекуле (C1-C2 и С3-С4) рис. 1) несколько длиннее (0,136 нм), чем двойная связь в этилене (0,134 нм). Простая же связь (С2-С3), расположенная между двумя двойными связями, короче обычной σ -связи (сравните: 0,146 нм в дивиниле и 0,154 нм в этане). Причина такого "выравнивания" длин углерод-углеродных связей в дивиниле состоит в том, что 2р-орбитали всех четырех углеродных атомов перекрываются между собой (правда, это перекрывание между C2 и С3 несколько меньше). Схематично это можно представить так:
Взаимодействие двух соседних π-связей способствует процессу взаимного влияния атомов в такой системе (эффект сопряжения). Такое состояние является энергетически выгодным.
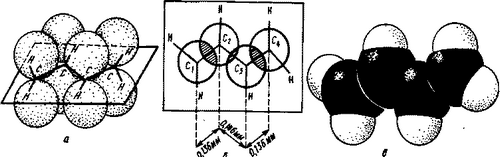
Рис.1. Образование π-связей в молекуле бутадиена-1,3 за счет перекрывания 2р-орбиталей:
а - вид сбоку; б - вид сверху; в - модель молекулы бутадиена-1, 3
Обучающиеся далее делают вывод о том, что в молекуле бензола так же образуется единая π-электронная система с сопряженными связями.
Преподаватель: Предлагает учащимся предположить, проанализировав особенности строения молекулы бензола, особенности его поведения в химических реакциях.
Обучающиеся моделируют с помощью шаростержневых моделей процесс хлорирования бензола по типу замещения в присутствии катализатора и записывают уравнение реакции.
![]()
Какой тип реакций характерен для непредельных углеводородов? (Присоединение)
Но реакции присоединения у бензола протекают труднее, чем реакции замещения.
Смоделируем реакцию хлорирования бензола по типу замещения при ярком освещении:
Обучающиеся моделируют данный процесс с помощью шаростержневых моделей и записывают уравнение реакции.
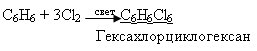
Бензол вступает в реакции присоединения, характерные для непредельных углеводородов.
Коптящим пламенем горят предельные или непредельные углеводороды? (Непредельные) Чтобы узнать характер пламени бензола посмотрим второй видеофрагмент «Горение бензола».
Пламя бензола коптящее из-за высокого содержания углерода в молекуле. Бензол является непредельным углеводородам.
Учащиеся составляют и записывают уравнение реакции горения бензола:
2С6Н6 + 15О2 --> 12СО2 + 6Н2О.
Что такое реакция нитрования? (Взаимодействие с азотной кислотой) . Углеводороды какого класса подвергаются реакции нитрования?(Алканы, предельные углеводороды) Будет ли подвергаться нитрованию бензол? Посмотрим третий видеофрагмент «Нитрование бензола».
Бензол подвергается нитрованию также, как алканы, предельные углеводороды.
Обучающиеся моделируют данный процесс с помощью шаростержневых моделей и записывают уравнение реакции:
![]()
Значение бензола в практической деятельности человека
Преподаватель: Я думаю, что у вас возник вопрос: «Какое применение находят бензол и его производные?».
Обучающиеся слушают сообщение, иллюстрированное слайдами презентации «Области применения бензола и его производных».
6 обучающийся. Бензол - важнейшее сырьё для химической промышленности, поскольку он используется и как исходный реагент (практически все современные синтетические материалы, как правило, содержат ароматические группировки), и как растворитель для других веществ. Вот только основные синтезы с участием бензола: получение фенола, бензойной кислоты, анилина, фенолформальдегидной смолы, специальных видов каучука, толуола, а, следовательно, и взрывчатых веществ(тринитротолуола), лекарств(аспирина, например)...
Бензол и его производные находят широкое применение в народном хозяйстве.
Бензол служит исходным сырьём для синтеза многих органических соединений: лекарств, душистых веществ, красителей, растворителей, полимеров. Используется как добавка к моторному топливу для улучшения его свойств.
Хлорпроизводные бензола используются в сельском хозяйстве в качестве средств защиты растений, для сухого протравливания семян пшеницы и ржи против твёрдой головни, для борьбы с филлоксерой на виноградниках.
VI. Вывод по уроку.
Преподаватель: итак, подводим итоги нашей работы.
- Что вы узнали и чему научились сегодня на уроке?
Обучающиеся: бензол- это циклическое ароматическое соединение с шестиэлектронной π-связью, придающей бензолу ароматический характер; характерными для бензола являются реакции замещения; бензол получают из каменноугольной смолы и нефти, бензол ядовит и является канцерогеном; бензол находит широкое применение в органическом синтезе и при изготовлении растворителей.
VII. Закрепление
Вопросы для закрепления.
-
Каковы физические свойства бензола?
-
В чём заключается противоречие между структурной формулой бензола и его свойствами?
-
Структурную формулу бензола изображают в виде шестиугольника с окружностью внутри. Что эта окружность означает?
-
В чём заключается сходство бензола с алканами и алкенами?
VIII. Рефлексия
-
Узнали много нового.
-
Было интересно.
-
Было над чем подумать.
-
Поработали добросовестно.
-
Урок понравился.
(Уходя с урока, ребята прикрепляют свои смайлики на магнитную доску)
IХ. Подведение итогов, домашнее задание.
Выставляются оценки, отмечается работы наиболее активных обучающихся.
Домашнее задание:
*§8, повторить §3-7
*Прочитать конспект.
*Выучить определения.
Индивидуальные задания:
*Опорный конспект (творческая работа).
*Вычислить выход нитробензола в процентах от теоретически возможного, если при нитровании 23,4 г бензола было получено 29,52 г нитробензола.
ЛИТЕРАТУРА
-
Рудзитис Г. Е., Фельдман Ф. Г. Химия. 10 класс. Базовый уровень : учеб. для общеобразоват. учреждений. - М.,Просвещение. 2011.
-
Гранкова А.Ю. Химия. Методическое пособие. -М.: Астрель,2002.
-
Гара Н. Н., Зуева М. В.Контрольные и проверочные работы по химии.-М.: Дрофа,2002.
-
Корощенко А. С., Снастина М. Г. Самое полное издание типовых вариантов реальных заданий ЕГЭ.- М.: Астрель,2010.
-
Чернобельская Г. М. Теория и методика обучения химии.- М.: Дрофа,2010.
-
Ижболдина Л. П., Эдельштейн О. А. Номенклатура неорганических и органических соединений.- Иркутск: ИИПКРО,2010.