- Учителю
- Конспект урока по теме Кислоты (8 класс)
Конспект урока по теме Кислоты (8 класс)
|
Конспект урока по химии
Тема: Кислоты.
8 класс учитель: КондратоваН.В. МБОУ СОШ №3 г. Сургут
|
Урок по теме «Кислоты»
(8 класс, по программе и учебнику О.С. Габриеляна).
Цель урока: Изучение одного из классов неорганических веществ - кислот, их классификации и номенклатуры, индикаторов, правил работы с кислотами, значения отдельных кислот в природе и жизни человека.
Задачи:
Образовательные:
-
обеспечить восприятие и осмысление понятия кислота, состав кислот, классификация кислот.
-
закрепить опорные понятия: сложное вещество, основание, степень окисления, физические свойства веществ, индикатор.
-
подвести учащихся к осознанию практической значимости знаний о кислотах.
Развивающие:
-
создать условия для развития у школьников умений анализировать результаты лабораторных исследований, делать выводы, совершенствовать навыки работы с лабораторным оборудованием.
-
развивать познавательный интерес и эмоции школьников, умения выделять главное, сравнивать, обобщать, логически излагать мысли;
-
развивать умение дискутировать, выслушивать друг друга.
Воспитательные:
-
воспитывать бережное отношение к своему здоровью;
-
воспитывать организованность, аккуратность при проведении эксперимента.
Оборудование и реактивы:
-
компьютер, мультимедийный проектор;
-
ресурсы из Единой коллекции цифровых образовательных ресурсов, по теме «Кислоты» (school-collection.edu.ru/);
-
презентация «Кислоты», созданная средствами Microsoft Office PowerPoint;
-
Цифровая лаборатория СПАРК
Лабораторное оборудование и реактивы для учащихся: серная кислота (концентрированная), лучинка, растворы кислот: серной, соляной, азотной, фосфорной, уксусной, яблочной, лимонной; индикаторы, твердые вещества: аскорбиновая, ацетилсалициловая, никотиновая, кремниевая кислоты. Обугленные кристаллы сахара в стакане. В лотках у учащихся: по два стаканчика с кислотами, индикаторы, аскорбиновая кислота, кусочек лимона и яблока, кефир, газированная вода.
Дидактический материал:
Таблицы с формулами кислот, тестовые задания по теме «Кислоты».
Таблицы, рисунки и фотографии с изображением продуктов содержащих кислоты «Фрукты», «Пищеварительная система человека», «Лишайники».
Тип урока: комбинированный. Основная часть - формирование новых знаний и умений.
Литература для учителя: Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. Химия. 8 класс - М,: Дрофа, 2002.
Литература для учащихся: О.С.Габриелян Химия 8 класс. Учебник для общеобразовательных учреждений, М.: Дрофа, 2010.
Ход урока:
1.Повторение изученного материала.
Начнем урок с повторения пройденного материала.
Задание на интертерактивной доске (приложение1).
слайд 1
Фронтальный опрос.
-
На какие группы делят неорганические вещества?
-
Какие сложные вещества вы знаете?
-
Что такое оксиды?
-
Из данного перечня на доске выберите формулы оксидов, подчеркните их и дайте им названия (задание на интерактивной доске).
-
На какие группы их делят?
-
Какие оксиды относят к основным? Приведите примеры.
-
Какие оксиды относят к кислотным? Приведите примеры.
-
Какие оксиды относят к амфотерным? Приведите примеры. Назовите исключения.
-
Какие вещества называют основаниями? Есть ли их формулы в данном ряду?
-
Какой условной записью выражается общая формула оснований?
-
По какому принципу делятся все основания?
Ребята, а почему не все формулы подчёркнуты? Они не относятся ни к оксидам, ни к основаниям, так как не соответствуют по составу. Это вещества других классов. А каких (соли и кислоты)? Сегодня нам предстоит путешествие по одному из этих классов. А по какому именно, вы узнаете, отгадав кроссворд (приложение 2).
слайд 2
2. Изучение нового материала.
Тема урока «Кислоты» (слайд 3). Запишите тему урока в тетрадь.
Ребята, подумайте, о чём мы будем сегодня говорить, выскажите свои предположения. Сегодня на уроке мы с вами познакомимся с миром кислот, изучим их строение, познакомимся с их классификацией и свойствами.
Цель урока: Изучить один из классов неорганических веществ - кислоты, их классификацию и номенклатуру, познакомиться с индикаторами, с правилами работы с кислотами, показать значение отдельных кислот в природе и жизни человека (слайд 4).
-
Роль кислот в жизни человека.
К уроку я просила вас приготовить небольшие сообщения о кислотах.
Сообщения о кислотах (слайд 5, 6, 7, 8, 9,10).
-
Определение и классификация кислот.
Работа с коллекцией на демонстрационном столе и слайдом презентации: растворы кислот соляной, серной, азотной, фосфорной (слайд 11).
-
Рассмотрите формулы кислот.
-
Что общего в составе этих веществ?
-
В чем разница?
Если мысленно убрать атомы водорода, то останется кислотный остаток, который, как правило, образован элементами неметаллами.
Исходя из состава, дайте определение понятию - кислота.
Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка.
(слайд 12).
Посмотрите, какова общая формула кислот, запишите ее в тетрадь:
Hn (KO)-n где n- количество атомов водорода.
Названия кислот (слайд 13), таблица с основными представителями данного класса, у каждого на столах.
Как вы думаете: на какие группы их можно разделить? Одинаково ли количество атомов водорода в молекуле кислоты? (разное количество атомов водорода делит кислоты на одноосновные и многоосновные) Обратите внимание: кислоты имеют разное число атомов водорода в своем составе, что может служить признаком их классификации.
Кто заметил еще один признак, по которому можно было бы классифицировать кислоты? (Атом кислорода, обсуждаем классификацию по этому признаку). С соляной кислотой вы уже знакомы, она принадлежит к бинарным соединениям. Однако к классу кислот относят соединения, состоящие и из большего числа элементов. Какой это обычно элемент? Как бы вы разделили кислоты по этому признаку? (слайд 14,15)
По формулам кислот можно рассчитать степени окисления элементов. В бинарных соединениях это просто: НС1. Не так уж и сложно это в кислородсодержащих кислотах.Одноосновные
HCI
Двухосновные
H 2SO4
Трехосновные
H 3PO4
2
По наличию кислорода в кислотном остатке
Кислородные
HNO3
Бескислородные
H 2S
-
Физические свойства кислот.
Как вы думаете, какие агрегатные состояния характерны для кислот? (слайд 16)
На какие группы делят кислоты по растворимости? У вас на столах лежат следующие вещества: аскорбиновая кислота; кусочек лимона. Все эти продукты содержат те или иные кислоты. Какой вкус имеют эти продукты? (в кабинете химии ничего нельзя пробовать на вкус). Готовы ли вы теперь ответить на вопрос: почему вещества называются кислотами. Однако, не все кислоты кислые на вкус. Среди них встречаются сладкие (салициловая) и горькие (никотиновая), но большинство все - таки кислые (слайд 17).
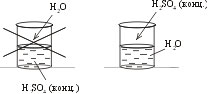
Как вы думаете, почему при работе с кислотами в химической лаборатории необходимо соблюдать осторожность? Давайте посмотрим, что произойдет при разбавлении концентрированной серной кислоты в воде. Для этого воспользуемся температурным датчиком цифровой лаборатории СПАРК (Демонстрационный эксперимент «Разбавление конц. H2SO4»). Что наблюдаете? Как изменяется температура? Какой вывод можно сделать? При разбавлении всех кислот будет повышаться температура? Давайте это проверим, у вас на столах находятся кислоты: салициловая, аскорбиновая, лимонная. С помощью цифровой лаборатории СПАРК определите изменится ли температура при растворении этих кислот, постройте графики изменения температуры, сравните их. Какой вывод можно сделать? Температура изменяется незначительно, значит при разбавлении этих кислот особых правил предосторожности можно не соблюдать. Однако не следует забывать о основных правилах техники безопасности.
-
Правила техники безопасности при работе с кислотами (приложение 3).
(слайд 18)
При работе с кислотами необходимо соблюдать правила техники безопасности:
-
При работе в химической лаборатории: ничего нельзя пробовать на вкус.
-
Необходимо наливать в пробирку количество кислоты, которое указано в инструкции.
-
Заполнять пробирку можно только на 1/3 объема.
-
Взбалтывать вещества следует, слегка покачивая пробиркой, при этом не закрывать ее отверстие пальцем.
-
При разбавлении серной кислоты необходимо приливать кислоту в воду, а не наоборот. При работе с большими объемами кислот необходимо использовать индивидуальные средства защиты: резиновые перчатки и защитные очки. Фиксируется внимание учащихся на том, что в связи с большим выделением количества теплоты при растворении концентрированной серной кислоты в воде нельзя вливать воду в кислоту. В этом случае вода, имеющая меньшую плотность, окажется на поверхности, закипит, и её брызги вместе с кислотой могут обжечь руки и лицо.
Демонстрационный опыт (проводит учитель): обугливание древесины концентрированной серной кислотой, т. к. она жадно отнимает воду у органических веществ. Энергии выделяется столько, что палочка обугливается.
-
При работе с большими объемами кислот необходимо использовать индивидуальные средства защиты: резиновые перчатки и защитные очки. Концентрированная серная кислота вызывает ожоги. Поэтому попавшую на кожу или ткань кислоту необходимо тотчас стряхнуть, смыть большим количеством воды, а затем 5% раствором питьевой соды и вновь смыть водой.
-
Качественные реакции. Индикаторы.
Ребята, какие ощущения вы испытали, когда разговаривали о кислотах? Почему? (Кислые на вкус). А можно ли использовать вкус для определения кислот? Почему? Для этого существуют особые вещества - индикаторы: лакмус, фенолфталеин, метилоранж. Проведем эксперимент.
Задание: Разлейте кислоту в три пробирки, соблюдайте Т.Б! В 1-ю добавьте лакмус, во 2-ю капните метилоранж, в 3-ю - фенолфталеин, посмотрите, что произошло с окраской. Результаты запишите в таблицу. (Учащиеся объясняют результаты опытов и приходят к выводу, что есть вещества способные изменять свою окраску в растворах кислот, записываем определение индикатора и выясняем, что не все индикаторы можно использовать для определения кислой среды). Просмотр ЦОРа (приложение 4).
Вещества, изменяющие цвет в растворах кислот, называются индикаторами (с лат. «показатель»)(слайд 19).
А как вы думаете, можно ли использовать этот эксперимент для определения кислот, содержащихся в продуктах питания? Попробуйте сделать это. Что обнаружили? Значит, свойства всех кислот одинаковы.
Сообщение об индикаторах.
Однажды английский химик Роберт Бойль, изучая свойства соляной кислоты, закупленной в Германии у И. Глаубера, случайно пролил ее. Кислота попала на сине-фиолетовые лепестки фиалок. Спустя некоторое время лепестки стали ярко-красными. Это явление удивило Р. Бойля, и он тут же провел серию опытов с разными кислотами и цветами разных растений. Оказалось, что и васильки, и роза, и цветки некоторых других растений изменяли свою окраску при действии кислот. Особенно интересным оказался фиолетовый настой лакмусового лишайника. В растворах кислот он становился красным, а в растворах щелочей - синим. После некоторых раздумий такие вещества Р. Бойль назвал индикаторами, что в переводе с латинского означало «указатели». Эти вещества затем стали использовать многие химики в своих опытах для распознавания кислот и оснований. Индикаторы помогли Р. Бойлю открыть новую кислоту. Сжигая фосфор и растворяя образовавшийся белый продукт в воде, он получил неизвестную химикам кислоту. По исходному веществу он назвал ее фосфорной.
3. Закрепление.
Что называется кислотами? С какими кислотами вы познакомились сегодня на уроке? На какие группы делятся кислоты по числу атомов водорода? По содержанию атомов кислорода? Какие существуют меры предосторожности при работе с кислотами? Назовите правила разбавления серной кислоты. Что такое индикаторы?
Тест (1 вариант)
1. Кислородсодержащей кислотой является:
а) хлороводородная кислота; б) сероводородная кислота;
в) азотная кислота; г) иодоводородная кислота.
2. Степень окисления фосфора в кислоте Н3Р04 равна:
а)+5; б)+3; в)+2; г)+4.
3. Заряд у иона S04 равен:
а)0; б)1+; в)1-; г)2-.
4. Данная кислота - бесцветная жидкость, вязкая, как масло, не имеющая запаха, почти вдвое тяжелее воды, используется для осушения газов, обугливает древесину, кожу, ткани:
а)НС1; б)H2S04; в)Н2С03; г)H2Si03.
5.Вещество, раствор которого окрашивает метиловый оранжевый в розовый цвет - это:
а) гидроксид калия; б) оксид кальция; в) соляная кислота; г) гидроксид натрия.
Тест (2 вариант)
1. Двухосновной кислотой является:
а) азотная кислота; б) кремниевая кислота;
в) бромоводородная кислота; г) фосфорная кислота.
2. Степень окисления углерода в кислоте H2С03:
а)+5; б)+3; в)+2; г)+4.
3. Заряд у иона N03 равен:
а)0; б)1+; в)1-; г)2-.
4. Данная кислота получена при растворении летучего водородного соединения в воде.
а)НС1; б)H2S04; в)Н2С03; г)H2Si03.
5.Вещество, раствор которого окрашивает лакмус в красный цвет, - это
а) азотная кислота; б) едкий натр;
в) едкое кали; г) индикатор.
4. Домашнее задание (слайд 20).
§20, выучить определения. Упр.4 с.107учебника.
Творческое задание: составить сказку, кроссворд, ребус, стихотворение о кислотах.
5. Рефлексия (слайд 21).</</p>
Сегодня на уроке я:
-
Научился…
-
Мне показалось важным…
-
Я понял, что…
-
Я почувствовал, что…
Своей работой на уроке я:
-
Доволен…
-
Не совсем доволен…
-
Я не доволен, потому что…