- Учителю
- Интегрированный Урок Реакции ионного обмена 9 класс
Интегрированный Урок Реакции ионного обмена 9 класс
МБОУ «Белькачинская ООШ»
Составила учитель химии
Печенина Л.Н
Открытый
Интегрированный урок
«Реакции ионного обмена»
Класс : 9
Предметы : химия, биология ,физика, математика
Эпиграф урока : «Электролитическая диссоциация оказалась применимой и полезной во всех областях современной науки»
Сванте Аррениус
Цели:
* Формирование представления о единстве школьных дисциплин в понимании целостности окружающего мира;
-
Формирование умений применять математические знания в составлении реакций ионного обмена;
-
Создать условия для обобщения и углубления знаний, полученных на уроках химии и уроках естественно-математического цикла связанного с реакциями ионного обмена, электролитической диссоциацией;
Задачи:
Образовательные: систематизация и закрепление знаний об обратимых и необратимы реакциях, повторение и закрепление материала об реакциях ионного обмена на примерах из дисциплин естественно-математического цикла;закрепление умений и навыков составления полных и сокращенных ионных уравнений;
Развивающие: развивать самостоятельность и навыки самоанализа, умения выделять закономерности, устанавливать причинно- следственные связи, сравнивать и делать выводы, повышать уровень владения экспериментом с соблюдением ТБ в кабинете химии; развивать коммуникативные умения (для участия в дискуссии ).
Воспитывающие: обучение взаимоконтролю и самоконтролю; повышение интереса к изучаемому предмету и дисциплинам естественно-математического цикла, выбору профессии; создание эмоционального настроя и активизация творческой деятельности обучающихся.
Тип урока: обобщающий
Методы обучения- частично-поисковый, проблемный, интегрированный.
Оборудование и реактивы: на лотках учеников - штативы с пробирками, склянки с минеральной водой, яблочным соком, растворы гидроксида калия, хлорида бария, азотной кислоты, соляной кислоты, карбоната натрия, демонстрационный стол - хлорида меди (II), лакмуса, фенолфталеина, штативы с пробирками; проектор, компьютер.
Презентация "реакции ионного обмена или исследуй неизвестный раствор", на столах учеников лотки с реактивами, посудой, технологическая карта (приложение 2), карта ученика (приложение 1).
Ход урока
-
Теоретический блок
-
Организационный момент
Актуализация базовых знаний
Учитель. Открываем тетради, записываем дату, диктант: «Растворы, ион, катион, анион, электролит, неэлектролит, гидротация, диссоциация, кристаллогидрат,донор, акцептор, гидроксоний, степень диссоциации, индикатор, ионное уравнение». Учитель задает вопрос: Какова тема нашего урока? Вы догадались? (Ребята отвечают). Учитель: Каковы задачи и цели нашего урока «Реакции ионного обмена» (ребята отвечают).
Учитель рассказывает о порядке проведения урока, о карте ученика, о технологической карте.
Ученики. Знакомятся с картой ученика, которая находится у каждого на столе. Записывают цели и задачи урока. Цели урока: научиться проводить реакции ионного обмена, определять ионы по их качественным реакциям.
Учитель. Нас окружает множество органических и неорганических веществ. Растворы - это понятие вам давно знакомо. Каков состав раствора? Растворы состоят из растворенного вещества и растворителя. В 7 кл. вы считали, что это процесс физический (физика 7 класс). Скажите, какое физическое явление лежит в основе растворения веществ (ребята отвечают). В 8 кл. мы говорили о растворимых веществах и нерастворимых веществах в воде, теперь вы работаете с таблицей растворимости и определяете, пойдет реакция или нет. И наконец, в 9 классе мы выяснили, что растворение какой процесс? (физико-химический). Почему? Вы должны знать, что все живое питается растворами, в том числе и человек. Наша кровь, желудочный сок, межклеточная жидкость - это все растворы. Мы с вами узнали свойство растворов и они просто удивительны. Так, растворы кислот, солей и щелочей проводят электрический ток, в отличие от раствора сахара, спирта. Давайте вспомним, почему? Ну что ж, начинаем зарабатывать баллы. За правильный ответ каждый из вас может заработать один дополнительный балл, получив карточку с надписью +1 балл (карточки из бумаги с клеевым краем), и наклеивает её на карту ученика.
Учитель задаёт вопросы, ученики отвечают на них. Вопросы +:
Какие вещества называются электролитами и неэлектролитами?
Какие вещества к ним относятся? (Вопрос-+)?
Почему растворы электролитов проводят электрический ток? (Вопрос-+)?
Как называется процесс распада веществ на ионы? Что такое ионы? (Вопрос-+)
Ученики выполняют задание, на карте ученика учащиеся отмечают ответ.
Задание №1. Выберите выигрышный путь, как в игре "крестики-нолики", где три вещества являются: 1 вариант - электролитами, 2 вариант - неэлектролитами.
Учитель. Задаёт вопросы ученикам.
С образованием каких ионов диссоциируют растворы кислот, солей и щелочей? (вопрос -+).
Какие основания называются щелочами? (вопрос - +)
Ученики. Отвечают на вопросы учителя, зарабатывая дополнительные баллы. Учитель. Предлагает ответить всему классу на вопросы, которые находятся на слайде презентации.
Задание №2. Запишите, какие ионы входят в состав веществ? (проверка слайд</ №9)
Na2СO3 - карбонат натрия
Как называются положительно заряженные ионы?
K2SO4 - сульфат калия
NaOH - гидроксид натрия
Как называются отрицательно заряженные ионы?
Ученики. На карте ученика учащиеся записывают правильный ответ.
Учитель. Максимальное количество баллов за это задание - 2 балла.
Ученики. Проверяют по ответам, которые высвечиваются на презентации. Выставляют сумму заработанных за это задание баллов.
Учитель. Предлагает ответить всему классу на вопросы, которые находятся на слайде презентации (слайды 10,12,13).
Переходим к 3 заданию на карте.
Задание №3. "Допиши определение…".
Учитель. Исследования показали, что ионы бывают бесцветные и окрашенные. Обратите внимание, на демонстрационном столе находятся пробирки с растворами соляной кислоты и гидроксидом натрия. В водном растворе соляная кислота и гидроксид натрия находится в виде ионов. Обратите внимание, что растворы бесцветны, ионы-бесцветны. Задаёт вопросы ученикам.
Ученики отвечают на вопросы, зарабатывая дополнительные баллы?
Какие ионы входят в состав этих веществ (вопрос - +)
Каким образом можно распознать данные вещества в пробирках? (вопрос - +)
Учитель. Проведём демонстрационный опыт.
Опыт.1. Взаимодействие раствора кислоты и щелочи с индикатором (раствор лакмуса и фенолфталеина).
Ученики обсуждают опыт, формулируют вывод: качественная реакция на Н+, ОН- взаимодействие с индикатором, изменение цвета индикатора.
Учитель. Рассмотрим раствор хлорида меди(II). Хлорид меди (II) в водном растворе находится в виде ионов Cu2+ и CL-. Cu 2+имеет характерную окраску синего цвета. На каждый ион существует свой качественный реактив, своя качественная реакция, по которой можно определить его наличие в растворе. Проведём качественную реакцию на ион Cu2+ - взаимодействие с раствором щелочи ОН-.
Ученики обсуждают опыт, формулируют вывод: качественная реакция на Cu2+
Взаимодействие с раствором щёлочи ОН- с образованием характерного осадка синего цвета.
Учитель. Давайте вспомним, как составляются уравнения в молекулярном, полном и сокращённом ионном виде на примере взаимодействия хлорида меди(II) с гидроксидом натрия.
Ученики выходят к доске и записывают уравнение реакции в молекулярном виде, полном и сокращённом ионном виде. Ответы учеников оцениваются отдельными оценками. По интерактивному слайду в презентации рассматриваем уравнение химической реакции - распад веществ на ионы, взаимодействие ионов между собой с образованием новых веществ, Обсуждаем полученные результаты.
Физкультминутка (упражнение для глаз) - презентация «Часы»
Блок 2. Эксперимент - исследование
Мы знаем ,что любая система стремится к равновесию и наш
организм не исключение. Мы сегодня говорим о кислотах, щелочах,
солях. Скажите, а в нашем организме есть эти вещества? Конечно,
наш организм работает только с растворами этих веществ и
причем. как и любая система стремится к равновесию кислотно -
щелочному. Ну, вспомните, хотя бы рекламу о жевательной резинке
(рот).
Если происходит смещение равновесию , например в кислую
сторону, это когда мы устаем - увеличивается количество
молочной кислоты в организме. У нас падает настроение (говорят
- кислое выражение лица). Что делать, чтобы повысить настроение
(т.е. раскислить организм )? Нужно съесть фрукт, пусть даже
кислый. Дело в том , что кислотные остатки органических кислот
- яблочной, лимонной больше связаны не с ионом Н+, а
с ионами Са2+, Na+,К+, эти
ионы и помогают сдвинуть равновесие в щелочную сторону ,
понижается количество молочной кислоты ,а у нас повышается
настроение. За счет чего? Правильно, конечно же, за счет
реакций ионного обмена.
Мы знаем, что молекула больше иона и в клетку может попасть только ион, например , ион Са2+- он является структурным элементом клеточных мембран. Он как привратник в клетке ,способствует поступлению питательных веществ в нее, но чтобы ион кальция попал в клетку нужны и другие микроэлементы: бор, магний, кремний и еще 13 микроэлементов и еще катализатор селен. Теперь вы понимаете ,почему нам советуют пить соки, минеральную воду, есть фрукты и овощи - все просто, нам нужны медь, цинк, железо, калий и т. д., т.е. вся таблица Д. И. Менделеева, а точнее, вы теперь знаете - их ионы.
Я предлагаю поработать вам химиками - технологами. К вам обратились с просьбой установить есть ли в яблочном соке и минеральной воде полезные микроэлементы, а точнее их ионы. Работаем с технологической картой, проведите качественные реакции, определите нужные ионы, заполните таблицу, сделайте выводы. Работаем по сладу (№18) (презентация). Соблюдайте правила техники безопасности!
Далее появляется таблица определения ионов, которой ученики пользуются в процессе своей работы.
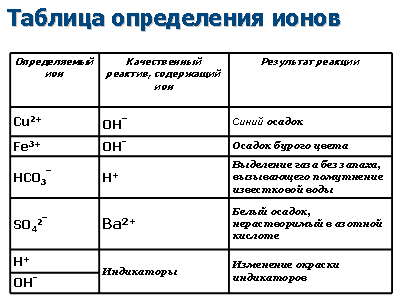
Учитель. исследовать предложенные объекты, на содержание ионов Cu2+, OH-, H+, Fe3+, HCO3-, SO42- - в растворе по их качественным реакциям. Представить итоги работы: указать ионы, содержащиеся в растворе, сокращенное ионное уравнение, отражающее сущность химической реакции, признак химической реакции и представить свой объект. Оформите своё отношение к уроку. Для работы используйте технологическую карту-инструкцию. Роль учителя - организатор и координатор групповой работы.
Ученики выполняют задание в группах: одна - яблочного сока, следующая - минеральная вода, на содержание ионов Cu2+, OH-, H+, Fe3+, HCO3-, SO42- Подробный план работы с описанием опытов, техникой безопасности, небольшой текст для анализа по каждой теме содержится в технологической карте-инструкции. Оформляют выводы в итоговый слайд №20. После выполнения задания каждый выступает с результатами своей работы. Проецируется итоговый слайд, происходит сравнение результатов эксперимента учеников с табличными данными (презентация).
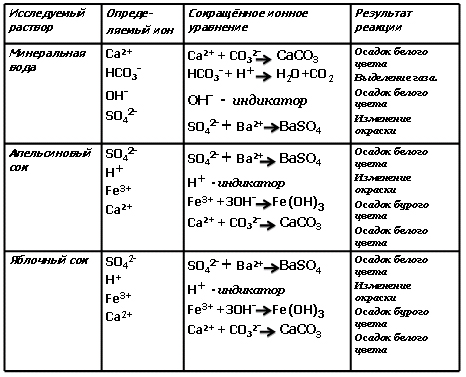

Учитель. Подведём итоги нашей работы. Какое заключение вы дадите заказчику? (Ребята зачитывают, делают выводы. Все исследуемые объекты содержат полезные для жизнедеятельности человека элементы.
Ученикам предлагается проверить себя, выполнив задания.
Ученики выполняют задание "Самостоятельная работа" (презентация).
Даны растворы, содержащие ионы.
Отвечают на вопрос, происходит самопроверка и самооценивание с использованием презентации (задание - 1 балл).
Учитель. Выполним следующее задание самостоятельной. Ученики выполняют задание повышенного уровня сложности.
Установите соответствие между сокращенным ионным уравнением и исходными веществами в молекулярном уравнении химической реакции:
Учитель. Давайте подведём итоги нашего урока, подсчитаем количество заработанных баллов каждым из вас, оценим результаты своей работы.
Ученики подсчитывают набранное количество баллов за урок. По количеству набранных баллов выставляют себе оценки. Если количество баллов у ученика превысило максимальный балл за этот урок, то баллы сохраняются и могут быть использованы на последующих уроках.
8-10 баллов - "оценка 5"
6-7 баллов - "оценка 4"
3-5 баллов - "оценка 3"
Молодцы!
Высказывают своё отношение к уроку (смайлик на карте ученика).
Учитель. Подведем итоги нашего урока, достигнуты ли наши цели урока? Обсуждение. Цели появляются на слайде презентации.
-
Научиться проводить реакции ионного обмена.
-
Определять ионы Cu2+, OH-, H+, Fe3+, HCO3-, SO42- - в растворе по их качественным реакциям.
-
Узнать о качестве известных напитков.
Учитель. Дополнительную информацию по теме урока можно найти на сайтах, перейдя по ссылкам. (Презентация)
-
www.xumuk.ru
-
www.anchem.ru
-
www.experimentanium.ru
Заключительное слово учителя. Спасибо за урок.
Домашнее задание: подготовиться к контрольной работе- п.1-6.
Список литературы
1. Рудзитис Г.Е. Неорганическая и органическая химия. 9 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2009 г.119с.:ил.
2. Попель П.П.Химия:8 кл.: учебник для общеобразовательных учебных заведений/П.П. Попель, Л.С.Кривля. -К.: ИЦ «Академия»,2008.-240 с.: ил.
3. Габриелян О.С. Химия. 9 класс. Учебник. Издательство: Дрофа.:2001. 224с
4.С. Ю. Дибленко, Е.А Смирнова, С.М. Колмыкова Химия 9класс:поурочные планы по учебнику Л.С. Гузея, В.В. Сорокина, Р.Н .Суровцевой. Издательство «Учитель» 2005г.- 169 с..