- Учителю
- Разработка урока по химии на тему Кислород(9 класс)
Разработка урока по химии на тему Кислород(9 класс)
Цели урока: Образовательные:
- актуализировать знания учащихся о положении элемента кислорода в Периодической системе Д.И. Менделеева;
- познакомить учащихся с историей открытия кислорода;
- дать понятие о кислороде как о химическом элементе и простом веществе: нахождение в природе, химические свойства кислорода: взаимодействие с простыми веществами (металлами и неметаллами), сложными веществами; применение кислорода.
- актуализировать понятия: горение и медленное окисление, дыхание и фотосинтез;
- дать понятие о способах получения кислорода и биологическом значении кислорода.
Развивающие:
- Развивать логическое мышление, умение анализировать, делать выводы;
- развивать общеучебные компетенции: умение слушать, делать записи, применять полученные знания в практической деятельности.
Воспитательные:
- формировать естественно-научное мировоззрение учащихся;
- воспитывать положительное отношение к предмету;
- поддерживать интерес к науке «химия».
Тип урока: урок сообщения новых знаний (урок - путешествие)
Формы и методы работы на уроке: фронтальный, объяснительно - иллюстративный, наглядный, эксперимент, работа с дидактическим материалом, ИКТ
Оборудование:
-
ТСО - телевизор, видеомагнитофон, компьютер, проектор, экран.
-
ПСХЭ Д. И. Менделеева;
-
Прибор для получения кислорода разложением перманганата калия и собирания кислорода способом вытеснения воды -1 шт.
-
Спиртовка, спички, лучинка.
-
Дидактический материал к уроку - маршрут урока - план урока для учащихся (Приложение 1)
Реактивы: перманганат калия, оксид марганца (IV), уголек древесный, известковая вода, сера.
Ход урока
I. Организационный момент.
II. Мотивация познавательной деятельности
Сообщение темы и целей урока.
Учитель: Сегодня мы совершим путешествие по удивительной стране «Кислород», побываем на многих станциях, узнаем много интересного об этом элементе и веществе.
Перед нами сегодня стоят следующие цели: слайд-презентация. (Приложение 2)
Сообщение нового материала по плану:
1) Станция «Менделеевская»
Актуализация понятия «Положение элемента кислорода в ПСХЭ Д.И. Менделеева» - фронтальная беседа с классом .
Назовите положение элемента кислорода в ПСХЭ Д.И. Менделеева»
1.Порядковый номер
2.Массовое число
3.номер периода
4.Номер группы
Напишите схему строения атома .
Назовите элементы, которые входят в VI А группу.
Учитель: Элементы этой подгруппы: кислород, сера, селен, теллур имеют общее название «халькогены», что означает в переводе с греческого «рождающие руды».
А ведь и в самом деле основные руды, используемые в металлургической промышленности, представляют собой соединения родоначальников подгруппы кислорода - оксиды:
а) Красный железняк (гематит) - Fe2O3
б) Бурый железняк (лимонит) - 2Fe2O3 ∙ 3 Н2О
в) Магнитный железняк (магнетит) - Fe3O4
и серы:
г) Железный колчедан (пирит) - FeS2
д) Медный колчедан- CuFeS3
е) Цинковая обманка - ZnS
ж) Свинцовый блеск - PbS
Мы с вами уже изучали некоторые руды, в состав которых входят эти элементы (при изучении темы «Железо»)
2) Станция «Историческая» - история открытия кислорода
Рассказ ученика - презентация
«Кислород открыли и впервые получили почти одновременно два выдающихся химика XVIII века - швед Карл Шееле путем нагревания селитры и англичанин Джозеф Пристли.
Джозеф Пристли нагревал красный оксида ртути (II) в солнечных лучах, сфокусированных линзой. Пристли собрал полученный газ над ртутью, внес в него слабо горящую свечу, тлеющую лучинку и нагретую железную проволоку. Свеча в полученном газе загоралась ярко, лучинка вспыхивала, проволока начинала светиться.
Шееле получил кислород раньше, чем Пристли, но результаты опытов Пристли стали известны сразу же, а труды Шееле значительно позже.
Пристли изучал «связанный воздух» или углекислый газ и обнаружил то, что в присутствии зеленых веток этот газ после пребывания на свету становился пригодным для горения и дыхания.
Классический опыт Пристли, во время которого умирающие мыши оживали после внесения под колпак зеленых веток, ученые смогли объяснить лишь после создания учения о фотосинтезе.
Истинную природу кислорода, его роль в химических реакциях и название элементу дал великий французский химик Антуан Лавуазье: oxygenium - т.е. «рождающий кислоты», или «кислород».
В 1775 году Антуан Лавуазье установил, что кислород - это составная часть воздуха», как химический элемент кислород содержится во многих веществах, находящихся в природе.
3) Станция «Природа» (Приложение 2)
Учитель:
-
На этой станции мы с вами познакомимся с нахождением этого удивительного и очень важного для всех нас элемента и вещества - кислород в природе.
-
Слайд-презентация и чтение стихотворения «Кислород» учащимся.
Рассказ учителя + слайд - презентация.
Кислород - самый распространенный химический элемент на нашей планете. Он входит в состав воды - 88,9%, в состав многочисленных минералов - 49,6% (в составе земной коры).
Как простое вещество кислород входит в состав атмосферы ≈ 21 % - по объему.
Как химический элемент кислород образует две аллотропных модификации - кислород с молекулярной формулой О2 и озон с молекулярной формулой - О3, которые резко отличаются друг от друга по свойствам.
4) Станция «Химическая лаборатория»
Учитель: На этой станции мы побываем с вами в химической лаборатории и узнаем, а также и повторим сведения о том, как же можно получить такое замечательное вещество - кислород в нашем химическом кабинете.
В 8 классе при изучении темы «Простые вещества» мы говорили о кислороде и способах его получения и собирания. Мы получали кислород из перманганата калия. Сегодня мы это вспомним, а также узнаем много нового.
Способы получения кислорода и собирания в лаборатории - демонстрационные опыты, Приложение 3.
Опыт № 1. Разложение пероксида водорода в присутствии оксида марганца (IV) и собирание кислорода способом вытеснения воздуха.
![]()
MnО2 - катализатор - т.е. вещество, которое увеличивает скорость протекания химической реакции (записать определение в тетрадях).
Опыт № 2. Разложение перманганата калия и собирание кислорода способом вытеснения воды - актуализация понятия.
![]()
Вывод - формулируют учащиеся по опорным вопросам:
-
Агрегатное состояние кислорода…
-
Цвет…
-
Запах
-
Растворимость в воде…
Плотность по отношению к воздуху… ![]()
Способы собирания кислорода…
Кислород - это газ без цвета, запаха, малорастворимый в воде, чуть тяжелее воздуха.
Кислород можно собирать способом вытеснения воды т.к. кислород в воде малорастворим и способом вытеснения воздуха, т.к. кислород чуть тяжелее воздуха (Мr(возд) = 29) < Мr (O2) = 32)
Учитель: Кислород в промышленности получают перегонкой жидкого воздуха.
При охлаждении и сжатии воздуха при помощи компрессора:
-
первым испаряется азот, ιº(кип. ж. N2) = -196 ºC
-
вторым испаряется аргон ιº(кип. ж. Аr) = -186 ºC
-
третьим испаряется кислород ιº(кип. ж. О2) = -183 ºC
5) Станция «Химические превращения» - химические свойства кислорода - демонстрационные опыты ,учащиеся составляют уравнения реакцииХимические свойства кислорода
Значение кислорода
1. С простыми веществами
С0 + О20 = C +4О2-2 + Q
S0 + О20 = S+4О2-2+ Q
3Fe0 + 2О20 = Fe3+2,+3О4-2 + Q
4Al0 + 3О20 = 2Al2+3О3-2+ Q
2. Со сложными веществами
C-4H4+1 + 2О20 = C+4О2-2 + 2Н2+1О-2 + Q
2H2+1S-2 + 3О20 = 2S+4О2-2+ 2Н2+1О-2+ Q
1. Реакции горения - это такие реакции, которые сопровождаются выделением тепла и света.
2. Реакции окисления - это такие реакции, которые протекают с участием кислорода:
-
Горение
-
Медленное окисление-переваривание пищи
-
Дыхание- газообмен в легких и тканях
Фотосинтез
</
) Станция «Практическая» - применение кислорода в практической деятельности человека - работа учащихся с текстом учебника, стр.127 - 128 + работа учащихся в тетрадях по составлению схемы «Применение кислорода» _

III. Закрепление - работа учащихся по осмыслению полученных знаний - работа с кроссвордом по теме «Кислород»
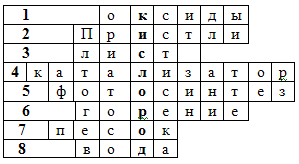
По горизонтали:
-
Соединенения, состоящие из двух элементов, одним из которых является кислород (оксиды)
-
Фамилия английского ученого, получившего кислород разложением оксида ртути (II) (Пристли)
-
Орган растения, где образуется кислород (лист)
-
Вещество, ускоряющее химическую реакцию (катализатор)
-
Процесс образования кислорода на свету (фотосинтез)
-
Реакция окисления, которая сопровождается выделением тепла и света (горение)
-
Вещество, в состав которого входит элемент кислород (песок)
-
Самое распространенное вещество на Земле, в состав которого входит кислород (вода)
Ключевое слово - самый распространенный химический элемент на Земле (кислород)
IV. Рефлексия.
-
Что нового вы узнали сегодня на уроке?
-
В чем испытывали затруднения?
-
Что понравилось на уроке?
V.Домашнее задание: § 21 №№ 1-3 (письменно) + презентация тем (по выбору учащихся)
- Кислород и озон
- Фотосинтез -
УМК и литература
.
1.Габриелян О.С. «Химия - 9». Учебник для общеобразовательных учреждений - М.: Дрофа, 2007
-
О.С. Габриелян, Химия 9 кл. «Настольная книга учителя». - М.: Дрофа, 2006
-
В.С.Полосин, Школьный эксперимент по неорганической химии,1972
CD «Химия элементов»
-
Энциклопедический словарь юного химика, М. «Педагогика»,1982