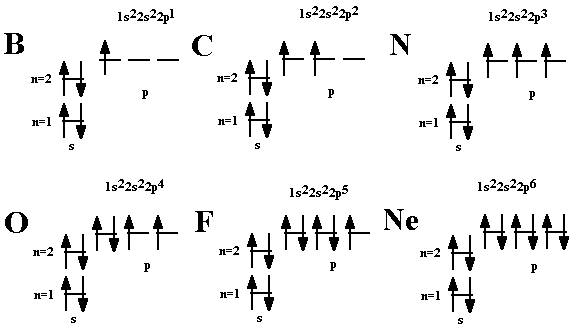- Учителю
- План урока по химии на тему Строение атомов химических элементов (10 класс)
План урока по химии на тему Строение атомов химических элементов (10 класс)
|
11.1.Повторение Строение атомов химических элементов |
Школа: школа-лицей №17 г.Атырау
| |||||
|
Дата:5-10.09.16 |
Имя учителя: Ким Е.Г. | |||||
|
КЛАСС: 10а,б,в |
Количество присутствующих: |
отсутствующих: | ||||
|
Цели обучения, которые необходимо достичь на данном уроке |
| |||||
|
Ресурсы |
Полезная основная информация и диаграммы на сайте:
| |||||
|
Языковые цели |
Учащиеся могут: объяснять значение данных терминов и применять при выполнении заданий на примерах Лексика и терминология, специфичная для предмета: «химический элемент», «атом», «молекула» орбиталь, «энергетический уровень»,»Электронные конфигурации» Полезные выражения для диалогов и письма:
| |||||
|
Предыдущее обучение
|
Требуются навыки, знание и понимание Курса химии с 8 по 9 классы | |||||
|
Дифференциация |
Все учащиеся смогут: Выполнить работы, проводимые в предыдущих классах, по изучению строения атома уметь давать характеристику «химический элемент», «атом», «молекула», составлять электронные формулы, объяснять строение электронных оболочек, уметь выполнять задания по данному материалу объяснять данные понятия при выполнении заданий Большинство учащихся сможет: Выполнить работы, проводимые в предыдущих классах, по изучению строения атома уметь давать характеристику «химический элемент», «атом», «молекула», составлять электронные формулы, объяснять строение электронных оболочек, уметь выполнять задания по данному материалу объяснять данные понятия при выполнении заданий на некоторых примерах Некоторые учащиеся смогут: Выполнить работы, проводимые в предыдущих классах, по изучению строения атома уметь давать характеристику «химический элемент», «атом», «молекула», составлять электронные формулы, объяснять строение электронных оболочек, уметь выполнять задания по данному материалу объяснять данные понятия при выполнении заданий на большинстве примерах | |||||
|
Привитие ценностей |
Уважение Открытость Труд и творчество Обучение на протяжении всей жизни | |||||
|
Связь с другими предметами |
Физика, биология | |||||
|
Применение ИКТ |
Видеоролики, презентация | |||||
|
План | ||||||
|
Запланиро ванные сроки |
Запланированные мероприятия Деятельность учителя на уроке |
Деятельность учащихся | ||||
|
0-1 мин
2-4 мин
5-8 мин
9-20 мин
21-27 мин
|
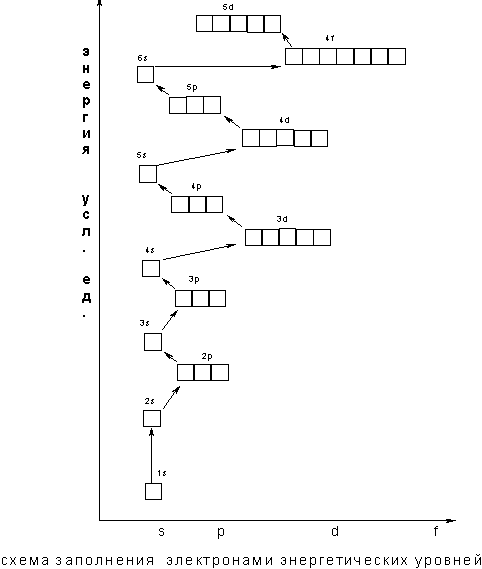
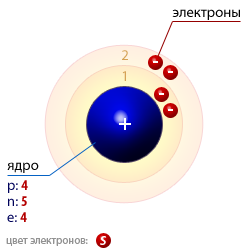
Приветствие учащихся Игра» Броуновское движение»(учащиеся хожят и показывают движение частиц в молекулах, жидкостях и газах) Учитель просит учащихся, используя мини-доски, пройти небольшой тест на знание количества электронов первых 20-ти ХЭ ПС. «У меня 7 электронов - кто я ?» (Ответ: Азот) «Мой символ Si - кто я?» (Ответ: Кремний ) « Моя подруга живет в квартире №16, её имя - ?» (Ответ: Сера) «У меня 20 нейтронов и 20 электронов , а живу я в подъезде номер ?» (Ответ: Кальций) «Я - фосфор, подскажите сколько у меня электронов» (Ответ: 15) Проверка домашнего задания Учитель объявляет тему и цели урока. Учитель: Давайте, вспомним строение атома элемента? Как мы определяем число электронов, протонов и нейтронов? Учащиеся зарисовывают структуру атома элемента№1-20 Распределение электронов по энергетическим уровням. Характеристика состояния электронов в атомах. Электроны в атомах обладают различным запасом энергии,
которую они поглощают или излучают определенными
порциями, или так называемыми квантами. Электроны, обладающие наименьшим запасом энергии (n=1
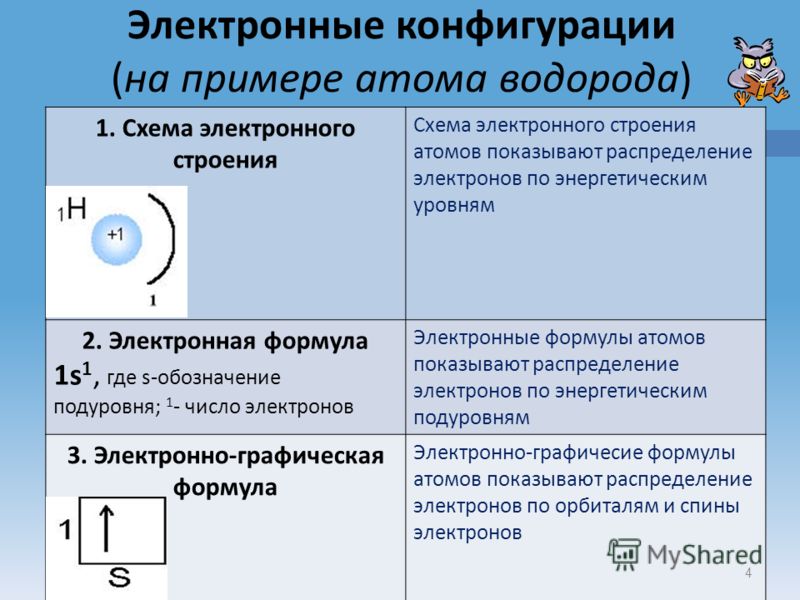
), находятся на первом энергетическом уровне. Предложить учащимся рассмотреть графическое изображение состояние электронов в атомах на примере атома водорода.
Далее показать вторую картинку Электронное облако водорода с неравномерной плотностью
Попросить учащихся ответить на вопросы по данным картинкам. Например, Понятно ли им, что показывают данные картинки? Есть ли траектория движения у электрона? Экспериментально доказано, что вероятность пребывания
электрона в области заряженного ядра не одинакова.
Просмотр видео: Что такое атомная орбиталь? Задать вопросы по данному видео после просмотра учащимися. Что такое орбита? Что такое атомная орбиталь. Как можно определить атомные орбитали? Какова природа электрона.
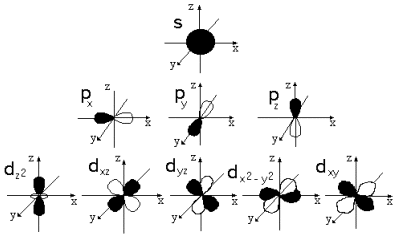
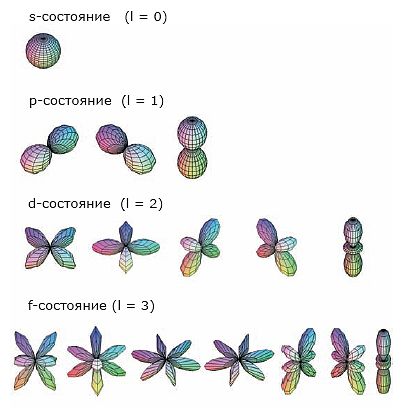
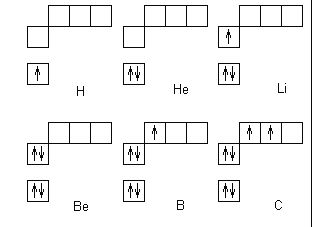
Объяснение учителем: Понятие о s-, p-электронах и их распределении по энергетическим уровням и подуровням. Электроны, состояние которых описывается облаком (орбиталью) сферической формы, принято называть s-электронами.
Задать вопрос учащимся: Сколько электронов в атоме
гелия ?
Графически это изображается так:
Клетка обозначает орбиталь, стрелка - электрон, разнонаправленные стрелки - противоположные (антипараллельные) спины.
Расположение электронов в атомах принято также
изображать в виде электронных формул, например:
Цифра перед буквой показывает номер энергетического уровня; Буква - энергетический подуровень и форму электронного облака; Цифра справа над буквой - число электронов на указанном подуровне с данной формой облака.
Число электронов на энергетическом уровне соответствует известной формуле N=2n2 Учащимся предлагается выполнить задание уровня А: Сколько и какие химические элементы первого периода содержат от одного до двух электронов ? (Ответ: в 1-м периоде периодической таблицы химических элементов не может быть больше двух химических элементов. Это водород и гелий).
У атома бора В появляется пятый электрон.
Этот электрон при движении образует облако, напоминающее форму гантели
Показать учащимся возможную ориентацию р- электронных облаков в пространстве
Гантелеобразные электронные облака располагаются взаимно перпендикулярно по осям x, y, z.
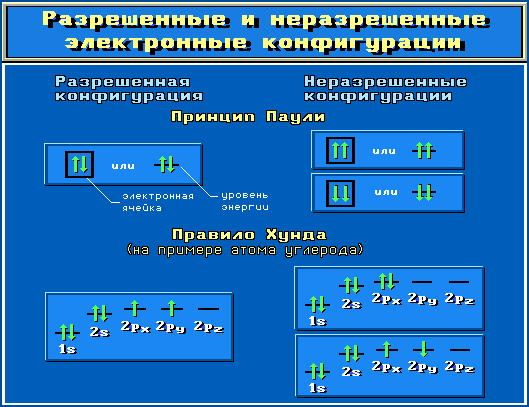
Объяснить учащимся, что для построения электронных конфигураций атомов необходимо учитывать: Принцип Паули. В1925 г. швейцарский физик В.Паули (в 1945 г. ему была присуждена Нобелевская премия по физике) установил правило, названное впоследствии принципом Паули (или запретом Паули): В атоме не может быть двух электронов, обладающих одинаковыми свойствам
Правило Хунда. При данном значении l (т.е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным. Если, например, в трех p-ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке.
Принцип наименьшей энергии
Работа в группах Задание: составьте схемы распределения электронов
Взаимопроверка работ группами по ключам ответов.
Объяснить, что отображает данный слайд.
Показать учащимся возможные схемы изображения электронно-графических конфигураций атомов.
Индивидуальная работа учащихся Задание: Объяснить значения электронных конфигураций на примере атома водорода.
Взаимопроверка работ учащихся
Демонстрируется видеоматериал с www.bilimland.kz/ «Расположение электронов в атомах. Порядок заполнения оболочек электронами» После просмотра видеоматериала учащиеся исправляют свои ошибки в работах. Демонстрируется видеоматериал с www.bilimland.kz/ «Электронная конфигурация элементов. Модели атомов» После просмотра учитель совместно с учащимися записывает электронные конфигурации бора, серы. Групповая работа Далее следует провести групповую работу по изготовлении моделей атомов первых 20-ти элементов (навыки 2 гр: применение знаний) Запишите электронные конфигурации с распределением электронов по орбиталям нижеследующих элементов: Кремния, фосфора, алюминия, лития. Обмениваясь мнениями они дополняют свои ответы. Учитель, выслушав ответы учащихся, дополняет их |
Учащиеся выполняют задание учителя самостоятельно
Учащиеся в тетрадях выполняют задание
Учащиеся индивидуально отвечают на вопросы
| ||||
|
28-42 мин
|
Выполнение заданий по сборнику упражнений Стадия осмысления Устное оценивание учащихся Атом - это ……………. частица, которая состоит из ……………… заряженного ядра и ………………. заряженных электронов. Задание уровня В: Ядра атомов состоят из элементарных частиц ……..видов : …………(p) и …………….(n). Сумма протонов и нейтронов в ядре одного атома называется ………………: где А - ………….число, N - число…………, Z - число………… Задание уровня С: Электроны распределяются по …………… орбиталям в соответствии с принципом ………… …………, принципом ……….. и правилом ………. . Такое распределение называется …………. ……………….. …………. . |
Учащиеся выполняют индивидуальную работу Темирбулатова А.Е.Химия с.93-96 | ||||
|
|
Выполнение упражнений на расчет массовой доли элемента, молярного объема,числа молекул. Хомченко «Пособие по химии», Выполнение у доски и в тетрадях, взаимооценивание и самомоценивание работ. Подведение итогов урока: На уроке было рассмотрено строение атома, состояние электронов в атоме, введено понятие «атомная орбиталь и электронное облако». Узнали, что такое форма орбиталей (s, p-) каково максимальное число электронов на энергетических уровнях и подуровнях, распределение электронов по энергетическим уровням, что такое s-, p- и d-элементы. Привели графические схемы строения электронных слоев атомов (электронно-графическая формула). Домашнее задание: 1) Элементы имеют следующие электронные формулы: а) 1s2 2s2 2p4. б) 1s2 2s2 2p6 3s2 3p1. в) 1s2 2s2 2p6 3s2 3p6 3d6 4s2. Какие это элементы? Напишите их символы и названия на латинском и русском языках. 2) Составьте синквейн по данной теме Рефлексия
Вопросы рефлексии:
|
Учащиеся выполняют индивидуальную работу | ||||
|
43-45 мин
|
</ Домашнее задание: п.2.1-2.4 у. 8-10 с.64 1) Элементы имеют следующие электронные формулы: а) 1s2 2s2 2p4. б) 1s2 2s2 2p6 3s2 3p1. в) 1s2 2s2 2p6 3s2 3p6 3d6 4s2. Какие это элементы? Напишите их символы и названия на латинском и русском языках. 2) Составьте синквейн по данной теме Рефлексия
Вопросы рефлексии:
|
Стикеры красного и зеленого цвета | ||||
|
Дополнительная информацияМежпредметные связи Проверка здоровья и безопасности Связи с ИКТ Связи с ценностями (воспит. элемент) | ||||||
|
В данном уроке дифференциация происходит очень часто. Менее способные учащиеся получают вспомогательные листы, а наиболее способным предлагается расширить свое понимание путём использования учителем метакогнитивного опроса. Все учащиеся смогут: Все учащиеся смогут: Выполнить работы, проводимые в предыдущих классах, по изучению строения атома уметь давать характеристику «химический элемент», «атом», «молекула», составлять электронные формулы, объяснять строение электронных оболочек, уметь выполнять задания по данному материалу объяснять данные понятия при выполнении заданий Большинство учащихся сможет: Выполнить работы, проводимые в предыдущих классах, по изучению строения атома уметь давать характеристику «химический элемент», «атом», «молекула», составлять электронные формулы, объяснять строение электронных оболочек, уметь выполнять задания по данному материалу объяснять данные понятия при выполнении заданий на некоторых примерах Некоторые учащиеся смогут: Выполнить работы, проводимые в предыдущих классах, по изучению строения атома уметь давать характеристику «химический элемент», «атом», «молекула», составлять электронные формулы, объяснять строение электронных оболочек, уметь выполнять задания по данному материалу объяснять данные понятия при выполнении заданий на большинстве примерах
|
В данном уроке существуют постоянные возможности для оценки. Оценка здесь во многом неформальная: учитель задаёт вопросы учащимся внимательно и, задавая вопросы повышенного уровня, достигается хорошее понимание вопроса у отдельных учащихся.
|
Этот урок включает в себя групповую работу учащихся и широкое обсуждение результатов с другими учащимися, отражающие ценность уважения к другим мнениям и коммуникативные навыки. Есть много возможностей для критического рассмотрения при объяснении принципов, лежащих в основе наблюдений учащихся. Using of interactive whiteboard, Power Point Presentation
| ||||
|
Размышления Были ли цели урока/цели обучения реалистичными? Что учащиеся выучили сегодня? Какая атмосфера царила в классе? Сработало ли дифференциация, проводимая мной? Уложился (лась) ли я в сроки? Какие отступления были от плана урока и почему?
|
Используйте данный раздел для размышлений об уроке. Ответьте на самые важные вопросы о Вашем уроке из левой колонки. | |||||
|
Общая оценка, Какие два аспекта урока прошли хорошо (подумайте как о преподавании, так и об обучении)? 1: 2: Какие две вещи могли бы улучшить урок (подумайте как о преподавании, так и об обучении)? 1: 2: Что я узнал (а) за время урока о классе или отдельных учениках такого, что поможет мне подготовиться к следующему уроку?
| ||||||



 Вольфганг
Паули
Вольфганг
Паули
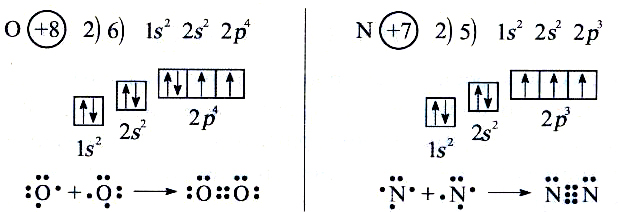
 Фридрих
Хунд
Фридрих
Хунд