- Учителю
- Обобщение сведений о классах неорганических соединений.Урок химии в 8 классе
Обобщение сведений о классах неорганических соединений.Урок химии в 8 классе
Урок по теме «ОБОБЩЕНИЕ СВЕДЕНИЙ О КЛАССАХ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ»
Цели урока:
Образовательные:
-
уметь применять полученные знания и умения при характеристике состава и свойств оксидов, оснований, кислот и солей
-
определять, между какими из предложенных веществ возможно протекание необратимых реакций обмена
Развивающие:
-
развивать умение высказывать самостоятельные суждения в ходе урока;
-
формирование умений формулировать определения;
-
разъяснять смысл изученных понятий и объяснять последовательность действий при определении валентности по формуле вещества;
-
развивать умение работать коллективно, оценивать ответы своих товарищей.
Ход урока:
I.Повторение и обобщение знаний
1.Вспоминаем четыре класса изученных неорганических соединений,
даем краткие определения этих классов. Размещаем их названия на
первом слайд
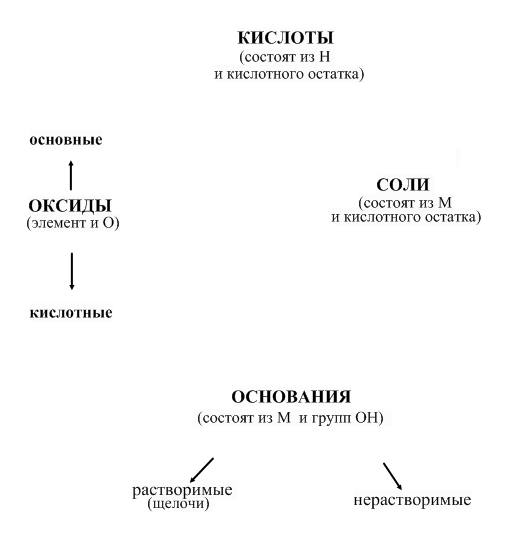
2. Повторяем классификацию веществ каждого класса. На схеме указываем классификацию оксидов и оснований, она имеет значение при записи химических свойств. Дополняем схему. Слайд2
3.С помощью стрелки указываем на схеме пары веществ, взаимодействующих друг с другом. Вдоль стрелки подписываем названия классов образующихся веществ или типы реакций.
Слайд 3
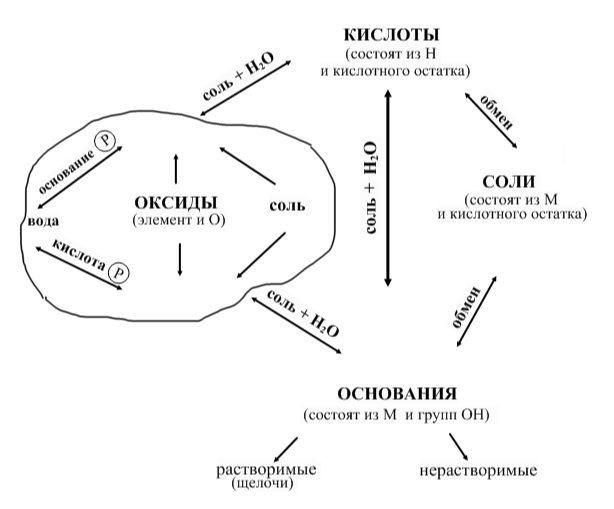
Поскольку химических свойств много, мы используем три правила, они помогают в создании таблицы.
Правило 1.
В природе взаимодействуют противоположности: кислое - основное. Благодаря этому правилу находим на схеме четыре пары веществ:
кислота основание,
кислота основной оксид,
кислотный оксид основание,
кислотный оксид основной оксид.
Во всех случаях образуются нейтральные вещества - соль и вода. Только в последней паре - соль.
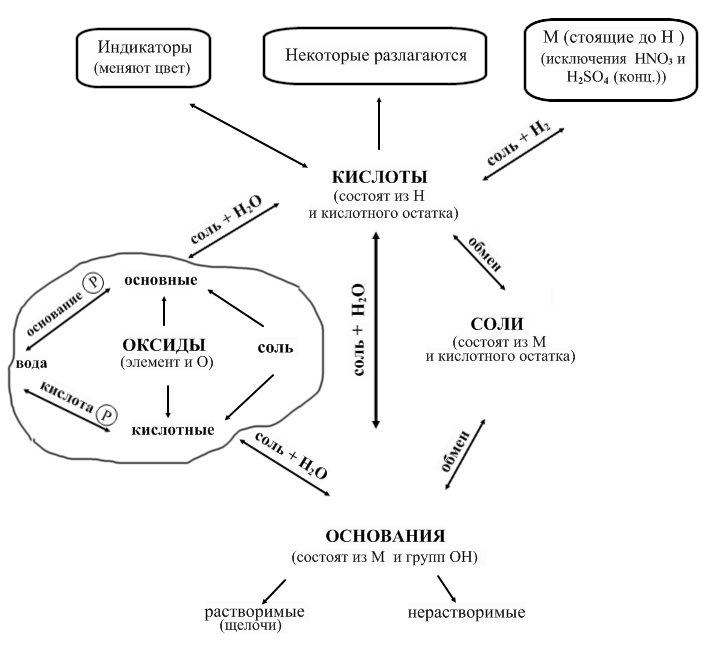
</<font face="Times New Roman, serif">Правило 2.
Кислоты могут взаимодействовать и с солями.
Растворимые соли могут взаимодействовать со щелочами. Причем реакция протекают до конца, если образуется осадок, газ или малодиссоциирующее вещество.
Растворимые соли взаимодействуют друг с другом.
Вода соединяется с кислотными оксидами ( кроме SiO2), с оксидами щелочных и щелочноземельных металлов. При этом образуются растворимые Р соединения (кислота или основание).
Вводим в схему воду и указываем еще четыре пары веществ:
соль кислота,
соль основание,
вода основной оксид,
вода кислотный оксид.
Правило 3.
Специфические свойства веществ каждого класса.
Кислоты:
взаимодействие с металлами;в) взаимодействуют с индикаторами.
г) некоторые разлагаются
Слайд 4.
Основания:
а) нерастворимые разлагаются при нагревании;
б) растворимые взаимодействуют с индикаторами.
Слайд 5
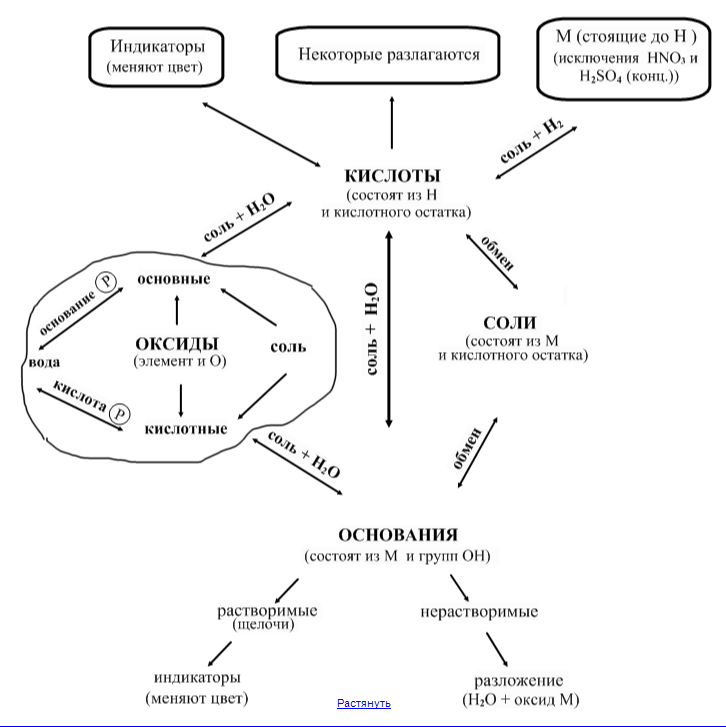
Соли:
а) взаимодействуют с металлами (реакция замещения).Реакция идет в том случае, когда вытесняющий металл стоит в ряду напряжений левее того металла, который входит в состав соли.
б) нерастворимые соли при нагревании разлагаются.
в) гидролизуются водой
.
Окончательный вид схемы приведен на слайде 6.
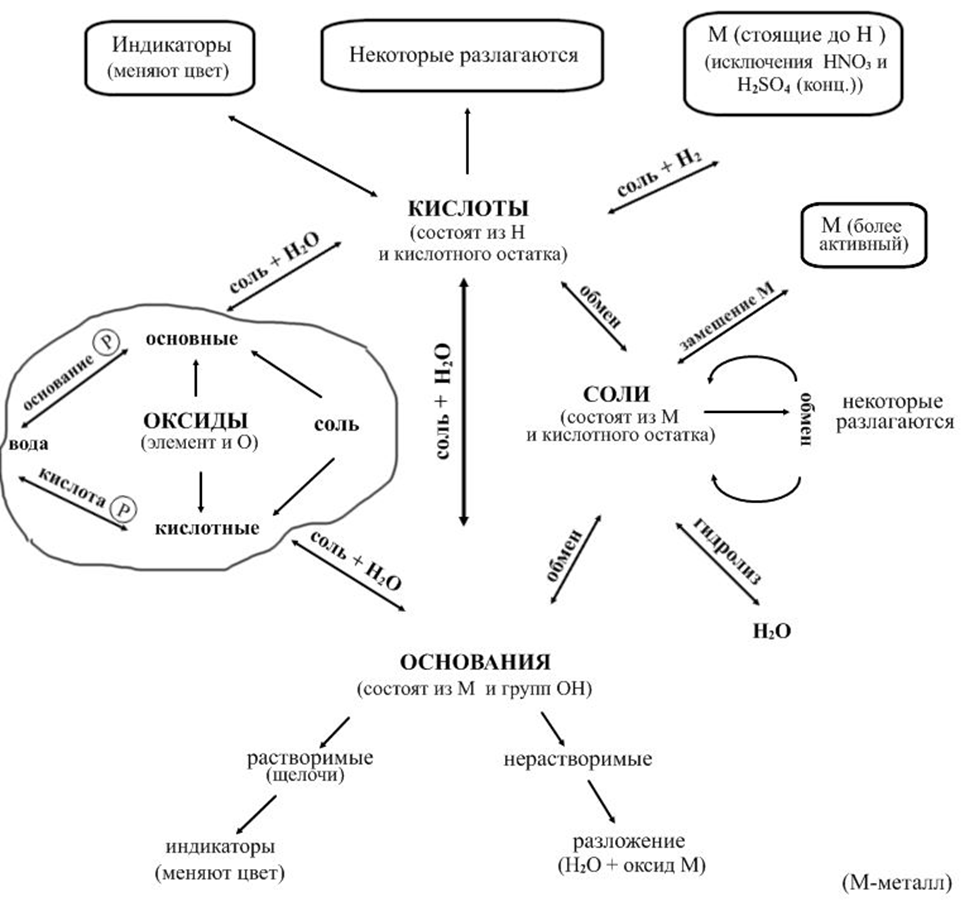
II.Закрепление материала с использованием схемы. Здесь можно предложить два типа заданий:
- определение соединения (к какому классу относится);
- составление уравнений химических реакций.