- Учителю
- Урок на тему«Скорость химической реакции. Факторы, влияющие на скорость химической реакции».
Урок на тему«Скорость химической реакции. Факторы, влияющие на скорость химической реакции».
Урок на тему: «Путешествие в страну Неметаллов»
Цель: 1) учебная: обобщить, систематизировать и углубить знания учащихся о составе, химическом строении, физико-химических свойствах, способах получения и применения неметаллов, закрепить умение составлять уравнения характерных реакций, решения задач на определение количества вещества и массы продукта реакции;
2) развивающая: научить устанавливать причинно-следственные связи между строением и свойствами веществ, применение знаний в нестандартных ситуациях, прогнозировать химические реакции, развивать ассоциативное, образное мышление, познавательную активность, творческие способности учащихся;
3) воспитательная: научить высказывать свои мысли, воспитывать культуру общения.
Тип урока: обобщение и систематизация знаний, умений и навыков.
Метод: проблемно-поисковый.
Формы работы: тестирование, фронтальный опрос, выполнение творческих заданий, работа в парах, применение элементов проблемного и опережающего обучения.
Характеристика учебной деятельности: работа в парах и в составе малых гетерогенных групп.
Оборудование: учебник, ватманы, маркеры, цветные сигнальные карточки, таблица «растворимости веществ в воде», «Периодическая система Д.И.Менделеева».
Ход урока.
Девиз урока:
«Просто знать это ещё не всё, знания нужно уметь применять».
Гёте
I. Организация класса.
Определение целей и задач урока
II. Мотивация учебной деятельности.
Учитель: сегодня мы с вами совершим удивительное путешествие в страну Неметаллию, во время которого вы можете узнать много нового и интересного об этой стране. Не следует забывать, что любое путешествие в малоизвестные страны, это, в первую очередь, испытание на умение приспосабливаться к новым условиям жизни.
Такими испытаниями для вас станут необычные задания, для решения которых нужны знания. В этом путешествии вам понадобится взаимоуважение и помощь туристической группы, т.е. друг друга.
Во время путешествия туристы обычно делают записи в маршрутных листах. Страна веществ размещена на нескольких островах. Сегодня мы с вами отправляемся на остров, где живут неметаллы. Итак, в путь.
III. Обобщение и систематизация знаний учащихся.
Задание: выполнить в парах работу по тестам и результаты проверить друг у друга (самопроверка).
Тестирование (работа в парах)
1). К неметаллам относятся все перечисленные:
А: S, O, K, Cu
Б: Cl, He, H, P
В: F, Fe, N, Na
Г: Si, C, Mg, Zn
2) Неметалл того же периода, что и сера:
А: Na
Б: P
В:С
Г: N
3) Неметалл, у которого на внешнем слое 4 е:
А: T
Б: Pb
В: Si
Г: Be
4. Неметаллы подгруппы, в которой расположен Br:
А: O и F B: Se и Kr
Б: Cl и Mg Г: F и Cl
5. Неметаллы, расположенные в одной подгруппе:
А: N и P В: Li, Na
Б: Al и Sc Г: Cl, Ar
6. Укажите количество неспаренных электронов в возбуждённом состоянии атомов С:
А: 1 В: 3
Б: 2 Г: 4
7. Укажите последовательность аллотропных видоизменений одного элемента:
А: сера, ромбич, сера моноклинная, H2S
Б: графит, алмаз, карбин
В: фосфор белый, фосфор красный, PH3
Г: кислород, озон, вода
8. Сумма индексов в формуле оксида серы в высшей степени окисления:
А: 1 В: 3
Б: 2 Г: 4
9. Найти соответствие между названием вещества и формулой:
1. Гидроген хлорид А. CO2
2. Гидроген кислорода Б. HCl А3 Б1 В5 Г4
3. Карбон оксид В. NH3
4. Силиций оксид Г. SiO2
5. Аммониак
10. Вещество с минимальной растворимостью в воде:
А: O2 В: NH3
Б: H2 Г: N2
11. Какому элементу принадлежит формула 1s2 2s2 2p6 3s23p3?
А: C В: S
Б: Si Г: P
12. Бария - ионы в растворе можно определить с помощью ионов:
А: Сl- В: PO43-
Б: NO3 Г: SO42-
Результаты тестирования проверяются с помощью сигнальных карточек
А - красный; В - зелёный;
Б - жёлтый; Г - синий
IV. Выполнение творческих заданий (работа в группах).
-
Задание (10 мин) «Знакомые незнакомцы»
-
Дать характеристику подгруппы, определить физико-химические свойства.
-
Назвать соединения данного элемента.
-
Данные оформить в виде таблиц:
Признаки
Подгруппа элементов неметаллов
(уравнение химических реакций)
№ 1
Взаимодействие с простыми веществами:
а) с неметаллами;
б) с металлами.
№ 2
Взаимодействие со сложными веществами:
а) оксиды;
б) кислоты;
в) основания;
г) соли
Учащиеся разделены на команды:
-
Подгруппа С.
-
Подгруппа N.
-
Подгруппа O.
-
Подгруппа галогены.
-
Инертные газы.
- Все данные оформляются на отдельных разноцветных листах и с помощью маркера;
- Работа каждой группы проверяются сразу после защиты у доски учащимся другой команды, команды оценивает учитель.
2. Задание «Я не волшебник, я только учусь…»
а) определить по электронной формуле элемент;
б) назвать его соединения и их области применения.
№ 1 - 1s22s22p2 - C
№ 2 - 1s 22s22p4 - O
№ 3 - 1s 2 2s22p63s23p3 - P
№ 4 - 3s2 3p5 - Cl
№ 5 - 3s23p6 - Ar
 CH4
C2H2 бензол ВМС
CH4
C2H2 бензол ВМС
C

 CO2 H2CO3 минеральные удобрения
CO2 H2CO3 минеральные удобрения
 CO
химическая промышленность
CO
химическая промышленность
-
Задание «Удиви меня».
1). Используя положение элементов в периодической системе, определить:
а) изменение неметаллических свойств в периодах и группах;
б) изменение описанных свойств в гидридах;
в) изменение описанных свойств в кислородосодержащих соединениях.
2) Расположить неметаллы в порядке увеличения их окислительных свойств:
C, J, Cl, O, N, Na, P, S, Br, Se; ответ обоснуйте!
4. Задание «Темпераментное»
Даны кислоты. Определить их силу с учётом всех показателей
HCl, HNO3, H3PO4, H2SO4, H2CO3
Составить уравнение реакции нейтрализации:
-
HCl + NaOH→
-
HNO3 + KOH→
-
H3PO2 + Mg (OH)2→
-
H2SO4 + Fe (OH)3→
-
H2CO3 + Zn→
5. Задание «Принцип Домино»
- Выполнить превращения по схеме:
1)N2→NO2→N2O5→HNO3→Ca(NO3)2
2)C→CO2→Na2CO3→NaHCO3→NaCl
3)S→H2S→SO3→FeSO4→Fe(OH)2→FeO
4)Br2→HBr→KBr→AgBr→AgOH→Ag2O
5)P→PH3→H3PO4→Ca3(PO4)2→Ca(OH)2→CaCl2
6. Задание «Остановка математическая».
а) Даны 2 раствора: 5% раствор NaOH массой 400г и 9,8% раствор H3PO4 массой 200г. Определите массу полученной соли.
б) 500г мела сожгли, определите объём выделившегося газа.
Решение: 1) m(NaOH)=0,05*400=20г M(NaOH)=40г/моль
m(H3PO4)=0,098*200=19.6г M(H3PO4)=98г/м
n(NaOH)=![]()
![]() =0.5моль
=0.5моль
n(H3PO4)==0.2 моль (в избытке)
0,5 м x м
3NaOH+H3PO4→Na3PO4+H2O
3 м 1 м
n(Na3PO4)==0.167 моль; M(Na3+PO4)=164 г/м.
m(H3PO4)=0.167*164=27.39 г
2) 500г x л
CaCO3→CaO+CO2
100г 22,7л
M(CO2)=100г
V(CO2)==112 л. CO2
Ответ: 1) 27,39г; 2)112л
-
Подведение итогов:
Учитель: Ваше путешествие в страну веществ не заканчивается, с другими представителями мы познакомимся на следующих уроках.
Учащиеся сдают маршрутные листы.
-
Домашнее задание.
Составить уравнение реакций по схеме: «Пирамида» или «Древо элемента»
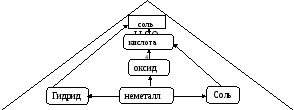
а) «Пирамида»
б) «Древо элемента»




 PH3
P2O3 Ca3P
Mg3P2 P2O5
PH3
P2O3 Ca3P
Mg3P2 P2O5
 H2O
P2O5
Ca3(PO4)2 Mg(OH)2
H2O
P2O5
Ca3(PO4)2 Mg(OH)2
MgCl2 (NH4)2HPO4
 Na
H3PO4
Na
H3PO4
CaO
Ca3(PO4)2 Ca(NO3)2 Mg(OH)Cl (NH4)2PO4
NH3
в) «Десять шагов»
1 S - неметалл
2 S - твердое
3 S - не растворяется в воде
4 S - без запаха
5 S - желтого цвета
6 S - не теплопровод
7 S - не обладает
электропроводимостью
8 S - окислитель
9 S - восстановитель
10 S - химически активный
Урок на тему: «Скорость химической реакции.
Факторы, влияющие на скорость химической ![]() реакции»
реакции»
Лабораторный практикум.
Цель: 1) учебная: углубить знания учащихся о типах химических реакций, о скорости химической реакции и факторах, влияющих на скорость реакции, научить определять скорость реакции по известной концентрации реагирующих веществ, p системы, t; научить составлять термохимические уравнения реакций, определять факторы, влияющие на равновесие системы;
2) развивающая: научить устанавливать причинно-следственную связь между скоростью реакции и факторами, влияющими на неё, научить определять влияние одного и нескольких факторов на скорость реакции и равновесие системы, продолжить развивать ассоциативное, образное мышление, познавательную активность, творческие способности учащихся;
3) воспитательная: научить высказывать свои мысли, воспитывать культуру общения, работу и заинтересованность учащихся в коллективном творчестве.
Тип урока: изучение нового материала.
Метод: проблемно-поисковый.
Формы работы: тестирование, выполнение творческих заданий, применение элементов проблемного и опережающего обучения.
Характеристика учебной деятельности: работа в парах, в составе малых гетерогенных групп.
Оборудование: учебник, таблица «Растворимость кислот, солей и оснований в воде», «Электрохимический ряд металлов», «Периодическая таблица Д.И.Менделеева», цветные сигнальные карточки, маркеры, «цветик-семицветик»- «Правила ТБ и ОТ», лабораторное оборудование, реактивы.
Ход урока.
Девиз урока: «Границы научного познания и предвидения определить невозможно». Д.И.Менделеев
I. Организация класса.
II. Мотивация учебной деятельности.
Учитель: Сегодня мы с вами отправимся в удивительное путешествие по стране «Химреакция». Здесь нас будут ждать уже известные нам события и факты, но и конечно, будет много нового, загадочного, неизведанного. Поэтому каждый из вас должен приложить максимум усилий, чтобы из страны «Химреакия» попасть в новую, ещё неизведанную страну «Химравновесие». Итак, в путь.
III. Повторение и систематизация знаний. Теоретический тур.
Задание: выполнить работу в парах по тестам и результаты проверить друг у друга (самопроверка)
Тестирование: работа в парах с помощью сигнальных карточек.
Время 3 минуты
Ответ: А - красный
Б - жёлтый
В - зелёный
Г - синий
1. Растворы бывают:
А: разбавленные, концентрированные;
Б: проводимые, непроводимые;
В: насыщенные и разбавленные;
Г: сильнонасыщенные, слаборазбавленные.
2. К электролитам не относятся:
А: H2SO4 B: NaOH![]()
![]()
Б: H2CO3 Г: N2
3. При диссоциации кислот образуются:
А: катионы металлов; В: катионы кислотного
остатка;
Б: катионы неметаллов; Г: катионы гидрогена.
4. Реакция нейтрализации - это взаимодействие:
А: кислоты и основного оксида; В: соли и основания;
Б: соли и кислоты; Г: кислоты и основания.
5. Различают реакции:
А: соединения, обмена, диссоциации, восстановления;
Б: соединения, разложения, обмена и замещения;
В: соединения, окисления, восстановления и разложения;
Г: соединения, замещения, разложения и окисления.
6. Определи массовую долю растворённого вещества, если при выпаривании 500 г раствора осталось 50 г соли
А: 10% В: 15%
Б: 20% Г: 2%
7. Скорость реакции зависит от:
А: формулы вещества;
Б: концентрации реагирующих веществ;
В: объёма реакционной смеси;
Г: дня недели.
8. Реакция обмена идёт до конца, если:
А: количества веществ равны; В: образуется соль и
вода;
Б: образуется МДС, осадок, газ Г: в результате реакции
выделяется Q.
9. Эндотермические реакции протекают:
А: с поглощением Q;
Б: с выделением Q;
В: при повышении t реакционной смеси;
Г: при понижении t реакционной смеси;
10. Катализатор - вещество, которое:
А: не меняет скорость реакции;
Б: меняет скорость реакции и сам расходуется;
В: увеличивает скорость реакции и не расходуется;
Г: уменьшает скорость реакции и не расходуется.
1 1.
При повышении давления в реакционной системе 2Н2 +
О2 → 2Н2О
1.
При повышении давления в реакционной системе 2Н2 +
О2 → 2Н2О
А: скорость реакции увеличивается;
Б: скорость реакции не меняется:
В: С реагирования и продуктивность равны;
Г: скорость реакции изменится.
12. При добавлении примесей в реакционную смесь, скорость реакции:
А: увеличивается; В: не меняется;
Б: уменьшается; Г: зависит от t.
IV. Практический тур «Цветик - семицветик».
-
«Повторим правила ТБ и ОТ учащихся при выполнении лабораторных работ».
Задание: определите правила безопасности при работе (работа в группах):
-
Красный - с растворами кислот и щелочей;
-
Жёлтый - с активными металлами;
-
Зелёный - при нагревании растворов веществ;
-
Голубой - при работе со стеклом;
-
Белый - при работе со спиртовкой;
-
Фиолетовый - при работе с пахучими и ядовитыми веществами;
-
Оранжевый - при смешивании растворов едких веществ.
-
Решение лабораторных задач (творческие задания, работа в гетерогенных группах)
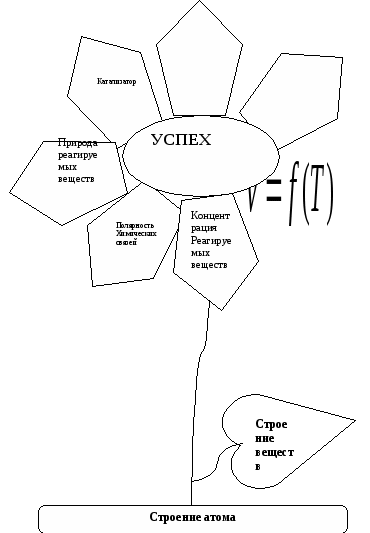
Цель: Доказать с помощью химических реакций, влияние различных факторов на скорость химической реакции.
На доске: «Цветик-семицветик» - «цветок Успеха».
Учитель: Мы должны с помощью химической реакции выяснить, что такое скорость реакции, от каких факторов она зависит, и какие факторы не влияют на скорость реакции. Для того, чтобы каждая группа в конце путешествия добилась результата и получила цветочек Успеха, мы должны работать:
А: быстро и качественно,
Б: соблюдая правила ТБ и ОТ;
В: результаты оформить в виде отчёта;
Г: работать дружно и слаженно.
Опыт № 1 (1 группа) остановка «Зри в корень»
Даны 3 металла: Mg, Fe и Pb, раствор HCl и H2O
Задание: 1) определить скорость взаимодействия металлов с H2O и кислотой;
2) составить уравнения реакций;
3) объяснить увиденное с точки зрения положения металлов в электрохимическом ряду металлов Бекетова.
Опыт № 2 (2 группа) остановка «Кристаллическая».
Даны вещества: Zn(порош.), Zn гран. + Zn (пров.), HCl.
Задание: 1) определить скорости реакции взаимодействия «металл+кислота»;
2) составить уравнения реакции;
3) объяснить реакции и определить факторы, влияющие на скорость реакции
Опыт № 3 Остановка «Полярная»
Даны растворы двух кислот: (HCl, H3PO4 ), Mg, Zn.
Задание: 1) определить скорости реакции взаимодействия кислот с металлами;
2) объяснить реакции, определить фактическую V реакции;
3) с какими металлами кислоты реагируют и почему?
4) какая из кислот химически активна?
Опыт № 4 Остановка «Концентрированная»
Даны: два раствора (разбавленный и концентрированный раствор HCl, Mg и CaCO3.
Задание: 1) составить уравнения реакций, сравнить скорости реакции Mg и CaCO3
2) составить кинетические уравнения реакций: VMg = k* CA*CB
VCaCO3 =
Опыт№5 (5 группа) Остановка «Термическая»
Даны: разб. и конц. HNO3, Cu.
Задание: 1) определить скорость реакции взаимодействия Cu с разбавленным концентрированным растворами HNO3;
2) составить уравнения реакций;
3) определить во сколько раз изменится скорость реакции, если нагреть систему до 100оС;
4) почему Cu растворяется в HNO3?
Опыт № 6 (6 группа) Остановка «Каталитическая»
Задание: Даны: MnO2, H2O2, лучина.
-
определить скорость реакции, составить уравнение получения кислорода;
-
доказать наличие О2 в реакционной смеси?
-
как влияет MnO2 на скорость реакции?
-
что происходит с kat после реакции?
Опыт № 7 (7 группа) Остановка «Удивительная» (приложение стр.6)
Даны: раствор кислоты и яйцо.
Задание: 1) доказать влияние Р на скорость реакции;
2) доказать влияние концентрированного раствора на скорость реакции;
3) доказать влияние t на скорость реакции;
4) составить уравнение соответствующих реакций.
Итог: у доски каждая группа определяет фактор, влияющий на скорость реакции.
Общий вывод:
На скорость реакции влияют: 1) t, 2) p, 3) kat, ингибитор, 4) природа вещества, 5) агрегатное состояние, 6) концентрация реагирующих веществ,
7) природа химической связи.
Учитель: Давайте сравним результаты наших экспериментов с уже известными данными:
Учитель: Переходим к следующему этапу.
3) Расчётные задачи
1. Концентрация одного из веществ через 20сек
после начала реакции 0,1![]() ,через
30с - 0,02 моль/л. Определить среднюю скорость реакции
,через
30с - 0,02 моль/л. Определить среднюю скорость реакции
Решение:
Vр= ![]() =
=![]() =
0,008
=
0,008
Ответ:
Vреак.=0,008 ![]()
2. Реакционную смесь нагрели до 80о, =3,
Определить V реакции
Решение: V = ![]() = 38
= 38
Ответ: в 6561 раз увеличится V реакции
3.Дано: N2 +
O2![]() 2NO
- 200 кДж
2NO
- 200 кДж
1м
Определить количество вещ. исходных вещ. если в результате реакции израсходовано 1000 кДж энергии.
Решение:
1 моль N2![]() 200кДж
200кДж
х![]() 1000кДж
1000кДж
х = 5 мольN2
4. Дано: N2 + 3H2
![]() 2NH3
2NH3
Определить как изменится V реакции ,если давление в системе увеличится в 3 раза.
Решение: N2 + 3H2
![]() 2NH3 V исх= 4м.
2NH3 V исх= 4м.
1 м. 3м. 2м. V прод= 2м.
V1== k * p(N2) * p3(H2)
V2=k* 3p(N2)*(3p(H2))3 = 81k * p(N2)*p3(H2)
V= ![]() = 81 раз увел-ся.
= 81 раз увел-ся.
Ответ: в 81 раз увеличится.
Учитель: Наше путешествие подходит к концу, к станции «Успех». Я надеюсь, что каждый прибыл сюда с багажом новых знаний.
V. Подведение итогов работы, выставление оценок.
VI. Домашнее задание:
1) Составить по 1 уравнению реакции (в мол. и ионном видах) соединения, замещения, обмена, разложения.
2) Назвать вещества по современной украинской номенклатуре.
3) Параграф 15, упр. 3,4,6 (стр. 99)
Приложение
Сценка «Каталитические реакции»
4 действующих лица: сваха, Н, N, O
Сваха: Я, сваха, у меня такое доброе сердце, не могу смотреть, что столько свободных атомов вокруг меня, таких, которые не создали ещё молекул. А всем всё равно. А мне не всё равно. Одному посоветую, других познакомлю, вроде как случайно. Вот и мне легче.
Я не обычная сваха - у меня очень тонкая работа, каждой паре атомов подходит только одна из нас. Это очень деликатное дело - найти необходимые атомы, словно случайно их свести и так обставить дело, чтобы всё закончилось наилучшим образом. Химики называют нас катализаторами. Чтобы всё сложилось, как задумалось, необходимы ум, такт и случай. У меня тут дела на 100 тысяч: нужно устроить дочку знакомых к богатому жениху (сваха выставляет водород).
Сваха: Не смотрите, что такая, худая и бледная, а вот красавицу, да ещё и с приданным, и так возьмут, а вот такую? - нужно быть виртуозом, мастером своего дела. (Водород стесняясь, отпирается от свахи).
Сваха (к Н): Не дрожи, глупышка, всё будет хорошо. Я плохих советов не даю (поправляет вид девушки) ВОТ и ОН идёт! (навстречу идёт важно Азот).
Сваха: Добрый вечер, дорогой господин Азот! Сколько лет, сколько зим… Как поживаете? Как бизнес? Сколько процентов в воздухе получили, как перерабатывающая промышленность, как доходы? Всё хорошо?
Азот: Да, да, всё отлично, просто замечательно.
Сваха: Вижу, вижу - что не очень весело. Заглядывала, как-то, на днях, к Вам, домой. Не обижайтесь. Пора, пора. Не хватает женской руки. Вам бы молодую хозяюшку!
(выталкивает вперёд Н ).
Сваха: Вот, познакомьтесь - девка из старинного рода, раньше были при дворе, в наше время остались замки у гидрогенов в Первой и на Седьмой улицах - группах. А какая умница, работница, скромная, интеллигентная, добрая…
Азот: А что ей остаётся с одним электроном приданного.
Сваха (отводит его в сторону). Глупец! Бедняжки - самые лучшие жены. Всю жизнь на Вас молиться будут, в рот заглядывать, пылинки сдувать, потому что знают - без мужика пропадут.
Азот: Считаешь? Но деньги… захочется ей сладкой жизни, нарядов, ресторанов, тренажёрных залов… А без приданного?
Сваха: Ну ты и умён, какое приданное? Деньги? Не в деньгах счастье! (Сваха выставляет Н в центр).
Сваха: Смотри - аристократический профиль, стройная как берёзка, почти не ест. Ну чем не пара?
Водород: Всё, достаточно! Не хочу за него! Негодяй! Разве это жизнь? Всё время одним электроном в глаза будет колоть. (девушка пытается убежать, но сваха останавливает её)
Сваха: Куда ты, глупышка! Это же твоё счастье, потерпи! Всё встанет на свои места.
Азот: Так… Девушка вроде ничего, хороша. Но ведь и я находка для каждой девушки! У меня же целых пять электронов - заводов (всё это время разглядывает Н). С одной стороны, она честная, прямолинейная, скромная. Но характер же, как у дикой кошки. Разве можно, такую на люди выпускать? Ну что же, рискну! Кто не рискует, тот не пьёт шампанского!
Сваха (говорит очень быстро): Вот и хорошо, голубки, вы тут поворкуйте, а я побежала.
Азот (приглядываясь к Н): И чего мне не хватает - деньги есть, дом есть, бизнес процветает, в доме покой, никто не трогает, а тут будет перед глазами мельтешить, дармоедка несчастная…
Водород (не выдерживает, в сердцах): А пошёл бы ты… Лучше умереть с голоду, чем всю жизнь такое выслушивать!
(Н уходит, N остаётся).
Азот: Вот и отлично! Не хотел отказывать Мадам Катализатору, ведь она может ещё пригодиться, а так скажу ей - не сложилось. О, а это что? Да ещё с грозой? (Идёт О под зонтом, Азот бросается к О под зонтик)
Азот: О, мадемуазель Кислород! Я ослеплён молнией и вашей красотой (встаёт на колено). Будьте моей женой!
Урок на тему: «Путешествие в страну Неметаллов»
Цель: 1) учебная: обобщить, систематизировать и углубить знания учащихся о составе, химическом строении, физико-химических свойствах, способах получения и применения неметаллов, закрепить умение составлять уравнения характерных реакций, решения задач на определение количества вещества и массы продукта реакции;
2) развивающая: научить устанавливать причинно-следственные связи между строением и свойствами веществ, применение знаний в нестандартных ситуациях, прогнозировать химические реакции, развивать ассоциативное, образное мышление, познавательную активность, творческие способности учащихся;
3) воспитательная: научить высказывать свои мысли, воспитывать культуру общения.
Тип урока: обобщение и систематизация знаний, умений и навыков.
Метод: проблемно-поисковый.
Формы работы: тестирование, фронтальный опрос, выполнение творческих заданий, работа в парах, применение элементов проблемного и опережающего обучения.
Характеристика учебной деятельности: работа в парах и в составе малых гетерогенных групп.
Оборудование: учебник, ватманы, маркеры, цветные сигнальные карточки, таблица «растворимости веществ в воде», «Периодическая система Д.И.Менделеева».
Ход урока.
Девиз урока:
«Просто знать это ещё не всё, знания нужно уметь применять».
Гёте
I. Организация класса.
II. Мотивация учебной деятельности.
Учитель: сегодня мы с вами совершим удивительное путешествие в страну Неметаллию, во время которого вы можете узнать много нового и интересного об этой стране. Не следует забывать, что любое путешествие в малоизвестные страны, это, в первую очередь, испытание на умение приспосабливаться к новым условиям жизни.
Такими испытаниями для вас станут необычные задания, для решения которых нужны знания. В этом путешествии вам понадобится взаимоуважение и помощь туристической группы, т.е. друг друга.
Во время путешествия туристы обычно делают записи в маршрутных листах. Страна веществ размещена на нескольких островах. Сегодня мы с вами отправляемся на остров, где живут неметаллы. Итак, в путь.
III. Обобщение и систематизация знаний учащихся.
Задание: выполнить в парах работу по тестам и результаты проверить друг у друга (самопроверка).
Тестирование (работа в парах)
1). К неметаллам относятся все перечисленные:
А: S, O, K, Cu
Б: Cl, He, H, P
В: F, Fe, N, Na
Г: Si, C, Mg, Zn
2) Неметалл того же периода, что и сера:
А: Na
Б: P
В: Cr
Г: N
3) Неметалл, у которого на внешнем слое 4 е:
А: T
Б: Pb
В: Si
Г: Be
4. Неметаллы подгруппы, в которой расположен Br:
А: O и F B: Se и Kr
Б: Cl и Mg Г: F и Cl
5. Неметаллы, расположенные в одной подгруппе:
А: N и P В: Li, Na
Б: Al и Sc Г: Cl, Ar
6. Укажите количество неспаренных электронов в возбуждённом состоянии атомов С:
А: 1 В: 3
Б: 2 Г: 4
7. Укажите последовательность аллотропных видоизменений одного элемента:
А: сера, ромбич, сера моноклинная, H2S
Б: графит, алмаз, карбин
В: фосфор белый, фосфор красный, PH3
Г: кислород, озон, вода
8. Сумма индексов в формуле оксида серы в высшей степени окисления:
А: 1 В: 3
Б: 2 Г: 4
9. Найти соответствие между названием вещества и формулой:
1. Гидроген хлорид А. CO2
2. Гидроген кислорода Б. HCl А3 Б1 В5 Г4
3. Карбон оксид В. NH3
4. Силиций оксид Г. SiO2
5. Аммониак
10. Вещество с минимальной растворимостью в воде:
А: O2 В: NH3
Б: H2 Г: N2
11. Какому элементу принадлежит формула 1s2 2s2 2p6 3s23p3?
А: C В: S
Б: Si Г: P
12. Бария - ионы в растворе можно определить с помощью ионов:
А: Сl- В: PO43-
Б: NO3 Г: SO42-
Результаты тестирования проверяются с помощью сигнальных карточек
А - красный; В - зелёный;
Б - жёлтый; Г - синий
IV. Выполнение творческих заданий (работа в группах).
-
Задание (10 мин) «Знакомые незнакомцы»
-
Дать характеристику подгруппы, определить физико-химические свойства.
-
Назвать соединения данного элемента.
-
Данные оформить в виде таблиц:
(уравнение химических реакций)
№ 1
Взаимодействие с простыми веществами:
а) с неметаллами;
б) с металлами.
№ 2
Взаимодействие со сложными веществами:
а) оксиды;
б) кислоты;
в) основания;
г) соли
Учащиеся разделены на команды:
-
Подгруппа С.
-
Подгруппа N.
-
Подгруппа O.
-
Подгруппа галогены.
-
Инертные газы.
- Все данные оформляются на отдельных разноцветных листах и с помощью маркера;
- Работа каждой группы проверяются сразу после защиты у доски учащимся другой команды, команды оценивает учитель.
2. Задание «Я не волшебник, я только учусь…»
а) определить по электронной формуле элемент;
б) назвать его соединения и их области применения.
№ 1 - 1s22s22p2 - C
№ 2 - 1s 22s22p4 - O
№ 3 - 1s 2 2s22p63s23p3 - P
№ 4 - 3s2 3p5 - Cl
№ 5 - 3s23p6 - Ar
 CH4
C2H2 бензол ВМС
CH4
C2H2 бензол ВМС
C

 CO2 H2CO3 минеральные удобрения
CO2 H2CO3 минеральные удобрения
 CO
химическая промышленность
CO
химическая промышленность
-
Задание «Удиви меня».
1). Используя положение элементов в периодической системе, определить:
а) изменение неметаллических свойств в периодах и группах;
б) изменение описанных свойств в гидридах;
в) изменение описанных свойств в кислородосодержащих соединениях.
2) Расположить неметаллы в порядке увеличения их окислительных свойств:
C, Ji, Cl, O, N, Na, P, S, Br, Se; ответ обоснуйте:
4. Задание «Темпераментное»
Даны кислоты. Определить их силу с учётом всех показателей
HCl, HNO3, H3PO4, H2SO4, H2CO3
Составить уравнение реакции нейтрализации:
-
HCl + NaOH→
-
HNO3 + KOH→
-
H3PO2 + Mg (OH)2→
-
H2SO4 + Fe (OH)3→
-
H2CO3 + Zn→
5. Задание «Принцип Домино»
- Выполнить превращения по схеме:
1)N2→NO2→N2O5→HNO3→Ca(NO3)2
2)C→CO2→Na2CO3→NaHCO3→NaCl
3)S→H2S→SO3→FeSO4→Fe(OH)2→FeO
4)Br2→HBr→KBr→AgBr→AgOH→Ag2O
5)P→PH3→H3PO4→Ca3(PO4)2→Ca(OH)2→CaCl2
6. Задание «Остановка математическая».
а) Даны 2 раствора: 5% раствор NaOH массой 400г и 9,8% раствор H3PO4 массой 200г. Определите массу полученной соли.
б) 500г мела сожгли, определите объём выделившегося газа.
Решение: 1) m(NaOH)=0,05*400=20г M(NaOH)=40г/моль
m(H3PO4)=0,098*200=19.6г M(H3PO4)=98г/м
n(NaOH)=![]()
![]() =0.5моль
=0.5моль
n(H3PO4)==0.2 моль (в избытке)
0,5 м x м
3NaOH+H3PO4→Na3PO4+H2O
3 м 1 м
n(Na3PO4)==0.167 моль; M(Na3+PO4)=164 г/м.
m(H3PO4)=0.167*164=27.39 г
2) 500г x л
CaCO3→CaO+CO2
100г 22,7л
M(CO2)=100г
V(CO2)==112 л. CO2
Ответ: 1) 27,39г; 2)112л
-
Домашнее задание.
Составить уравнение реакций по схеме: «Пирамида» или «Древо элемента»

а) «Пирамида»
(II, III уровень)
-
Подведение итогов:
Учитель: Ваше путешествие в страну веществ не заканчивается, с другими представителями мы познакомимся на следующих уроках.
Учащиеся сдают маршрутные листы.
-
Домашнее задание
б) «Древо элемента» (IV уровень)






 PH3
P2O3 Ca3P
Mg3P2 P2O5
PH3
P2O3 Ca3P
Mg3P2 P2O5
H2O P2O5 Ca3(PO4)2 Mg(OH)2
MgCl2 (NH4)2HPO4
Na H3PO4
CaO
Ca3(PO4)2 Ca(NO3)2 Mg(OH)Cl (NH4)2PO4
NH3
в) «Десять шагов» 1 S - неметалл
(I уровень) 2 S - твердое
3 S - не растворяется в воде
4 S - без запаха
5 S - желтого цвета
6 S - не теплопровод
7 S - не электропроводим
8 S - окислитель
9 S - восстановитель
10 S - химически активный
7