- Учителю
- Скорость химических реакций. Факторы, влияющие на скорость химической реакции.
Скорость химических реакций. Факторы, влияющие на скорость химической реакции.
Тема урока: Скорость химических реакций. Факторы, влияющие на скорость химической реакции.
Класс: 10 «Б»
Дата:
Цель урока
-
обучающая: продолжить формирование понятия «скорость химических реакций», вывести формулы для вычисления скорости гомогенных и гетерогенных реакций, рассмотреть от каких факторов зависит скорость химических реакций;
-
развивающая: учить обрабатывать и анализировать экспериментальные данные; уметь выяснять взаимосвязь между скоростью химических реакций и внешними факторами;
-
воспитательная: продолжить развитие коммуникативных умений в ходе парной и коллективной работы; акцентировать внимание учащихся на важности знаний о скорости химической реакции протекающих в быту (коррозия металла, прокисание молока, гниение и др.)
Средства обучения: компьютер, интерактивная доска
Содержание урока
1. Организация класса
Прогнозируемая деятельность учеников
Готовность класса к работе.
2. Подготовка к основному этапу усвоения учебного материала. Активизация опорных знаний и умений
Тема урока «Скорость химических реакций. Факторы, влияющие на скорость химической реакции».
Активная работа учащихся показывает их готовность к восприятию темы урока. Нужны знания учащихся о скорости химической реакции из курса 9 класса (внутрипредметная связь).
Обсудим следующие вопросы (фронтально, слайд 2):
Зачем нужны знания о скорости химических реакций?
Какими примерами можно подтвердить то, что химические реакции протекают с различными скоростями?
Как определяют скорость механического движения? Какова единица измерения этой скорости?
Как определяют скорость химической реакции?
Какие условия необходимо создать, чтобы началась химическая реакция?
Скорости реакций будут математически определяться по-разному.
Учение о скоростях и механизмах химических реакций называется химической кинетикой.
3. Усвоение новых знаний и способов действий
Скорость реакции определяется изменением количества вещества в единицу времени
В единице V (для гомогенной)
На единице поверхности соприкосновения веществ S (для гетерогенной)

Очевидно, что при таком определении величина скорости реакции не зависит от объёма в гомогенной системе и от площади соприкосновения реагентов - в гетерогенной.
Активные действия учащихся с объектом изучения. Занесение таблицы в тетрадь.
Из этого следуют два важных момента :
1) по приведённым формулам можно рассчитать лишь некоторую среднюю скорость данной реакции в выбранном интервале времени (ведь для большинства реакций скорость уменьшается по мере их протекания);
2) рассчитанная величина скорости будет зависеть от того, по какому веществу её определяют, а выбор последнего зависит от удобства и лёгкости измерения его количества.
Например, для реакции 2Н2 +О2 = 2Н2О: υ (по Н2) = 2 υ (по О2) = υ (по Н2О)
4. Закрепление первичных знаний о скорости химической реакции
Для закрепления рассмотренного материала решим расчетную задачу.
Прогнозируемая деятельность учеников
Первичное осмысление полученных знаний о скорости реакции. Правильность решения задачи.
Задача (слайд 5). Химическая реакция протекает в растворе, согласно уравнению: А+В = С. Исходные концентрации: вещества А - 0,80 моль/л, вещества В - 1,00 моль/л. Через 20 минут концентрация вещества А снизилась до 0, 74 моль/л. Определите: а) среднюю скорость реакции за этот промежуток времени;
б) концентрацию вещества В через 20 мин. Решение (приложение 4</<font face="Times New Roman, serif">, слайд 6).
5. Усвоение новых знаний и способов действий .
Рассмотрим факторы, которые влияют на скорость реакции.
1) Природа реагирующих веществ . Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в неорганических и органических веществах.
Величина энергии активации веществ - это фактор, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
2) Температура . Учащиеся знают, что в большинстве случаев при повышении t скорость реакции увеличивается.
Учитель просит объяснить эту закономерность на основе теории столкновений.
Два предположения:
частицы реагирующих веществ начинают интенсивнее двигаться и чаще сталкиваться;
удачных, эффективных соударений становится больше, так как увеличивается доля «активных» частиц (энергия которых достаточна для преодоления энергетического барьера).
Учитель отмечает, что учащиеся рассуждают правильно, но всё-таки большее значение имеет второй фактор, так как расчёты показывают, что при увеличении температуры на каждые 100С общее число столкновений увеличивается только на 1,6 %, а скорость реакции увеличивается в 2-4 раза (на 100-300%)!
Прогнозируемая деятельность учеников
Осмысливают определение и записывают его в тетрадь.
Последнее заключение на основе экспериментальных исследований сделал в прошлом веке голландский физикохимик Я. Вант-Гофф (первый нобелевский лауреат по химии).
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 100С, называют температурным коэффициентом.
Правило Вант-Гоффа математически выражается следующей формулой:
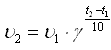 ,
,
где υ2-скорость реакции при температуре t2, υ1- скорость реакции при температуре t1, γ - температурный коэффициент.
Константа скорости реакции, конечно, зависит от температуры, ведь чем больше температура, тем больше скорость реакции при тех же самых концентрациях реагирующих веществ. Закон действующих масс учитывает лишь концентрации газообразных или растворённых веществ и не учитывает концентрации твёрдых веществ (так как они считаются постоянными).
Кроме катализаторов ускоряющих реакции, есть другие вещества противоположного действия. Это ингибиторы, они реагируют с активными частицами с образованием малоактивных соединений, а потому замедляют протекание реакций. И такие вещества тоже нужны, чтобы предотвращать нежелательные процессы.
Приведите примеры гетерогенных реакций:
С(т)+О2(г)=СО2;
Zn(т)+2HCI(ж)à ZnCI2+H2
Вспоминаем формулу для вычисления средней скорости гетерогенной реакции:
![]()
При таком определении величина скорости гетерогенной реакции не зависит от площади этой поверхности, т.е. степени измельчения. Такая формула удобна в научных целях при изучении скорости реакции.
6. Подведение итогов занятия, выставление и комментирование оценок за работу на уроке
7. Домашнее задание.