- Учителю
- Методическая разработка Решение расчётных задач
Методическая разработка Решение расчётных задач
Формирование умения решать расчётные задачи по уравнению реакции в курсе основной школы
Умение решать расчётные задачи является важным показателем усвоения учеником основ химии, способствует развитию логического мышления, требует привлечения знаний математики.
Умение решать расчётные задачи включает в себя следующие элементы
Состав умения:
-
Знание физических величин (масса вещества, объём, плотность, количество вещества, массовая доля) их единиц измерения, переход от одних единиц измерения к другим.
-
Знание расчётных формул и умение их преобразовывать.
-
Умение составлять уравнение химической реакции в соответствии с условием, расставлять коэффициенты, определять продукты реакции на основе химических свойств веществ.
-
Умение составлять план решения задачи.
-
Умение составлять математические уравнения на основе пропорции и решать их.
-
Умение сделать проверку, оценить правильность полученного результата.
Этапы формирования, умения решать расчётные задачи.
Химические формулы.
Относительная атомная и молекулярная массы.
Простые вещества металлы.
Простые вещества неметаллы.
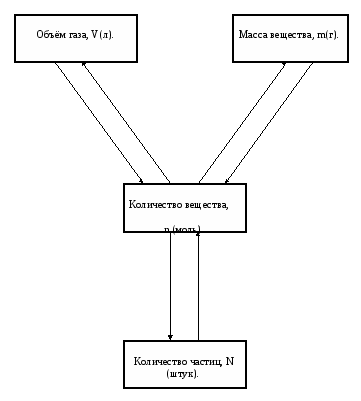
Количество вещества
Молярный объём газов
Решение задач с применением массы, объёма, количества вещества
Новые физические величины Ar и Mr
Новая единица измерения массы - атомная единица массы, связь а.е.м. с граммом, границы применимости а.е.м., связь между относительной и абсолютной атомной массой.
Решение математических задач на сплавы с химическим содержанием.
Решение математических задач на смеси, примеси с химическим содержанием, на нахождение m, V, ρ вещества.
Введение новой физической величины, ее размерность, связь с массой.
Молярная масса вещества, её связь с относительной молекулярной массой. Число Авогадро.
Постоянные и переменные физической величины, характеризующие вещество связь массы, объема, плотности и количества вещества.
Знание и преобразование расчётных формул. Решение задач с помощью пропорций.
Степень окисления.
Чистые вещества и смеси.
Массовая и объёмная доля компонентов смеси (раствора).
Химические реакции.
Расчёты по химическим уравнениям.
Основные классы неорганических веществ.
Умение правильно составлять формулы химических соединений
Обозначение массовой, объёмной доле вещества в смеси или растворе их размерность, связь φ и х для газов.
Преобразование расчётных формул или применение пропорций для решения задач
Умение записывать химические уравнения и расставлять коэффициенты
Преобразование формул.
Составление плана решения задачи.
Отработка алгоритма решения задач.
Знание химических свойств веществ, определение продуктов реакции, условий протекания реакций.
Практические способы и методы формирования умения решать расчётные задачи.
Формирование любой составной части умения решать расчётные задачи предусматривает следующие этапы:
1. "Введение" умения
2. объяснения учителя у доски
3. закрепления умения
4. корректировка умения (анализом типичных ошибок)
5. проверка элементов учения
При этом использую методы парной работы с одним заданием, тренировочные диктанты с самопроверкой или взаимной поверкой, индивидуальную работу по карточкам, тестовые задания, используют демонстрационные таблицы как опорные схемы.
Для отработки математических навыков и умения записывать величины с помощью условных обозначений на начальном этапе изучения химии предлагаю учащимся для решения математические задачи с химическим содержанием.
Задача №1
Масса сплава двух металлов железа и никеля составляет 200 г. Массовая доля железа в сплаве составляет 80%. Определите массу каждого металла в сплаве.
Примерный образец записи условия в тетради ученика:
mсплава = 200 г
Fe+Ni
м ассовая доля
(Fe) = 80%
ассовая доля
(Fe) = 80%
m Fe =?
m Ni =?
Решение:200 г сплава - 100%
X г железа - 80%
200/x = 100/80; X = 200•80/100 = 160
mFe = 160 г
mNi = 200 г - 160 г = 40 г
Ответ: В 200 г сплава содержится 160 г железа и 40 г никеля.
Задача №2
Какой объём займёт кислород массой 64 г, если плотность газа составляет
1, 48 г/л

m (О2) = 64 г V = m/ ρ; V = 64 г/1,48 г/л ≈43,2л
ρ (О2) = 1, 48 г/л
V (O2) -?
Ответ: 64 г О2 займут объём ≈ 43,2л
Задача №3
Вещество массой 48 г занимает объём 22, 4 л. Найти плотность вещества, определить, в каком агрегатном состоянии находится вещество.
Задача №4
Сколько граммов железа и серы нужно взять для приготовления смеси массой 100 г, чтобы массы железа и серы находились в отношении:
а)1:2 б) 2:3 в) 3:4
Задача №5
Сколько г жира содержится в 200 г молока, если % жира в молоке составляет 3, 2%
Задача №6
Чему равна доля кислоты в растворе, образовавшемся при смешивании 20 г уксусной кислоты и 80 г воды?
?
При решении задач на нахождение массы, объёма, количества веществ по расчётным формулам использую опорную схему, позволяющую сразу проследить ход решения, составить план решения, определить количество действий в задаче .
При решении задач на первоначальном этапе можно переписывать элементы схемы.
№ 1
1
m

 (CO2)
= 88 г m V
(CO2)
= 88 г m V
V (CO2) = ?
M (CO2) = 44 г/моль n 1) n (CO2) = m(CO2)/M (CO2)
VM (газа) = 22, 4 л/моль 2) V (CO2) = n (CO2)•VM
№2
V

 (CO2)=44,8 л m V
(CO2)=44,8 л m V
m (CO2) - ?
M (CO2)= 44 г/моль n 1) n = V/VM
VM (газа)= 22, 4 л/моль 2)m = n• M
Для закрепления умения решать расчётные задачи по формулам составляем таблицы, позволяющие последить, какие величины могут изменяться, а какие остаются постоянными. В них хорошо видна прямо пропорциональная зависимость между количеством вещества и массой, объёмом вещества .
При решении задач по теме «Растворы и смеси» также составляем таблицы (Приложение 3). Слабые учащиеся на первоначальном этапе могут пользоваться «треугольником», позволяющим облегчить запоминание формул связи массы вещества, массы раствора и доли вещества в растворе.
Практика показывает, что самым трудным в решении задач по уравнениям оказывается составление пропорции между количествами веществ в реакции. Поэтому этот элемент умения отрабатываем отдельно, решая задачи следующего типа:
1) Сколько молей вещества В вступит в реакцию с веществом А, если
а) nA : nB =1:2
б) nA : nB = 2:3
в) nA : nB = 3:4
2) Хватит ли 10 молей вещества B для реакции с 3 моль вещества А, если отношение количеств веществ А и В в реакции составляет
а) 1:2 б) 2:3 в) 3:2
Решение задач осуществляем 2 способами
-
с помощью пропорций
-
с помощью формул
При решении задач осуществляем проверку решения (устную).
В некоторых классах отрабатываем это умение дополнительно с помощью таблиц.
Заполните таблицу, если известны вещества А и В вступают в реакцию в отношении
а) 1:2 б) 2:3 в) 2:1 г) 3:2
по количеству вещества
а) б)А
В
1моль
3 моль
10 моль
1:2
А
В
1моль
3 моль
10 моль
2:3
в) г)А
В
1моль
3 моль
10 моль
2:1
А
В
1моль
3 моль
10 моль
3:2
После того, как учащиеся осваивают решение задач по формулам и находят количество веществ по уравнению в соответствии с коэффициентами, приступаем к решению расчётных задач по уравнению химических реакций в 3 действиях. Сначала, как правило, подробно рассматривается конкретная задача с подробным анализом, решение записывается с пояснениями к каждому действию, записывается полный ответ, анализируется найденное решение. Затем составляем алгоритм решения задач в 3 действия в общем виде и с опорой на эту схему решаем задачи в парах, затем индивидуально.
На начальном этапе уравнения реакции даём в готовом виде, затем по мере изучения химических свойств веществ, учащиеся составляют его сами. Для задач, предлагаемых в качестве домашнего задания, в классе составляем краткий план решения.
Сильным учащимся, освоившим алгоритм решения задач, на последующих уроках предлагаются задачи с усложнением (прямые задачи на примеси и растворы).
Решение задач по уравнениям с использованием растворов можно предварить опытом.
Навеску металла цинка растворяем в соляной кислоте, массу которой предварительно рассчитываем. После того, как учащиеся видят, что не весь цинк растворился (вступил в реакцию), задаём вопрос, почему. Учащиеся высказывают свои гипотезы. Приходим к заключению, что в растворе содержится вода, поэтому не происходит полное растворении цинка. Делаем вывод, что mр-ра кислоты, необходимого для реакции, всегда > m "чистой" кислоты. Когда записываем массы веществ по условию над веществами в уравнении реакции, ещё раз акцентируем внимание на том, почему над HCL нельзя записывать данную массу раствора кислоты определённой концентрации. При нахождении m кислоты в растворе актуализируем понятие % и доля (20% = 1/5 = 0, 2).
Делаем вывод, если вещество находится в виде раствора или содержит примеси, в I действии нужно находить m чистого вещества, т.к. в большинстве случаев имеется ввиду, что растворитель и примеси не вступают в реакцию.
После отработки прямых задач на растворы и примеси приступаем к решению обратных задач по нахождению mр-ра, ωв-ва в растворе или техническом образце вещества. При анализе условия определяем, к какому из 3 типов принадлежит данная задача, для сильных учащихся можно дополнить схему объёмом раствора и плотностью раствора и усложняющим элементом на нахождение массовой доли веществ в растворе после окончания реакции.
При решении задач уделяю постоянное внимание, особенно не на первых порах правильному и аккуратному оформлению, структурированию решения в виде пронумерованных действий, правильной записи условных обозначений, единиц измерения. Постоянные величины обычно берём из справочной литературы.
В - во, n(моль)
m(г)
M(г/моль)
V(л)
VM(л/моль)
Ρ(плотность)
1моль Н2О
18 г
18 г/моль
18 мл
18 мл/моль
1 г/мл
2моль Н2О
Н2О
9 г
1моль H2SO4
1,84 г/мл
0,5моль H2SO4
CO2
22,4 л CO2
CO2
44,8 л CO2
mр-ра
ωв-ва в растворе
1
20 г
80 г
2
30 г
0,3
3
100 г
400 г
4
10 г
40 г
5
200 г
0,5



 mчасти
mчасти
Массовая доля ω=--------------
mобщая
1). Массовая доля вещества А в смеси двух веществ
mА mВ
ωА=-------------- ωА=-------------- ωА + ωВ = 1 (100%)
mА + mВ mА + mВ
2). Массовая доля вещества в водном растворе
mА mн2о
ωА=----------------- ωН2О=----------------- ωА + ωН2О = 1 (100%)
mА + mн2о mА + mн2о
3). Массовая доля элемента Э в веществе
m(элемента в данной навеске вещества)
ωЭ=-----------------------------------------------------------------
m(вещества)
Так как ωЭ не зависит от выбранной массы вещества, можно взять для расчета массу, равную Mr Mr(H2SO4)=m(H) + m(S) + m(O)=1*2 + 32*1 + 16*4=98;
2 32 64
ω(H)=-----; ω(S)=-----; ω(O)=-----; ω(Э)=1; (100%)
98 98 98
Алгоритм решения задач по уравнению реакции.
1). Нахожу количество вещества в заданной массе вещества А (или в заданном объёме).
mA VA VA
nA=--------- или nA=---------=------------------
MA VM 22,4 л/моль
2). Зная количество вещества А, нахожу количество вещества B
nA a nA * b а - коэффициент перед веществом А
-------=------; nB=------------ b - коэффициент перед веществом B
nB b a
3). Нахожу массу (или объём) вещества B количеством nB моль
mB=nB * MB или VB=nB * 22,4 л/моль
А - вещество с известной массой или объёмом
а - коэффициент перед веществом А в уравнении реакции
МА - молярная масса вещества А (г/моль), рассчитывается по периодической системе или берётся из справочной литературы
B - вещество, массу или объём которого нужно найти по задаче
b - коэффициент перед веществом B в уравнении реакции
MB - молярная масса вещества B
VM - молярный объём вещества, для газов постоянная величина, равная 22,4 л/моль при нормальных условиях
Решение задач на примеси фактически сводится к решению задач на смеси.
Для формирования осознанного умения решать расчетные задачи целесообразно использовать такие приёмы как
-
составление текста задачи по краткому условию и уравнению
-
составление задачи по уравнению реакции
-
составление обратных задач после решения прямых задач
Ответ, найденный в прямой задаче, становится исходным данным для обратной задачи, например
Прямая задача
Д ано: Найти:
ано: Найти:
m (Zn)=6,5г m(р-ра
HCl)=?
(Zn)=6,5г m(р-ра
HCl)=?
ω(HCl в р-ре)=0,2 Ответ: 49г
Обратная задача
Дано: Найти:
m(р-ра HCl)=49г m(Zn)=6,5г
ω(HCl в р-ре)=0,2 Ответ: 6,5г
Решение обратной задачи является проверкой правильности решения прямой задачи.
 Прямая задача
Прямая задача







 mZn
nZn nHCl mHCl mHCl
р-ра
mZn
nZn nHCl mHCl mHCl
р-ра
 Обратная
задача
Обратная
задача
Расчётные задачи по химии учащиеся решают с начала VIII класса и до конца обучения в школе. Решение задач позволяет:
-
расширять кругозор учащихся;
-
развивать умение логически мыслить;
-
воспитывать самостоятельность, внимательность, умение анализировать, делать правильные выводы;
-
устанавливать связь химии с другими науками: физикой, математикой, биологией, экологией и др.;
-
способствует политехнической подготовке учащихся, готовиться к успешной аттестации по предмету (в том числе и в форме ЕГЭ).
Решая задачи, учащиеся более глубоко усваивают учебный материал, учатся применять приобретённые теоретические знания на практике.
Традиционная методика обучения решения химических задач (чаще всего - это решение задач методом составления пропорций) имеет ряд недостатков. В результате лишь немногие учащиеся сознательно и творчески овладевают общим подходом к решению, умеют оценивать свои действия в процессе решения, самостоятельно составлять условия задач, умеют выбирать рациональные способы решения и др.
Представленная методика обучения решения задач от общих приёмов к частным позволяет решить недостатки традиционных способов обучения. В данной работе показываются приёмы решения задач с использованием основных физических величин. Среди них величина n (или ν) - количество вещества - позволяет связать все основные физические величины друг с другом. Это даёт возможность составлять логические схемы решения задач с использованием этих физических величин.
Задача учителя состоит в том, чтобы научить учащихся понимать смысл этих физических величин и применять физические формулы при решении расчётных задач различных типов, научить анализировать условия задач, через составление логической схемы решения конкретной задачи на основе знания общего подхода к решению. Составление логической схемы задачи предотвращает многие ошибки, которые допускают учащиеся.
Ниже приведены основные формулы физических величин и их взаимосвязи, которые учащиеся должны знать в обязательном порядке и использовать их при решении.
В данной работе показываются примеры решения некоторых основных типов задач, по которым можно понять методический подход при обучении учащихся.
Исходные формулы, отображающие взаимосвязь физических величин.
1. Относительная атомная масса (Ar):
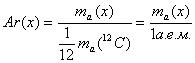 , где x - любой
химический элемент.
, где x - любой
химический элемент.
2. Относительная молекулярная масса (Mr): 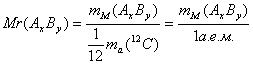 ;
;
![]() .
.
3. Плотность вещества (ρ) позволяет связать собой массу (m) и объем (V) вещества:
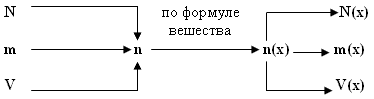
Алгоритм решения базовой задачи.
-
Заданный по условиям параметр переводим в количество вещества (n или ν).
-
По индексам определяем количество вещества искомого химического элемента (n(х) или ν(х)).
-
По формулам, отображающим взаимосвязь величин, рассчитываем неизвестный параметр.
Графическая схема решения базовой задачи.
Примеры задач
Задача 1. Рассчитайте число атомов углерода и кислорода в 11,2 л. (н.у.) углекислого
1.Метод уточняющих вопросов
2. Метод опережающего обучения
3.индивидуализация обучения
4. При хлорировании алкана было получено моно-хлорпроизводное с содержанием хлора 38,4%. Определите молекулярную формулу алкана, напишите уравнение реакции его хлорирования. Сколько изомеров возможно для моно-хлорпроизводного такого состава? Напишите их структурные формулы.
Составной частью ест-научного образования и важным средством развития личности является хим. Образование, которое невозможно без обучения решению задач. Умение решать задачи является одним из важных показателей уровня развития хим мышления, глубины усвоения материала.Все исследователи сходятся во мнении, что для того чтобы научиться решать задачи, надо решать их систематически.Основная фориа деятельности учащихся при это самостоятельная работа, требующая активных действий и понимание сути происходяших хим процессов. Дляформирования умения решать задачи важно постепенное овладевание элементами этого умения.
Умение решать расчётные задачи включает в себя следующие элементы
Состав умения:
Знание физических величин (масса вещества, объём, плотность, количество вещества, массовая доля) их единиц измерения, переход от одних единиц измерения к другим. Из физики и математики учащиеся знают такие ф величины как масса, объем. Плотность, поэтому уже с первых уроков можно формировать этот элемент. Обсуждаются такие вопросы 1) Каким способом можно измерить:
а) массу б) объём в) плотность
2) Верно ли, что плотность вещества не зависит от величины выбранной массы для её расчёта.
3) Плотность вещества = 1,2 г/л. В каком агрегатном состоянии находится вещество?
4) Сплавили два металла одинаковой массы. Чему равна массовая доля каждого металла в сплаве?
10) Металлы подразделяет на тяжёлые и лёгкие. По измерению какой величины осуществляют это деление?
11) В каких единицах измеряется массовая доля вещества в смеси?
12) Может ли массовая доля иметь значения 1, 1/2, 1,3
Далее вводим такую величину как количество вещества.
Знание расчётных формул и умение их преобразовывать. 26) Сколько молекул газов содержится в кубе объёмом 22, 4 л (показ бумажного куба)
27) Какова масса воздуха в этом кубе?
28) Какую массу будет иметь этот куб, если заполнить его а) кислородом
б) водородом
29) Одинаковы ли массы одной молекулы и одного моля вещества, если нет, во сколько раз они разнятся?
30) Какой объём займёт один моль газа при давлении 2 атм.?
31) Какие условия считаются нормальными?
32) Объясните, почему одинаковые количества молекул разных газов при одинаковых условиях занимают одинаковый объём?
33) Сколько атомов кислорода содержится в 22,4 литра кислорода?
34) Пачка соли массой 100 г стоит 3 рубля. Рассчитайте примерную стоимость одного моля поваренной соли.
35) Почему неверна запись М(Н2О)=36 г/моль?
36) В результате опыта Вася получил водород количеством 0,1 моль, а Маша - кислород объёмом 2,24 литра. Какого газа получилось больше
а) по объёму,
б) по массе?
-
37) В одной банке находится 1 литр кислорода, в другой - 1
-
Умение составлять уравнение химической реакции в соответствии с условием, расставлять коэффициенты, определять продукты реакции на основе химических свойств веществ.
-
Умение составлять план решения задачи и определять тип задачи.
-
Умение составлять математические уравнения на основе пропорции и решать их.
-
Умение сделать проверку, оценить правильность полученного результата.
Остановлюсь на умении сост уравнения хим. реакции. Очень часто мы видим, что учащиеся неосознанно составляют уравнение реакций, не представляя за символами сути процессов.Поэтому я использую не только ур-ия хр, но и рисунки, указывающие агрег состояние веществ. Опыт использования таких схем позволяет более наглядно представлять прохождение реакции.
При решении задач различных типов состаляем алгоритм решения или опорную схему . Вывод формулы в-ва по продуктам сгорания-схема . Схемы и опорные алгоритмы позволяют понять, что каждая задача не является абсолютно самостоятельной , она включена в систему задач. Что позволяет обобщать и систематизировать умения и навыки, способствует образованию связей между новой задачей и уже имеющимися знаниями и умениями решать известные задачи, позволяет вычленить в сложных задачах уже знакомые элементы действий, известные по более простым задачам. После того, как учащиеся осваивают решение задач по формулам и находят количество веществ по уравнению в соответствии с коэффициентами, приступаем к решению расчётных задач по уравнению химических реакций в 3 действиях. Сначала, как правило, подробно рассматривается конкретная задача с подробным анализом, решение записывается с пояснениями к каждому действию, записывается полный ответ, анализируется найденное решение. Затем составляем алгоритм решения задач в 3 действия в общем виде и с опорой на эту схему решаем задачи в парах, затем индивидуально.
На начальном этапе уравнения реакции даём в готовом виде, затем по мере
Составление задач.
Прямые и обратные залачи.
Метод уточняющих вопросов-изменение условий
Задача №1Масса сплава двух металлов железа и никеля составляет 200 г. Массовая доля железа в сплаве составляет 80%. Определите массу каждого металла в сплаве.
Примерный образец записи условия в тетради ученика:
mсплава = 200 г
Fe+Ni, массовая
доля (Fe) = 80%
массовая
доля (Fe) = 80%
m Fe =? m Ni =?
Решение:200 г сплава - 100%
X г железа - 80%
200/x = 100/80; X = 200•80/100 = 160
mFe = 160 г mNi = 200 г - 160 г = 40 г
Ответ: В 200 г сплава содержится 160 г железа и 40 г никеля.
Задача №2 Какой объём займёт кислород массой 64 г, если плотность газа составляет1, 48 г/л
m (О2)
= 64 г V = m/ ρ; V = 64 г/1,48 г/л
≈43,2л
(О2)
= 64 г V = m/ ρ; V = 64 г/1,48 г/л
≈43,2л
ρ (О2) = 1, 48 г/л
V (O2) -?
Задача №3Вещество массой 48 г занимает объём 22, 4 л. Найти плотность вещества, определить, в каком агрегатном состоянии находится вещество.
Задача №4Сколько граммов железа и серы нужно взять для приготовления смеси массой 100 г, чтобы массы железа и серы находились в отношении:
а)1:2 б) 2:3 в) 3:4
Задача №5 Сколько г жира содержится в 200 г молока, если % жира в молоке составляет 3, 2%
Задача №6Чему равна доля кислоты в растворе, образовавшемся при смешивании 20 г уксусной кислоты и 80 г воды?
Заполните таблицу, если известны вещества А и В вступают в реакцию в отношении а) 1:2 б) 2:3 в) 2:1 г) 3:2 по количеству вещества
а) б)А
В
1моль
3 моль
10 моль
1:2
А
В
1моль
3 моль
10 моль
2:3
в) г)А
В
1моль
3 моль
10 моль
2:1
А
В
1моль
3 моль
10 моль
3:2
После того, как учащиеся осваивают решение задач по формулам и находят количество веществ по уравнению в соответствии с коэффициентами, приступаем к решению расчётных задач по уравнению химических реакций в 3 действиях. Сначала, как правило, подробно рассматривается конкретная задача с подробным анализом, решение записывается с пояснениями к каждому действию, записывается полный ответ, анализируется найденное решение. Затем составляем алгоритм решения задач в 3 действия в общем виде и с опорой на эту схему решаем задачи в парах, затем индивидуально.
На начальном этапе уравнения реакции даём в готовом виде, затем по мере изучения химических свойств веществ, учащиеся составляют его сами. Для задач, предлагаемых в качестве домашнего задания, в классе составляем краткий план решения.
Сильным учащимся, освоившим алгоритм решения задач, на последующих уроках предлагаются задачи с усложнением (прямые задачи на примеси и растворы).Решение задач по уравнениям с использованием растворов можно предварить опытом.
Навеску металла цинка растворяем в соляной кислоте, массу которой предварительно рассчитываем. После того, как учащиеся видят, что не весь цинк растворился (вступил в реакцию), задаём вопрос, почему. Учащиеся высказывают свои гипотезы. Приходим к заключению, что в растворе содержится вода, поэтому не происходит полное растворении цинка. Делаем вывод, что mр-ра кислоты, необходимого для реакции, всегда > m "чистой" кислоты. Когда записываем массы веществ по условию над веществами в уравнении реакции, ещё раз акцентируем внимание на том, почему над HCL нельзя записывать данную массу раствора кислоты определённой концентрации. При нахождении m кислоты в растворе актуализируем понятие % и доля (20% = 1/5 = 0, 2).
Делаем вывод, если вещество находится в виде раствора или содержит примеси, в I действии нужно находить m чистого вещества, т.к. в большинстве случаев имеется ввиду, что растворитель и примеси не вступают в реакцию.
После отработки прямых задач на растворы и примеси приступаем к решению обратных задач по нахождению mр-ра, ωв-ва в растворе или техническом образце вещества.