- Учителю
- конспект урока по химии на тему 'Кальций и его соединения' (9 класс)
конспект урока по химии на тему 'Кальций и его соединения' (9 класс)
Предмет: химия Дата проведения: 19.01. Учитель: Баишева А.С. Класс: 9А
Тема урока: Электрохимический ряд напряжений металлов, (активность атомов и ионов, роль металлов и их соединений в природной среде и в живых организмах биогены и загрязнители).
Тип урока: урок изучения нового материала
Вид урока: урок-беседа
ТДЦ урока:
обучить: начать формирование знаний, умений и навыков по положению металлов в электрохимическом ряду напряжений металлов; закрепить знания, умения и навыки по определениям особенностей строения атомов металлов и их кристаллов; организовать повторение изученного материала о металлах и их соединениях; обеспечить закрепление и углубление знаний, полученных в теоретическом обучении;
развить: развивать умения умственной деятельности (умение сравнивать, выделять главное, анализировать; аргументировать, делать выводы, нестандартно мыслить ); развивать индивидуальные способности учащихся; обеспечить мотивационную готовность учащихся к работе на уроке; развивать интеллектуальные способности учащихся.
воспитать: воспитывать у учащихся веру в свои силы, стремление к самостоятельной деятельности; способствовать воспитанию у учащихся стремления к саморазвитию, самообучению; прививать учащимся интерес к изучению темы, предмета; способствовать развитию умения и желания учиться, приобретать необходимые умения и навыки учебной деятельности.
Оборудование: компьютер, интерактивная доска, проектор, презентация по теме.
Литература: химия: учебник для 9 кл.общеобразоват.школы/Нурахметов Н.Н.; сборник задач и упражнений по химии (с дидактическим материалом): учебное пособие для студ.сред.проф.учеб.заведений/Ю.М.Ерохин,В.И.Фролов-2-е изд.
Методы обучения:
1.Методы организации научно-познавательной деятельности:
-
Словесные: рассказ, лекция, беседа и т.д.
-
Наглядные: демонстрация, иллюстрация.
-
Практические упражнения: лабораторные опыты, трудовые действия.
-
Проблемно-поисковые.
-
Репродуктивные.
-
Методы самостоятельной учебной работы школьников.
2.Методы стимулирования учебно-познавательной деятельности:
-
Методы познавательной игры.
-
Учебных дискуссий.
-
Создания ситуаций успеха в учёбе.
-
Предъявление учебных требований.
-
3.Методы поощрения
-
Методы контроля за эффективностью учебно-познавательной деятельности:
-
Методы устного, письменного, лабораторного контроля.
-
Индивидуального, фронтального, тематического контроля. Поурочного контроля.
-
Формы организации познавательной деятельности учащихся: фронтальная, групповая, ролевая игра, индивидуальная, парная.
Дидактический материал: раздаточный материал, видеотека, игротека, таблицы, тесты, карточки
Этап урока
Содержание учебного материала
Примечание
1.Организационный момент
Приветствие. Подготовка учащихся к восприятию новых знаний, сообщение темы и целей урока.
2-3 мин.
2.Повторение пройденного материала.
Краткое повторение пройденного материала, а именно положение металлов в периодической системе химических элементов, (особенности строения их атомов и кристаллов, металлическая связь, металлическая кристаллическая решетка, сравнительная характеристика строения атомов металлов (I-III периодов).
Фронтальный опрос
1. Где расположены металлы в ПСХЭ? Каково строение их атомов? К каким семействам относятся эти металлы (примеры)?
2. Какими общими физическими свойствами обладают металлы? В чем причина общности химических свойств?
3. По каким физическим свойства металлы отличаются друг от друга? В чем причина? Как классифицируются металлы?
Ответы на вопросы учащиеся формулируют, опираясь на записи в тетрадях и текст учебника § 18.
По окончании фронтального опроса необходимо разобрать ответы на вопросы 1, 2 § 18.
Щелочные и щелочноземельные металлы расположены в I и II группах главных подгруппах. Это s-элементы. Валентные электроны расположены на внешнем энергетическом уровне, s-подуровне. У щелочных металлов ns1 - один s-электрон, поэтому С.О. +1; у щелочноземельных металлов ns2 - два s-электрона, С.О. +2.
У металлов побочных подгрупп заполняется d-подуровень, предвнешнего энергетического уровня. Валентные электроны расположены на s-подуровне внешнего энергетического уровня и d-подуровня предвнешнего энергетического уровня. С.О. они проявляют в зависимости от того, какие электроны участвуют в образовании соединения. Если участвуют s-электроны, то С.О. будет минимальной. Если участвуют s- и d- электроны, то С.О. может быть и максимальной, равной номеру группы элемента, и промежуточной.
5 мин
3.Изложение нового материала по плану.
План изложения нового материала.
1.Металлы-восстановители. Восстановительная способность металлов на основании их положения в ПСХЭ.
2. Электрохимический ряд напряжений металлов.
3. Общие химические свойства металлов:
а) взаимодействие с простыми веществами - неметаллами, металлами;
б) взаимодействие металлов со сложными веществами: водой, кислотами, оксидами и солями, органическими соединениями.
Главная задача изучении данного вопроса на уроке - обобщить основные сведения теории о химической активности металлов на основании строения их томов. В атомах металлов на внешнем энергетическом уровне малое количество электронов и очень большой атомный радиус, что способствует быстрой отдаче электронов атомами металлов в результате их взаимодействия с другими соединениями.
![]()
Металлы окисляются, сами выступают восстановителями. Химическую активность металлов можно оценить на основании их Положения в ПСХЭ.
В периодах - с увеличением заряда ядра атома она ослабевает; в группах, главных подгруппах с возрастанием заряда ядра она усиливается, т. к. чем больше атомный радиус и меньше электронов на внешнем энергетическом уровне, тем меньше требуется энергии на их отрыв.
Однако чаше реакции протекают в водных растворах. Химическая активность металлов тогда будет определяться на основании их положения в электрохимическом ряду напряжений металлов. В этом ряду металлы расположены с учетом затрат энергии на «игры» валентных электронов и разрушение кристаллической решетки, а также с учетом энергии, выделяющейся при гидратации иона металла.
Таким образом, чем меньше энергии затратится на отрыв и разрыв кристаллической решетки и выделится больше энергии при гидратации ионов металлов, тем сильнее восстановительная способность металла в реакциях, происходящих в водных растворах, тем левее он располагается в ряду напряжений металлов.
Следует отметить следующее: высокая электрохимическая активность металла не всегда означает его химическую активность (и наоборот). Обратите внимание на расположение Li и Na в ПСХЭ и в электрохимическом ряду напряжений металлов.
На основании их расположения в ПСХЭ Na активнее Li (учитывается только один фактор - атомный радиус Ar(Na) > Ar(Li)). На основании положения в электрохимическом ряду напряжений металлов Li стоит левее Na, его восстановительная способность выше, т. к. в этом случае учитывается не только атомный радиус металлов, но и энергия отрыва электронов, энергия разрушения кристалла и энергия гидратации ионов металлов. В целом три фактора.
Работая с электрохимическим рядом напряжений металлов, следует помнить:
- металлы расположены в порядке убывания восстановительных свойств при реакциях в растворах (t° = 25 °С, Р = 1 атм);
- металл, стоящий левее, вытесняет правее стоящий металл из растворов их солей;
- металл, стоящий в ряду напряжений до водорода, вытесняет его из разбавленных кислот (кроме HNO3(разб. ), HNО3(конц.) и H2SО4(конц.));
- металлы, стоящие в ряду напряжений до Al, взаимодействуют с водой с образованием щелочей и выделением водорода. Остальные металлы взаимодействуют в жестких условиях с образованием оксида металла и водорода;
- металлы, стоящие в ряду напряжений за водородом, не взаимодействуют с водой;
- на основании восстановительной способности металлов в ряду напряжений металлы условно можно разделить на три группы по активности:
от Li до Аl - очень активные металлы;
от Аl до Н2 - металлы средней активности;
от Н2 до Au - малоактивные металлы.
Зная такое условное деление металлов по их химической активности, возможно правильное объяснение их химических свойств по отношению к простым и сложным веществам.
1. Взаимодействие металлов с простыми веществами - неметаллами и металлами:
а) взаимодействие с кислородом:
![]()
![]()
Образуются пероксиды и оксиды.
б) взаимодействие с серой.
![]() - сульфид цинка
- сульфид цинка
Образуются сульфиды.
в) взаимодействие с галогенами:
![]()
Mg + Cl2 = MgCl2 без нагревания.
Галогениды: фториды, хлориды, бромиды, иодиды.
г) взаимодействие с водородом - только активные металлы:
2Na + Н2 = 2NaOH - гидрид натрия;
д) взаимодействие с азотом:
6Li + N2 = 2Li3N - без нагревания.
Остальные металлы реагируют с азотом при нагревании; образуются нитриды.
е) взаимодействие с металлом, получение интерметаллического соединения: Cu3Au, LaNi5.
2. Взаимодействие со сложными веществами:
а) взаимодействие с водой.
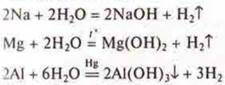 - удаление оксидной пленки под слоем ртути,
- удаление оксидной пленки под слоем ртути,
Чем активнее металл, тем скорость реакции выше.
б) взаимодействие металлов с растворами неорганических и органических кислот.
Эксперимент: взаимодействие металлов Mg, Zn, Fe, Сu с растворами:
а) соляной кислоты:
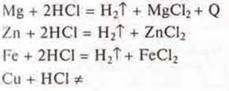
б) уксусной кислоты:
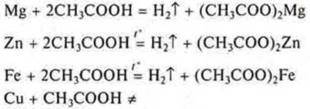
На основании положения металлов Mg, Zn, Fe в электрохимическом ряду напряжений металлов убеждаемся экспериментально в том, что они вытесняют водород из растворов кислот. Они расположены до водорода. Сu - не вытесняет водород из растворов кислот, т. к. расположен в электрохимическом ряду напряжений за водородом.
в) взаимодействие металлов с растворами солей.
Задание: На основании положения металлов в электрохимическом ряду напряжений обоснуйте возможность протекания следующих химических реакций:
а) Zn и CuSO4; Сu и ZnSO4;
б) Fe и CuSO4; Сu и FeSO4.
Ответ: a) Zn активнее Сu, т. к. расположен в ряду напряжений левее Сu; Zn способен вытеснить Сu из раствора ее соли.
![]()
б) Fe активнее Сu, так как расположен в ряду напряжений левее Сu; Fe способен вытеснить Сu из раствора ее соли.
![]()
При взаимодействии активных металлов (до Al) с растворами солей не происходит вытеснения менее активного металла, т. к. активный металл будет вытеснять водород из воды.
в) взаимодействие металлов с органическими веществами:
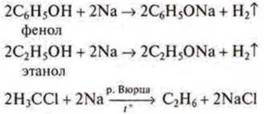
г) взаимодействие переходных металлов с растворами щелочей.
![]()
20 мин
4.Самостоятельное усвоение новых знаний
- работа с учебником: §30 читать, выделить главное, с.142 таблица 8 схематично зарисовать.
5.Закрепление нового материала:
- повторение учителем наиболее трудных, важных вопросов;
- повторение учащимися основных положений темы;
- ответы на вопросы;
- выполнение упражнений устных и письменных.
Вывод: Знание особенностей положения металлов в ПСХЭ Д. И. Менделеева, в электрохимическом ряду напряжений даст возможность характеризовать общие химические свойства металлов: отношение их к простым и сложным веществам.
5 мин
6.Домашнее задание:
- выделение основного в домашнем задании;
- изучение материала по новой теме;
- выполнение упражнений по новой теме.
§30-31 конспект, с.143 № 4.
2-3 мин