- Учителю
- Урок-конспект по химии «Галогены- солероды», 9 класс
Урок-конспект по химии «Галогены- солероды», 9 класс
Разработка урока по теме: «Галогены- солероды»
9-й класс
Алдабергенова Л.А.
учитель химии
Средняя Школа № 26,
город Актобе
Цели урока:
Образовательные:
-
создать условия для формирования знаний о галогенах, обобщенного умения давать характеристику элементов по их положению в Периодической системе и строению атома;
-
повторить, обобщить и закрепить, конкретизировать на материале химии галогенов такие важнейшие химические понятия, как химическая связь, кристаллические решетки, окисление и восстановление, скорость химической реакции.
Развивающие:
-
способствовать дальнейшему развитию логического мышления учащихся - формировать умение сравнивать, обобщать, продолжить развитие навыков самообразования;
-
подтвердить на примере изучения данной темы причинно-следственные связи: состав - строение - свойства.
Воспитательные:
-
создать условия для воспитания навыков сотрудничества, умения слушать.
Оборудование и реактивы:
-
Образцы галогенов - простых веществ: бром и йод.
-
Изделия с содержанием галогенов: фторсодержащие зубные пасты, бромсодержащие лекарства, йодная настойка, поваренная соль.
-
Оборудование к опыту - возгонка йода.
К уроку прилагается презентация
Этапы урока:
1. Активизация учащихся к учебной деятельности
- Мы продолжаем изучение большой и важной темы «Неметаллы». Сегодняшний урок будет посвящен изучению самых активных неметаллов. Попробуйте определить, о каком химическом элементе идет речь.
Угадай элемент:
-
Данное вещество впервые было получено шведским химиком К. Шееле в 1774 г.
-
Во время первой мировой войны это вещество применяли в качестве боевого отравляющего средства. При содержании этого вещества в воздухе количеством 0,9 мл/л смерть наступает в течении пяти минут.
-
Его слабый запах можно ощущать в водопроводной воде (им обеззараживают воду) и при применении отбеливателя. (Хлор)
Угадай элемент:
-
В 1811г. Б.Куртуа, сыном известного селитровара, из золы морских водорослей было получено это вещество.
-
Молекулы этого вещества обладают уникальной способностью проникать в организм даже через неповрежденную кожу. Поэтому спиртовую настойку этого вещества применяют для лечения внутрикожных воспалений.
-
Каждый пользовался спиртовой настойкой этого вещества как кровоостанавливающим и обеззараживающим средством. (Йод)
Угадай элемент:
-
Открытие данного вещества произошло в 1826г. Антуаном Баларом, двадцатичетырехлетним лаборантом химии.
-
Пары этого вещества очень ядовиты.
-
Его соединения применяют в фотографии в качестве светочувствительного вещества.
-
Многие соединения обладают успокоительным действием. (Бром)
Угадай элемент:
-
В свободном состоянии это очень ядовитый газ. Некоторые ученые, когда получали и изучали его свойства, поплатились своим здоровьем.
-
В 1886 году А. Муассан (Нобелевская премия) впервые получил это вещество в свободном состоянии
-
Этот химический элемент входит в состав костной ткани и зубной эмали.
-
Его соединения добавляют в зубную пасту. (Фтор)
Угадай элемент:
-
Возможность существования этого химического элемента было предсказано Менделеевым, давшим ему имя «экайод».
-
Элемент оказался неуловимым. В 30-40-е годы 20-го столетия появилось несколько сообщений об открытии этого элемента, но каждый раз открытия оказывались ложными. Поэтому одно название элемента сменялось другим.
-
То это был «дакин» - от названия древней страны даков, то «алабамий» - по имени штата Алабама в США; то «гельвеций» - в честь старинного имени Швейцарии; то «лептин» - в переводе с греческого - слабый.
-
Открыт этот элемент только в 1940 г. итальянским физиком Э.-Д. Сегре. Свое название элемент получил позднее, в 1947 г. В переводе с греческого означает «неустойчивый».
-
Самый долгоживущий изотоп имеет период полураспада всего 8,3 ч. (Астат)
- К какому семейству соединений относятся эти вещества? (Галогены.)
- Тема урока: Галогены.
- В одно время галогены называли солеродами. Почему такое название дано этим веществам? Как это название соотносится с названием поваренной соли? (Рождают соли при взаимодействии с металлами.)
В 1811 г. И.К.Швейгер предложил химикам называть эти элементы галогенами («галос» - соль, «генес» - рождаю).
- Как вы думаете с чего необходимо начинать изучение любых химических элементов? (Положения в Периодической системе, строения атома, изменения свойств по группам и периодам, физических и химических свойств.)
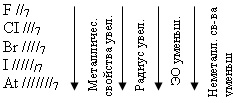
Цели нашего урока:
-
дать характеристику семейства галогенов по их положению в Периодической системе и строению атомов;
-
изучить состав и строение молекул, физические и химические свойства галогенов в свете ОВР.
2. Изучение нового материала
1. Характеристика химического элемента.
1.Положение в периодической системе Д.И.Менделеева.
2. Строение (схема электронного строения).
3. Свойства
-
Атомный радиус
-
Окислительно-восстановительная способность
-
Возможные степени окисления
У доски составить электронные формулы хлора и фтора.
- Что общего в строении всех атомов галогенов?
- Чем отличаются атомы галогенов по строению?
- Почему возрастает атомный радиус в группе?
- Какие возможные степени окисления могут быть у галогенов?
- Почему фтор является самым электроотрицательным элементом?
HClO - хлорноватистая кислота
H ClO2- хлористая кислота
HClO3- хлорноватая кислота
HClO4- хлорная кислота
2. Галогены - простые вещества
- Какова этимология (происхождение) названий галогенов? (В названии использованы свойства веществ).
1. Строение молекулы. Записать формулы галогенов.
2. Вид химической связи. Какой вид химической связи в молекулах галогенов? Составить схему образования химической связи.
3. Тип кристаллической решетки
- Зависят ли свойства вещества от типа кристаллической решетки?
- Какими свойствами должны обладать вещества с молекулярной кристаллической решеткой?
- Для йода характерно такое физическое явление как возгонка, т.е.переход вещества из твердого состояния в газообразное, минуя жидкую фазу. При возгонке в нагреваемой части прибора кристаллическое вещество испаряется, а в охлажденной снова конденсируется. (Опыт)
4. Физические свойства галогенов (работа с таблицей учебника)
- Какую закономерность вы выявили при изменении агрегатного состояния и цвета веществ?
- Какова закономерность при изменении температур плавления и кипения?
5. Химические свойства
А) Взаимодействие галогенов с металлами (с хлором, медью, сурьмой).
Демонстрация видеофрагментов. Записать уравнение реакции, составить окислительно-восстановительный процесс.
Вывод: галогены окислители в реакции с металлами.
Б) Взаимодействие с водородом
H2 + F2 = 2HF + Q (со взрывом)
H2 + Cl2 = 2HCl + Q (на свету)
H2 + Br2 = 2HBr + Q
H2 + I2 = 2HI - Q
- Что можно сказать о скорости химических реакций? Какой фактор химической реакции оказывает влияние на скорость?
В) Наиболее активные галогены вытесняют из растворов солей менее активные галогены.
(Демонстрация видеофрагментов)
Окислительная способность галогенов снижается в ряду Cl2 - Br2 - I2
Наиболее активные галогены вытесняют из растворов солей менее активные галогены.
- Почему для фтора эта реакция нехарактерна?
Фтор взаимодействует с водой, вытесняя из нее кислород.
2F2 + 2H2O = 4HF + O2
- А йод способен вытеснить другие галогены?
3. Рефлексия
- А теперь вернемся к целям нашего урока? Достигли ли мы их?
- А что вы еще хотели бы узнать о галогенах?
4. Домашнее задание по учебнику Индивидуально - подготовить сообщение об истории открытия, биологической роли и областях применения галогенов