- Учителю
- Типы химических реакций: реакции замещения
Типы химических реакций: реакции замещения
МБОУ СОШ УИОП г .Зерноград
Тема урока
«Типы химических реакций.
Реакции замещения»
Класс 8
Предмет химия
Учитель Гданская А.В.
2015
Предмет: химия
Класс: 8
Раздел: «Изменения, происходящие с веществами»
Учебник химии, 8 класс, Габриелян О.С., изд. Дрофа, 2015г
Цель урока: на основе имеющихся у обучающихся знаний об условиях, признаках протекания химических реакций обеспечить усвоение обучающимися понятия классификации химических реакций по числу и составу реагирующих веществ, деление их на типы, дать первоначальное понятие об электрохимическом ряде напряжений металлов
Задачи урока:
Образовательные: обучающиеся должны повторить знания о химических реакциях, правилах их составления, законе сохранения массы веществ, изучить классификацию химических реакций, научиться определять их тип; продолжить формирование умений записывать уравнения.
Развивающие: обучающиеся должны продолжить работу по развитию интеллектуальных и мыслительных умений (умение анализировать, сравнивать и обобщать); развивать познавательный интерес при выполнении лабораторных опытов.
Воспитательные: обучающиеся должны продолжить воспитывать культуру общения через работу в группах «ученик-ученик», «ученик-учитель» (умение слушать и слышать другого человека); воспитывать такие личностные качества, как внимание, наблюдательность, инициатива; проводить рефлексию собственной деятельности.
Тип урока: урок открытия нового знания и закрепление ранее полученных знаний.
Форма урока: химическая лаборатория.
Методы обучения: интерактивный; проблемный.
Форма обучения: объяснение; показ Д/Э; просмотр видеофрагмента;
Формы работы с учащимися: фронтальная; групповая, беседа, видеоэксперимент, лабораторные опыт
Технологии обучения: критического мышления, ИКТ
Тема урока «Реакции замещения»
Оборудование: схема-кластер, видеоматериалы с демонстрационными опытами, презентация, компьютер, мультимедийный поектор, электронные образовательные ресурсы, размещенные в федеральных коллекциях ФЦИОР ФЦИОР www.fcior.edu.ru и ЕК ЦОР school-collection.edu.ru</<font face="Times New Roman, serif">; набор реактивов на столе учителя (гранулы цинка, раствор медного купороса, соляной кислоты)
Ход урока
-
Организационный момент. Релаксация (слайд 1)
-
Выполнение самостоятельной работы (использование презентации
слайды 3-9)
-
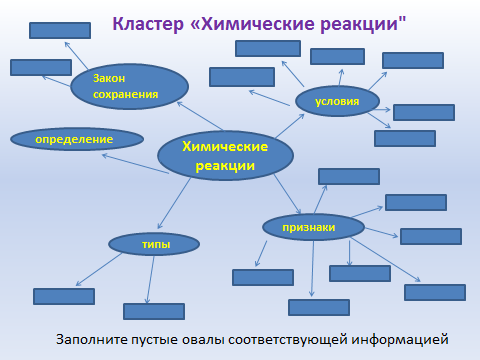
Работа с кластерами
-
Физминутка (слайд 10)
-
Изучение нового материала
Представьте, мы находимся в научно-исследовательском институте на кафедре неорганической химии. Предположите, чем занимаются в лаборатории?
Основное действие, которое происходит в лаборатории можно выразить загадкой: «Она идет, она прошла! Никто не скажет, что пришла!» Отгадывают загадку (химическая реакция).
Самое интересное в окружающем нас мире - это то, что он очень сложно устроен, и к тому же постоянно меняется. Каждую секунду в нём происходит неисчислимое множество химических реакций, в результате которых одни вещества превращаются в другие. Мы с вами сделали вдох - и в организме начались реакции окисления органических веществ. Сделали выдох - и в воздух попал углекислый газ, который поглотился растениями и в них превратился в углеводы. Некоторые реакции мы можем наблюдать непосредственно - ржавление железных предметов, свёртывание крови, сгорание автомобильного топлива. Однако большинство химических реакций остаются невидимыми, но именно они определяют свойства окружающего мира. Чтобы управлять превращениями веществ, необходимо как следует разобраться в природе подобных реакций. Для этого и нужна химия. За то недолгое время, пока мы с вами изучаем химию, мы узнали о там, что существуют молекулы и атомы, химические реакции и физические явления, научились их различать, решать несложные задачи.
Химических реакций много
И каждая в отдельности важна, поверьте мне.
Реакции мы делим на типы очень строго
Какие это типы? Поведаю я вам»
Формулируют тему и цель урока.
Слайд 11
Виртуальная лаборатория (8, 9 кл опыты)
Объяснение ряда напряжений Ме
Правило 1: если металл стоит в ряду напряжений металлов до металла соли, то он способен вытеснять этот металл из раствора соли (опыт 1 СВОЙСТВА СОЛЕЙ ВЗАИМОДЕЙСТВИЕ РАСТВОРОВ СОЛЕЙ С МЕАЛЛАМИ 8 кл виртуальная лаборатория)
Правило 2: если металл стоит в ряду напряжений до водорода, он способен вытеснять водород из растворов кислот, если после - нет. (опыт ВЗАИМОДЕЙСТВИЕ ЩЕЛОЧНЫХ И ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ С ВОДОЙ 9 кл. виртуальная лаборатория)
Закрепление материала Работа в кл. РТ стр.150 №2
Подведение итогов урока
Выставление и комментарий оценок.
ДЗ РТ С.150 1,3-6