- Учителю
- Сборник лекций по общей химии для студентов профессионального образования (базовый уровень)
Сборник лекций по общей химии для студентов профессионального образования (базовый уровень)
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
ДОНЕЦКОЙ НАРОДНОЙ РЕСПУБЛИКИ
Государственное профессиональное образовательное учреждение
«Донецкий техникум промышленной автоматики»
Комплект лекций
к проведению занятий
по учебной дисциплине БД 09 "Химия "
Для студентов дневной формы обучения I курса всех специальностей
 естественно-научных
дисциплин и БЖД
естественно-научных
дисциплин и БЖД
Составила
и рекомендовано к утверждению
Преподаватель химии
Протокол №1 от «02» 09.2015 г.
специалист высшей категории
Председатель цикловой комиссии ___ О.М.Пугачёва
Поплавская Е.Ф
2015 р.
Лекция № 1.
Основные сведения о строении атома. Ядро. Электроны. Электронная оболочка. Энергетический уровень. Периодический закон Д. И. Менделеева в свете учения о строении атома. Периодическая система химических элементов Д. И. Менделеева - графическое отображение периодического закона. Физический смысл порядкового номера элемента, номера периода и номера группы. Значение периодического закона и периодической системы химических элементов Д. И. Менделева.
Основные понятия: порядковый номер химического элемента, период, группы, относительная атомная масса, орбиталь (S, P, D, F), энергетический уровень, химический элемент.
План изучения темы
(перечень вопросов, обязательных к изучению):
-
Периодический закон Д. И. Менделеева в свете учения о строении атома. Периодическая таблица химических элементов - графическое отображение Периодического закона.
-
Структура периодической таблицы: периоды (малые и большие), группы (главная и побочная).
-
Основные сведения о строении атома. Атом сложная частица. Ядро (протоны и нейтроны) и электронная оболочка.
-
Строение электронных оболочек атомов элементов малых периодов. Особенности строения электронных оболочек атомов элементов больших периодов (переходных элементов).
-
Понятие об орбиталях. S-, p-, d- орбитали. 8. Электронные конфигурации атомов химических элементов.
Содержание лекции:
Периодический закон Д. И. Менделеева в свете учения о строении атома.
Химия относиться к числу естественных наук. Эта наука о веществах, их свойствах, составе, строение и процессах превращения веществ. Вещество -это то, из чего состоят физические тела. Веществ очень много, поэтому их классифицируют на простые и сложные, а также смеси, которые состоят из атомов. Определенный вид атомов называют химическим элементом- это совокупность атомов с одинаковым зарядом ядра.
Периодический закон, открытый в 1869 г. Дмитрием Ивановичем Менделеевым, стал одним из основных среди общих законов природы. За основу своей классификации Д.И. Менделеев взял атомный вес элемента и расположил все известные химические элементы (63) в порядке возрастания их атомных весов и обнаружил закономерность периодичности свойств элементов.
Это дало возможность ученому так сформулировать периодический закон. Свойства простых веществ, а также свойства соединений химических элементов находятся в периодической зависимости от величины атомных весов.
По сравнению с другими законами особенностью периодического закона является отсутствие количественного выражения, то есть формулы или уравнения, которые его отражают. Зато этот закон, единственный среди других законов, имеет графическое выражение в виде периодической системы химических элементов.
Периодическая система Д.И. Менделеева - это наглядное графическое изображение периодического закона.
Периодическая система химических элементов Д. И. Менделеева - так называют упорядоченную множество химических элементов и их классификацию. В краткой форме этой системы четко прослеживается расположение химических элементов в восьми вертикальных столбиках - группах, каждый из которых имеет свой номер и делится на главную и побочную подгруппы, и в семи горизонтальных рядах - периодах, первые три из которых получили название маленькие, а остальные - большие.
Группа - это вертикальный столбик химических элементов, сходных по свойствам образуемых ими соединений.
Период - это горизонтальный ряд химических элементов, расположенных в порядке возрастания их атомных масс, начинающийся щелочным металлическим элементом, а заканчивается инертным элементом.
В таблице 119 хим. элементов, которые располагаются по периодам, рядам, группам и подгруппам.
Место каждого химического элемента в периодической системе четко определено (исключение составляет Водород, его располагают и в первой, и в седьмой группах), за каждым элементом закреплен его порядковый номер.
Основные сведения о строении атома.
Атомы состоят из ядра и электронной оболочки. В ядре находятся протоны и нейтроны.
Согласно теории Бора, атом элемента состоит из электронов, протонов и нейтронов. Электрон (ē)- элементарная частица, с зарядом -1 и массой 1/1840 у.е. Протон (Р) входит в состав ядра атома элемента, имеет заряд +1 и массу 1 у.е.
Число протонов соответствует порядковому номеру элемента и всегда равно числу электронов в атоме. Нейтрон (n) элементарная частица, входит в состав ядра атома элемента, имеет массу 1 у.е. и не имеет заряда. Чтобы найти число нейтронов в атоме, нужно от массы атома вычесть порядковый номер элемента. Например: найти число электронов, протонов и нейтронов у элемента с порядковым номером 15. Находим в таблице элемент под номеров 15- это фосфор. Его символ Р, т.к. число протонов и электронов равны, то пишем Р=15, ē=15, а нейтроны находим вычитанием из массы атомов -31 за минусом 15, получаем 16 нейтронов.
Открытие физиками вначале ХХ в. сложного строения атома подтвердило гениальность Д. И. Менделеева как создателя периодического закона. Оказалось, что все без исключения химические элементы расположены в периодической системе за ростом заряда ядер их атомов. А периодическое изменение свойств элементов и их соединений связана с особенностями строения атомов химических элементов в пределах одной группы и одного периода. Это дало основания для современной формулировки периодического закона.
Свойства химических элементов, а также
образуемых ими соединений находятся в периодической зависимости от
величины зарядов ядер их атомов.
Известно, что:
• порядковый номер химического элемента указывает на величину заряда ядра атома, количество протонов в ядре - число электронов в электронной оболочке атома;
• количество нейтронов в ядре атома равна разности между относительной атомной массой химического элемента и его порядковым номером;
• номер периода совпадает с количеством энергетических уровней (электронных слоев) в электронной оболочке атома;
• химические элементы одной подгруппы имеют одинаковую электронную формулу внешнего энергетического уровня (электронного слоя);
• у элементов главных подгрупп число электронов на внешнем энергетическом уровне совпадает с номером группы;
• высшая валентность атомов химического элемента в оксидах равна номеру группы (существуют исключения);
• количество неспаренных электронов в атомах неметаллических элементов V-VII групп можно определить действием вычитания: 8 - номер группы.
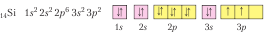
Электронная формула атома - это запись распределения электронов в атоме, в котором числами обозначают энергетические уровни (1, 2 ...), буквами - подуровня (s, p, d, f), а верхними индексами - количество электронов по подуровням. Например: 14Si 1s2 2s2 2p6 3s 23p2.
На основе теории Бора была установлена тесная взаимосвязь с периодической системой, из которой следует, что порядковый номер элемента указывает на общее число электронов, которые располагаются по энергетическим уровням или слоям. Число электронов на уровне можно рассчитать по формуле. N=2 , где n- номер уровня. На первом уровне 2ē, На втором 8ē, на третьем 18ē, На четвертом 32ē, на пятом уровне 50ē. Уровни подразделяются на подуровни: S,P,d,f, которые составлены из орбиталей. S подуровень составлен из одной 1Sорбитали, содержащий 2ē. P подуровень составлен из 3Pорбиталей, содержащих 6ē. d подуровень составлен из 5dорбиталей, содержащих 10ē. f подуровень составлен из 7fорбиталей, содержащих 14ē.
Чтобы составить электронную формулу любого хим. элемента, нужно помнить: 1 уровень может содержать максимально 2ē 1 2 уровень содержит 8ē 3 уровень содержит 18ē , , . 4 уровень содержит 32ē , , и т.д.. При составлении электронной формулы нужно знать положение хим.элементов в таблице, каков его заряд ядра (порядковый номер элемента), в каком периоде он находится (число энергетических уровней), и в главной или побочной подгруппе стоит данный элемент, потому что номер главной подгруппы показывает число электронов внешнего уровня. Если элемент находится в побочной подгруппе, то он будет содержать в основном 2 электрона, но есть исключения, у которых на последнем слое по одном электрону. Cu, Ag, Au, Nb, Mo, Cr, Ru, Rh, Pt.
Графические электронные формулы дополняют
информацию о строении электронной оболочки атома сведениями о
количестве энергетических ячеек (каждую ячейку обозначают
квадратиком) и заполнения их электронами. Два спаренные электроны
одной ячейки обозначают двумя противоположно направленными
стрелками, неспаренный электрон - одной.
Графическая электронная формула - это отображение распределения
электронов в электронной оболочке атома с помощью энергетических
ячеек и стрелок.
Современная формулировка закона доказывает прозорливость Д.И. Менделеева, т.к. до настоящего времени ею пользуются, не смотря на то что она все время пополняется новыми хим. элементами.
Контроль знаний:
1.Дайте определение понятия «химический эквивалент».
Почему атомная масса элемента - величина, в среднем, постоянная, а мольная масса эквивалента - переменная?
2. Почему атомная масса элемента - величина, в среднем, постоянная, а мольная масса эквивалента - переменная?
3. Сформулируйте Закон сохранения массы.
4. Радиус которого атома больше: Бора или
кислорода, углерода или Силицию? Почему? Объясните.
5. Какой объем при нормальных условиях занимает один
грамм-эквивалент водорода? Кислорода?
6. Какой из оксидов более кислотный: серы (VI) оксид или хлор (VII) оксид, азота (в) оксид или бор оксид? Почему? Объясните.
7. Какой из оксидов более основной натрий оксид или магний оксид, бор оксид или алюминий оксид? Почему? Объясните.
8. Определите, атом какого элемента имеет электронную формулу 1 s22s22pe3s23p1
Домашнее задание:
Проработать: Л2.стр 4-6, Л2.стр.10-15.16, пересказ конспекта лекции №1. Повторить периодический закон, материал о строении атома, химической связи. Составить электронные формулы элементов с порядковыми номерами:12,18,24,28,29,31,35.
Лекция № 2.
Тема: Ионная химическая связь. Классификация ионов. Ионные кристаллические решетки. Ковалентная химическая связь. Электроотрицательность. Полярная и неполярная ковалентные связи. Диполь. Полярность связи и полярность молекулы.
Молекулярные и атомные кристаллические решетки. Свойства веществ с этими типами кристаллических решеток.
Металлическая химическая связь. Особенности строения атомов металлов. Металлическая химическая связь и металлическая кристаллическая решетка. Свойства веществ с этим типом связи.
Водородная химическая связь. Межмолекулярная и внутримолекулярная водородная связь. Значение водородной связи для организации структур биополимеров.
Оборудование: таблица к занятию, наборы трафаретов моделей атомов.
План изучения темы
(перечень вопросов, обязательных к изучению):
1. Виды химической связи.
2.Электроотрицательность. Полярная и неполярная ковалентные связи. Диполь. Полярность связи и полярность молекулы.
3.Водородная химическая связь.
4. Кристаллические решетки.
Содержание лекции:
-
Виды химической связи.
Основой теории химической связи является
положение о том, что образование химических связей сопровождается
достижением атомами завершенной строения внешнего энергетического
уровня.
Внешний энергетический уровень считается завершенным, если он
содержит 8 электронов (для Водорода и Гелия - 2). При образовании
химических связей ядра атомов не изменяются; изменения происходят
только в электронных оболочках.
Химической связью называют взаимодействие между атомами, что приводит к образованию молекул и кристаллов.
У Кислорода на внешнем энергетическом уровне 6 электронов, то есть он близок к завершенному для него восьми электронного состава. Имея половину и более половины электронов, чем их есть на завершенном энергетическом уровне, атомам этих элементов энергетически выгоднее не отдавать электроны, а присоединять или образовывать общие электронные пары. Так, в молекуле водорода два атома Водорода достигают завершенности внешнего энергетического уровня за счет образования общей электронной пары, в молекуле кислорода. Неметаллические элементы характеризуются высокой, по сравнению с металлическими, электро- отрицательностью, поэтому между атомами неметаллических элементов химическая связь образуется за счет общих электронных пар, а не путем отдачи и присоединения электронов.
При всем многообразии химических связей их природа едина и носит электростатический характер.
Механизм образования химической связи может быть смоделирован различными способами. Простейшим является метод валентных связей (ВС), предложенный Льюисом.
Метод валентных связей рассматривает химическую связь как результат притяжения ядер двух атомов к одной или нескольким общим для них электронным парам.
2.Электроотрицательность. Полярная и неполярная ковалентные связи. Диполь. Полярность связи и полярность молекулы.
Электроотрицательность - это периодическое свойство атома, которое выражается в способности атома в соединении с другим притягивать к себе электроны. Она напрямую зависит от радиуса или размера атома. Чем радиус меньше, тем сильнее он будет притягивать электроны от другого атома. Поэтому, чем выше и правее стоит элемент в периодической таблице, тем меньше у него радиус и больше электроотрицательность (самый электроотрицательный фтор). По существу, электроотрицательность определяет вид химической связи.
Например, HCl. Хлор более электроотриц., он оттягивает общую эл. пару на себя, связь ковал. полярная.
Полярность химических связей - характеристика химической связи (как правило, ковалентной), показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах.
Полярность молекул.
Молекулы, которые образованы атомами одного и того же элемента, как правило, будут неполярными, как неполярны и сами связи в них. Так, молекулы Н2, F2, N2 неполярны. Молекулы, которые образованы атомами разных элементов, могут быть полярными и неполярными. Это зависит от геометрической формы. Если форма симметрична, то молекула неполярна (BeH2, BF3, CH4, CO2, SO3), если асимметрична (из-за наличия неподелённых пар или неспаренных электронов), то молекула полярна (NH3, H2O, SO2, NO2). При замене одного из боковых атомов в симметричной молекуле на атом другого элемента также происходит искажение геометрической формы и появление полярности, например в хлорпроизводных метана CH3Cl, CH2Cl2 и CHCl3 (молекулы метана CH4 неполярны).
Полярность несимметричной по форме молекулы вытекает из полярности ковалентных связей между атомами элементов с разной электроотрицательностью.
Как отмечалось выше, происходит частичный сдвиг электронной плотности вдоль оси связи к атому более электроотрицательного элемента, например:
Bδ+ → Fδ−
Cδ− ← Hδ+
Nδ− ← Hδ+
(здесь δ - частичный электрический заряд на атомах).
Чем больше разность электроотрицательностей элементов, тем выше абсолютное значение заряда δ и тем более полярной будет ковалентная связь.В симметричных по форме молекулах (например, BF3) "центры тяжести" отрицательного (δ−) и положительного (δ+) зарядов совпадают, а в несимметричных молекулах (например, NH3) - не совпадают. Вследствие этого в несимметричных молекулах образуется электрический диполь - разнесённые на некоторое расстояние в пространстве разноименные заряды, например, в молекуле воды.
Химическую связь с помощью общих электронных пар называется ковалентной. Если общие электронные пары равноудалены от ядер обоих атомов, он - неполярный, а если смещены в сторону более электроотрицательного атома - полярный.
Принципиально возможны два механизма образования ковалентной связи:
1. спаривание электронов двух атомов при условии противоположной ориентации их спинов;
2. донорно-акцепторное взаимодействие, при
котором общей становится готовая электронная пара одного из атомов
(донора) при наличии энергетически выгодной свободной орбитали
другого атома (акцептора).
Повторим образования ковалентной и ионной связей на примере
соединений химических элементов с порядковыми номерами 1, 8, 11,
17.
Сначала запишем электронные и графические электронные формулы
атомов указанных элементов:
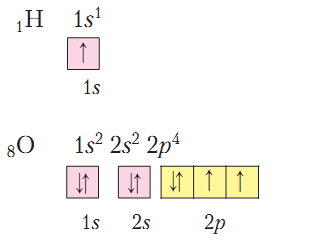
Имеющийся в атоме Водорода 1 электрон составляет половину от количества, завершенного для него (двухэлектронного) внешнего энергетического уровня. У Кислорода на внешнем энергетическом уровне 6 электронов, то есть он близок к завершенному для него восьмиэлектронному составу. Имея половину и более половины электронов, чем их есть на завершенном энергетическом уровне, атомам этих элементов энергетически выгоднее не отдавать электроны, а присоединять или образовывать общие электронные пары. Так, в молекуле водорода два атома Водорода достигают завершенности внешнего энергетического уровня за счет образования общей электронной пары, в молекуле кислорода - двух (рис. 2).
-
електронегативність
ім
-
1
электроотрицательность
Додатково…
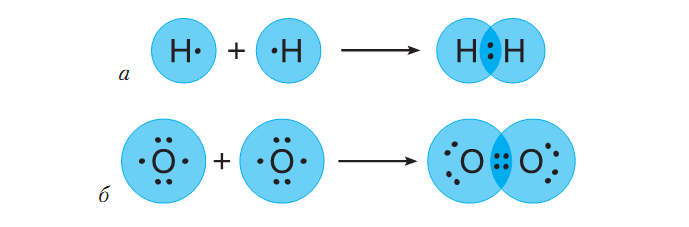
Рис.2. Схемы образования химической связи между
атомами одного
химического элемента Водорода (а); Кислорода (б).
В обеих молекулах общие электронные пары равноудалены от ядер атомов, между которыми образовалась химическая связь. Химическая связь с помощью общих электронных пар называется ковалентной. Если общие электронные пары равноудалены от ядер обоих атомов, он - неполярный, а если смещены в сторону более электроотрицательного атома - полярный.
Натрий хлорид, в отличие от водорода, кислорода и воды, является веществом немолекулярного строения. Поэтому образование химической связи происходит по-другому. Атом Натрия отдает единственный электрон внешнего энергетического уровня и превращается в катион, у которого завершенный внешний энергетический уровень (им становится предпоследний энергетический уровень атома Натрия). Потому Хлору энергетически выгодно присоединить этот электрон на внешний энергетический уровень и завершить его. При этом нейтральные атомы Натрия и Хлора превращаются в заряженные частицы - ионы:
-
електронегативність
ім
-
1
электроотрицательность
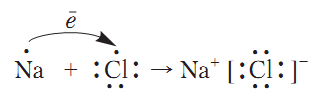
Связь, которая образуется в веществах за счет притяжения разноименно заряженных ионов, называется йонной связью.
Ионная связь - предельный случай ковалентной полярной связи. Её можно рассматривать как электростатическое притяжение, возникающее между разноименно заряженными ионами.
Ионная связь, в отличие от ковалентной, является ненаправленной, ненасыщенной, а координационные числа в ионных соединениях определяются соотношением радиусов взаимодействующих ионов.
3.Водородная химическая связь.
Водородная связь -
форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.
Часто водородную связь рассматривают как электростатическое взаимодействие, усиленное небольшим размером водорода, которое разрешает близость взаимодействующих диполей. Тогда об этом говорят как о разновидности донорно-акцепторной связи, невалентном взаимодействии между атомом водорода H, ковалентно связанным с атомом A группы A-Hмолекулы RA-H и электроотрицательным атомом B другой молекулы (или функциональной группы той же молекулы) BR'. Результатом таких взаимодействий являются комплексы RA-H···BR′ различной степени стабильности, в которых атом водорода выступает в роли «моста», связывающего фрагменты RA и BR′.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность, её распространенность и важность, особенно в органических соединениях, а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода.
В настоящее время в рамках теории молекулярных орбиталей водородная связь рассматривается как частный случай ковалентной с делокализацией электронной плотности по цепи атомов и образованием трёхцентровых четырёхэлектронных связей (например, -H···[F-H···F]-).
4.Кристаллические решетки.
В зависимости от вида частиц и от характера связи между ними различают четыре типа кристаллических решеток: ионные, молекулярные, атомные и металлические.
Молекулярная кристаллическая решетка, в узлах которой располагаются молекулы, например Cl2, I2, H2, Br2 и т. д.. Химические связи в них ковалентные, как полярные, так и неполярные. Связи в молекулах прочные, но между молекулами связи не прочные. Вещества с МКР имеют малую твёрдость, плавятся при низкой температуре, летучие, при обычных условиях находятся в газообразном или жидком состоянии.
Атомная кристаллическая решетка, в узлах которой находятся отдельные атомы, которые соединены очень прочными ковалентными связями, например, алмаз.
Ионная кристаллическая решетка в узлах которой находятся ионы, их образуют вещества с ионной связью. это соли, некоторые оксиды и гидроксиды металлов, самый простой пример NaCl, KI. Связи между ионами в кристалле очень прочные и устойчивые. Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучие.
Металлическая кристаллическая решетка, в узлах которой располагаются атомы и ионы металла, ну это все металлы Na, K, Mg, Ca и другие.
Металлическая связь. Связь в металлах между положительными ионами посредством обобществленных электронов. Для металлов характерны: блеск, электропроводность, теплопроводность, пластичность. Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток находятся атомы и положительные ионы металлов, а в объеме кристалла свободно перемещаются валентные электроны. Электроны электростатически притягивают положительные ионы металлов. Этим объясняется стабильность решетки.
Контроль знаний:
1.Внешний и предпоследний уровень атома элемента имеет вид:
4s4p4d5s. В каком периоде, и в какой группе и подгруппе находится
этот элемент? К какому электронному семейству он относится? Его
высшая степень окисления? Составьте формулу оксида, отвечающая
высшей степени окисления этого элемента.
2.Приведите примеры веществ, которые имеют ионную, атомную и молекулярную кристаллические решетки. Из этих веществ будет низкую температуру плавления, а какая - высшую? Почему?
3. Кислород образует химические связи с натрием,
хлором, азотом и Цинком. Запишите формулы этих соединений, укажите
вид химической связи и тип кристаллической решетки. Объясните,
связь будет наименее полярной.
6.Какой из химических связей является наиболее полярной?
Н-С1, Н-Вг, Н-І, Н-Р, Н-в.
4. Приведите примеры веществ, в которых Флор
образует ионную, ковалентную полярную и неполярную связи, укажите
тип кристаллической решетки в этих соединениях.
5.Металл массой 4,5 г, имеющий степень окисления в соединениях +3,
прореагировал с соляной кислотой. При этом выделился водород
объемом 5,6 л (н. У.). Назовите металл.
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л2.стр.32-34, Л2.стр.35-38, пересказ конспекта лекции №2, выучить термины.
Лекция № 3.
Тема: Классификация химических реакций. Реакции, идущие без изменения состава веществ. Аллотропия и аллотропные видоизменения. Причины аллотропии на примере модификаций кислорода, углерода и фосфора.
Реакции, идущие с изменением состава веществ. Реакции соединения, разложения, замещения и обмена в неорганической и органической химии. Реакции экзо- и эндотермические. Тепловой эффект химической реакции и термохимические уравнения. Реакции горения, как частный случай экзотермических реакций.
Обратимость химических реакций. Необратимые и обратимые химические реакции.
Реакции, идущие с изменением состава веществ.
Основные понятия и термины по теме: химические реакции, классификация, состав, степень окисления, тепловой эффект, реакции соединения, разложения, замещения и обмена в неорганической и органической химии.
План изучения темы
(перечень вопросов, обязательных к изучению):
-
Понятие реакции.
-
Классификация реакций по различным признакам:
Реакции, идущие без изменения состава веществ;
Реакции, идущие с изменением состава веществ.
3. Обратимость химических реакций.
Изложение лекции:
Понятие реакции.
Химическая реакция - процессы образования веществ и химических соединений, протекающие с изменением электронных оболочек, и образованием новых химических веществ.
Химические реакции классифицируют по различным признакам.
Рассмотрим реакции, идущие без изменения состава веществ и
реакции, идущие с изменением состава веществ.
Реакции, идущие без изменения состава веществ.
Реакция, идущая без изменения состава вещества - в неорганической химии примерами таких химических реакций являются процессы изменения аллотропных модификаций одного и того же химического элемента (графит переходит в алмаз, кислород в озон).
В органической химии примерами будут реакции изомеризации алканов, алкенов, алкинов и другие, идущие без изменения не только качественного, но и количественного состава реагентов.
Аллотропия - существование двух и более простых веществодного и того же химического элемента, различных по строению и свойствам - так называемых аллотропных (или аллотропических) модификаций или форм.
В настоящее время известно более 400 разновидностей простых веществ. Способность элемента к образованию аллотропных форм обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов.
Причиной аллотропии являются, например, разное число атомов в молекуле, как у кислорода О2 и озона О3.Или разное строение кристаллической решетки, как у алмаза и графита. И у того и другого она атомная, но упаковка в них атомов углерода определяется его гибридизацией. Ни один элемент Периодической системы Менделеева не обладает тем разнообразием свойств, иногда прямо противоположных, которое присуще углероду. В карбине и фуллерене, между атомами углерода существуют двойные и тройные связи. Все это сказывается на физических и химических свойствах аллотропов. Графит, алмаз, карбин, лонсдейлит, фуллерены, углеродные нанотрубки, графен, аморфный углерод- все это аллотропия углерода, а у кислорода сам кислород и озон. Кислород бесцветен, не имеет запаха; озон имеет выраженный запах, имеет бледно-фиолетовый цвет, он более бактерициден. Каждый, кто обратил внимание на то, как пахнет воздух после грозы или вблизи источника электрического разряда, знает запах этого газа очень хорошо. В природе озон образуется не только при электрических разрядах в атмосфере, но и под действием ультрафиолетового излучения Солнца.
Известно 11 аллотропных модификаций фосфора. Основные модификации: белый, красный и чёрный фосфор. Белый фосфор ядовит, светится в темноте, способен самовоспламеняться, красный фосфор не ядовит, не светится в темноте, сам по себе не воспламеняется. Белый фосфор похож на воск, он мягкий и легкоплавкий, светится в темноте и вдобавок огнеопасен и ядовит. Чтобы избежать самовоспламенения белого фосфора, его хранят под слоем воды. Если нагревать белый фосфор до 300°С без доступа воздуха, он превратится в красный фосфор. Красный фосфор - порошок красно-фиолетового цвета, не ядовитый и совсем не светящийся. Под очень большим давлением получается чёрный фосфор, похожий по свойствам на металл.
У серы большое число аллотропных модификаций, второе место после углерода. Основные модификации: ромбическая, моноклинная и пластическая сера.
Реакции, идущие с изменением состава веществ. Классификация:
а.Реакции соединения:
Из нескольких веществ образуется одно сложное вещество (сопровождаются выделением тепла, всегда носят окислительно-восстановительный характер).
A + B + C = D
S + O2 = SO2
СаСО3 + СО2 + Н2О = Са (НСО3)2,
2FеСl2 + Сl2 = 2FеСl3.
б.Реакции разложения:
Из одного сложного вещества образуется несколько новых веществ.
А = В + С + D.
2KNO3 → 2KNO2 + O2↑
CH4 → C + 2H2
Из реакций разложения следует отметить разложение кристаллогидратов, оснований, кислот и солей кислородсодержащих кислот:
CuSO4 5H2O=CuSO4 + 5H2O
Cu(OH)2=CuO + H2O
H2SiO3=SiO2 + H2O.
К реакциям разложения окислительно-восстановительного характера относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления:
2SO3=2SO2 + O2.
4HNO3=2H2O + 4NO2O + O2O.
2AgNO3 = 2Ag + 2NO2 + O2,
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O.
Особенно характерны окислительно-восстановительные реакции разложения для солей азотной кислоты. Реакции разложения в органической химии носят название крекинга:
С18H38 = С9H18 + С9H20,
или дегидрирования:
C4H10 = C4H6 + 2H2.
в. Реакции замещения.
При реакциях замещения обычно простое вещество взаимодействует со сложным, образуя другое простое вещество и другое сложное:
А + ВС = АВ + С.
Эти реакции в подавляющем большинстве принадлежат к окислительно-восстановительным:
2Аl + Fe2O3 = 2Fе + Аl2О3,
Zn + 2НСl = ZnСl2 + Н2,
2КВr + Сl2 = 2КСl + Вr2,
2КСlO3 + l2 = 2KlO3 + Сl2.
СаСО3+ SiO2 = СаSiO3 + СО2,
Са3(РО4)2 + ЗSiO2 = ЗСаSiO3 + Р2О5,
Иногда эти реакции рассматривают как реакции обмена:
СН4 + Сl2 = СН3Сl + НСl.
г. Реакции обмена.
Реакциями обмена называют реакции между двумя соединениями, которые обмениваются между собой своими составными частями:
АВ + СD = АD + СВ.
Это наиболее распространенная группа реакций между сложными веществами - оксидами, основаниями, кислотами и солями:
ZnO + Н2SО4 = ZnSО4 + Н2О,
AgNО3 + КВr = АgВr + КNО3,
СrСl3 + ЗNаОН = Сr(ОН) 3 + ЗNаСl.
Частный случай этих реакций обмена - реакции нейтрализации:
НСl + КОН = КСl + Н2О.
Обычно эти реакции подчиняются законам химического равновесия и протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного, летучего вещества, осадка или малодиссоциирующего (для растворов) соединения:
NаНСО3 + НСl = NаСl + Н2О + СО2↑,
Са (НСО3)2 + Са (ОН) 2 = 2СаСО3↓ + 2Н2О,
СН3СООNа + Н3РО4 = СН3СООН + NаН2РО4.
По тепловому эффекту:
-Реакции, протекающие с выделением тепла, называются экзотермическими реакциями.
С + О2 → СО2 + Q
-Реакции, протекающие с поглощением тепла, называются эндотермическими реакциями.
N2 + O2 → 2NO - Q
По признаку обратимости:
-Обратимые - реакции, проходящие при одних и тех условиях в двух взаимопротивоположных направлениях.
H2 + I2 ![]() 2HI
2HI
-Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных веществ в конечные, называются необратимыми, при этом должен выделяться газ, осадок, или малодиссоциирующее вещество- вода.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Na2CO3 +2HCl → 2NaCl + CO2↑ + H2O
Окислительно-восстановительные реакции - реакции, протекающие с изменением степени окисления.
Са + 4HNO3 → Ca(NO3)2 + 2NO2 + 2H2O
И реакции, протекающие без изменения степени окисления.
HNO3 + KOH → KNO3 + H2O
Различают два процесса: Окисление - это отдача электронов, в результате степень окисления увеличивается. Атом молекула или ион, отдающий электрон называется восстановителем.
Mg0 - 2e → Mg+2
2I- 2e → I2
Восстановление - процесс присоединения электронов, в результате степень окисления уменьшается. Атом молекула или ион, присоединяющий электрон называется окислителем. S0 +2e → S-2
O20 +4e → 2O-2
В окислительно-восстановительных реакциях должно соблюдаться правило электронного баланса (число присоединенных электронов должно быть равно числу отданных, свободных электронов быть не должно). А так же должен соблюдаться атомный баланс (число одноименных атомов в левой части должно быть равно числу атомов в правой части).
Контроль знаний:
Правило написание окислительно-восстановительных реакций.
-
Написать уравнение реакции
-
Поставить степени окисления
-
Найти элементы, у которых изменяется степень окисления
-
Выписать попарно их.
-
Найти окислитель и восстановитель
-
Написать процесс окисление или восстановления
-
Уравнять электроны, пользуясь правилом электронного баланса (найти н.о.к.), расставив коэффициенты
-
Написать суммарное уравнение
-
Поставить коэффициенты в уравнение химической реакции
KClO3 → KClO4 + KCl; N2 + H2 → NH3; H2S + O2 → SO2 + H2O; Al + O2 = Al2O3;
Сu + HNO3 → Cu(NO3)2 + NO + H2O; KClO3 → KCl + O2; P + N2O = N2 + P2O5;
NO2 + H2O = HNO3 + NO
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л2.стр.52-59, отвечать на вопросы, пересказ конспекта лекции №3.
Лекция № 4.
Тема: Неметаллы. Положение неметаллических элементов в периодической системе. Сравнительная характеристика галогенов как наиболее типичных представителей неметаллов. Окислительные свойства неметаллов (взаимодействие с металлами и водородом). Восстановительные свойства неметаллов (взаимодействие с более электроотрицательными неметаллами и сложными веществами-окислителями).
Основные понятия: положение неметаллов в ПСХЭ Д.И.Менделеева, аллотропия, строение неметаллов, сера, графит, красный фосфор, бром, иод, спиртовой раствор иода,
План изучения темы
(перечень вопросов, обязательных к изучению):
1. Общая характеристика неметаллических элементов. Неметаллы как простые вещества.
2.Физические свойства неметаллов.
3. Химические свойства неметаллов.
Содержание лекции:
-
Общая характеристика неметаллических элементов. Неметаллы как простые вещества.
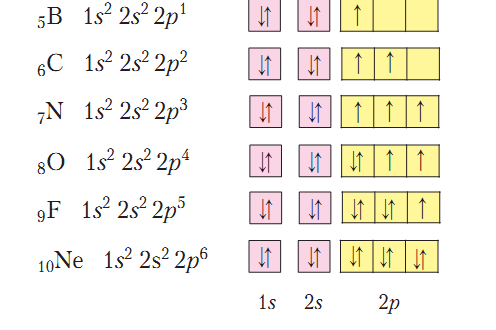
Неметаллические элементы Бор, Карбон, Азот, Кислород, Фтора и Неона относятся ко второму периоду периодической системы химических элементов и имеют такие электронные и графические электронные формулы атомов:
По этим формулам четко прослеживается одинаковое строение первого энергетического уровня неметаллических элементов второго периода и постепенное увеличение числа электронов на втором (внешнем) энергетическом уровне, пока последний элемент Неон не достигнет завершенности внешнего энергетического уровня. Начиная с Азота, в атомах химических элементах наблюдается постепенное уменьшение количества неспаренных электронов на внешнем энергетическом уровне. Так, атом Азота способен образовать три общие электронные пары с другими атомами, Кислорода - две, Фтора - одну.
В атоме Неона отсутствуют неспаренные электроны, и он не образует химических связей с другими атомами.
Рассмотренные примеры доказывают, что атомы
неметаллических элементов второго периода имеют по 2 энергетических
уровня, но отличаются количеством электронов на внешнем
энергетическом уровне.
Особенностью атомов неметаллических элементов является то, что
количество электронов на внешнем энергетическом уровне совпадает с
номером группы.
Поэтому без записи электронной формулы атома,
например, неметаллического элемента VII группы Астату можно с
уверенностью сказать, что с 85 электронов в его электронные
оболочки 7 находятся на внешнем энергетическом уровне.
Неметаллические элементы одной подгруппы. Карбон и Кремний
находятся в IV группе главной подгруппе периодической системы
химических элементов, т.е. являются элементами одной группы и
подгруппы.
Напишем электронную и графическую электронную формулу атома
Кремния:
-
електронегативність
ім
-
1
электроотрицательность
До
-
електронегативність
ім
-
1
электроотрицательность
Воспользуемся электронной и графической
электронной формулой атома Углерода из примера 1 и сравним
электронные формулы атомов этих химических элементов. Результаты
сравнения указывают на то, что электронные оболочки их атомов
отличаются числом энергетических уровней, однако на внешнем
энергетическом уровне у них одинаковое количество электронов и она
численно равна номеру группы. Электронные формулы атомов Углерода и
Кремния свидетельствуют, что неметаллические элементы IV группы
главной подгруппы имеют одинаковое строение внешнего
энергетического уровня и количество электронов в нем равна половине
электронов внешнего завершенного восьми электронного
энергетического уровня.
Задачи: 1. Напишите электронные и графические электронные формулы
неметаллических элементов третьего периода и сделайте вывод, что
общего и чем отличается строение электронных оболочек их
атомов.
2.Напишите электронные и графические электронные формулы
неметаллических элементов V группы главной подгруппы Азота и
Фосфора.
Общая электронная формула атомов неметаллов
ns2np1−5, этому соответствует большое
разнообразие степеней окисления неметаллов в соединениях.
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению высокой окислительной активности. Вот почему значения электроотрицательности у них велики. Отсюда многообразие в химических свойствах и способах получения неметаллов. Электроотрицательность - мера неметалличности, т.е. чем более электроотрицателен данный химический элемент, тем ярче выражены неметаллические свойства.
Другая характерная особенность неметаллов - стремление образовывать ковалентные связи с атомами других неметаллов и амфотерных элементов. Поэтому и простые вещества и соединения неметаллов имеют ковалентное строение. В отличие от металлов неметаллы - простые вещества, характеризуются большим многообразием свойств.
Неметаллы имеют различное агрегатное состояние при обычных условиях:
-
газы - H2, O2, O3, N2, F2, Cl2;
-
жидкость - Br2;
-
твердые вещества - модификации серы, фосфора, кремния, углерода и др.( I2, At, , Te, As, и В).
Молекулы неметаллов могут состоять из разного
количества атомов.
Физические свойства неметаллов.
Неметаллы отличаются по цвету, запаху, отсутствуют блеск. Агрегатное состояние: жидкое, твердое, газообразное. Теплопроводность (только графит). Электропроводность. (только графит и черный фофсфор). Так, водород, кислород, азот - бесцветные газы; фтор - бледно-желтый, а хлор - желто-зеленый ядовитый газ с резким специфическим запахом; бром - темно-красная жидкость, желто - бурые пары которой имеют резкий, раздражающий запах, а при попадании на кожу вызывают сильные ожоги.
Сера - твердое вещество желтого цвета. Йод - твердое черно-фиолетовое вещество с металлическим блеском.
Поскольку неметаллы имеют разные агрегатные
состояния, то и температуры их плавления и кипения находятся в
широких пределах. Газообразные неметаллы (водород, кислород, азот)
при нормальных условиях кипят при низких температурах (около -200
°С). Твердое вещество йод при нагревании сублимируется - сразу
переходит из твердого состояния в газообразное. Для того чтобы
расплавить серу, достаточно температуры спиртовки или сухого
горючего, тогда как одна из аллотропных видоизменений Углерода -
алмаз - имеет температуру плавления свыше +3000 °С.
Большинство неметаллов не проводят электрический ток, т.е. являются
диэлектриками. Кремний - полупроводник, а графит - проводник
электрического тока. Неметаллы плохо проводят тепло, хрупкие,
растворимость в воде не является их характерной общим свойством.
Однако многие из них хорошо растворимы в органических
растворителях. Лучшую растворимость в воде имеют галогены. Раствор
брома в воде известный вам под названием бромная вода.
5.Химические свойства неметаллов.
Неметаллы имеют атомное или молекулярное строение. Для них характерны невысокие температуры плавления и кипения, неспособность проводить электрический ток. Неметаллы вступают в реакции с металлами, водородом, кислородом и преимущественно являются окислителями. Большинство неметаллов используют в технике, химической промышленности.
Неметаллы в химических реакциях могут быть восстановителями и окислителями (фтор, кислород).
-
Взаимодействие неметаллов с металлами
2Na + Cl2 = 2NaCl,
Fe + S = FeS,
6Li + N2 = 2Li3N,
2Ca + O2 = 2CaO
-
Взаимодействие неметаллов с углеродом. Для углерода более характерны реакции, в которых он проявляет восстановительные свойства. Это имеет место при полном сгорании углерода любой аллотропической модификации
C + 2Cl2 = CCl4.
Продуктами взаимодействия двух неметаллов являются вещества с различным агрегатным состоянием, что имеют ковалентный тип химической связи, общие электронные пары которого смещаются к атому более электроотрицательного неметаллического элемента.
-
Взаимодействие неметаллов с водородом:
3H2 + N2 = 2NH3,
H2 + Br2 = 2HBr;
-
Взаимодействие неметаллов с другими неметаллами:
S + 3F2 = SF6,
S + O2 = SO2,
4P + 5O2 = 2P2O5;
-
Взаимодействие металлов с углеродом.
При обычной температуре углерод весьма инертен. Его химическая активность проявляется лишь при высоких температурах. Соединения углерода с металлами называются карбидами.
4А1 + ЗС = АІ4C 3 (Карбид алюминия)
Физические и химические свойства водорода H2. Молекула Н2 содержит неполярную σ-связь. Бесцветный газ, без запаха и вкуса, устойчив к нагреванию до 2000 °С. Практически не растворяется в воде.
Физические константы: Mr = 2,016, ρ = 0,09 г/л (н.у.), tпл = −259,19 °C, tкип = −252,87 °C.
Водород Н2 может проявлять в одних условиях восстановительные свойства (чаще), в других условиях - окислительные свойства (реже):
восстановитель H20 - 2e− = 2HI
окислитель H20 + 2e− = 2H−I
Реагирует с неметаллами, металлами, оксидами (обычно при нагревании):
2H2 + O2 = 2H2O
H2 + S = H2S
H2 + CuO = Cu + H2O
H2 + Ca = CaH2
Качественная реакция на водород - сгорание с "хлопком" собранного в пробирку газа.
Водородные соединения неметаллов.
В отличие от металлов неметаллы образуют газообразные водородные соединения. Их состав зависит от степени окисления неметаллов.Выводы:
1.Элементы-неметаллы расположены в главных подгруппах III-VIII групп ПС Д.И. Менделеева, занимая её верхний правый угол. 2.На внешнем электронном слое атомов элементов-неметаллов находятся от 3 до 8 электронов.
3.Неметаллические свойства элементов усиливаются в периодах и ослабевают в подгруппах с увеличением порядкового номера элемента. 4.Высшие кислородные соединения неметаллов имеют кислотный характер (кислотные оксиды и гидроксиды).
5.Атомы элементов-неметаллов способны как принимать электроны, проявляя окислительные функции, так и отдавать их, проявляя восстановительные функции.
Контроль знаний:
-
Дайте характеристику подгруппе азота.
-
Запишите общую электронную конфигурацию для подгруппы фосфора.
3. Сопоставьте значения валентности и степени окисления каждого элемента:
а) в воде; б) в кислороде; в) в азоте; г) водород перекиси Н2О2… -
Дайте характеристику подгруппе кислорода.
-
Запишите общую электронную конфигурацию для подгруппы кислорода.
ДОМАШНЕЕ ЗАДАНИЕ
Проработать: Л2.стр.162-172, пересказ конспекта лекции №4.Подготовить короткие сообщения о природных соединениях неметаллов.
Лекция № 5.
Тема: Кислоты неорганические и органические. Классификация кислот. Химические свойства кислот: взаимодействие с металлами, оксидами металлов, гидроксидами металлов, солями, спиртами (реакция этерификации). Особые свойства азотной и концентрированной серной кислоты.
Основания неорганические и органические. Основания, их классификация. Химические свойства оснований: взаимодействие с кислотами, кислотными оксидами и солями. Разложение нерастворимых оснований.
Соли. Классификация солей: средние, кислые и основные. Химические свойства солей: взаимодействие с кислотами, щелочами, металлами и солями. Представители солей и их значение.
Основные понятия и термины по теме: кислоты, органические и неорганические кислоты, классификация, применение, химические свойства, получение. основания, гидроксильные группы, растворимость, классификация, физические свойства, химические свойства. соли, кислотный остаток, классификация, растворимость, физические свойства, химические свойства.
План изучения темы
(перечень вопросов, обязательных к изучению):
-
Классификация кислот, (…оснований), (…солей).
-
Физические свойства
-
Химические свойства.
-
Понятие этерификации.
-
Особые свойства азотной и концентрированной серной кислоты.
-
Получение кислот.
Изложение лекции:
Кислоты- это сложные вещества, содержащие атомы водорода, которые могут замещаться атомами металла.
Кислоты - это электролиты, которые в водном растворе диссоциируют на катионы Водорода и анионы кислотного остатка. Например:
HCl → H+ + Cl-
В растворах кислот имеются катионы Водорода,
обусловливающие общие свойства кислот.
1.Классификация.
1. По основности. (Основность кислоты-это число атомов водорода,
которые в молекуле кислоты могут замещаться атомами металла):
· Одноосновные, молекулы которых содержат один атом водорода.
· Двухосновные, молекулы которых содержат два атома водорода.
· Трехосновные, молекулы которых содержат три атома водорода.
· Четырехосновные, молекулы которых содержат четыре атома водорода.
2. По содержанию атомов кислорода в молекуле кислоты:
· Бескислородные, молекулы которых не содержат атомов кислорода.
· Кислородосодержащие, молекулы которых содержат атомы кислорода.
Также неорганические кислоты классифицируются по стабильности (стабильные или устойчивые - все, кроме угольной и сернистой, нестабильные или неустойчивые - угольная и сернистая).
По силе кислоты могут быть сильными: серная, соляная, азотная, хлорная и другие, а также слабыми: сероводородная, хлорноватистая и другие.
Совсем не такое разнообразие предлагает органическая химия. Кислоты, которые имеют органическую природу, относятся к карбоновым кислотам. Их общая особенность - наличие функциональной группы -СООН. Например, НСООН (муравьиная), СН3СООН (уксусная), С17Н35СООН (стеариновая) и другие.
2.Химические свойства:
Кислоты одинаково изменяют цвет индикатора: метилоранж (в обычной среде - оранжевый, в кислотах - красный), лакмус (в нейтральной - фиолетовый, в кислотах - красный) или некоторые другие.
Взаимодействуют:
а). С основаниями Основание + Кислота = Соль + H2O
H3PO4 + 3NaOH = Na3PO4+ 3H2O
Б). С основными оксидами Кислота + Основной оксид = Соль + H2O
2HCl + CaO = CaCl2 + H2O
В)· С амфотерными оксидами Кислота + Амфотерный оксид = Соль + H2O
2HNO3 + ZnO = Zn(NO3)2 + H2O
Г).С амфотерными гидроксидами Кислота + Амфотерный гидроксид = Соль + H2O
3HCl + Cr(OH)3 = CrCl3 + 3H2O
Д).С нормальными солями Кислота + Соль = Соль + Кислота
HCl +AgNO3 = AgCl + HNO3
И)· С металлами 2HCl + Mg = MgCl2 + H2
3.Этерификация -реакция образования сложных эфиров при взаимодействии кислот и спиртов:
RCOOH + R'OH ⇔ RCOOR' + Н2О
4. Особые свойства азотной и концентрированной серной кислоты.
Азотная кислота - HNO3, кислородосодержащая
одноосновная сильная кислота. Твёрдая азотная кислота образует две
кристаллические модификации с моноклинной и ромбической решётками.
Азотная кислота смешивается с водой в любых соотношениях. В водных
растворах она практически полностью диссоциирует на ионы. Образует
с водой азеотропную смесь с концентраций 68,4 % и tкип120 °C при 1
атм. Известны два твёрдых гидрата: моногидрат (HNO3•H2O) и
тригидрат (HNO3•3H2O).
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие
происходящего на свету процесса разложения:
HNO3 ---> 4NO2 + O2 + 2H2O
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении.
Азотная кислота является сильным окислителем, концентрированная азотная кислота окисляет серу до серной, а фосфор - до фосфорной кислоты, некоторые органические соединения (например, амины и гидразин, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Степень окисленности азота в азотной кислоте
равна 4-5. Выступая в качестве окислителя, НNО![]() может восстанавливаться до различных продуктов:
может восстанавливаться до различных продуктов:
![]()
Какое из этих веществ образуется, т. е.
насколько глубоко восстанавливается азотная кислота в том или ином
случае, зависит от природы восстановителя и от условий реакции,
прежде всего от концентрации кислоты. Чем выше концентрации
HNO![]() ,
тем менее глубоко она восстанавливается. При реакциях с
концентрированной кислотой чаще всего выделяется
,
тем менее глубоко она восстанавливается. При реакциях с
концентрированной кислотой чаще всего выделяется ![]() .
.
При взаимодействии разбавленной азотной кислоты
с малоактивными металлами, например, с медью, выделяется NO. В
случае более активных металлов - железа, цинка, -
образуется![]() .
.
Сильно разбавленная азотная кислота взаимодействует с активными металлами -цинком, магнием, алюминием -- с образованием иона аммония, дающего с кислотой нитрат аммония. Обычно одновременно образуются несколько продуктов.
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией. Так, концентрированная азотная кислота реагирует с медью с образованием диоксида азота, а разбавленная - оксида азота (II):
Cu + 4HNO3----> Cu(NO3)2 + NO2 + 2H2O
3Cu + 8 HNO3 ----> 3Cu(NO3)2 + 2NO + 4H2O
Большинство металлов реагируют с азотной кислотой с выделением оксидов азота в различных степенях окисления или их смесей, разбавленная азотная кислота при реакции с активными металлами может реагировать с выделением водорода и восстановлением нитрат-иона до аммиака.
Некоторые металлы (железо, хром, алюминий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Смесь азотной и серной кислот носит название «меланж». Азотная кислота широко используется для получения нитросоединений.
Смесь трех объёмов соляной кислотой и одного
объёма азотной называется «царской водкой». Царская водка
растворяет большинство металлов, в том числе и золото. Её сильные
окислительные способности обусловлены образующимся атомарным хлором
и хлоридом нитрозила:
3HCl + HNO3 ----> NOCl + 2[Cl] =2H2O
Серная кислота - тяжелая маслянистая жидкость, не имеющая цвета. Смешивается с водой в любых отношениях.
Концентрированная серная кислота активно поглощает воду из воздуха, отнимает её от других веществ. При попадании органических веществ в концентрированную серную кислоту происходит их обугливание, например, бумаги:
(C6H10O5)n + H2SO4 => H2SO4 + 5nH2O + 6C
При взаимодействии концентрированной серной кислоты с сахаром образуется пористая угольная масса, похожая на черную затвердевшую губку:
C12H22O11 + H2SO4 => C + H2O + CO2 + Q
Химические свойства разбавленной и концентрированной серной кислоты отличаются.
Разбавленные растворы серной кислоты реагируют с металлами, расположенными в электрохимическом ряду напряжений левее водорода, с образованием сульфатов и выделением водорода.
Концентрированные растворы серной кислоты проявляют сильные окислительные свойства, обусловленные наличием в её молекулах атома серы в высшей степени окисления (+6), поэтому концентрированная серная кислота является сильным окислителем. Так окисляются некоторые неметаллы:
S + 2H2SO4 => 3SO2 + 2H2O
C + 2H2SO4 => CO2 + 2SO2 + 2H2O
P4 + 8H2SO4 => 4H3PO4 + 7SO2 + S + 2H2O
H2S + H2SO4 => S + SO2 + 2H2O
Она взаимодействует с металлами, расположенными в электрохимическом ряду напряжений металлов правее водорода (медь, серебро, ртуть), с образованием сульфатов, воды и продуктов восстановления серы. Концентрированные растворы серной кислоты не реагируют с золотом и платиной вследствие их малой активности.
а) малоактивные металлы восстанавливают серную кислоту до диоксида серы SO2 :
Cu + 2H2SO4 => CuSO4 + SO2 + 2H2O
2Ag + 2H2SO4 => Ag2SO4 + SO2 + 2H2O
б) с металлами средней активности возможны реакции с выделением любого из трех продуктов восстановления серной кислоты:
Zn + 2H2SO4 => ZnSO4 + SO2 + 2H2O
3Zn + 4H2SO4 => 3ZnSO4 + S + 4H2O
4Zn + 5H2SO4 => 4ZnSO4 + H2S + 2H2O
в) с активными металлами могут выделяться сера или сероводород:
8K + 5H2SO4 => 4K2SO4 + H2S + 4H2O
6Na + 4H2SO4 => 3Na2SO4 + S + 4H2O
г) с алюминием, железом, хромом, кобальтом, никелем концентрированная серная кислота на холод (то есть без нагревания) не взаимодействует - происходит пассивирование этих металлов. Поэтому серную кислоту можно перевозить в железной таре. Однако при нагревании возможно взаимодействие с ней и железа, и алюминия:
2Fe + 6H2SO4 => Fe2(SO4)3 + 3SO2 + 6H2O
2Al + 6H2SO4 => Al2(SO4)3 + 3SO2 + 6H2O
Т.О. глубина восстановления серы зависит от восстановительных свойств металлов. Активные металлы (натрий, калий, литий) восстанавливают серную кислоту до сероводорода, металлы, расположенные в ряду напряжений от алюминия до железа - до свободной серы, а металлы с меньшей активностью - до сернистого газа.
5.Получение кислот.
1. Бескислородные кислоты получают путем синтеза водородных соединений неметаллов из простых веществ и последующего растворения полученных продуктов в воде
Неметалл + H2 = Водородное соединение неметалла
H2 + Cl2 = 2HCl
2. Оксокислоты получают взаимодействием кислотных оксидов с водой.
Кислотный оксид + H2O = Оксокислота
SO3 + H2O = H2SO4
3. Большинство кислот можно получить взаимодействием солей с кислотами.
Соль + Кислота = Соль + Кислота
2NaCl + H2SO4 = 2HCl + Na2SO4
Основания- это сложные вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксидных групп.
Основания - это электролиты, которые диссоциируют с образованием катионов металлического элемента и гидроксид-анионов.
Например:
КОН = К+1 + ОН-1
6.Классификация оснований:
1.По числу гидроксильных групп в молекуле:
а)· Однокислотные, молекулы которых содержат одну гидроксидную группу.
б)· Двухкислотные, молекулы которых содержат две гидроксидные группы.
в)· Трехкислотные, молекулы которых содержат три гидроксидые
группы.
2. По растворимости в воде: Растворимые и Нерастворимые.
7.Физические свойства оснований:
Все неорганические основания- твердые вещества (кроме гидроксида аммония). Основания имеют разный цвет: гидроксид калия-белого цвета, гидроксид меди-голубого, гидроксид железа-красно-бурого.
Растворимые основания образуют мыльные на ощупь растворы, через что эти вещества получили название щелочь.
Щёлочи образуют лишь 10 элементов периодической системы химических элементов Д. И. Менделеева: 6 щелочных металлов - литий, натрий, калий, рубидий, цезий, франций и 4 щелочноземельных металла - кальций, стронций, барий, радий.
8.Химические свойства оснований:
1. Водные растворы щелочей изменяют окраску индикаторов. фенолфталеин - малиновый, метилоранж - желтый. Это обеспечивается свободным присутствием гидроксогрупп в растворе. Именно поэтому малорастворимые основания такой реакции не дают.
2. Взаимодействуют :
а) с кислотами: Основание + Кислота = Соль + H2O
KOH + HCl = KCl + H2O
б) с кислотными оксидами: Щелочь + Кислотный оксид = Соль + H2O
Ca(OH)2 + CO2 = CaCO3 + H2O
в) с растворами: Раствор щелочи + Раствор соли = Новое основание + Новая соль
2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
г) с амфотерными металлами: Zn + 2NaOH = Na2ZnO2 + H2
Амфотерные гидроксиды:
а) Реагируют с кислотами с образованием соли и воды:
Гидроксид меди (II) + 2HBr = CuBr2 + вода.
б). Реагируют с щелочами: итог - соль и вода (условие: сплавление):
Zn(OH)2 + 2CsOH = соль + 2H2O.
в). Реагируют с сильными гидроксидами: итог - соли, если реакция идет в водном растворе: Cr(OH)3 + 3RbOH = Rb3[Cr(OH)6]
Нерастворимые в воде основания при нагревании разлагаются на основной оксид и воду:
Нерастворимое основание = Основной оксид + H2O
Cu(OH)2 = CuO + H2O
Соли- это продукты неполного замещения атомов водорода в молекулах кислот атомами металла или это продукты замещения гидроксидных групп в молекулах оснований кислотными остатками.
Соли это электролиты, которые диссоциируют с образованием катионов металлического элемента и анионов кислотного остатка.
Например:
К2СО3 = 2К+1 + СО32-
Классификация:
Нормальные соли. Это продукты полного замещения атомов водорода в молекуле кислоты атомами неметалла, или продукты полного замещения гидроксидных групп в молекуле основания кислотными остатками.
Кислые соли. Это продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла.
Основные соли. Это продукты неполного замещения гидроксидных групп в молекулах многокислотных оснований кислотными остатками.
Типы солей:
Двойные соли - в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами.
Смешанные соли - в их составе присутствует два различных аниона.
Гидратные соли (кристаллогидраты) - в их состав входят молекулы кристаллизационной воды.
Комплексные соли - в их состав входит комплексный катион или комплексный анион.
Особую группу составляют соли органических кислот, свойства которых значительно отличаются от свойств минеральных солей. Некоторые из них можно отнести к особенному классу органических солей, так называемых ионных жидкостей или по-другому «жидких солей» , органических солей с температурой плавления ниже 100 °C.
Физические свойства:
Большинство солей-твердые вещества белого цвета. Некоторые соли имеют окраску. Например, дихромат калия-оранжевого, сульфат никеля-зеленого.
По растворимости в воде соли делятся на растворимые в воде, малорастворимые в воде и нерастворимые.
Химические свойства:
Растворимые соли в водных растворах диссоциируют на ионы:
1. Средние соли диссоциируют на катионы металлов и анионы кислотных остатков:
KCl = K + Cl
· Кислые соли диссоциируют на катионы металла и сложные анионы:
KHSO3 = K + HSO3
· Основные металлы диссоциируют на сложные катионы и анионы кислотных остатков:
AlOH(CH3COO)2 = AlOH + 2CH3COO
2. Соли взаимодействуют с металлами с образованием новой соли и нового металла: Ме(1) + Соль(1) = Ме(2) + Соль(2)
CuSO4 + Fe = FeSO4 + Cu
3. Растворы взаимодействуют с щелочами Раствор соли + Раствор щелочи = Новая соль + Новое основание:
FeCl3 + 3KOH = Fe(OH)3 + 3KCl
4. Соли взаимодействуют с кислотами Соль + Кислота = Соль + Кислота:
BaCl2 + H2SO4 = BaSO4 + 2HCl
5. Соли могут взаимодействовать между собой Соль(1) + Соль(2) = Соль(3) + Соль(4):
AgNO3 + KCl = AgCl + KNO3
6. Основные соли взаимодействуют с кислотами Основная соль + Кислота = Средняя соль + H2O:
CuOHCl + HCl = CuCl2 + H2O
7. Кислые соли взаимодействуют с щелочами Кислая соль + Щелочь = Средняя соль + H2O:
NaHSO3 + NaOH = Na2SO3 + H2O
8. Многие соли разлагаются при нагревании: MgCO3 = MgO + CO2
Представители солей и их значение:
Соли повсеместно используются как в производстве, так и в повседневной жизни:
- Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия.
- Хлорид натрия (поваренную соль) выделяют из озерной и морской
воды, а также добывают в соляных шахтах. Поваренную соль используют
в пищу. В промышленности хлорид натрия служит сырьём для получения
хлора, гидроксида натрия и соды.
- Хлорид калия используют в сельском хозяйстве как калийное удобрение.
- Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при обжиге горной породы (дигидрат сульфата кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс.
- Декагидрат сульфата натрия используют в качестве сырья для получения соды.
- Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим из них является нитрат натрия, нитрат калия,нитрат кальция и нитрат аммония. Обычно эти соли называют селитрами.
- Из ортофосфатов важнейшим является ортофосфат кальция. Эта соль служит основной составной частью минералов - фосфоритов и апатитов. Фосфориты иапатиты используются в качестве сырья в производстве фосфорных удобрений,например, суперфосфата и преципитата.
- Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести.
- Карбонат натрия (соду) применяют в
производстве стекла и при варке мыла.
- Карбонат кальция в природе встречается и в виде известняка, мела
и мрамора.
Материальный мир, в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Единство и многообразие химических веществ этого мира наиболее ярко проявляется в генетической связи веществ, которая отражается в так называемых генетических рядах.
Генетической называют связь между веществами разных классов, основанную на их взаимопревращениях.
Если основу генетического ряда в неорганической химии составляют вещества, образованные одним химическим элементом, то основу генетического ряда в органической химии (химии углеродных соединений) составляют вещества с одинаковым числом атомов углерода в молекуле.
Контроль знаний:
1.Дать определение солям, основаниям, кислотам, их характеристику, основных характерных реакций.
2.Почему кислоты и основания объединяются в группу гидроксиды? Что у них общего и чем они отличаются? Почему щелочь нужно приливать к раствору соли алюминия, а не наоборот?
3. Задание: Приведите примеры уравнений реакций, иллюстрирующих указанные общие свойства нерастворимых оснований.
4. Задание: Определите степень окисления атомов металлических
элементов в приведенных формулах. Какая закономерность
прослеживается между их степенью окисления в оксиде и основе?
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л2.стр.162-172, пересказ конспекта лекции №5.
Записать уравнения возможных реакций согласно схемам, указать
типы реакций: а) НСl + СаО ![]() ... ;
... ;
б) НСl + Аl(ОН)3 ![]() ... ;
... ;
в) Mg + HCl ![]() ... ;
... ;
г) Hg + HCl ![]() ... .
... .
Разделить вещества по классам соединений. Формулы веществ: H2SO4, NaOH, CuCl2, Na2SO4, CaO, SO3, H3PO4, Fe(OH)3, AgNO3, Mg(OH)2, HCl, ZnO, CO2, Cu2O, NO2
Лекция № 6.
Тема: Металлы. Положение металлических элементов в периодической системе. Нахождение металлов в природе. Металлы. Взаимодействие металлов с неметаллами (хлором, серой и кислородом).
Оборудование: периодическая система химических элементов, коллекция металлов, ряд активности металлов.
План изучения темы
(перечень вопросов, обязательных к изучению):
1. Положение элементов - металлов в периодической системе, строение их атомов.
2. Металлы как простые вещества. Металлическая связь, металлические кристаллические решетки.
3. Общие физические свойства металлов.
4. Распространенность металлических элементов и их соединений в природе.
5. Химические свойства элементов-металлов.
6. Понятие о коррозии.
Содержание лекции:
1. Положение элементов - металлов в периодической системе, строение их атомов.
Из 110 элементов периодической системы более 80 - металлы.
Металлы - это химические элементы атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя превращаясь в положительные ионы.
Металличность определяется способностью атомов отдавать электроны. Чем меньше надо отдать электронов и чем легче их отдавать, тем ярче выражены металлические свойства атомов.
К элементам-металлам относятся s-элементы (за
исключением Н и Не), все d - и f-элементы. Среди p-элементов
металлические размещены в левой части периодической системы
химических элементов под диагональю Бор В - Астату At. Также
металлами являются элементы побочных подгрупп, т.к. они имеют на
последнем слое 2 электрона и у них происходит заполнение
d-подуровня предпоследнего слоя.
Для большинства элементов-металлов характерно небольшое количество
электронов на внешнем энергетическом уровне их атомов (от 1 до 3) и
сравнительно большие радиусы атомов(сурьма, висмут - 5, полоний - 6
электронов, но большой радиус атома), что обусловливает способность
атомов металлов легко терять валентные электроны и образовывать
положительно заряженный ион. Наиболее активным металлом является
франций.
( Краткая запись в конспект: I, II, III, группы( исключение Н, He, B), главные подгруппы, побочные подгруппы, лантаноиды, актиноиды. На внешнем энергетическом уровне 1-3 электрона ( s или p ), в образовании связи принимают участие d- е предыдущего уровня. Все металлы имеют во внешней оболочке по одному или два электрона, могут легко их отдавать, образуя ионы с устойчивыми конфигурациями благородных газов. Заряд катиона равен количеству отданных электронов): ( Ме - ne- = Men+)
2. Металлы как простые вещества. Металлическая связь, металлические кристаллические решетки.
Металлические элементы образуют простые вещества, то есть металлы. Например, Алюминий - алюминий; Феррум - железо; Купрум - медь; Аргентум - серебро.
Для металлов характерной является общая металлическая связь и физические свойства, вид химической связи - металлический. Металлическая связь - это связь между атомами и катионами металла посредством обобществённых электронов. Металлическая связь является не направленной, поскольку валентные электроны распределены по всему кристаллу почти равномерно. Он существует в кристаллах и расплавах металлов и сплавов, в чистом виде характерен для щелочных и щелочноземельных металлов. У переходных металлов связь между атомами частично ковалентным.
Металлы имеют металлическую кристаллическую решётку в узлах которой находятся атомы и катионы металлов, вследствие отдачи отдельными атомами валентных электронов, а пространство между ними заполнено «электронным газом», становятся обобществленными всеми ионами металла и прочно связывают.
Все металлы имеют кристаллическое строение. Тип
решетки зависит от химической природы и фазового состояния металла.
Она имеет формы: гексагональную, кубическую, гранецентрированную,
объёмноцентрированную.
3. Общие физические свойства металлов.
Наличие металлического связи обуславливает общие свойства металлов. Она определяет физические свойства металлов:
а) агрегатное состояние-все металлы твёрдые вещества и кристаллического строения, кроме ртути Hg и францию Fr; . Твердость - все металлы кроме ртути и галия, при обычных условиях твердые вещества. Самые мягкие - натрий, калий. Их можно резать ножом; самый твердый хром Cr и вольфрам W. - царапает стекло.
б) цвет- с металлическим блеском от серебристо-белого цвета (Ag, Al, Ni, Pa) до темного серебристо-серого (Fe, Pb), за исключением золота Au и меди Cu.
Металлический блеск - электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло. Лучше всего отражают свет индий In и серебро Ag. В порошке все металлы, кроме АI и Мg, теряют блеск и имеют черный или темно - серый цвет. По окраске металлы условно делят на черные и цветные. К черным металлам чаще всего относят железо и его сплавы (чугун, сталь). Все другие - называют цветными.
в) плавкость. Металлы делятся на легкоплавкие( tпл 350,самые низкаие: Hg= - 38,87, ), галий «плавится» на ладони, и тугоплавкие( tпл< 350-3 370- W). Легкоплавкие tпл - натрий, магний, алюминий; тугоплавкие - медь, железо, хром, титан, молибден.
г) электропроводность, теплопроводность металлов обусловлена их строением. (за счёт свободных электронов) и увеличивается в ряду напряжений Ме-ла ( Ag наивысший,на втором месте - медь Cu, далее золото Au и алюминий Al.).
Хаотически движущиеся электроны под действием электрического напряжения приобретают направленное движение, в результате чего возникает электрический ток. Металлы - хорошие проводники электрического тока и теплоты, причем их электро - и теплопроводность уменьшаются с повышением температуры.
Теплопроводность самая высокая у Hg. Холод металла объясняется тем что тепло ладони быстро передаётся Ме-лу, он становится более тёплым. А ладонь холодеет.
д) плотность. Металлы делятся на лёгкие, мягкие (0,5г/см- Li) и тяжелые (22.5г/см- Осмий). Среди тяжелых металлов (плотность более 5 г/см3) - цинк, железо, медь, свинец, ртуть, золото. Отличие по температуре плавления: Ртуть при комнатной температуре остается жидким и затвердевает только при температуре - 38,50 С; галлий плавится от тепла руки - его температура плавления составляет + 29,50 С, а чтобы расплавить вольфрам, его нужно нагреть до 34500С
е) пластичность (ковкость) - способности под ударами изменять свою форму без разрыва химических связей, объясняется возможностью перемещения (скольжения) одних слоёв металлов относительно других благодаря наличию «электронного газа». И поэтому металл характеризуется высокой пластичностью. Их можно прокатывать в тончайшие листы, проволоку, тоньше волоса. (самым ковким элементом есть золото - по 1 г этого металла можно вытянуть проволоку длиной 2,4 км в несколько сотен раз тоньше волоса). Стибий самый хрупкий (хром, манган тоже) - его можно растереть в порошок.
Все s-металлы горят в атмосфере воздуха, образуя оксиды одного или нескольких типов - оксиды состава Ме2О (I группа) и МеО (II группа), пероксиды состава Ме2О2 (I группа) и МеО2 (II) группа. Медь горит зелёным, Теллур горит синим, кальций - оранжево-красный, карминно-красный - литий. Магний и алюминий - ослепительно белый. Натрий придаёт пламени жёлтый цвет. Если в пламя внести крупинку поваренной соли (хлористого натрия, NaCl), то пламя окрашивается в интенсивный желтый цвет, и спектральный аппарат обнаруживает в желтой части спектра две близко расположенные линии, характерные для спектра паров натрия; KCl - в фиолетовый; Зеленая окраска пламени - "визитная карточка" бария, даже если он присутствует в микроскопических количествах. Когда во время салютов вы видите зеленые ракеты или как, разбрасывая искры, медленно горит зеленый бенгальский огонь, вспомните, что в их составе обязательно есть соли бария. К примеру, в состав зеленого бенгальского огня входят Ba(NO3)2 и BaCl2; От стронция пламя будет красным. Дополнение: «Несгораемая бумага»: Приготавливают насыщенный раствор калийной селитры KNO3, опускают в него на 5-7 минут лист газетной бумаги. По истечении указанного времени его вынимают из раствора и сушат. Затем вносят в пламя горелки, он не горит, а тлеет.
Можно приводить еще много примеров значительных различий в физических свойствах различных металлов.
Что же лежит в основе единства веществ, которые имеют свойства металлов?
Одна из главных идей химии заключается в том, что свойства веществ зависят от их состава и строения . Физические свойства металлов зависят не только от строения внешних электронных оболочек атомов, но и от других причин. 4. Применение металлов. Распространенность металлических элементов и их соединений в природе.
Эпиграф: «В начале был век
медный».
Все s - металлы встречаются в природе только в виде соединений, либо в составе минералов (KCI, NaCI, СаСОз и т.п.), либо в виде ионов в морской воде. Одни из них очень редко встречаются в природе, а некоторые наоборот, являются очень распространенными, например алюминий, железо, медь.
Так, кальций, натрий, калий и магний по распространенности на Земле занимают соответственно пятое, шестое, седьмое и восьмое места. Стронций распространен в умеренных количествах. Остальные s - металлы составляют незначительную часть земной коры и океанических вод.
Металлы имеют огромное значение в развитии человеческой цивилизации. С давних времен человечеству известны золото, серебро, медь и железо. Современная металлургия получает для нужд техники более 60 металлов и на их основе более 5000 сплавов.
Подавляющее большинство металлов встречается в природе в виде различных соединений. В свободном состоянии в земной коре встречаются лишь некоторые металлы:(это так называемые самородные металлы): золото Au, платина Pt и платиновые металлы - осмий Os, иридий Ir, рутений Ru, родий Rh, палладий Pd, иногда серебро Ag, ртуть Hg и медь Cu.
Природные минеральные соединения, из которых экономически целесообразно добывать металл в производственных условиях называют рудами. Важнейшими рудами являются оксиды, сульфиды и карбонаты металлических элементов.
Первым этапом переработки руд является удаление пустой породы - обогащение руды. Добывание металлов из руд основано на их восстановлении разными способами.
Природные минеральные образования, из которых технологически возможно и экономически целесообразно добывать металлы, называют рудами.В состав руды, кроме полезных минералов, входит еще пустая порода.
Важными рудами являются оксиды (Fe2O3, Fe3O4, Al2O3 • nH2O, MnO2 и др);сульфиды (ZnS, PbS, Cu2S, HgS и др.), соли (NaCl, KCl, MgCl2 CaCO3 и т. д.). Малоактивные металлы встречаются преимущественно в виде оксидов и сульфидов, а активные (щелочные и щелочноземельные) - исключительно в виде солей. В свободном состоянии в природе встречаются только неактивные металлы.
В зависимости от того, какие соединения металлов, содержащихся в руде, различают:
-оксидные руды - Fe3O4, Al2O3
-сульфидные руды - FeS2, MoS2
-хлоридные руды - NaCl, MgCl2
-карбонатные руды - CaCO3, FeCO3
Металлические руды - основное сырье металлургии, отрасли промышленности, производящей металлы.
Биологическая роль металлов:
- Кальций входит в состав костей и крови, а также в состав мела и извести;
- Магний - основа магнезии MgO, которую применяют в медицине при лечении повышенной кислотности и изжоги или при отравлении кислотами;
- Калий входит в состав минеральных удобрений и является необходимым для производства стекла и линз;
- Натрий входит в состав поваренной соли; простое вещество Na является основой пиропатрона, что надувает подушки безопасности в автомобилях;
- Палладий применяют в изготовлении белого золота или зубных протезов;
- Тантал и титан применяют в производстве костных протезов;
- Литий является частью аккумуляторов, в частности литий - ионного аккумулятора, а его соли используют в лечении психических заболеваний.
5.Химические свойства элементов-металлов. Во всех химических реакциях металлы являются восстановителями:
Характерной особенностью металлов является способность их атомов отдавать свои валентные электроны и образовывать положительно заряженные ионы. В отличие от неметаллов металлы отрицательно заряженных ионов не образуют. Итак, свободные металлы являются восстановителями. Чем легче данный металл отдает свои валентные электроны, тем он активнее восстановитель.
По химической активности металлы можно распределить на три группы: сильно активные - калий, натрий, барий, кальций и др., средней активности - цинк, железо, никель и т.п. и мало активные - серебро, золото и платина.
По активности металлы располагаются в ряд (ряд Бекетова, вытеснительными ряд, активности, электрохимический ряд металлов):
![]()
![]()
уменьшение химической активности
- каждый металл этого ряда может вытеснить из водного раствора соединения любой из металлических элементов, что стоит справа от него, и может быть вытеснен любым из металлов, стоящих слева;
- все металлы, стоящие левее водорода, могут вытеснять Водород из кислот, а те, что стоят справа, - не могут;
- чем левее стоит металл в ряду, тем он более сильный восстановитель и тем труднее восстановить его.
Металлы:
Взаимодействуют с неметаллами: При различных условиях металлы взаимодействуют с неметаллами, причём, чем больше активность металла и неметалла, тем мягче условия протекания реакции. Магний взаимодействует с серой с образованием сульфида магния, но для начала реакции требуется нагревание: Mg0 + S0 = Mg+2S-
Взаимодействие с галогенами: Каждый галоген является самым сильным окислителем в своем периоде. Элементы главной подгруппы VII группы Периодической системы, объединенные под общим названием галогены, фтор P, хлор Сl, бром Вr, иод I, астат Аt Окислительные свойства галогенов отчетливо проявляются при их взаимодействии с металлами. При этом, как вы уже знаете, образуются соли (отсюда и название подгруппы). Так, фтор уже при обычных условиях реагирует с большинством металлов, а при нагревании и с золотом, серебром, платиной, известными своей химической пассивностью. Алюминий и цинк в атмосфере фтора воспламеняются. Например, натрий реагирует с хлором при обычных условиях с образованием хлорида натрия: Na0 + Cl20 = 2Na+Cl-. Остальные галогены реагируют с металлами в основном при нагревании. Так, в колбе, наполненной хлором, красиво вспыхивают и сгорают кристаллики измельченной сурьмы (рис. 17), образуя при этом смесь двух хлоридов сурьмы(ІІІ) и (V).
Взаимодействуют с кислородом: По отношению металлов к кислороду их можно разделить на три группы. Металлы, реагирующие с кислородом при обычных условиях, например, 2Са0 + О20 = 2Са+2О-2. Металлы, взаимодействующие с кислородом только при нагревании, например, медь: 2Сu0 + O20 = 2Cu+2O-2. И третья группа - это металлы, не взаимодействующие с кислородом, например, золото, платина. Взаимодействуют с серой: В зависимости от активности металла сера может восстанавливаться до сероводорода H2S-2 , серы S0 или оксида серы(IV) S+4O2 .
Взаимодействуют с водой: (щелочные и щелочноземельные металлы взаимодействуют с водой при стандартных условиях с образованием щелочей): 2Na0 + 2H2+1O = 2Na+1OH + H20. Менее активные металлы реагируют с водой при нагревании:Zn0 + H2+1O = Zn+2O + H20.Золото, медь, серебро, платина, ртуть не взаимодействуют с водой. Взаимодействуют с кислотами: С растворами кислот взаимодействуют металлы, стоящие в ряду напряжения до водорода. В результате реакции образуются соль и водород. Например, Zn0 + 2H+1Cl = Zn+2Cl2 + H20. Разбавленная азотная и концентрированные серная и азотная кислоты способны взаимодействовать и с металлами, стоящими в ряду напряжения после водорода. Это объясняется тем, что они проявляют окислительные свойства за счёт S+6 и N+5. В результате реакций обязательно образуются соль и вода и ещё продукт восстановления S+6 или N+5. Например:
2H2S+6O4(конц.) + Cu0 = Cu0SO4 + H2O + S+4O2
8HN+5O3(разб.) + 3Cu0 = 3Cu+2(NO3)2 + H2O + 2N+2O
4HN+5O3(конц.) + Cu0 = Cu+2(NO3)2 + H2O + 2N+4O2
Взаимодействуют с солями (реакция происходит только в водном растворе: более активные металлы вытесняют менее активные):
Zn0 + Cu+2SO4 = Zn+2SO4 + Cu0.
Взаимодействуют с оксидами (активные металлы восстанавливают менее активные из оксидов при нагревании - металлотермия): Окисляемость. Она характеризует способность металлов соединяться с кислородом и образовывать оксиды.
Взаимодействуют со щелочами (металлы, которым соответствуют амфотерные гидроксиды реагируют с щелочами .
Железо, Fe - это элемент ПСХЭ. Его порядковый номер 26, 4-й период, VIII В - группа. Аr = 55,847. В атоме железа 26 протонов, 30 нейтронов, 26 электронов, которые образуют 4энергетических уровня. Электронная конфигурация показывает, что это d-элемент, т.к. электронами заполняется d-подуровень предпоследнего уровня, третий от ядра, уровень. На последнем уровне, как и у металлов главных подгрупп, небольшое число электронов, два электрона. В этом заключается общая особенность элементов побочных подгрупп. Как элемент побочной подгруппы, проявляет переменную степень окисления:+2,+3, реже +6; например, в соединении K2FeO4 - феррат калия. По распространению в земной коре железо занимает 4 - е место. И всё это железо находится в связанном состоянии.
В организме человека доля железа составляет ~ 0,005 -0,006%.
Качественная реакция :
2Fe2+ + 2К3 [Fe(CN)6] = Fe3 [Fe(CN)e]2+ 6К+
Fe203 - амфотерный оксид коричневого цвета, твердый, нерастворимый в воде.
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl - Бурый осадок. Осадок растворим и в кислотах, и в избытке щелочи:
Fe (ОН)3 + НС1 -»Fe(OH)3+NaOH
Элемент алюминий расположен в III группе, главной «А» подгруппе, 3 периоде периодической системы, порядковый номер №13, относительная атомная масса Ar(Al) = 27. Его соседом слева в таблице является магний - типичный металл, а справа - кремний - уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными.
Al +13 )2)8)3 , p - элемент, Алюминий проявляет в соединениях степень окисления +3:
Al0 - 3 e- → Al+3
Физические свойства алюминия.
Серебристо-белый металл, легкий и пластичный, р = 2,7 г / см3, ИПЛ = 660 ° С. Легко вытягивается в проволоку, прокатывается в листы и фольгу. По электропроводностью уступает лишь серебру и меди. Входит в состав легких сплавов.
Природные соединения алюминия:
• Каолинит А1203 • 2SiOa • 2Н20, входит в состав глины.
• Корунд А1203, кристаллы: красные (рубины), синие (сапфиры).
• Полевой шпат К20 • А1203 • 6Si02.
• Боксит А1203 гаН20.
• Нефелин Na20 • А1203 • 2SiOa.
• Криолит Na3 [AlF6].
Способы получения:
Получают электролизом А1203 в расплавленном криолите при температуре около 1000 ° С.
Химические свойства алюминия:
1) Взаимодействие с неметаллами.
Легко соединяется с галогенами при комнатной температуре:
2 А1 + С12 =2AlCl3
В результате нагрева:
2A1 + S = Al2S3
2) алюмотермия: Cr203 + 2А1 = А1203 + 2Cr
3) 3 водой не взаимодействует, поверхность металла защищена оксидной пленкой, но если снять ее, протекать реакция:
2А1 +6 Н20 = 2Al(OH)3 + 3H2
4) Алюминий легко взаимодействует с растворами кислот.
Al + HNO3 (разб.) = Аl(NO3)3 + 3NO2 + 3Н2О.
Al + H2S04 (конц.) = Аl2(SО4)3 + 3SО2 + 6Н2О
5) реагирует со щелочами при нагревании:
2А1 + 2NaOH + 2Н20 = 2NaA102 + Н20
6) восстанавливает металлы из их оксидов.
3 Fe3O4 + 8 Al = 4 Al2O3 + 9 Fe +Q
7) С растворами солей:
2Al + 3CuSO4 = Al2(SO4)3 + 3Cu.
Контроль знаний:
1. У какого элемента ярче выражены металлические свойства? (по группам и периодам в периодической системе).
2. Какие средства борьбы с коррозией вы знаете.
3. При взаимодействии магния массой 45,78 г. с разбавленным раствором серной кислоты образовалась соль. Сколько соли по массе образовалось?
4. Какие общие физические свойства имеют все металлы?
5.Почему металлы отличаются физическими свойствами? 6. Какой металл имеет низкую температуру плавления?
7. Какой металл наиболее электропроводный?
8. Какой металл является наиболее пластичный?
9. В чем причина различия между свойствами алюминия, кальция и калия?
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л2.стр.119-123, 150-155, пересказ конспекта лекции №6.
Подготовить сообщение о применении металлов в технике и народном хозяйстве, охране окружающей среды в черной металлургии. Задача: 1) Вычислить массу хрома, полученного силикатотермическим способом из 800 г хром (III) оксида с массовой долей примесей 0,22%. (427 г).
Лекция № 7.
Тема: Взаимодействие щелочных и щелочноземельных металлов с водой. Электрохимический ряд напряжений металлов. Взаимодействие металлов с растворами кислот и солей. Алюминотермия. Взаимодействие натрия с этанолом и фенолом.
Основные понятия: щелочные и щелочноземельные металлы, пероксиды, восстановитель, окислитель.
План изучения темы
(перечень вопросов, обязательных к изучению):
1. Щелочные, щелочноземельные элементы.
2. Физические и химические свойства простых веществ, основной характер их оксидов и гидроксидов.
4. Понятие о жесткости воды (постоянную, временную) и методы ее устранения (уменьшения).
Содержание лекции:
-
Щелочные, щелочноземельные элементы.
Среди щелочных металлов важное практическое значение имеют элементы Натрий и Калий. Размещение электронов по энергетическим ячейкам:
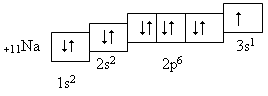
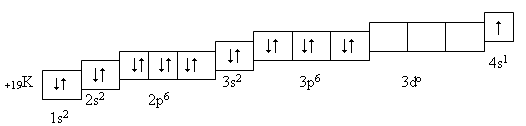
Некоторые свойства щелочных металлов.
Щелочные металлы в природе в свободном состоянии не встречаются, только в виде соединений.
Характерной чертой строения атомов щелочных
металлов является наличие одного электрона на внешнем электронном
уровне. Благодаря этому все они с легкостью отдают электрон,
переходя к законченной электронной оболочке предыдущего уровня и
являются очень сильными восстановителями.
Хотя щелочные металлы чрезвычайно распространены на Земле, в
природе они существуют исключительно в виде соединений через
высокую восстановительную активность. Na, K открыты Гемфри Дэви в
1807 г., который первым начал широко применять электролиз. Щелочные
металлы - мягкие (натрий режется ножом, как сливочное масло, другие
немного жестче) металлы от серебристо-белого до серого цвета с
характерным блеском, что очень быстро тускнеют на воздухе.
Легкоплавкие и подвижные. Агрессивные, взрывоопасные (сохраняются в
атмосфере инертного газа или под слоем керосина).
К семейству щелочноземельных элементов входят элементы II группы главной подгруппы: Кальций, стронций, барий, радий. В названии семьи присутствует составляющая щелочное том, что растворы их гидратов оксидов тоже мылкие на ощупь.
Вторая составляющая названия - земельные связана
с тем, что окислы этих элементов впервые были выделены из минералов
земной коры.
У всех представителей этой семьи одинаковое строение внешнего
энергетического уровня, на нем размещены 2 электрона. Способность
отдавать 2 внешних валентных электрона возрастает в подгруппе с
увеличением атомного радиуса и атомного номера элемента.
Максимальная степень окисления равна +2.
Физические и химические свойства простых веществ, основной характер их оксидов и гидроксидов.
Щелочные металлы - мягкие (натрий режется ножом, как сливочное масло, другие немного жестче) металлы от серебристо-белого до серого цвета с характерным блеском, что очень быстро тускнеют на воздухе. Легкоплавкие и подвижные. Агрессивные, взрывоопасные (сохраняются в атмосфере инертного газа или под слоем керосина). В свободном состоянии все металлы ІІА - подгруппы - серебристо-белые
вещества за исключением бериллия, который имеет светло-серый цвет.
Химические свойства.
1. Легко реагируют с кислородом воздуха. Литий при окислении образует оксид Lі2O, остальные - пероксиды и супероксиды:
4Li + O2 = 2Li2O
4Na + O2 = 2Na2O
4K + O2 = 2K2O
2.Легко и со взрывом реагируют с водой: 2Na + 2H2O = 2NaOH + H2 3.Легко реагируют с неметалами: Na + S = Na2S 2K + Br2 = 2KBr
За исключением бериллия и радия, все они являются достаточно ковкими, пластичными и мягкими, хоть и тверже щелочные металлы. Бериллий отличается значительной твердостью и хрупкостью, барий при резком сильном ударе раскалывается на отдельные куски.
Температуры плавления и кипения этих металлов
выше, чем в щелочных, причем с ростом порядкового номера
Тпл. меняются не монотонно, что связано с измененной
типа кристаллических решеток От Be к Mg при одинаковом типе решетки
температуры плавления уменьшаются. При переходе от Mg к Са
изменяется тип кристаллической решетки, поэтому Тпл.
(Mg) < Тпл. (Са). Затем, начиная от Са, температуры
плавления вновь уменьшаются. Тип связи - металлический -
предопределяет высокую тепло - и электропроводность.
Бериллий и магний покрыты оксидной пленкой и не изменяются на
воздухе. Благодаря химической активности и для предотвращения
взаимодействия с воздухом щелочноземельные металлы хранят в
запаянных ампулах, под слоем керосина.
Таблица химических свойств щелочноземельных металлов.Условия протекания реакции
Продукты реакции
Примеры уравнений реакции
Выявляют свойства активных восстановителей, приобретают степень окисления + 2
Взаимодействия с простыми веществами
С кислородом воздуха
Оксиды
2Mg + O2 = 2 MgO
2Ca + O2 = 2 CaO
С серой при нагревании
Сульфиды
Ba + S = BaS
Mg + S = MgS
Ca + S = CaS
С галогенами
Галогениды
Ca + Cl2 = CaCl2
Mg + Br2 = MgBr2
Ba + I2 = BaI2
С азотом при нагревании
Нитриды
3Ba + N2 =
Ba3N2
2Ca + N2 = Ca3N2
Mg + N2 = Mg3N2
С фосфором при t0
Фосфиды
3Ca + 2 P = Ca3P2
3Mg + 2 P = Mg3P2
С водородом при нагревании
Гидриды
Ca + H2 = CaH2
Mg + H2 = MgH2
Взаимодействие со сложными веществами
Магний свободно растворяется в воде кипящей, остальные металлы энергично-взаимодействуют с водой
Гидроксид и водород
Ba + 2H2O = Ba(OH)2 +
H2↑
Mg + H2O = MgO + H2↑
Ca + 2H2O = Ca(OH)2 + H2↑
Все металлы растворяются в сильных кислотах
Соль и водород
Ca + 2HCl = CaCl2 +
H2↑
Mg+ H2SO4 = MgSO4+ H2↑
Оксиды и гидроксиды щелочноземельных элементов имеют четко выраженные основные свойства. В подтверждение этого проведем демонстрационный опыт. К небольшому количеству порошка кальций оксида, насыпанного в фарфоровую чашку, добавим воды - наблюдаем бурное взаимодействие, сопровождающееся вспениванием содержимого чашки. Если к полученному раствору добавить несколько капель индикатора фенолфталеина, то он вступит малинового цвета, что свидетельствует о наличии щелочи:
СаО + Н20 = Са(ОН)2
(эта реакция имеет название «гашение» негашеной
извести).
Добывают в технике термическим разложением соответствующих
природных карбонатов:
MgCO3 = MgO + CO2↑ CaCO3 = CaO +
CO2↑
Все оксиды - тугоплавкие вещества. Магний оксид с водой не реагирует; оксиды щелочноземельных элементов энергично реагируют с водой:
MgO + H2O ≠ BaO + H2O = Ba(OH)2
CaO + H2O = Ca(OH)2
Выявляют характерные свойства основных оксидов:
реагируют с кислотами и кислотными оксидами с образованием
солей.
MgO + H2SO4 = MgSO4 +
H2O
CaО+H2S04 = CaS04+ Н20
CaO + SO3 = CaSO4
Гидроксиды Магния и щелочноземельных элементов.
Магний гидроксид добывают из растворимых солей Магния действием растворов щелочей:
MgSO4 + 2KOH = Mg(OH)2↓ +
K2SO4
Гидроксиды щелочноземельных металлов получают при взаимодействии соответствующих оксидов с водой:
SrO + H2O = Sr(OH)2
Mg(OH)2 - плохо растворим в воде,
основание средней силы. Кальций гидроксид (гашеная известь) -
малорастворимое в воде вещество. Насыщенный раствор
Са(ОН)2 - называют известковой водой. Sr(OH)2
и Ba(OH)2 - гидроксиды хорошо растворимые в воде.
Гидроксиды Магния и щелочноземельных элементов разлагаются при
нагревании:
Ba(OH)2 = BaO + H2O
Mg(OH)2 = MgO + H2O
Другое общее свойство этих гидроксидов -
взаимодействие в растворимые с кислотами и кислотными оксидами с
образованием солей:
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
Ba(OH)2 + CO2 = BaCO3↓ + H2O
Вследствие осаждения ВаСО3 раствор баритовой воды мутнеет; эта реакция используется для обнаружения углекислого газа.
Распространение в природе: Содержание Кальция в земной коре - 4,1%, а Магния - 1,87 %. Кальций и Магний входят в состав осадочных горных пород, различных минералов (известняк, мрамор, мел - СаСО3, гипс - СаSO4 • 2Н2O; фосфориты и апатиты - Са3(РO4)2; доломит - СаСО3 • МgСО3, магнетит - МgСО3).
Применение: Магний - для получения легких сплавов (дюралюминия). Добавляют его и к чугунку с целью улучшения механических свойств чугуна. Кальций - используют в металлургии для очистки чугунка и стали от оксидов.
Гидроксиды щелочных металлов NaOH, KOH -
кристаллические вещества ионного строения, белого цвета, легко
поглощают влагу, особенно натрий гидроксид NaOH, хорошо
растворяются в воде с выделением большого количества теплоты.
Гидроксиды натрия и калия разъедают ткани, кожу, органические
вещества, поэтому их называют едкими щелочами.
В водных растворах гидроксиды щелочных металлов полностью
диссоциируют на ионы:
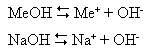
Действие кислот на индикаторы:Лакмус
Метиловый -оранжевый
Фенолфталеин
Универсальный индикатор
Синий
Желтый
Малиновый
Синий
Для додавання перекладу у вибране
потрібно авторизуватися.
Гидроксиды щелочных металлов вступают в реакцию нейтрализации с кислотами, образуя средние или кислые соли и воду:
2NaOH + H2SO4 = Na2SO4 + 2H2O
NaOH + H2SO4 = NaHSO4 + H2O
1. Взаимодействие с кислотными оксидами:
2KOH + SO3 = K2SO4 + H2O
2NaOH + SiO2 = Na2SiO3 + H2O - сплав
2. Взаимодействие с амфотерными оксидами:
2NaOH + ZnO = Na2ZnO2 + H2O - сплав
2KOH + Al2O3 = 2KAlO2 + H2O - сплав
3. Взаимодействие с амфотерными гидроксидами:2NaOH + Zn(OH)2 = Na2ZnO2 + 2H2O - сплав
2NaOH + Zn(OH)2 = Na2[Zn(OH)4] - в растворе
4. Взаимодействие с металлами, которым соответствуют амфотерные гидроксиды:
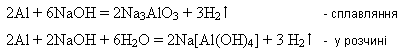
5.Взаимодействие с солями:
Реакция между гидроксидами и солями происходит по типу реакции обмена, которая проходит только в растворе, при этом образуются основные соли, или нерастворимые в воде основания:
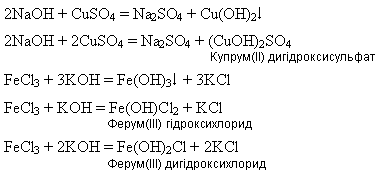
6. Взаимодействие с ацетатом натрия:
![]()
Жесткость воды, ее виды, методы ее устранения.
Жесткость воды - свойство природной воды, обусловленная наличием в
ней растворенных солей Кальция и Магния. Суммарное их содержание в
воде называется общей жесткостью.
Жесткость воды бывает двух типов:
- карбонатная (временная);
- не карбонатная (постоянная).
Чем выше в воде содержание ионов Са2+ та
Mg2+, тем большей будет ее твердость.
Карбонатная жесткость воды обусловливается тем, что взаимодействуя
с карбон (IV) оксидом, который содержится в воздухе, карбонаты
Кальция и Магния превращаются в растворимые кислые соли -
гидрогенкарбонаты:
СО2 + Н2О Н2СО3
СаСО3 + Н2О + СО2 → Са(НСО3)2
MgCO3 + Н2О + СО2 → Mg(НСО3)2
Карбонатную или временную жесткость воды можно устранить простым кипячением, в результате которого гидрогенкарбонаты превращаются в нерастворимые в воде карбонаты Кальция и Магния:
Са(НСО3)2 = СаСО3↓ + Н2О + СО2↑
Mg(НСО3)2 = MgCO3↓ + Н2О + СО2↑
Другой способ устранения временной жесткости - действие известковым молоком или содой:
Ca(OH)2 + Ca(HCO3)2 = 2CaCO3↓ + 2H2O
Ca(OH)2 + Mg(HCO3)2 = CaCO3↓ + MgCO3↓ + 2H2O
Ca(HCO3)2 + Na2CO3 = CaCO3↓ + 2NaHCO3
Mg(HCO3)2 + Na2CO3 = MgCO3↓ + 2NaHCO3
Некарбонатная или постоянная жесткость воды
обусловлена содержанием в воде сульфатов и хлоридов Кальция и
Магния. Ее также можно устранить, но сделать это гораздо
труднее.
Постоянную жесткость воды устраняют действием соды или натрий
ортофосфата. При этом происходят следующие реакции:
Ca2+ + Na2CO3 = CaCO3↓ + 2Na+
MgSO4 + Na2CO3 = MgCO3↓ + Na2SO4
3MgSO4 + 2Na3РO4 = Mg3(РO4)2↓ + 3Na2SO4
Для хозяйственно-бытовых нужд следует
использовать воду с незначительной твердостью, ибо от ее кипячения
образуется накипь.
Накипь плохо проводит теплоту, поэтому возможен перегрев
двигателей, паровых котлов, кроме того, ускоряется их износ.
Жесткая вода затрудняет крашение и стирка ткани, не пригодна для
варки мыла и приготовления эмульсий в парфюмерном производстве.
Контроль знаний:
1. Дайте определение карбонатной жесткости воды.
2. Какие средства ее устранения вам известны?
3. Какие ионы обусловливают жесткость воды?
4. Какие способы устранения карбонатной жесткости вы знаете?
5. Запишите формулы соединения, которая имеет
электронную конфигурацию:
а). …3s23p4 б). …6s26p2
в). …4s24p4. г) …4s13d5
6. Назовите элементы, которые относят к щелочным металлов.
7. Какую роль в организме имеют щелочные металлы?
8. Напишите уравнения химических реакций, чтобы осуществить цепочку
превращений: Ca → CaO → Ca(OH)2 → CaCO3 →
CaHCO3
9. В чем причина различия между свойствами алюминия, кальция и калия?
• Как можно объяснить эти различия учитывая строение их атомов?
- Могут ли быть Al изделия дороже золотых?
- В каких цистернах можно без боязни перевозить
кислоты HNO3 и H2SO4?
- Почему щелочные растворы нельзя хранить в алюминиевой посуде?
- Почему бытовые изделия из алюминия служат долго и не подвергаются
коррозии?
-Недавно во Флориде построен первый дом из алюминия. Алюминий был
получен при переработке вторичного сырья. Всего на сооружение дома
потребовалось более полмиллиарда единиц этого вторичного сырья. Что
это за сырьё?
- Почему алюминий называют металлом будущего?
Задача: Доля железа в организме человека 0,005-0,006% от общей массы тела. Зная массу своего тела, вычислите массу железа в вашем организме. Ответ. Например, масса тела 60 кг: m(Fe) = 60 кг • 0,005 : 100% = 0, 003кг(3г).
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л2.стр.124-133, пересказ конспекта лекции №8.
Дописать уравнения реакций:
1) Na2O2 + KJ + H2SO4 = J2 +
2) Na2O2 + Fe(OH)2 + H2O =
3) NaH + H2O = H2 + …
4) Na2O2 +KMnO4 + H2SO4 = MnSO4
5) Na + H2 =
6) Li3N + H2 = LiH +
Подготовить сообщения:
1. Положение алюминия в периодической системе, строение атома.
2. Физические свойства алюминия.
3. Природные соединения алюминия.
4. Способы получения алюминия.
Решить задачу: Гидрид натрия NaH взаимодействует с водой с образованием щелочи и газообразного водорода. Напишите химическое уравнение этой реакции. Вычислите объем водорода, образующегося из 60 г. гидрида натрия.
ОРГАНИЧЕСКАЯ ХИМИЯ
Лекция № 8.
Тема: Введение: Предмет органической химии. Сравнение органических соединений с неорганическими. Валентность. Основные положения теории химического строения органических соединений. Понятие о гомологии и гомологах, изомерии и изомерах.
Основные понятия и термины по теме: изомеры, углеродный скелет, углеводороды, функциональные группы, гомологические группы и ряды, номенклатура органических соединений, радикальные реакции, галогенирование, полимеризация.
План изучения темы
(перечень вопросов, обязательных к изучению):
1. Предмет органической химии. Сравнение органических соединений с
неорганическими.
2. Теория химического строения органических соединений А. М.
Бутлерова.
3. Явление изомерии. Структурная изомерия, номенклатура.
4.Значение теории химического строения.
5. Многообразие органических соединений.
6. Классификация насыщенных углеводородов, номенклатура.
Содержание лекции:
-
Предмет органической химии. Сравнение органических соединений с неорганическими.
Органическая химия - это раздел химической науки, в котором изучаются соединения углерода и их превращения.
Однако сам карбон и некоторые простейшие его
соединения, такие как оксид углерода (II), оксид углерода (IV),
угольная кислота, карбонаты, карбиды и т.п., по характеру свойств
относятся к неорганическим соединениям. Поэтому часто используется
и другое определение:
Органические соединения - это углеводороды (соединения углерода с
водородом) и их производные.
Благодаря особым свойствам элемента углерода,
органические соединения очень многочисленные. Сейчас известно более
20 миллионов синтетических и природных органических веществ, и их
число постоянно растет. Органические соединения играют важную роль
в различных сферах нашей жизни. Органическая химия занимает ведущее
место в естествознании благодаря тому, что человек получил для
своих нужд топливо, резину, краски, клеи, моющие средства,
лекарства, одежду, обувь, еду, вещи быта, труда, отдыха.
Углерод - особый элемент. Ни один другой химический элемент не
способен образовывать такое многообразие соединений.
Причина этого многообразия в том, что атомы
углерода способны:
1) соединяться друг с другом в цепи различного строения: открытые
(неразветвленные, разветвленные), замкнутые:
| | | | | | |
-c-c-c-c- -c-c-c-
| | | | | | |
2) образовывать не только простые (одинарные), но и кратные (двойные, тройные) связи: > С = С < - С ≡С -
-НС=С=СН - НС=С-С≡СН-
3) образовывать прочные связи почти с любым другим элементом.
Эти уникальные свойства углерода объясняются
сочетанием двух факторов:
• наличие на внешнем энергетическом уровне (2s и 2p) четырех
электронов (поэтому атом углерода не склонен ни терять, ни
приобретать свободные электроны с образованием ионов) и четырех
валентных орбиталей;
• малый размер атома (в сравнении с другими элементами IV
группы).
Вследствие этого углерод образует главным образом ковалентные, а не
ионные связи, и проявляет валентность, равную 4.
Органические соединения отличаются от неорганических характерными чертами:
• почти все органические вещества горят или
легко разрушаются при нагревании с окислителями, выделяя
СО2 (по этому признаку можно установить принадлежность
исследуемого вещества к органическим соединениям);
• в молекулах органических соединений углерод может быть соединен
почти с любым элементом Периодической системы;
• органические молекулы могут содержать последовательность атомов
углерода, соединенных цепи (открытые или замкнутые);
• молекулы большинства органических соединений не диссоциирует на достаточно устойчивые ионы;
• реакции органических соединений протекают значительно медленнее и в большинстве случаев не доходят до конца;
• среди органических соединений широко распространено явление изомерии;
•органические вещества имеют более низкие температуры фазовых переходов (т.кип., т.пл.).
Органические соединения содержатся во всех живых организмах.
Есть много современных продуктов и материалов, без которых человек не может обходиться, которые также относятся к органическим соединениям.
-
Для додавання перекладу у вибране
потрібно авторизуватися.
2. Теория химического строения органических соединений А. М. Бутлерова.
Решающая роль в создании теории строения органических соединений
принадлежит великому русскому ученому Александру Михайловичу
Бутлерову.
19 сентября 1861 года на 36-м съезде немецких
естествоиспытателей А.М.Бутлеров обнародовал ее в докладе "О
химическом строение вещества".
Основные положения теории химического строения А.М. Бутлерова:
1. Атомы в молекулах соединены друг с другом
в определенной последовательности согласно их валентностям.
Последовательность межатомных связей в молекуле называется ее
химическим строением и отражается одной структурной формулой
(формулой строения).(В соответствии с этими представлениями
валентность элементов условно изображают черточками,) Такое
схематичное изображение строения молекул называют формулами
строения и структурными формулами. 2. Химическое строение можно
устанавливать химическими методами. (В настоящее время используются
также современные физические методы). 3. Свойства веществ
зависят от их химического строения. Свойства вещества зависят не
только от того какие атомы и сколько их входит в состав молекул, но
и от порядка соединения атомов в молекулах.(т.е. свойства зависят
от строения) Данное положение теории строения орг.веществ
объяснило, в частности, явление изомерии. Существуют соединения,
которые содержат одинаковое число атомов одних и тех же элементов,
но связанных в различном порядке. Такие соединения обладают разными
свойствами и называются изомерами.
Явление существования веществ с одинаковым составом, но разным
строением и свойствами называется изомерией
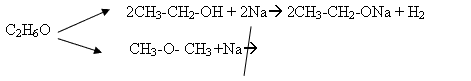
4. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы - предвидеть свойства.
5. Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Первое положение. Атомы в молекулах соединяются в определенном
порядке в соответствии с их валентностью. Углерод во всех
органических и в большинстве неорганических соединений
четырехвалентен.
Очевидно, что последнюю часть первого положения теории легко
объяснить тем, что в соединениях атомы углерода находятся в
возбужденном состоянии:
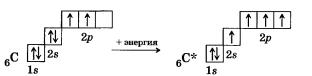
а) атомы четырехвалентного углерода могут соединяться друг с другом, образуя различные цепи:
- открытые разветвленные;
- открытые неразветвленные:
- замкнутые .
б) порядок соединения атомов углерода в молекулах может быть различным и зависит от вида ковалентной химической связи между атомами углерода - одинарной или кратной (двойной и тройной).
Второе положение. Свойства веществ зависят не только от их
качественного и количественного состава, но и от строения их
молекул.
Это положение объясняет явление изомерии.
Явление изомерии. Структурная изомерия, номенклатура.
Вещества, имеющие одинаковый состав, но разное химическое или пространственное строение, а следовательно, и разные свойства, называют изомерами. Основные виды изомерии:
Структурная изомерия, при которой вещества различаются порядком связи атомов в молекулах:
-
изомерия углеродного скелета
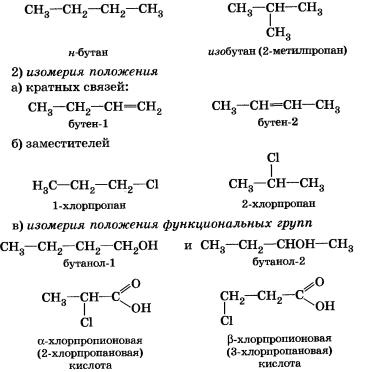
-
изомерия гомологических рядов (межклассовая)
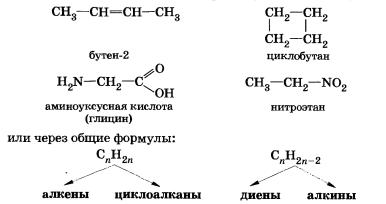
Пространственная изомерия, при которой молекулы веществ отличаются не порядком связи атомов, а положением их в пространстве: цис-транс-изомерия (геометрическая).
Эта изомерия характерна для веществ, молекулы которых имеют плоское строение: алкенов, циклоалканов и др.
Если два атома Углерода образуют двойную связь, то валентные орбитали каждого из них находятся в состоянии sp2 - гибридизации. Каждый из атомов Углерода образует по три связи, которые находятся в одной плоскости и направлены к вершинам равностороннего треугольника. Связь между атомами Углерода расположен в плоскости, что является перпендикулярной к плоскости, в которой расположены связи. То есть, связи и связь расположены во взаимно перпендикулярных плоскостях.
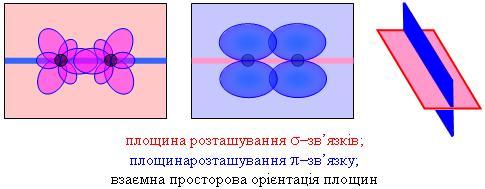
Рассмотренное строение молекул с двойной связью обусловливает так называемую цис - и транс - изомерию. К цис - изомеров относят такие, которые имеют одинаковые заместители по одну сторону от плоскости, в которой расположена связь. К транс -изомерам относят такие, которые имеют одинаковые заместители по разные стороны от плоскости, в которой расположена связь.
К пространственной изомерии относится и
оптическая (зеркальная) изомерия.
Четыре одинарные связи вокруг атома углерода, как вы уже знаете,
расположены тетраэдрически.
Если атом углерода связан с четырьмя различными атомами или группами, то возможно разное расположение этих групп в пространстве, то есть две пространственные изомерные формы.
Представьте себе, что молекулу аланина поместили перед зеркалом. Группа -NH2 находится ближе к зеркалу, поэтому в отражении она будет впереди, а группа -СООН - на заднем плане и т. д. (см. изображение справа). Алании существует в двух пространственных формах, которые при наложении не совмещаются одна с другой.
Динамическая изомерия (таутомерия) определяется сосуществованием различных изомеров, которые при обычных условиях могут переходить один в другой.
Глюкоза может образовывать одну линейную и две циклические формы сосуществуют при обычных условиях:
β- Глюкоза и α-глюкоза отличаются положением гидроксогрупп у
атома Углерода С1.
Универсальность второго положения теории
строения химических соединений подтверждает существование
неорганических изомеров.
Так, первый из синтезов органических веществ - синтез мочевины,
проведенный Велером (1828 г.), показал, что изомерны неорганическое
вещество - цианат аммония и органическое - мочевина:

Если заменить атом кислорода в мочевине на атом серы, то получится тиомочевина, которая изомерна роданиду аммония, хорошо известному вам реактиву на ионы Fе3+. Очевидно, что тиомочевина не дает этой качественной реакции.
Третье положение. Свойства веществ зависят от
взаимного влияния атомов в молекулах.Например, в уксусной кислоте в
реакцию со щелочью вступает только один из четырех атомов водорода.
На основании этого можно предположить, что только один атом
водорода связан с кислородом:
![]()
Чтобы убедиться в универсальности положения теории строения о зависимости свойств веществ от взаимного влияния атомов в молекулах, которое существует не только у органических, но и у неорганических соединений, сравним свойства атомов водорода в водородных соединениях неметаллов. Они имеют молекулярное строение и в обычных условиях представляют собой газы или летучие жидкости. В зависимости от положения неметалла в Периодической системе Д. И. Менделеева можно выявить закономерность в изменении свойств таких соединений:
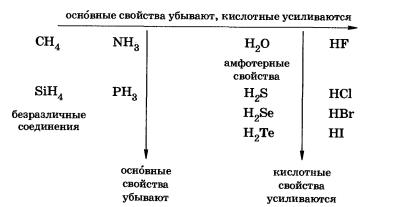
Метан не взаимодействует с водой. Отсутствие
основных свойств у метана объясняется насыщенностью валентных
возможностей атома углерода.
Аммиак проявляет основные свойства. Его молекула способна
присоединять к себе ион водорода за счет его притяжения к не
поделённой электронной паре атома азота (донорно-акцепторный
механизм образования связи).
В периодах слева направо увеличиваются заряды ядер атомов, уменьшаются радиусы атомов, увеличивается сила отталкивания атома водорода с частичным положительным зарядом §+, а потому кислотные свойства водородных соединений неметаллов усиливаются.
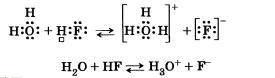
4.Значение теории химического строения А. М. Бутлерова для органической химии можно сравнить со значением Периодического закона и Периодической системы химических элементов Д. И. Менделеева для неорганической химии.
Теория объяснила неясности и противоречия в знаниях об окружающем мире; творчески обобщила достижения в области химии; представила качественно новый подход к пониманию строения и свойств веществ; указала направления и возможные пути получения новых веществ, необходимых людям.
Номенклатура органических веществ и ее виды. Номенклатура - совокупность названий индивидуальных химических веществ, их групп и классов, а также правила составления их названий. Название вещества должно отражать не только его качественный и количественный состав, но и однозначно показывать его химическое строение, названию должна соответствовать единственная формула строения.
В настоящее время для наименования органических соединений применяются три типа номенклатуры: тривиальная, рациональная и систематическая номенклатура - номенклатура IUPAC (ИЮПАК) - (Международного союза теоретической и прикладной химии).
(Вспомним русский язык. Из каких частей состоит слово? : Приставка, корень, суффиксы, окончание.)
Название органического соединения так же состоит из приставки (префикса), корня, суффикса первого порядка, суффикса второго порядка. Корень слова определяет основную цепь органического соединения, зависит от количества атомов в цепи.
Префиксы указывают на наличие функциональной группы (кроме старшей), радикалы. Радикалы образованы из предельных углеводородов отнятием водорода от конечного углеродного атома называют заменяя суффикс «ан в названии углеводорода суффиксом «ил». Например, метан- метил. (Кассы неорганических соединений и название характеристических групп.)
Суффикс первого порядка указывает на определенный вид связи атомов углерода в соединении. Суффикс второго порядка указывает на наличие старшей функциональной группы.
В названии органического соединения используют локанты и множительные приставки. Локанты - цифры или буквы указывающие положение заместителей и кратных связей. Они могут ставятся перед префиксом или после суффикса. Множительные приставки указывают число одинаковых заместителей или кратных связей. ( ди-, три-, тетро-, пенто-) Составления структурных формул по названию органического соединения. Разберем на составные части название органического соединения:
3-этилпентан .
Определим корень (слово, указывающее наибольшее количество атомов углерода) пент. Выделим значком для корня. Перед корнем выделяем префикс 3-этил. После корня укажем суффикс «ан».
![]()
Составим структурную формулу по плану:
-
Составляем цепь из углеродов, в количестве указанном в корне.
-
Прономеруем атомы углерода.
-
Укажем радикал у третьего атома углерода, согласно префиксу.
-
Суффикс «ан» указывает на одинарную связь между атомами углерода.
-
Допишем недостающие атомы водорода, согласно валентности.
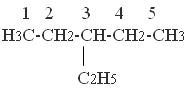
Составьте, самостоятельно, в тетрадях структурную формулу
2-метилбутанол-2.
А 15 B молекуле этилена имеются1)
две s- и две p-связи
2)
две s- и три p-связи ![]()
3)
пять s- и одна p-связь Корень эт - С2 ; Суффикс илен = связь
4)
три s- и две p-связи
проставим недостающие атомы водорода
Ответ: пять s- и одна p-связь. А 15-3
Составления названий органических соединений по структурной формуле.
Выполним обратное задание. Составим название органического соединения по ее структурной формуле. (Прочитайте правила составления названий органических соединений. Составите название органического соединения по структурной формуле.)

4. Многообразие органических соединений.
Ежедневно количество добытых и описанных
химиками органических веществ возрастает почти на тысячу. Сейчас их
известно около 20 миллионов (неорганических соединений существует в
десятки раз меньше).
Причиной многообразия органических соединений является уникальность
атомов Карбона, а именно:
- достаточно высокая валентность - 4;
- возможность создания простых, двойных и тройных ковалентных связей;
- способность сочетаться друг с другом;
- возможность образования линейных цепей, разветвленных, а также замкнутых, которые называют циклами.
Среди органических веществ наибольшее соединений Карбона с
Гидрогеном; их называют углеводородами. Это название происходит от
старых названий элементов - "углерод" и "водород".
Современная классификация органических
соединений базируется на теории химического строения. В основу
классификации положены особенности строения углеродной цепи
углеводородов, поскольку они просты по составу и в большинстве
известных органических веществ углеводородные радикалы составляют
основную часть молекулы.
5. Классификация насыщенных углеводородов.
Органические соединения можно классифицировать:
1) по структуре их карбонового каркаса. В основе такой
классификации лежат четыре главных класса органических соединений
(алифатические соединения, алициклические соединения, ароматические
соединения и гетероциклические соединения);
2) по функциональным группам.
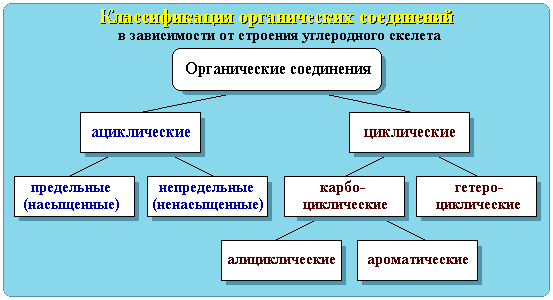
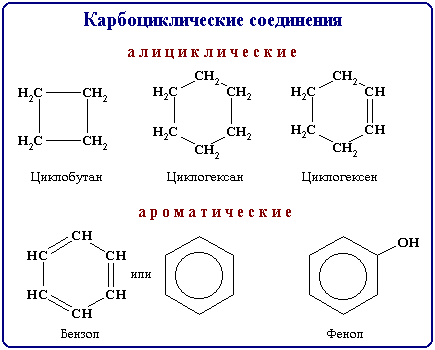
Ациклические (нециклические, цепные) соединения называют также жирными или алифатическими. Эти названия связаны с тем, что одними из первых хорошо изученных соединений такого типа были природные жиры.
Среди разнообразия органических соединений можно выделить группы веществ, которые сходны по своим свойствам и отличаются между собой на группу - СН2.
-
Соединения, сходные по химическим свойствам и состав которых отличается между собой на группу - СН2, называются гомологами.
-
Гомологи, расположенные в порядке возрастания их относительной молекулярной массы, образуют гомологический ряд.
-
Группа - СН22, называется гомологической разностью.
Примером гомологического ряда может быть ряд
насыщенных углеводородов (алканов). Самый простой его представитель
- метан СН4. Окончание -ан характерно для названий
предельных углеводородов. Далее идут этан
С2Н6, пропан СзН8, бутан
С4Н10. Начиная с пятого углеводорода,
название образуется из греческого числительного, указывающего число
углеродных атомов в молекуле, и окончание -ан. Это пентан
С5Н12, гексан С6Н14,
гептан С7Н16, октан
С8Н18, нонан СдН20, декан
С10Н22 и т. д.
Формулу любого следующего гомолога можно получить добавлением к
формуле предыдущего углеводорода гомологической разности.
Четыре С-Н связи, например, в метане, равноценны и размещены
симметрично (тетраэдрично) под углом 109028 относительно
друг друга. Это объясняется тем, что одна 2s и три 2p-орбитали
объединяются так, чтобы образовать четыре новые (идентичные)
орбитали, способные дать более прочные связи. Эти орбитали
направлены к вершинам тетраэдра - такого размещения, когда орбитали
максимально удалены друг от друга. Такие новые орбитали называются
sp3 - гибридизоваными атомными орбиталями.
Наиболее удобной номенклатурой, что дает
возможность называть любые соединения, является систематическая
номенклатура органических соединений.
Чаще всего систематические названия основываются на принципе
замещения, то есть любое соединение рассматривается как
неразветвленный углеводород - ациклический или циклический, в
молекуле которого один или несколько атомов Водорода замещены
другими атомами и группами, в том числе углеводородными остатками.
С развитием органической химии систематическая номенклатура
постоянно совершенствуется и дополняется, за этим следит комиссия
по номенклатуре Международного союза теоретической и прикладной
химии (Internation Union of Pure and Applied Chemistry - IUPAC).
Номенклатура алканов и их производных названия первым десяти членам
ряда насыщенных углеводородов уже дано. Чтобы подчеркнуть, что
алкан имел неразветвленный углеродный цепь, часто к названию
добавляют слово нормальный (н-), например:
При отрыве атома водорода от молекулы алкана образуются одновалентные частицы, которые называют углеводородными радикалами (сокращенно обозначают буквой R.
Названия одновалентных радикалов происходят от названий соответствующих углеводородов с заменой окончания -ан на -ил (-ил). Вот соответствующие примеры:
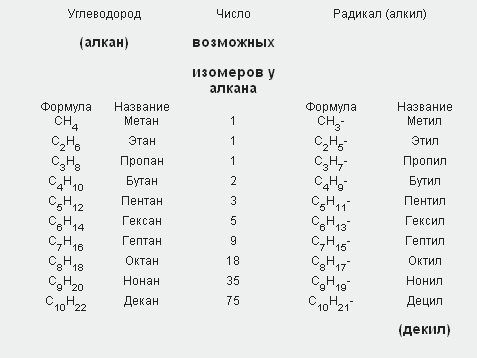
Контроль знаний:
1. Что изучает органическая химия?
2. Как отличить органические вещества от неорганических?
3. Элемент обязанностью входит в состав органических
соединений?
4. Перелечите типы органических реакций.
5. Запишите изомеры бутана.
6. Какие соединения называются насыщенными?
7. Которые номенклатуры вам известны? В чем заключается их
суть?
8. Что такое изомеры? Приведите примеры.
9. Что такое структурная формула?
10. Запишите шестой представитель алканов.
11. Как классифицируют органические соединения?
12. Какие способы разрыва связи вам известны?
13. Перелечите типы органических реакций.
ДОМАШНЕЕ ЗАДАНИЕ
Проработать: Л1. Стр.4-6 Л1. Стр.8-12, пересказ конспекта лекции
№8.
Лекция № 9.
Тема: Алканы: гомологический ряд, изомерия и номенклатура алканов. Химические свойства алканов (на примере метана и этана): горение, замещение, разложение и дегидрирование. Применение алканов на основе свойств.
Основные понятия и термины по теме: алканы, гомологический ряд алканов, крекинг, гомологи, гомологическая разность, строение алканов: тип гибридизации - sр3.
План изучения темы
(перечень вопросов, обязательных к изучению):
1. Насыщенные углеводороды: состав, строение, номенклатура.
2.Типы химических реакций, характерные для органических соединений.
3.Физические свойства (на примере метана).
4. Получение предельных углеводородов.
5. Химические свойства.
6. Применение алканов.
Содержание лекции:
1. Насыщенные углеводороды: состав, строение,
номенклатура.
Углеводороды - простейшие органические соединения, состоящие из
двух элементов: углерода и водорода.
Алканами или насыщенными углеводородами (международное название), называют углеводороды, в молекулах которых атомы Углерода соединены друг с другом простыми (ординарными) связями, а валентности углеродных атомов, которые не принимают участия в их взаимном сочетании, образуют связи с атомами Водорода.
Алканы образуют гомологический ряд соединений,
отвечающих общей формуле СnН2n+2, где: п -
число атомов углерода.
В молекулах насыщенных углеводородов атомы углерода связаны между
собой простой (одинарной) связью, а остальные валентностей насыщены
атомами водорода. Алканы называют также парафинами.
Для названия предельных углеводородов применяют в основном систематическую и рациональную номенклатуры.
Правила систематической номенклатуры.
Общее (родовое) название предельных
углеводородов - алканы.
Названия первых четырех членов гомологического ряда метана
тривиальные: метан, этан, пропан, бутан. Начиная с пятого названия
образованы от греческих числительных с добавлением суффикса -ан
(этим подчеркивается сходство всех предельных углеводородов с
родоначальником этого ряда - метаном).
Для простейших углеводородов изостроения сохраняются их
несистематические названия: изобутан, изопентан, неопентад.
По рациональной номенклатуре алканы рассматривают как производные простейшего углеводорода - метана, в молекуле которого один или несколько водородных атомов замещены на радикалы. Эти заместители (радикалы) называют по старшинству (от менее сложных к более сложным). Если эти заместители одинаковые, то указывают их количество. В основу названия включают слово "метан":
|
H3C-C-CH3
|
CH3
C2H5
|
H3C-CH-CH-CH3
|
CH3
тетраметилметан
(2,2-диметилпропан)
метилэтилизопропилметан
(2,3-диметилпентан)
Свою номенклатуру имеют и радикалы
(углеводородные радикалы). Одновалентные радикалы называют алкилами
и обозначают буквой R или Alk.
Их общая формула CnH2n+ 1 .
Названия радикалов составляют из названий соответствующих
углеводородов заменой суффикса -ан на суффикс -ил (метан - метил,
этан - этил, пропан - пропил и т.д.).
Двухвалентные радикалы называют, заменяя суффикс -ан на -илиден (исключение - радикал метилен ==СН2).
Трехвалентные радикалы имеют суффикс -илидин (исключение - радикал метин ==СН).
В таблице приведены названия первых пяти углеводородов, их радикалов, возможных изомеров и соответствующие им формулы.
Название
углеводорода
радикала
углеводорода
радикала
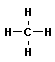
![]()
метан
метил
![]()
![]()
этан
этил
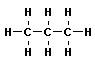
![]()
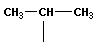
пропан
пропил
изопропил
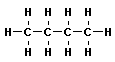
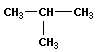
![]()
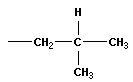
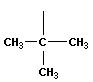
н-бутан
метилпропан
(изо-бутан)
н-бутил
метилпропил
(изо-бутил)
трет-бутил
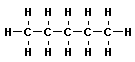
![]()
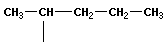
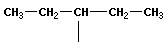
н-пентан
н-пентил
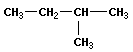

метилбутан
(изопентан)
метилбутил
(изопентил)
диметилпропан
(неопентан)
диметилпропил
(неопентил)
2.Типы химических реакций, характерные для органических
соединений
1) Реакции окисления (горения):
![]()
Такие реакции характерны для всех представителей гомологических рядов 2) Реакции замещения:
![]()
Такие реакции характерны для алканов, аренов (при определенных условиях), а также возможные для представителей других гомологичных рядов.
3) Реакции отщепления: Такие реакции возможны для алканов,
алкенов.
![]()
4) Реакции присоединения:
![]()
Такие реакции возможны для алкенов, алкинов, аренов.
Простейшая органическое вещество - метан - имеет
молекулярную формулу СН4. Структурная формула
метана:
Электронная формула метана:
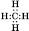
Молекула метана имеет форму тетраэдра: в центре
- атом Углерода, в вершинах - атомы Водорода, соединения направлены
к вершинам тетраэдра под углом .
3. Физические свойства метана. Газ без цвета и запаха, легче
воздуха, мало растворим в воде. В природе метан образуется при
гниении растительных остатков без доступа воздуха.
Метан является основной составной частью природного газа.
Алканы практически нерастворимы в воде, потому что их молекулы малополярные и не взаимодействуют с молекулами воды, но хорошо растворяются в неполярных органических растворителях, таких как бензен, тетрахлорметан. Жидкие алканы легко смешиваются друг с другом.
4.Получение метана.
1) С натрий ацетата:
![]()
2) Синтезом из углерода и водорода (400-500 и повышенное
давление):
![]()
3) С алюминий карбида(в лабораторных условиях):
![]()
4) Гидрирование (присоединение водорода) непредельных
углеводородов:
![]()
5) Реакция Вюрца, что служит для увеличения карбонной цепи:
![]()
5. Химические свойства метана:
1) Не вступают в реакции присоединения.
2) Горят:
![]()
3) Разлагаются при нагревании:
![]()
4) Вступают в реакции галогенирование (реакции замещения):
![]()
5) При нагревании и под действием катализаторов происходит
крекинг - гемолитический разрыв С-С связей. При этом образуются
алканы и низшие алканы, например:
![]()
6) При дегидрирование метана и этилена образуется ацетилен:
![]()
7) Горения:- при достаточном количестве кислорода образуется
углекислый газ и вода:
![]()
- при недостаточном количестве кислорода образуется угарный газ и
вода:
![]()
- или углерод и вода:
![]()
Смесь метана с воздухом взрывоопасна.
8) Термическое разложение без доступа кислорода на углерод и
водород:
![]()
6.Применение алканов:
Метан в больших количествах расходуется в качестве топлива. Из него получают водород, ацетилен, сажу. Он используется в органических синтезах, в частности, для получения формальдегида, метанола, муравьиной кислоты и других синтетических продуктов.
При обычных условиях первые четыре члена
гомологического ряда алканов ![]() - газы.
- газы.
Нормальные алканы от пентана до гептадекана
![]() - жидкости, начиная с
- жидкости, начиная с ![]() и выше - твердые вещества. По мере увеличения числа атомов в цепи,
т.е. с ростом относительной молекулярной массы, возрастают
температуры кипения и плавления алканов.
и выше - твердые вещества. По мере увеличения числа атомов в цепи,
т.е. с ростом относительной молекулярной массы, возрастают
температуры кипения и плавления алканов.
Низшие члены гомологического ряда используются
для получения соответствующих непредельных соединений реакцией
дегидрирования. Смесь пропана и бутана используется в качестве
бытового топлива. Средние члены гомологического ряда применяются
как растворители и моторные топлива.
Большое промышленное значение имеет окисление высших предельных
углеводородов - парафинов с числом углеродных атомов 20-25. Этим
путем получают синтетические жирные кислоты с различной длиной
цепи, которые используются для производства мыл, различных моющих
средств, смазочных материалов, лаков и эмалей.
Жидкие углеводороды используются как горючее (они входят в состав бензина и керосина). Алканы широко используются в органическом синтезе.
Контроль знаний:
1. Какие соединения называются насыщенные?
2. Которые номенклатуры вам известны? В чем заключается их
суть?
3. Что такое изомеры? Приведите примеры.
4. Что такое структурная формула?
5. Запишите шестой представитель алканов.
6. Что такое гомологический ряд и гомологическая разница.
7. Назовите правила, которыми пользуются, когда называют
соединения.
8. Определите формулу парафина, 5,6 г которого (н. у.) имеют массу
11г.
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л1. Стр. 25-34, пересказ конспекта лекции №9.
Лекция № 10.
Тема: Алкены. Этилен, его получение (дегидрированием этана и дегидратацией этанола). Химические свойства этилена: горение, качественные реакции (обесцвечивание бромной воды и раствора перманганата калия), гидратация, полимеризация. Полиэтилен, его свойства и применение. Применение этилена на основе свойств.
Алкины. Ацетилен, его получение пиролизом метана и карбидным способом. Химические свойства ацетилена: горение, обесцвечивание бромной воды, присоединение хлороводорода и гидратация. Применение ацетилена на основе свойств. Реакция полимеризации винилхлорида. Поливинилхлорид и его применение.
Основные понятия и термины по теме: алкены и алкины, гомологический ряд, крекинг, гомологи, гомологическая разность, строение алкенов и алкинов: тип гибридизации.
План изучения темы
(перечень вопросов, обязательных к изучению):
1Ненасыщенные углеводороды: состав.
2.Физические свойства этилена и ацетилена.
3.Строение.
4.Изомерия алкенов и алкинов.
5.Получение непредельных углеводородов.
6.Химические свойства.
Содержание лекции:
1.Ненасыщенные углеводороды: состав:
Углеводороды с общей формулой СnH2n и СnH2n-2, в молекулах которых между атомами углерода имеется двойная связь или тройная связь называются непредельными. Углеводороды с двойной связью относятся к непредельным ряда этилена (называют этиленовыми углеводородами, или алкенами) , с тройной - ряда ацетилена.
2.Физические свойства этилена и ацетилена:
Этилен и ацетилен - это бесцветные газы. Они плохо растворяются в воде, но хорошо в бензине, эфире и других неполярных растворителях. Температура кипения тем больше, чем больше их молекулярная масса. В сравнении с алканами, алкины имеют более высокие температуры кипения. Плотность алкинов меньше плотности воды.
3.Строение ненасыщенных углеводородов:
Изобразим строение молекул этилена и ацетилена структурно. Если углерод считать четырехвалентным, то исходя из молекулярной формулы этилена, у него не все валентности востребованы, а у ацетилена лишними оказываются четыре связи. Изобразим структурные формулы этих молекул:
На образование двойной связи атом углерода затрачивает по два электрона, а на тройную связь по три электрона. В формуле это обозначается в виде двух или трех точек. Каждая черточка - это пара электронов.
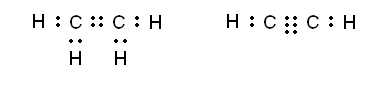
электронная формула.
Экспериментально доказано, что в молекуле с двойной связью одна из них относительно легко разрывается, соответственно с тройной связью легко разрываются две связи. Мы можем продемонстрировать это на опыте.
Демонстрация опыта:
-
Смесь спирта с H2SO4 нагреваем в пробирке с песком. Газ пропускаем через раствор KMnO4, затем поджигаем.
Обесцвечивание раствора происходит по причине присоединения атомов по месту разрыва кратных связей.
3СН2=СН2+2КМnO4+4H2O → 2MnO2+3C2H4(OH)2+2KOH
Электроны, образующие кратные связи, в момент взаимодействия с КМnO4 распариваются, образуются непарные электроны, легко вступающие во взаимосвязь с другими атомами с неспаренными электронами.
Этилен и ацетилен являются первыми в гомологических рядах алкенов и алкинов.
Этен. На плоской горизонтальной поверхности, которая демонстрирует плоскость перекрывания гибридных облаков (σ - связи) лежат 5 σ -связей. Перпендикулярно этой поверхности лежат Р -облака негибридные, они образуют одну π-связь.
Этин. В этой молекуле две π-связи, которые лежат в плоскости, перпендикулярной плоскости σ -связи и взаимно перпендикулярно друг другу. π-связи непрочные, т.к. имеют небольшую область перекрывания.
4.Изомерия алкенов и алкинов.
В ненасыщенных углеводородах кроме изомерии по углеродному скелету появляется новый вид изомерии - изомерия по положению кратной связи. Положения кратной связи указывается цифрой в конце названия углеводорода.
Например:
![]() бутен-1;
бутен-1;
![]() бутин-2.
бутин-2.
Считают атомы Карбона с той стороны, к которой ближе кратная связь.
Например:
 4-метилпентен-1
4-метилпентен-1
Для алкенов и алкинов изомерия зависит от положения кратной связи и строения углеродной цепи. Поэтому в названии цифрой следует указать положение боковых цепей и положение кратной связи.
изомерия кратной связи: СН3-СН2-СН=СН2 СН3-СН=СН-СН3
бутен-1
бутен-2
Для непредельных углеводородов характерна пространственная или
стереоизомерия. Она называется цис-, трансизомерией.
Подумайте, какое из этих соединений может иметь изомер.
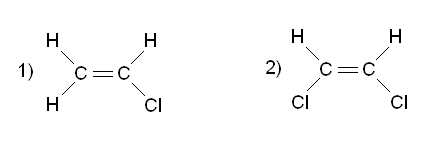
Цистрансизомерия возникает только в случае, если каждый атом углерода при кратной связи соединен с разными атомами или группами атомов. Поэтому в молекуле хлорэтена (1) как бы мы не повернули атом хлора, молекула будет такой же. Другое дело в молекуле дихлорэтена (2), где положение атомов хлора относительно кратной связи может быть различным.
Физические свойства углеводорода зависят не только от количественного состава молекулы, но и от ее строения.
Так, цисизомер 2 - бутена имеет температуру плавления - 138ºС, а его трансизомер - 105,5ºС.
Этен и этин: промышленные способы их получения связаны с дегидрированием предельных углеводородов.
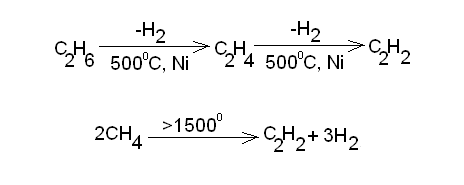
5.Получение непредельных углеводородов:
1. Крекинг нефтепродуктов. В процессе термического крекинга предельных углеводородов наряду с образованием алканов происходит образование алкенов.
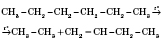
2.Дегидрирование предельных углеводородов. При пропускании алканов над катализатором при высокой температуре (400-600 °С) происходит отщепление молекулы водорода и образование алкена:
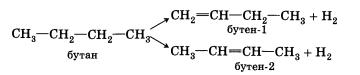
![]()
![]()
3.Дегидратация спиртов (отщепление воды). Воздействие водоотнимающих средств (Н2804, Аl203) на одноатомные спирты при высокой температуре приводит к отщеплению молекулы воды и образованию двойной связи:
![]()
Эту реакцию называют внутримолекулярной дегидратацией (в отличие от межмолекулярной дегидратации, которая приводит к образованию простых эфиров)
4.Дегидрогалогенирование (отщепление галогеноводорода).
При взаимодействии галогеналкана со щелочью в
спиртовом растворе образуется двойная связь в результате отщепления
молекулы галогеноводорода. Реакция идет в присутствии катализаторов
(платины или никеля) и при нагревании. В зависимости от степени
дегидрирования можно получить алкены или алкины, а также
осуществить переход от алкенов к алкинов:
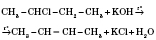
Обратите внимание, что в результате этой реакции образуется преимущественно бутен-2, а не бутен-1, что соответствует правилу Зайцева: Водород в реакциях разложения отщепляется от того атома Углерода, у которого наименьшее количество атомов Водорода:
![]()
(Водород отщепляется от ![]() , но не от
, но не от ![]() ).
).
5. Дегалогенирование. При действии цинка на дибромпроиз-водное
алкана происходит отщепление атомов галогенов, находящихся при
соседних атомах углерода, и образование двойной связи:
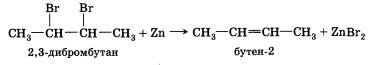
-
В промышленности ацетилен в основном получают термическим разложением метана:
![]()
6.Химические свойства.
Химические свойства непредельных углеводородов связаны прежде всего с наличием π - связи в молекуле. Область перекрывания облаков в этой связи мала, поэтому она легко разрывается, а углеводороды насыщаются другими атомами. Для непредельных углеводородов характерны реакции присоединения.
Для этилена и его гомологов характерны реакции, идущие с
разрывом одной из двойных соединений и присоединением атомов по
месту разрыва, то есть реакции присоединения.
1) Горение (в достаточном количестве кислорода или воздуха):
![]()
![]()
2) Гидрирование (присоединение водорода):
![]()
![]()
![]()
3) Галогенирование (присоединение галогенов):
![]()
![]()
![]()
4) Гидро галогенирование (присоединение галогеноводородов):
![]()
![]()
![]()
Качественной реакцией на непредельные углеводороды:
1) являются обесцвечивание бромной воды или 2) раствора калий перманганата.
При взаимодействии бромной воды с ненасыщенными углеводородами
происходит присоединение брома по месту разрыва кратных связей и,
соответственно, исчезновения окраски, которое было обусловлено
растворенным бромом:
![]()
Правило Марковникова: Водород присоединяется к тому атому
Углерода, который связан с большим числом атомов Водорода. Это
правило можно показать на реакциях гидратации несимметричных
алкенов и гидро- галогенирование:
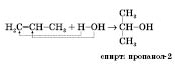
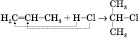
2-хлорпропан
При взаимодействии галогеноводородов с алкинами
присоединения второй молекулы галогеноводню идет в соответствии с
правилом Марковникова:
![]()
![]()
Для ненасыщенных соединений характерны реакции полимеризации.
Полимеризация - это последовательное соединение
молекул низкомолекулярного вещества с образованием
высокомолекулярного вещества. При этом соединение молекул
происходит по месту разрыва двойных связей. Например, полимеризация
этена:
![]()
Продукт полимеризации называется полимером, а
исходное вещество, вступающее в реакцию, - мономером; повторяющиеся
в полимере группировки называются структурными или элементарными
звеньями; число элементарных звеньев в макромолекуле называется
степенью полимеризации.
Название полимера складывается из названия мономера и приставки
поли-, например полиэтилен, поливинилхлорид, полистирол. В
зависимости от степени полимеризации тех же мономеров можно
получать вещества с различными свойствами. Например, полиэтилен с
короткими цепями ![]() является жидкостью, что имеет смазочные свойства. Полиэтилен с
длиной цепи в 1500-2000 звеньев - твердый, но гибкий пластический
материал, идущий на изготовление пленки, посуды, бутылок.
Полиэтилен с длиной цепи в 5-6 тыс. звеньев является твердым
веществом, из которого можно готовить литые изделия, трубы. В
расплавленном состоянии полиэтилена можно придать любую форму,
которая сохраняется после отверждения. Такое свойство называется
термопластичностью.
является жидкостью, что имеет смазочные свойства. Полиэтилен с
длиной цепи в 1500-2000 звеньев - твердый, но гибкий пластический
материал, идущий на изготовление пленки, посуды, бутылок.
Полиэтилен с длиной цепи в 5-6 тыс. звеньев является твердым
веществом, из которого можно готовить литые изделия, трубы. В
расплавленном состоянии полиэтилена можно придать любую форму,
которая сохраняется после отверждения. Такое свойство называется
термопластичностью.
Контроль знаний:
-
Какие соединения называются ненасыщенные?
-
Изобразить все возможные изомеры для углеводорода с двойной связью состава С6Н12 и С6 Н10. Дать им названия. Составить уравнение реакции горения пентена, пентина.
-
Решить задачу: Определить объем ацетилена, который можно получить из карбида кальция массой 100 г, массовой долей 0,96, если выход составляет 80% ?
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л1. Стр. 43-47,49-53, Л1. Стр. 60-65, пересказ конспекта лекции №10.
Лекция № 11.
Тема: Единство химической организации живых организмов. Химический состав живых организмов. Спирты. Получение этанола брожением глюкозы и гидратацией этилена. Гидроксильная группа как функциональная. Представление о водородной связи. Химические свойства этанола: горение, взаимодействие с натрием, образование простых и сложных эфиров, окисление в альдегид. Применение этанола на основе свойств. Вредное воздействие спиртов на организм человека. Понятие о предельных многоатомных спиртах. Глицерин как представитель многоатомных спиртов. Качественная реакция на многоатомные спирты. Применение глицерина.
Альдегиды. Получение альдегидов окислением соответствующих спиртов. Химические свойства альдегидов: окисление в соответствующую кислоту и восстановление в соответствующий спирт. Применение формальдегида и ацетальдегида на основе свойств.
Основные понятия и термины по теме: спирты их разновидности, гомологический ряд, гомологическая разность, строение спиртов и альдегидов, тип гибридизации, функциональные группы, качественные реакции.
План изучения темы
(перечень вопросов, обязательных к изучению):
1.Понятие о кислородосодержащие органические соединения,
функциональные группы.
2. Классификация оксигеносодержащих соединений,
их свойства, изомерия, номенклатура.
3. Понятие об альдегидах.
Содержание лекции:
1.Понятие о кислородосодержащие органические соединения, функциональные группы.
К кислородсодержащим органическим соединениям, которые состоят из атомов углерода, водорода и кислорода, относятся спирты, фенолы, альдегиды, кетоны, карбоновые кислоты, простые и сложные эфиры, углеводы и др. их химические свойства определяются наличием в молекулах различных функциональных групп.
Спирты - органические соединения, в состав
молекул которых входит одна или несколько гидрокс
ильных групп, соединенных с углеводородным радикалом.
Гидроксильная группа -ОН является функциональной группой двух важных классов соединений - спиртов и фенолов. В фенолах гидроксильная группа связана непосредственно с атомом Углерода ароматического ядра, а в спиртах - с другим атомом Углерода. Количество гидроксильных групп в молекуле спирта или фенола называют атомностю. В зависимости от углеводородного остатка спирты бывают насыщенными, ненасыщенными, циклическими, ароматическими.
По числу гидроксильных групп в молекуле спирты и фенолы делятся на одноатомные, двухатомные трехатомные и т. д.
Трехатомный спирт:
CH3-OH
метанол (метиловый спирт) муравиновая к-та
CH3CH2-OH
этанол (этиловый спирт), уксусная
HO-CH2-CH2-OH
этандиол-1,2 (этиленгликоль)
![]()
пропантриол-1,2,3 (глицерин)
Одноатомные спирты:
Общая формула одноатомных спиртов - R-OH.
По типу углеводородного радикала спирты делятся на предельные,
непредельные и ароматические.
Ароматический спирт:
CH3CH2CH2-OH
пропанол-1 (пропиловый спирт)
CH2=CH-CH2-OH
пропенол-2,1 (аллиловый спирт)
C6H5-CH2-OH
фенилметанол (бензиловый спирт)
Насыщенные одноатомные спирты образуют гомологический ряд с общей формулой СnH2n+1 OH.
Изомерия одноатомных спиртов обусловлена изомерией карбонового скелета углеводородного остатка; положением гидроксильной группы в одинаковых цепях.
Органические вещества, содержащие в молекуле гидроксильные группы, непосредственно связанные с атомами углерода бензольного кольца, называются фенолами. Например, C6H5-OH - гидроксобензол (фенол). По типу атома углерода, с которым связана гидроксильная группа, различают первичные (R-CH2-OH), вторичные (R-CHOH-R') и третичные (RR'R''C-OH) спирты.
Третичный спирт:
CH3CH2CH2CH2-OH
бутанол-1 (бутиловый сприт) маслянная
![]()
бутанол-2 (втор-бутиловый спирт)
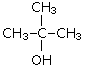
2-метилпропанол-2 (трет-бутиловый спирт)
Гексановавая- капроновая.
С15 Н31 СООН - пальмитиновая,
С16 Н33 СООН- маргариновая, С17
Н35 СООН - стеариновая .
Предельные одноатомные спирты изомерны простым эфирам - соединениям
с общей формулой R-O-R'. Изомеры и гомологиДля спиртов характерна
структурная изомерия (изомерия углеродного скелета, изомерия
положения заместителя или гидроксильной группы), а также
межклассовая изомерия.
Номенклатура и изомерия спиртов.
Названия спиртов выводят из названий радикалов, а также из названий углеводородов, добавляя окончание -ол (международные названия):
СН3ОН - метиловый спирт, или метанол;
С2Н5ОН - этиловый спирт, или этанол;
С3Н7ОН - пропиловый спирт или пропанол, и т. д.
Эти спирты образуют гомологический ряд, потому что они по составу
молекул отличаются друг от друга на гомологическую разницу.
Общая формула гомологического ряда
СnН2n+1 ОН,
или R - ОН, где
R - углеводородный радикал.
Начиная с третьего представителя гомологического ряда - пропанола, у спиртов появляются изомеры. У спиртов всегда больше изомеров, чем в соответствующих насыщенных углеводородах.
Алгоритм составления названий одноатомных спиртов.
-
Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, с одним из которых связана функциональная группа.
-
Пронумеруйте атомы углерода в главной цепи, начиная с того конца, к которому ближе функциональная группа.
-
Назовите соединение по алгоритму для углеводородов.
-
В конце названия допишите суффикс -ол и укажите номер атома углерода, с которым связана функциональная группа.
В зависимости от характера атома Углерода, с которым соединена гидроксогруппа, спирты делятся на первичные, если гидроксильная группа размещена у первичного атома Углерода, вторичные, если гидроксильная группа размещена у вторичного атома Углерода, и третичные, если гидроксильная группа размещена у третичного атома Углерода.
Первичные СН3 - СН2 - СН2-
ОН
Пропанол-1
С6Н5-СН2- ОН
Фенилметанол
Вторичные СН3 - СН - СН3
ОН
Пропанол-2
СН3
Третичные СН3 - СН - СН3
ОН
2-Метилпропанол-2
Если в молекуле спирта есть одна гидроксильная
группа, то он называется одноатомным, две - двухатомным, три -
трьохатомным и т. д. Простейшими представителями одноатомных,
двухатомным и трьохатомных спиртов соответственно являются метанол,
этиленгликоль и глицерин:
Физические свойства спиртов во многом определяются наличием между
молекулами этих веществ водородных связей:
С этим же связана и хорошая растворимость в воде низших спиртов.
Табл.: Физические свойства спиртов и фенолов:
Формула
d420
tплC
tкипC
Спирты
метиловый
СН3OH
0, 792
-97
64
этиловый
С2Н5OH
0,79
-114
78
пропиловый
СН3СН2СН2OH
0,804
-120
92
изопропиловый
СН3-СН(ОH)-СH3
0,786
-88
82
бутиловый
CH3CH2CH2CH2OH
0,81
-90
118
вторбутиловый
CH3CH2CH(CH3)OH
0,808
-115
99
третбутиловый
(СН3)3С-OH
0,79
+25
83
циклогексанол
С6Н11OH
0,962
-24
161
бензиловый
C6H5CH2OH
1,046
-15
205
этиленгликоль
HOCH2CH2OH
1,113
-15,5
198
глицерин
НО-СН2-CH(ОН)-СН2OH
1,261
-18,2
290
Фенолы
фенол
С6Н5OH
1,05(43°)
43
180
пирокатехин
о - С6Н4(OH)2
-
105
245
резорцин
м - С6Н4(OH)2
-
110
281
гидрохинон
n - С6Н4(OH)2
-
170
285
Простейшие спирты - жидкости с характерными запахами. С увеличением числа атомов углерода температура кипения возрастает, а растворимость в воде падает. Температура кипения у первичных спиртов больше, чем у вторичных спиртов, а у вторичных - больше, чем у третичных. Метанол крайне ядовит. Метанол. Наружно метанол подобный этанолу, но имеет сильное ядовитое действие и поэтому довольно опасный.
Используется для синтеза формальдегида, а также для получения
лекарств, мономеров, красителей и как растворитель.
Ядовитые свойства метанола вызваны его способностью окисляться в
организме человека до формальдегида и муравьиной кислоты, которые
разрушают белковые клетки (10 г вызывает слепоту, а 30 г -
смертельная
доза для человека).
Применение спиртов:
Этиленгликоль применяют: 1) в качестве антифриза; 2) для синтеза высокомолекулярных соединений (например, лавсана). Глицерин применяют:1) в парфюмерии и в медицине (для изготовления мазей, смягчающих кожу); 2) в кожевенном производстве и в текстильной промышленности; 3) для производства нитроглицерина.
Этанол. Этанол имеет многоплановое применение. Это один из лучших растворителей для многих органических соединений - подобно воде для неорганических. Добывают брожением углеводов. Из этанола получают уксусную кислоту, эфиры - этилацетат, бутилацетат и т.п. Его применяют для синтеза практически всех классов органических соединений.
Этанол используется в пищевой промышленности в
процессах изготовления пива, вин и других спиртных напитков.
Этанол действует на организм человека как наркотик и в небольшой
дозе вызывает опьянение, а в больших количествах может привести к
смерти.
Пропиловые спирты. 1-пропанол используют для добывания
пропионового альдегида. 2-пропанол применяется для синтеза
различных химических продуктов.
Бутиловые спирты. Применяются как растворители лаков и красок, для синтеза эфиров, бутиратной кислоты.
Высшие жирные спирты. Жидкие (6 - 10 атомов
Углерода), применяют как промежуточные продукты в производстве
моющих средств, пластификаторов, флотореагентов, в фармацевтической
и парфюмерной промышленности.
Твердые (цетиловый - С16Н33ОН) - является
основной частью спермацета - жирового вещества, которое находится в
черепной полости кашалота - в виде эстера пальмитиновой кислоты;
цериловый - С26Н53ОН, мирициловый
С30Н61ОН - входят в состав пчелиного
воска.
Химические свойства спиртов:
1.Горение: C2H5OH + 3O2
![]() 2CO2 +3H2O + Q
2CO2 +3H2O + Q
2.Реакции с щелочными и щелочноземельными металлами ("кислотные" свойства): реагируют с щелочными и щелочноземельными металлами, образуя солеобразные соединения - алкоголяты.
Атомы водорода гидроксильных групп молекул спиртов, также как и атомы водорода в молекулах воды, могут восстанавливаться атомами щелочных и щелочноземельных металлов ("замещаться" на них).
2Na + 2H-O-H ![]() 2NaOH + H2
2NaOH + H2![]()
2Na + 2R-O-H ![]() 2RONa + H2
2RONa + H2![]()
Атомы натрия легче восстанавливают те атомы
водорода, у которых больше положительный частичный заряд (![]() +).
И в молекулах воды, и в молекулах спиртов этот заряд образуется за
счет смещения в сторону атома кислорода, обладающего большой
электроотрицательностью, электронных облаков (электронный пар)
ковалентных связей. Молекулу спирта можно рассматривать как
молекулу воды, в которой один из атомов водорода замещен
углеводородным радикалом. А такой радикал, богатый электронными
парами, легче, чем атом водорода, позволяет атому кислорода
оттягивать на себя электронную пару связи R
+).
И в молекулах воды, и в молекулах спиртов этот заряд образуется за
счет смещения в сторону атома кислорода, обладающего большой
электроотрицательностью, электронных облаков (электронный пар)
ковалентных связей. Молекулу спирта можно рассматривать как
молекулу воды, в которой один из атомов водорода замещен
углеводородным радикалом. А такой радикал, богатый электронными
парами, легче, чем атом водорода, позволяет атому кислорода
оттягивать на себя электронную пару связи R![]() O.
O.
Атом кислорода как бы "насыщается", и за счет этого связь O-H
оказывается менее поляризованной, чем в молекуле воды (![]() +
на атоме водорода меньше, чем в молекуле воды).
+
на атоме водорода меньше, чем в молекуле воды).
В результате атомы натрия труднее восстанавливают атомы водорода в
молекулах спиртов, чем в молекулах воды, и реакция идет намного
медленнее.
Иногда, основываясь на этом, говорят, что кислотные свойства
спиртов выражены слабее, чем кислотные свойства воды.
Из-за влияния радикала кислотные свойства спиртов убывают в ряду :
метанол ![]() первичные спирты
первичные спирты ![]() вторичные спирты
вторичные спирты ![]() третичные спирты С твердыми щелочами и с их растворами спирты не
реагируют.
третичные спирты С твердыми щелочами и с их растворами спирты не
реагируют.
3.Реакции с галогеноводородами: C2H5OH +
HBr ![]() C2H5Br + H2O.
C2H5Br + H2O.
4.Внутримолекулярная дегидратация (t > 140oС, образуются алкены):
C2H5OH ![]() C2H4 + H2O
C2H4 + H2O
5.Межмолекулярная дегидратация (t < 140oС, образуются простые эфиры):
2C2H5OH ![]() C2H5OC2H5 +
H2O
C2H5OC2H5 +
H2O
6.Окисление (мягкое, до альдегидов):
CH3CH2OH + CuO ![]() CH3-CHO + Cu + H2O Это качественная реакция
на спирты: цвет осадка изменяется с черного на розовый, ощущается
своеобразный "фруктовый" запах альдегида).
CH3-CHO + Cu + H2O Это качественная реакция
на спирты: цвет осадка изменяется с черного на розовый, ощущается
своеобразный "фруктовый" запах альдегида).
7.Взаимодействие с оганическими кислотами (реакция этерификации) приводит к образованию сложных эфиров.
O
II
O
II
CH3-
C-
-OH + H -
-OC2H5 H2SO4CH3-
C
-O-C2H5(уксусноэтиловый эфир (этилацетат)) + H2O
В общем виде:
O
II
H+
O
II
R-
C-
-OH + H-
-OR'
R-
C
-O-R' + H2O
Это означает, что спирты - более слабые кислоты, чем вода.
Получение спиртов:
-
Щелочной гидролиз галогеналканов (лабораторный способ): C2H5Cl + NaOH
 C2H5OH + NaCl.
C2H5OH + NaCl.
-
Гидратация алкенов: C2H4 + H2O
 C2H5OH.
C2H5OH.
-
Брожение глюкозы : C6H12O6
 2C2H5OH + 2CO2
2C2H5OH + 2CO2 .
.
-
Синтез метанола: CO + 2H2
 CH3OH
CH3OH
Многоатомные спирты: Примерами многоатомных
спиртов является двухатомный спирт этандиол (этиленгликоль)
HO-CH2-CH2-OH и трехатомный спирт
пропантриол-1,2,3 (глицерин)
HO-CH2-CH(OH)-CH2-OH.
Это бесцветные сиропообразные жидкости, сладкие на вкус, хорошо
растворимы в воде. Этиленгликоль ядовит.
Химические свойства многоатомных спиртов по большей части сходны с
химическими свойствами одноатомных спиртов, но кислотные свойства
из-за влияния гидроксильных групп друг на друга выражены
сильнее.
Качественной реакцией на многоатомные спирты является их реакция с
гидроксидом меди(II) в щелочной среде, при этом образуется
ярко-синие растворы сложных по строению веществ. Например, для
глицерина состав этого соединения выражается формулой
Na2[Cu(C3H6O3)2].
Глицерин получают синтетическим путем из пропилена и путем гидролиза жиров.
Альдегиды:
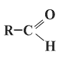
Оксосоединения - это такие органические вещества, содержащие в молекуле оксо - или карбонильную группу >C=О.
Альдегидами называются органические соединения, в молекулах
которых содержится ![]() функциональная группа.
функциональная группа.
Строение молекул: Электронная и структурная формулы альдегидов следующие:
![]()
У альдегидов в альдегидной группе между атомами
углерода и водорода существует ![]() -связь, а между атомами углерода и кислорода - одна
-связь, а между атомами углерода и кислорода - одна ![]() -связь и одна
-связь и одна ![]() -связь, которая легко разрывается.
-связь, которая легко разрывается.
Альдегиды и кетоны отличаются по характеру
атомов, окружающих карбонильную группу: у альдегидов хотя бы одна
из валентностей Углерода карбонильной группы тратится на связь с
Гидрогеном.
У кетонов обе валентности карбонильной группы тратятся на связь с
углеводородными остатками:
R - С = О R - С = О
| |
Н R1
Получение альдегидов: В промышленности:
а) окислением алканов: ![]()
б) окислением алкенов: ![]()
в) гидратацией алкинов: ![]()
г) окислением первичных спиртов: ![]()
(этот метод используется и в лаборатории).
Физические свойства:
Ароматические альдегиды и кетоны - нерастворимые в воде жидкости или твердые вещества. Альдегиды имеют запах горького миндаля, а кетоны - приятный цветочный запах.
За исключением метаналя (формальдегида), который является газообразным веществом, альдегиды состава С2 - С15 - безцветные вещества, начиная с альдегида С16 в молекуле - твердые вещества.
Альдегиды с С3 - С6 имеют
неприятный запах, высшие альдегиды - приятный.
Низшие кетоны (до С15 - жидкости с приятным запахом,
растворимые в воде. В воде карбонильная группа образует водородные
связи с молекулами воды.
Оксосоединения имеют более низкие температуры кипения, чем
алканолы, что свидетельствует о слабости межмолекулярной ассоциации
в альдегиды и кетоны вследствие отсутствия водородной связи. Высшие
альдегиды и кетоны хорошо растворимы в органических растворителях.
Химические свойства альдегидов:
1. Из-за наличия в альдегидной группе ![]() -связи наиболее характерны реакции присоединения:
-связи наиболее характерны реакции присоединения:
![]()
2. Реакции окисления (протекают легко):
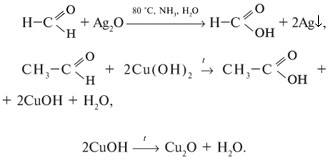
3. Реакции полимеризации и поликонденсации:
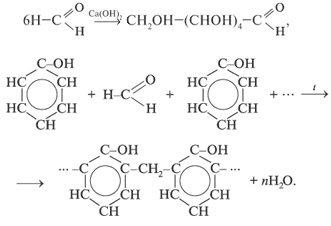
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АЛЬДЕГИДЫ. Альдегидную группу в органических соединениях можно обнаружить с помощью таких реакций, как взаимодействие со свежеосажденным гидроксидом меди(II) при нагревании,
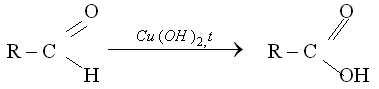
С аммиачным раствором оксида серебра {реакция серебряного зеркала).
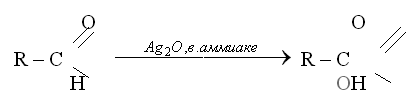
Эти реакции позволяют отличить альдегиды от кетонов.
При взаимодействии альдегида с гидроксидом меди (II) наблюдается образование кирпично-красного осадка оксида меди(I), а в реакции серебряного зеркала на стенках пробирки или колбы, в которой проводится эксперимент, образуется налет металлического серебра.
Впервые эта реакция была предложена немецким химиком
Ю. Либихом.
В результате окисления альдегидов образуется новый класс веществ, называемый карбоновыми кислотами. В качестве окислителя можно использовать и кислород воздуха, и неорганические соли (перманганат калия) и даже такие специфические слабые окислители, как аммиачный раствор оксида серебра или гидроксид меди (II).
Контроль знаний:
1. Как можно классифицировать спирты?
2. Запишите формулу двухатомного спирта.
3. Запишите третий представитель альдегидов.
4. Какие соединения называют карбоновыми кислотами, как их
классифицируют?
5.Какие химически свойства характерны для спиртов?
6. Какие способы получения спиртов вам известны?
7. Какие вызнаете области применения метанола и этанола?
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л1.СТР.88-93, 94-99,100-104. Л1. Стр.111-115,116-119, пересказ конспекта лекции №11.
Лекция № 12.
Тема: Карбоновые кислоты. Получение карбоновых кислот окислением альдегидов. Химические свойства уксусной кислоты: общие свойства с неорганическими кислотами и реакция этерификации. Применение уксусной кислоты на основе свойств. Высшие жирные кислоты на примере пальмитиновой и стеариновой.
Основные понятия и термины по теме: классификация карбоновых кислот, номенклатура карбоновых кислот, электронное и пространственное строение карбоксильной группы.
План изучения темы
(перечень вопросов, обязательных к изучению):
1.Понятие об карбоновых кислотах.
2. Получение карбоновых кислот окислением альдегидов.
3.Химические свойства карбоновых кислот.
4.Применение уксусной кислоты на основе свойств.
Содержание лекции:
1.Понятие об карбоновых кислотах.
Карбоновыми кислотами называются органические
соединения, в молекулы, в которых содержится функциональная
карбоксильная группа. Название «карбоксил» происходит от слов
карбонил и гидроксил.
Если в молекуле содержится одна карбоксильная группа, то кислота
называется одноосновной, две - двухосновной и т. д.
Карбоновые кислоты можно рассматривать как производные углеводородов, в которых атомы водорода замещены карбоксильными группами.
Общая формула гомологического ряда СпН2п +1СООН
или R-СООН (у первого гомолога вместо R - атом водорода).
По систематической номенклатуре названия кислот происходят от
названий соответствующих углеводородов с добавлением окончания -ова
и слова кислота.
По числу углеродных атомов карбоновые кислоты могут быть:
1. Низшими (С1-С3),
2. Средними (С4-С8) и
3. Высшими (С9-С26).
Получение карбоновых кислот окислением альдегидов:
![]()
-
Для додавання перекладу у вибране
потрібно авторизуватися.
3. Химические свойства карбоновых кислот обусловлены наличием в их молекулах карбоксильных групп. Электронное строение карбоновых кислот можно представить схемой
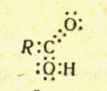
Атом кислорода, соединенный с углеродом двойной связью, оттягивает электроны к себе. Углерод приобретает некоторого положительного заряда и притягивает к себе электроны от второго атома кислорода из группы - ОН, что вызывает смещение электронного облака связи О - Н к атому кислорода. Взаимное влияние атомов в карбоксильной группе можно изобразить схемой:
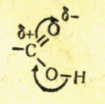
В результате взаимного влияния атомов в
карбоксильной группе связь С = О прочнее, чем в карбонильной
группе, а связь О-Н менее крепкий, чем в спиртах. Карбоновые
кислоты проявляют все свойства минеральных кислот.
В карбоновых кислотах под влиянием карбоксильной группы
увеличивается подвижность атомов водорода, стоящих у атома
углерода, соседнего с карбоксильной группой. Поэтому они могут
легко замещаться атомами хлора брома:
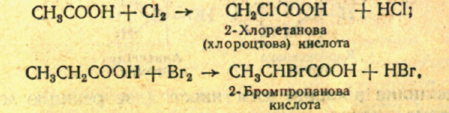
Карбоновым кислотам присущи общие свойства всех кислот.
1. Простейшие карбоновые кислоты в водном растворе диссоциируют:
СН3СООН ![]() Н+ +СН3СОО-.
Н+ +СН3СОО-.
2. Реагируют с металлами:
2HCOOH + Mg ![]() (HCOO)2Mg + H2
(HCOO)2Mg + H2![]() .
.
3. Реагируют с основными оксидами и гидроксидами:
HCOOH + КОН ![]() НСООК+ Н2О.
НСООК+ Н2О.
4. Реагируют с солями более слабых и летучих кислот:
2СН3СООН + К2СО3 ![]() 2СН3СООК + СО2
2СН3СООК + СО2![]() + Н2О.
+ Н2О.
5. Некоторые кислоты образуют ангидриды:
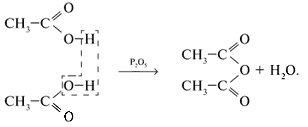
6. Реагируют со спиртами:
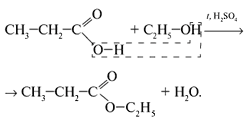
Очевидно, радикалы, которые содержат хлор или
бром, должны влиять на кислотность карбоксильной группы. И
действительно, степень диссоциации хлоруксусной кислоты примерно в
10 раз больше, чем уксусной, а трёхуксусная кислота по сытой близка
к соляной или серной. В этом случае ослабление связи водорода в
гидроксильной группе можно изобразить схемой:
Жирные кислоты - это вещества, из молекул которых состоят более сложные молекулы природных жиров и восков, как растительного, так и животного происхождения.
Химическое строение:
К жирным кислотам относятся предельные и непредельные карбоновые кислоты с открытой цепью атомов углерода.
Карбоновые кислоты характеризуются присутствием карбоксильной группы (карбоксила):
Формула карбоксила: 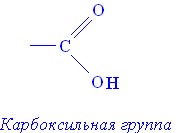
Важное значение имеют кислоты: пальмитиновая
С15Н3,СООН и стеариновая
С17НЗ3СООН - твердые вещества, а также жидкая
ненасыщенная олеиновая кислота
С17Н33СООН.
Остатки этих одноосновных кислот входят в состав жиров и масел.
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Примеры предельных высших жирных кислот:
1. Каприновая кислота - C9H19COOH,
2. Лауриновая кислота - С11Н23СООН,
3. Миристиновая кислота - С13Н27СООН,
4. Пальмитиновая кислота - С15Н31СООН,
5. Стеариновая кислота - С17Н35СООН.
Примеры непредельных высших жирных кислот:
1. Олеиновая кислота - С17Н33СООН, - имеет одну двойную связь,
2. Линолевая кислота - С17Н31СООН, - имеет две двойных связи,
3. Линоленовая кислота - С17Н29СООН. - имеет три двойных связи.
Структурные формулы соединений, в которых присутствуют длинные углеводородный радикалы, часто изображают следующим образом:
4.Применение уксусной кислоты на основе свойств.
УКСУСНАЯ КИСЛОТА, CH3COOH, бесцветная горючая жидкость с резким запахом, хорошо растворимая в воде. Имеет характерный кислый вкус, проводит электрический ток.
Уксусная кислота была единственной, которую знали древние греки. Отсюда и ее название: "оксос" - кислое, кислый вкус.
Уксусная кислота - это простейший вид органических кислот, которые являются неотъемлемой частью растительных и животных жиров. В небольших концентрациях она присутствует в продуктах питания и напитках и участвует в метаболических процессах при созревании фруктов. Уксусная кислота часто встречается в растениях, в выделениях животных. Соли и эфиры уксусной кислоты называются ацетатами.
Уксусная кислота - слабая (диссоциирует в водном растворе только частично). Тем не менее, поскольку кислотная среда подавляет жизнедеятельность микроорганизмов, уксусную кислоту используют при консервировании пищевых продуктов, например, в составе маринадов.
Получают уксусную кислоту окислением ацетальдегида и другими методами, пищевую уксусную кислоту уксуснокислым брожением этанола. Применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетата целлюлозы), в виде столового уксуса при изготовлении приправ, маринадов, консервов. Уксусная кислота участвует во многих процессах обмена веществ в живых организмах. Это одна из летучих кислот, присутствующая почти во всех продуктах питания, кислая на вкус и главная составляющая уксуса.
Как растворитель (например, в производстве ацетата целлюлозы), в виде столового уксуса при изготовлении приправ, маринадов, консервов.
Водный раствор уксусной кислоты используют в качестве вкусового и консервирующего средства (приправа к пище, маринование грибов, овощей).
В состав уксуса входят такие кислоты, как яблочная, молочная, аскорбиновая, уксусная.
Яблочный уксус ( 4% уксусной кислоты ):
Здоровым людям рекомендуется каждый день употреблять полезный и освежающий напиток: в стакане воды размешать ложку меда и добавить 1 ложку яблочного уксуса. Желающим похудеть, рекомендуем каждый раз во время еды выпивать стакан несладкой воды с двумя ложками яблочного уксуса.
В народной медицине уксус используется как неспецифическое жаропонижающее средство (путем протирания кожи раствором воды и уксуса в пропорции 3:1), а также при головных болях методом примочек. Распространено применение уксуса при укусах насекомых посредством компрессов.
Известно применение спиртового уксуса в косметологии. А именно для придания мягкости и блеска волосам после химической завивки и перманентной окраски. Для этого волосы рекомендуется ополаскивать теплой водой с добавлением спиртового уксуса (на 1 литр воды - 3-4 ложки уксуса)
Уксусная кислота применяется также для производства лекарственных средств.
Таблетки Аспирина (ЭС) содержат активный ингредиент ацетилсалициловую кислоту, которая представляет собой уксусный эфир салициловой кислоты.
Ацетилсалициловая кислота производится путём нагревания салициловой кислоты с безводной уксусной кислотой в присутствии небольшого количества серной кислоты (в качестве катализатора).
Уксусная кислота используется в и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров), в производстве негорючих пленок, парфюмерных продуктов, растворителей, при синтезе красителей, лекарственных веществ, например, аспирина. Соли уксусной кислоты используют для борьбы с вредителями растений.
Контроль знаний:
1.Какие свойства присущи карбоновым
кислотам?
2. Какой объем воздуха (объемное содержание кислорода 21 %)
расходуется на полное сжигание 1 м3 метана и 1 кг гептана (н. у.).
3.Напишите структурную формулу 3-метилбутановой кислоты.
4.Составьте уравнения реакций, при которых можно получить карбоновую кислоту.
5.Как используют уксусную кислоту.
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л1.стр.120-130, пересказ конспекта лекции №12.
Лекция № 13.
Тема: Углеводы, их классификация: моносахариды (глюкоза), дисахариды (сахароза) и полисахариды (крахмал и целлюлоза). Значение углеводов в живой природе и в жизни человека. Глюкоза - вещество с двойственной функцией - альдегидоспирт. Химические свойства глюкозы: окисление в глюконовую кислоту, восстановление в сорбит, брожение (молочнокислое и спиртовое). Применение глюкозы на основе свойств. Дисахариды и полисахариды. Понятие о реакциях поликонденсации и гидролиза на примере взаимопревращений: глюкоза - полисахарид.
Основные понятия и термины по теме: классификация углеводов: моносахариды, олигосахариды, полисахариды, характеристика представителей моносахаридов: глюкоза, фруктовый сахар, дезоксирибоза, качественные реакции.
План изучения темы
(перечень вопросов, обязательных к изучению):
1.Определение понятия: углеводы. Классификация.
2. Состав, физические и химические свойства углеводов.
3.Рспространение в природе. Получение. Применение
Содержание лекции:
Углеводы - органические соединения, содержащие карбонильные и гидроксильные группировки атомов, имеющие общую формулу Cn(H2O)m, (где n и m>3).
Углеводы - вещества, имеющие первостепенное биохимическое значение, широко распространены в живой природе и играют большую роль в жизни человека.
Название углеводы возникло на основании данных анализа первых известных представителей этой группы соединения. Вещества этой группы состоят из углерода, водорода и кислорода, причем соотношение чисел атомов водорода и кислорода в них такое же, как и в воде, т.е. на каждые 2 атома водорода приходится один атом кислорода. В прошлом столетии их рассматривали как гидраты углерода. Отсюда и возникло русское название углеводы, предложенное в 1844г. К.Шмидтом. Общая формула углеводов, согласно сказанному, СмН2пОп. При вынесении «n» за скобки получается формула См(Н2О)n, которая очень наглядно отражает название «угле - воды». Изучение углеводов показало, что существуют соединения, которые по всем свойствам нужно отнести в группу углеводов, хотя они имеют состав, не точно соответствующий формуле СмH2пОп. Тем не менее старинное название «углеводы», сохранилось до наших дней, хотя наряду с этим названием для обозначения рассматриваемой группы веществ иногда применяют и более новое название - глициды.
Углеводы можно разделить на три группы: 1) Моносахариды - углеводы, способные гидролизоваться с образованием более простых углеводов. К данной группе относятся гексозы (глюкоза и фруктоза), а также пентоза (рибоза). 2) Олигосахариды - продукты конденсации нескольких моносахаридов (например, сахароза). 3) Полисахариды - полимерные соединения, содержащие большое число молекул моносахаридов.
Моносахариды. Моносахариды являются гетерофункциональными соединениями. В их молекулах одновременно содержатся и карбонильная (альдегидная или кетонная), и несколько гидроксильных групп, т.е. моносахариды представляют собой полигидроксикарбонильные соединения - полигидроксиальдегиды и полигидроксикетоны. В зависимости от этого моносахариды подразделяются на альдозы (в моносахариде содержится альдегидная группа) и кетозы (содержится кетогруппа). Например, глюкоза - это альдоза, а фруктоза - это кетоза.
Получение. В свободном виде в природе встречается преимущественно глюкоза. Она же является структурной единицей многих полисахаридов. Другие моносахариды в свободном состоянии встречаются редко и в основном известны как компоненты олиго- и полисахаридов. В природе глюкоза получается в результате реакции фотосинтеза:
6CO2 + 6H2O C6H12O6(глюкоза) + 6O2
Впервые глюкоза получена в 1811 году русским химиком Г.Э.Кирхгофом при гидролизе крахмала. Позже синтез моносахаридов из формальдегида в щелочной среде предложен А.М.Бутлеровым
II
6C-H --Ca(OH)2 C6H12O6
I
H
В промышленности глюкозу получают гидролизом крахмала в присутствии серной кислоты.
(C6H10O5)n(крахмал) + nH2O --H2SO4,t nC6H12O6(глюкоза)
Физические свойства. Моносахариды - твердые вещества, легко растворимые в воде, плохо - в спирте и совсем нерастворимые в эфире. Водные растворы имеют нейтральную реакцию на лакмус. Большинство моносахаридов обладают сладким вкусом, однако меньшим, чем свекловичный сахар.
Глюкоза C6H12O6 (альдегидоспирт).
Глюкозу называют также виноградным сахаром, так как она содержится в большом количестве в виноградном соке. Кроме винограда глюкоза находится и в других сладких плодах и даже в разных частях растений. Распространена глюкоза и в животном мире: 0,1% ее находится в крови. Глюкоза разносится по всему телу и служит источником энергии для организма. Она также входит в состав сахарозы, лактозы, целлюлозы, крахмала.
В организме человека глюкоза содержится а мышцах, крови, и в небольших количествах во всех клетках.
В природе глюкоза на ряду с другими углеводами образуется в результате реакции фотосинтеза:
6СО2+6Н2О хролофил С6Н12О6+6О2-Q.
Физические свойства. Глюкоза -- бесцветное кристаллическое вещество со сладким вкусом, хорошо растворимое в воде. Из водного раствора она выделяется в виде кристаллогидрата С6Н12Об*Н2О. По сравнению со свекловичным сахаром она менее сладкая.
Глюкоза может существовать в линейной и циклической формах:
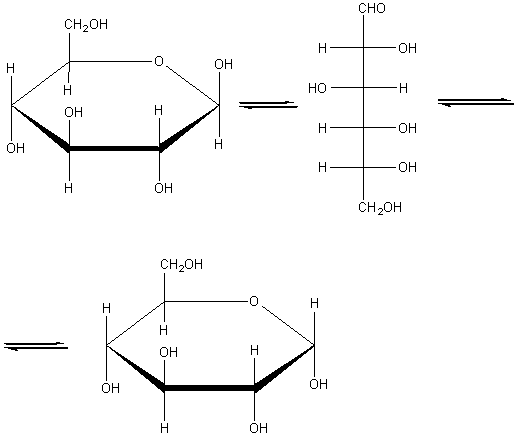
Получение.
Первый синтез простейших углеводов из формальдегида в присутствии гидроксида кальция был произведен А. М. Бутлеровым в 1861 г. На производстве глюкозу чаще всего получают гидролизом крахмала в присутствии серной кислоты:
(С6Н10О5)n + nН2О Н2SO4, t nС6Н12О6
Химические свойства:
Глюкоза обладает химическими свойствами, характерными для спиртов и альдегидов. Кроме того, она обладает и некоторыми специфическими свойствами.
1) Реакции альдегидной группы:
а) реакция «серебряного зеркала»:
CH2OH-(CHOH)4-CH=O + 2[Ag(NH3)2]OH →
→ CH2OH-(CHOH)4-COONH4 + 2Ag↓ +3NH3 + H2O;
б) реакция с гидроксидом меди (II):
t
CH2OH-(CHOH)4-CH=O + 2Cu(OH)2 →
CH2OH-(CHOH)4-COOH + Cu2O↓ + 2H2O,
в) восстановление:
[H]
CH2OH-(CHOH)4-CH=O → CH2OH-(CHOH)4-CH2OH.
2) Реакции гидроксильной группы:
а) взаимодействие с гидроксидом меди (II): Как и все многоатомные спирты, глюкоза с гидроксидом меди (II) дает интенсивное синее окрашивание (качественная реакция). Осадок гидроксида меди(II) сначала растворяется, затем при нагревании становится желто-оранжевым, что говорит о наличии альдегидной группы.
HOCH2(CHOH)4CHO + 2Cu(OH)2 ----- HOCH2(CHOH)4COOH + Cu2O + 2H2O
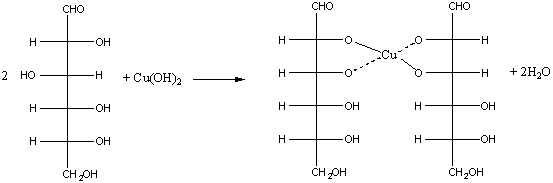 ярко синий раствор
ярко синий раствор
При действии бромной водой глюкоза также окисляется в глюконовую кислоту.
-Окисление глюкозы азотной кислотой приводит к двухосновной сахарной кислоте:
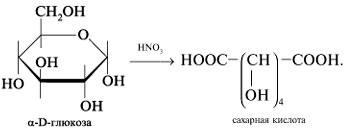
Восстановление глюкозы в шестиатомный спирт сорбит:
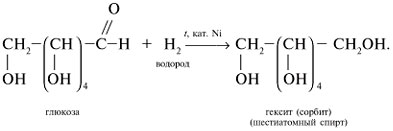
Cорбит содержится во многих ягодах и фруктах.
б) брожение - расщепление глюкозы под действием ферментов (специфические реакции)
C6H12O6 → 2C2H5OH + 2CO2 - спиртовое брожение,
C6H12O6 → 2CH3CH(OH)COOH - молочнокислое брожение
Существуют специфические свойства глюкозы, подобно алифатическим альдегидам она присоединяет молекулу синильной кислоты. Что позволяет увеличить длину цепи углевода:
HOCH2-(CHOH)4-COH + HCN ---- HOCH2_(CHOH)4-CHOH-CN
Фруктоза C6H12O6 (кетоноспирт). В растительном мире широко распространена фруктоза или фруктовый (плодовый) сахар. Фруктоза содержится в сладких плодах, меде. Извлекая из цветов сладких плодов соки, пчелы приготавливают мед, который по химическому составу представляет собой в основном смесь глюкозы и фруктозы. Также фруктоза входит в состав сложных сахаров, например тростникового и свекловичного.
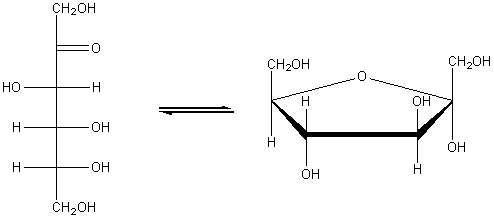
Химические свойства: Фруктоза вступает во все реакции, характерные для многоатомных спиртов, однако реакции карбонильной (альдегидной) группы, в отличие от глюкозы, для нее не характерны.
Рибоза C5H10O5 - пентоза (альдегидоспирт)
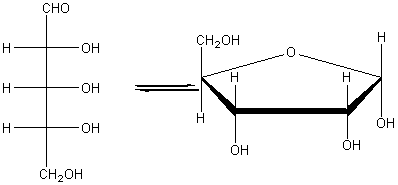
Химические свойства аналогичны глюкозе.
Дисахариды.
Важнейшие дисахариды -- сахароза, мальтоза и лактоза. Все они являются изомерами и имеют формулу С12Н22О11, однако их строение различно
Сахароза C12H22O11 - дисахарид. Сахароза образована остатками a-глюкозы и b-фруктозы:
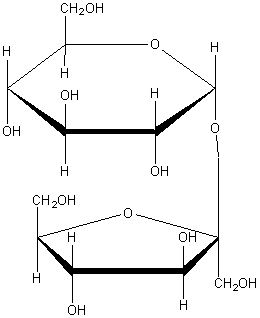
Химические свойства:
1) Гидролиз:
C12H22O11 + H2O → C6H12O6 + C6H12O6.
Сахароза глюкоза фруктоза
2) Взаимодействие с гидроксидом кальция с образованием сахарата кальция.
3) Сахароза не реагирует с аммиачным раствором оксида серебра, поэтому ее называют невосстанавливающим дисахаридом.
Индусы еще за 300 лет до нашей эры умели получать тростниковый сахар из тростника. В наше время получают сахарозу из тростника, произрастающего в тропиках (на о.Куба и в других странах Центральной Америки).
В середине 18 века дисахарид был обнаружен и в сахарной свекле, а в середине 19 века был получен в производственных условиях.
В сахарной свекле содержится 12-15% сахарозы, по другим источникам 16-20% (сахарный тростник содержит 14-26% сахарозы).
Тростниковый сахар применяется в медицине для изготовления порошков, сиропов, микстур и т.д.
Свекловичный сахар широко применяется в пищевой промышленности, кулинарии, приготовлении вин, пива и т.д.
Из молока получают молочный сахар - лактозу. В молоке лактоза содержится в довольно значительном количестве: в коровьем молоке 4-5,5% лактозы, женское молоко содержит 5,5-8,4% лактозы.
Лактоза отличается от других сахаров отсутствием гидроскопичности - она не отсыревает. Это свойство имеет большое значение: если нужно приготовить с сахаром какой-либо порошок, содержащий легко гидролизующее лекарство, то берут молочный сахар. Если взять тростниковый или свекловичный сахар, то порошок быстро отсыреет и легко гидролизующее лекарственное вещество быстро разложится.
Значение лактозы очень велико, т.к. она является важным питательным веществом, особенно для растущих организмов человека и млекопитающихся животных.
Солодовый сахар - это промежуточный продукт при гидролизе крахмала. По другому его называют еще мальтоза, т.к. солодовый сахар получается из крахмала при действии солода (по лат. солод - maltum).
Солодовый сахар широко распространен как в растительных, так и в животных организмах. Например, он образуется под влиянием ферментов пищеварительного канала, а также при многих технологических процессах бродильной промышленности: винокурения, пивоварении и т.д.
Мальтоза С12H22O11 - дисахарид, образованный двумя остатками a-глюкозы.
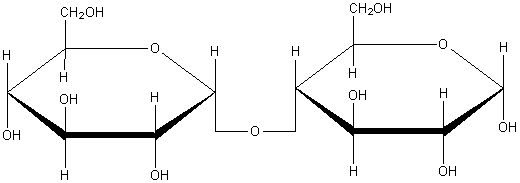
Химические свойства аналогичны глюкозе, поэтому ее называют восстанавливающим дисахаридом. Молекула мальтозы состоит из двух остатков б -глюкозы в пиранозной форме, соединенных через 1-й и 4-й атомы углерода.
Лактоза состоит из остатков (3-галактозы и а-глюкозы в пиранозной форме, соединенных через 1-й и 4-й атомы углерода. Все эти вещества представляют собой бесцветные кристаллы сладкого вкуса, хорошо растворимые в воде. Химические свойства дисахаридов определяются их строением. При гидролизе дисахаридов в кислой среде или под действием ферментов связь между двумя циклами разрывается и образуются соответствующие моносахариды, например:
С12Н22О11 + Н2О Н+, t С6Н12О6 + С6Н12О6
глюкоза фруктоза
По отношению к окислителям дисахариды делят на два типа: восстанавливающие и невосстанавливающие. К первым относятся мальтоза и лактоза, которые реагируют с аммиачным раствором оксида серебра по упрощенному уравнению:
NH3
C12H22O11 + Ag2O ------ > С12Н22О12 + 2Ag.
Эти дисахариды могут также восстанавливать гидроксид меди (II) до оксида меди (I):
C12H22O11 + 2Сu(ОН)2 ---- > С12Н22О12 + Cu2Ov + 2Н2О.
Восстановительные свойства мальтозы и лактозы обусловлены тем, что их циклические формы содержат гликозидный гидроксил (обозначен звездочкой), и, следовательно, эти дисахариды могут переходить из циклической формы в альдегидную, которая и реагирует с Ag2O и Сu(ОН)2. В молекуле сахарозы нет гликозидного гидроксила, поэтому ее циклическая форма не может раскрываться и переходить в альдегидную форму. Сахароза -- невосстанавливающий дисахарид; она не реагирует с гидро-ксидом меди (II) и аммиачным раствором оксида серебра.
Распространение в природе. Наиболее распространенный дисахарид -- сахароза. Это химическое название обычного сахара, который получают экстракцией из сахарной свеклы или сахарного тростника. Сахароза -- главный источник углеводов в пище
человека. Лактоза содержится в молоке (от 2 до 8%) и получается из молочной сыворотки. Мальтоза содержится в проросших семенах хлебных злаков. Мальтоза также образуется при неполном гидролизе крахмала.
Полисахариды: Молекулы полисахаридов можно рассматривать как продукт поликонденсации моносахаридов. Важнейшие из полисахаридов - это крахмал и целлюлоза (клетчатка). Они построены из остатков глюкозы. Общая формула этих полисахаридов (C6H10O5)n
Крахмал (С6H10O5)n - природный полимер, молекулы которого состоят из линейных и разветвленных цепей, содержащих остатки a-глюкозы. Крахмал - образуется в растениях при фотосинтезе и откладывается в виде "резервного" углевода в корнях, клубнях и семенах. Зерна риса, пшеницы, ржи и других злаков содержат 60-80% крахмала, клубни картофеля - 15-20%. Крахмальные зерна растений различаются по внешнему виду, что хорошо видно, когда их рассматриваешь под микроскопом.
Физические свойства: Внешний вид крахмала хорошо всем известен: это белое вещество, состоящее из мельчайших зерен, напоминающих муку, поэтому его второе название «картофельная мука». Крахмал не растворим в холодной воде, в горячей набухает и постепенно растворяется, образуя вязкий раствор (клейстер). При быстром нагревании крахмала происходит расщепление гигантской молекулы крахмала на мелкие молекулы полисахаридов, называемых декстринами. Декстрины имеют общую молекулярную формулу с крахмалом (С6Н12О5)х, разница лишь в том, «х» в декстринах меньше «n» в крахмале. Пищеварительные соки содержат несколько разных ферментов, которые при низкой температуре доводят гидролиз крахмала до глюкозы:
(С6Н10О5) ------- (С6Н10О5)х --------- С12Н22О11 --------- С6Н12О6
Крахмал легко подвергается гидролизу: при нагревании в присутствии серной кислоты образуется глюкоза. (C6H10O5)n(крахмал) + nH2O --H2SO4,t nC6H12O6(глюкоза)
Химические свойства:
1) Гидролиз
H+, t
(C6H10O5)n + nH2O → nC6H12O6
глюкоза
2) Крахмал дает интенсивно синее окрашивание с йодом за счет образования внутрикомплексного соединения(качественная реакция).
3) Крахмал не вступает в реакцию «серебряного зеркала».
Применение: Ферментативный гидролиз (разложение путем брожения) крахмала имеет промышленное значение в производстве этилового спирта из зерна и картофеля. Процесс начинается с превращением крахмала в глюкозу, которую затем сбраживают. Используя специальные культуры дрожжей и изменяя условия, можно направить брожение и в сторону получения бутилового спирта, ацетона, молочной, лимонной и глюконовой кислот. Подвергая крахмал гидролизу кислотами, можно получить глюкозу в виде чистого кристаллического препарата или в виде патоки - окрашенного нескристаллизирующего сиропа. Наибольшее значение крахмал имеет в качестве пищевого продукта: в виде хлеба, картофеля, круп, являясь главным источником в нашем рационе питания. Кроме того, чистый крахмал применяется в пищевой промышленности в производстве кондитерских и кулинарных изделий, колбас. Значительное количество крахмала употребляется для проклеивания тканей, бумаги, картона, производства канцелярского клея. В аналитической химии крахмал служит индикатором в йодометрическом методе титрования. Для этих случаев лучше применять очищенную амилозу, т.к. ее растворы не загустевают, а образуемая с йодом окраска более интенсивна. В медицине и фармации крахмал применяется для приготовления присыпок, паст (густых мазей), а также при производстве таблеток. В животном мире роль «запасного крахмала» играет родственный крахмалу полисахарид - гликоген. Гликоген содержится во всех животных тканях. Особенно много его в печени (до 20%) и в мышцах (4%).
Целлюлоза (С6H10O5)n - природный полимер, молекулы которого состоят из линейных цепей, содержащих остатки b-глюкозы. . Целлюлоза - многоатомный спирт, на элементную ячейку полимера приходятся три гидроксильных группы. В связи с этим, для целлюлозы характерны реакции этерификации (образование сложных эфиров). Наибольшее практическое значение имеют реакции с азотной кислотой и уксусным ангидридом.
Нахождение в природе: Целлюлоза, так же как и крахмал, образуется в растениях при реакции фотосинтеза. Она является основной составной частью оболочки растительных клеток; отсюда происходит ее название -- целлюлоза («целлула» -- клетка). Волокна хлопка -- это почти чистая целлюлоза (до 98%). Волокна льна и конопли тоже состоят главным образом из целлюлозы. В древесине ее содержится примерно 50%.
Получение: Образцом почти чистой целлюлозы является вата, полученная из очищенного хлопка. Основную массу целлюлозы выделяют из древесины, в которой она содержится вместе с другими веществами. Наиболее распространенным методом получения целлюлозы в нашей стране является так называемый сульфитный. По этому методу измельченную древесину в присутствии раствора гидросульфита кальция Ca(HSO3)2 или «гидросульфита натрия NaHSO3 нагревают в автоклавах при давлении 0,5-- 0,6 МПа и температуре 150 "С. При этом все другие вещества разрушаются, а целлюлоза выделяется в сравнительно чистом виде. Ее промывают водой, сушат и направляют на дальнейшую переработку, большей частью на производство бумаги.
Физические свойства. Целлюлоза -- волокнистое вещество, нерастворимое ни в воде, ни в обычных органических растворителях. Растворителем ее является реактив Швейцера -- раствор гидроксида меди (II) с аммиаком, с которым она одновременно и взаимодействует.
Химические свойства:
1) Гидролиз:
H+, t
(C6H10O5)n + nH2O → nC6H12O6.
глюкоза
2) Образование сложных эфиров с азотной и уксусной кислотами:
(C6H7O2(OH)3)n + 3nCH3COOH → (C6H7O2(OCOCH3)3)n + nH2O
целлюлоза
+ 3n HNO3
H2SO4
----
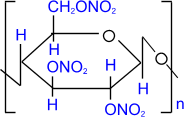
тринитрат целлюлозы
+ 3n H2О
Применение. Целлюлоза используется человеком с очень древних времен. Ее применение весьма разнообразно. Большое значение имеют продукты этерификации целлюлозы. Так, например, из ацетилцеллюлозы получают ацетатный шелк. Для этого триацетилцеллюлозу растворяют в смеси дихлорметана и этанола. Образовавшийся вязкий раствор продавливают через фильеры -- металлические колпачки с многочисленными отверстиями (рис. 36). Тонкие струи раствора опускаются в шахту, через которую противотоком проходит нагретый воздух. В результате растворитель испаряется и триацетил целлюлоза выделяется в виде длинных нитей, из которых прядением изготовляют ацетатный шелк Ацетил целлюлоза идет также на производство негорючей пленки и органического стекла, пропускающего ультрафиолетовые лучи. Тринитроцеллюлоза (пироксилин) используется как взрывчатое вещество и для производства бездымного пороха. Для этого тринитроцеллюлозу растворяют в этил-ацетате или в ацетоне. После испарения растворителей компактную массу размельчают и получают бездымный порох. Динитроцеллюлоза (коллоксилин) применяется также для получения коллодия. В этих целях ее растворяют в смеси спирта и эфира. После испарения растворителей образуется плотная пленка -- коллодий, применяемый в медицине. Динитроцеллюлоза идет также на производство пластмассы целлулоида. Его получают путем сплавления ди-нитроцеллюлозы с камфорой.
Целлюлоза (клетчатка) -- основное вещество растительных клеток. Древесина на 50% состоит из целлюлозы, а хлопок и лен -- это практически чистая целлюлоза.
Целлюлоза представляет собой твердое волокнистое вещество, нерастворимое в воде, но растворимое в аммиачном растворе гидроксида меди (II) (реактиве Швейцера).
Целлюлоза -- природный полимер. В отличие от крахмала, ее молекулы состоят только из линейных цепей, содержащих остатки р-глюкозы, которые связаны через первый и четвертый углеродные атомы.
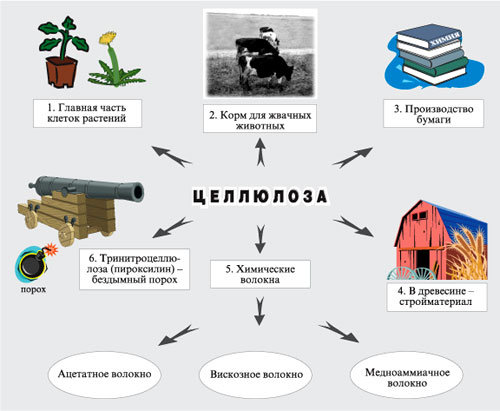
Контроль знаний:
1.Какой дисахарид лежит в нашей сахарнице?
2.Почему жизнь на Земле основана на углероде?
3. Какие вещества относятся к углеводам? Как классифицируют углеводы и почему?
4. Какие характерные химические свойства глюкозы и крахмала.
5. Приведите примеры значения углеводов.
6.Составьте уравнение реакций, при которых сахарозу можно превратить в этанол?
7. Изобразите известные вам процессы брожения глюкозы и укажите их практическое значение.
8.Вычислите, какой объём (в л.) оксида углерода (IV) образуется при окислении 0,25 моль сахарозы.
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л1. Стр.146-152,153-156,157-161,162-165, пересказ конспекта лекции №13.
Лекция № 14.
Тема: Амины. Понятие об аминах. Анилин как ароматический амин, органическое основание. Взаимное влияние атомов в молекуле анилина: ослабление основных свойств и взаимодействие с бромной водой. Применение анилина на основе свойств.
Аминокислоты. Получение аминокислот из карбоновых кислот и гидролизом белков. Химические свойства аминокислот как амфотерных органических соединений: взаимодействие со щелочами, кислотами и друг с другом (реакция поликонденсации). Пептидная связь и полипептиды. Применение аминокислот на основе свойств.
Белки. Получение белков реакцией поликонденсации аминокислот. Первичная, вторичная и третичная структуры белков. Химические свойства белков: горение, денатурация, гидролиз и цветные реакции. Биохимические функции белков. Генетическая связь между классами органических соединений.
Основные понятия и термины по теме: классификация аминокислот и структуры белков, изомерия. характеристика представителей, химические свойства, качественные реакции.
План изучения темы
(перечень вопросов, обязательных к изучению):
1.Понятие об аминах. Анилин как ароматический амин, органическое основание.
2.Способы получения аминокислот.
3.Химические свойства аминокислот как амфотерных органических соединений.
4.Применение аминокислот.
5.Получение белков реакцией поликонденсации аминокислот
6.Первичная, вторичная и третичная структуры белков.
7.Качественные реакции на белки.
8.Биохимические функции белков.
9.Генетическая связь между классами органических соединений.
Содержание лекции:
Понятие об аминах. Анилин как ароматический амин, органическое основание.
Амины - органические соединения, производные аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородный радикал. По числу атомов водорода в молекуле аммиака различают первичные (1), вторичные (2), и третичные (3) амины.
H H | | H - N-H H - N-CH3 или H3С - NH2 метиламин
Названия аминов обычно образуют от названий радикалов, входящих в молекулу, с добавлением окончания -амин.
Амины - это органические основания.
Большое значение имеют первичные амины, особенно фениламин или анилин C6H5NH2.
Анилин. Его получил Н.Н. Зинин в 1841 году из нитробензола. Как восстановитель М. М. Зинин использовал сульфид аммония:
![]()
Анилин можно рассматривать как производное бензола, в молекуле которого атом водорода замещен аминогруппой, или как производное аммиака, в молекуле которого один атом водорода замещен радикалом фенилом.
Структурная формула анилина такая:
Анилин - бесцветная маслянистая жидкость со
слабым характерным запахом. Он немного тяжелее воду и мало
растворим в ней, но хорошо растворяется в спирте, эфире, бензоле.
Ядовитый. На свойства анилина влияет бензольное ядро. 
Электроны бензольного ядра, вступая во взаимодействие с неразделенной электронной парой азота, притягивают ее в свою сферу и оттягивают на себя. Как следствие этого на атоме азота уменьшается электронная плотность, слабее связывается протон и меньше образуется свободных гидроксильных ионов. Поэтому анилин проявляет очень слабые основные свойства (они выражены слабее, чем у аминов насыщенного ряда и аммиака). Например, раствор анилина не окрашивает лакмус в синий цвет, но при взаимодействии с сильными кислотами анилин образует соли (подобно аминов насыщенных).
Открытое М. М. Зининым превращения ароматических нитросоединений в амины дало начало новой эпохе в химической промышленности и стало толчком для бурного развития промышленности органического синтеза, особенно анилинокрасочной и фармацевтической промышленности.
«Если бы Зинин не сделал ничего более, кроме превращения нитробензола на анилин, то и тогда его имя осталось бы записанным золотыми буквами в истории химии»,- так закончил свою речь, посвященную памяти Н. М. Зинина, в 1880 г. президент Немецкого химического общества, основатель немецкой анилинокрасочной промышленности А. В. Гофман.
Химические свойства.
Амины повторяют химические свойства аммиака, поскольку они е его производными.
Из - за взаимные влияния аминогруппы на радикал фенил, основные свойства анилина значительно слабее аммиака.
Так же, как и аммиак, амины взаимодействуют с кислотами, образуя соли.
Качественной реакцией на анилин является реакция с бромной водой.
![]()
Полученная соль 2,4,6 триброманилин представляет собой белый осадок. Основное применение - производство красителей, также лекарств, полимеров.
Среди азотосодержащих органических веществ имеются соединения с двойственной функцией. Особенно важными из них являются аминокислоты.
Любое соединение, которое содержит одновременно карбоксильную и аминогруппу, является аминокислотой. Аминокислоты, как правило, входят в состав полимеров - белков. В природе встречается свыше 70 аминокислот, но только 20 играют важную роль в живых организмах. Незаменимыми называются аминокислоты, которые не могут быть синтезированы организмом из веществ, поступающих с пищей, в количествах, достаточных для того, чтобы удовлетворить физиологические потребности организма. Незаменимые аминокислоты приводятся. Для больных фенилкетонурией незаменимой аминокислотой является также тирозин. Для простейших аминокислот обычно применяются тривиальные названия (глицин, аланин, изолейцин и т.д.).
Изомерия аминокислот связана с расположением функциональных групп и со строением углеводородного скелета. Молекула аминокислоты моет содержать одну или несколько карбоксильных групп и в соответствии с этим аминокислоты различаются по основности. Также в молекуле аминокислоты может находиться разное количество аминогрупп.
Физические свойства.
Аминокислоты - твердые кристаллические вещества с высокой т.пл., при плавлении разлагаются. Хорошо растворимы в воде, водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
СПОСОБЫ ПОЛУЧЕНИЯ АМИНОКИСЛОТ
1) Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот):
O2N-C6H4 -COOH + 3H2 → H2N-C6H4 -COOH + 2H2O
2) Гидролизом белков можно получить около 25 аминокислот, но полученную смесь трудно разделить. Обычно одна или две кислоты получаются в значительно больших количествах, чем остальные, и эти кислоты удается выделить довольно легко - с помощью ионообменных смол.
Химические свойства аминокислот как амфотерных органических соединений.
Аминокислоты - амфотерные вещества, которые могут существовать в виде катионов или анионов. Это свойство объясняется наличием как кислотной (-СООН), так и основной (-NH2) группы в одной и той же молекуле. В очень кислых растворах NH2-группа кислоты протонируется и кислота становится катионом. В сильнощелочных растворах карбоксильная группа аминокислоты депротонируется и кислота превращается в анион.
Подобно аминам, они реагируют с кислотами с образованием солей аммония:
H2N-CH2 -COOH + HCl → Cl- [H3N-CH2 -COOH]+
При взаимодействии с щелочами аминокислоты реагируют по карбоксильной группе.
Как карбоновые кислоты они образуют функциональные производные:
а) соли : H2N-CH2 -COOH + NaOH → H2N-CH2 -COO- Na+ + H2O
б) сложные эфиры(реакция этерификации):
NH2 -CH2 -COOH + CH3OH → H2O + NH2 -CH2 COOCH3 (метиловый эфир глицина)
При взаимодействии друг с другом аминокислоты образуют пептидную связь (существует в белке):
HOOC -CH2 -NH -H + HOOC -CH2 -NH2 → HOOC -CH2 -NH -CO -CH2 NH2 + H2O
При взаимодействии двух a-аминокислот образуется дипептид. Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO-NH - пептидной связью.
Применение аминокислот.
Аминокислоты широко используются в современной фармакологии. Являясь не только структурными элементами белков и других эндогенных соединений, они имеют большое функциональное значение. Некоторые из них выступают в качестве нейромедиаторных веществ. Некоторые аминокислоты нашли самостоятельное применение в качестве лекарственных средств.
Белки. Получение белков реакцией поликонденсации аминокислот.
Аминокислоты способны к поликонденсации, в результате которой образуется полиамид. Полиамиды, состоящие из -аминокислот, называются пептидами или полипептидами. Амидная связь в таких полимерах называется пептидной связью. Полипептиды с молекулярной массой не меньше 5000 называют белками.
Первичная, вторичная и третичная структуры белков.
Уникальная последовательность аминокислотных остатков в цепи, присущая данному белку, называется первичной структурой белка.
Фрагмент полипептидной цепи:
… - N - CH - C - N - CH - C - N - CH -C - N - CH - C - …
׀ ׀ ׀ ׀ ׀ ׀ ׀ ׀
H R O H R1O H R2O H R3O
Один из первых белков, первичная структура которого была установлена в 1954 г., - гормон инсулин (регулирует содержание сахара в крови), его молекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой - 30), Mr (инсулина)=5700. Другой белок - фермент рибонуклеаза - состоит из 124 аминокислотных остатков и имеет Mr=15000.
Белок крови - гемоглобин имеет Mr = 68000. Белки некоторых вирусов имеют Mr до 50 млн. Относительная молекулярная масса белков изменяется в широких пределах: от 5 тыс. до десятков миллионов.
Особенности скручивания цепей белковых молекул (взаимное расположение фрагментов в пространстве) называются вторичной структурой белков.
Полипептидные цепи белков могут соединяться между собой с образованием амидных, дисульфидных, водородных и иных связей за счет боковых цепей аминокислот. В результате этого происходит закручивание спирали в клубок. Эта особенность строения называется третичной структурой белка. Для проявления биологической активности некоторые белки должны сначала образовать макрокомплекс (олигопротеин), состоящий из нескольких полноценных белковых субъединиц. Четвертичная структураопределяет степень ассоциации таких мономеров в биологически активном материале.
Белки делятся на две большие группы - фибриллярные (отношение длины молекулы к ширине больше 10) и глобулярные(отношение меньше 10). К фибриллярным белкам относится коллаген, наиболее распространенный белок позвоночных; на его долю приходится почти 50% сухого веса хрящей и около 30% твердого вещества кости. В большинстве регуляторных систем растений и животных катализ осуществляется глобулярными белками, которые носят название ферментов.
Химические свойства
Денатурация - разрушение вторичной, третичной структуры белка под действием различных факторов: температура, действие кислот, солей тяжёлых металлов, спиртов и т.д.
При денатурации под влиянием внешних факторов (температуры, механического воздействия, действия химических агентов и других факторов) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы.
Первичная структура, а, следовательно, и химический состав белка не меняются. Изменяются физические свойства: снижается растворимость, способность к гидратации, теряется биологическая активность. Меняется форма белковой макромолекулы, происходит агрегирование. В то же время увеличивается активность некоторых групп, облегчается воздействие на белки протеолитических ферментов, а, следовательно, он легче гидролизуется.
В пищевой технологии особое практическое значение имеет тепловая денатурация белков, степень которой зависит от температуры, продолжительности нагрева и влажности. Это необходимо помнить при разработке режимов термообработке пищевого сырья, полуфабрикатов, а иногда и готовых продуктов. Особую роль процессы тепловой денатурации играют при бланшировании растительного сырья, сушке зерна, выпечке хлеба, получении макаронных изделий. Денатурация белков может вызываться и механическим воздействием (давлением, растиранием, встряхиванием, ультразвуком). К денатурации белков приводит действие химических реагентов (кислот, щелочей, спирта, ацетона). Все эти приемы широко используют в пищевой и биотехнологии.
Качественные реакции на белки:
а) При горении белка - запах палёных перьев.
б) ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца):
Белок +HNO3 → жёлтая окраска
в) биуретовая реакция, (на пептидные связи)
Раствор белка +NaOH + CuSO4 → фиолетовая окраска
Гидролиз
Белок + Н2О → смесь аминокислот
г) ) цистеиновая реакция (на остатки аминокислот, содержащих серу):
белок + NaOH + Pb (CH3COO)2 → чёрное окрашивание.
Гидратация
Процесс гидратации означает связывание белками воды, при этом они проявляют гидрофильные свойства: набухают, их масса и объем увеличивается.
Биохимические функции белков. Функции белков в природе:
· каталитические (ферменты);
· регуляторные (гормоны);
· структурные (кератин шерсти, фиброин шелка, коллаген);
· двигательные (актин, миозин);
· транспортные (гемоглобин);
· запасные (казеин, яичный альбумин);
· защитные (иммуноглобулины) и т.д.
Существуют белки, выполняющие специфические функции, например рецепторные, - обеспечивают передачу импульсов между нервными клетками и др.
Белки - необходимая составная часть пищи человека, отсутствие или недостаток их в пище может вызвать серьёзные заболевания.
Генетическая связь между органическими соединениями.
Генетическая связь ( от греч. «генезис» - происхождение).
Генетические связи - это связи между классами соединений, основанные на получении одного класса веществ с другого.
Генетическая связь отражает возможность взаимных превращений.
Правило генетических связей:
1) количество стрелок в схеме соответствует количеству уравнений химических реакций, которые необходимо сложить;
2) соединения, записанные перед стрелочкой обязательно должны вступить в химическую реакцию;
3) соединения, записанные после стрелочки должны образоваться в результате реакции.
Имея правила генетических связей давайте вместе совершим такое преобразование: С→СО2 → Н2СО3→СаСО3
Поэтому для неметаллов схема будет иметь такой вид:
Неметалл→ Кислотный оксид→ Кислота→Соль.
Изучая углеводороды, мы убедились в их разнообразии, которая
обусловлена способностью атомов Углерода образовывать молекулы
линейного, разветвленного, циклического строения; сочетаться между
собой с помощью простых и кратных связей. А еще - образовывать
гомологические ряды и изомеры.
Сравнив общие формулы алканов, алкенов и алкинов, можно заметить, что они отличаются количеством атомов Водорода в молекулах. Итак, реакциями гидрирования и дегидрирования можно переходить от одного класса углеводородов к другому. Существует также связь между насыщенными, ненасыщенными углеводородами и бензолом. Так, из метана реакцией дегидрирования можно получить ацетилен. А с него реакцией тримеризации добыть бензол:
2CH4 → C2H2 + 3H2;
3C2H2 → C6H6
Итак, при всем разнообразии углеводородов между
ними существует взаимосвязь, что отражается во взаимных
превращениях веществ. Это открывает огромные возможности для
химического синтеза.
Вещественный мир природы чрезвычайно разнообразен, и вместе с тем
все вещества взаимосвязаны. Генетическая связь между органическими
и неорганическими веществами заключается, прежде всего, в том, что
органические вещества можно добыть из неорганических. Например, при
нагревании
![]()
неорганического вещества цианата аммония образуются органическое вещество мочевина (NH2)2CO:
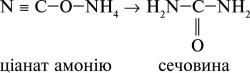
Ярким доказательством существования генетической связи между органическими и неорганическими веществами являются также круговорот биогенных элементов в природе. Следовательно, все вещества генетически связаны между собой. Генетическая связь заключается в том, что каждое вещество может химически взаимодействовать с веществами других классов. Органические вещества могут взаимодействовать с неорганическими. Их можно синтезировать из неорганических и превращать в неорганические.
В органической химии также следует различать
более общее понятие - генетическая связь и более частное понятие
генетический ряд. Если основу генетического ряда в неорганической
химии составляют вещества, образованные одним химическим элементом,
то основу генетического ряда в органической химии (химии углеродных
соединений) составляют вещества с одикиконым числом атомов
углерода</<font size="4"> в молекуле. Рассмотрим
генетический ряд органических веществ, в который включим наибольшее
число классов соединений: 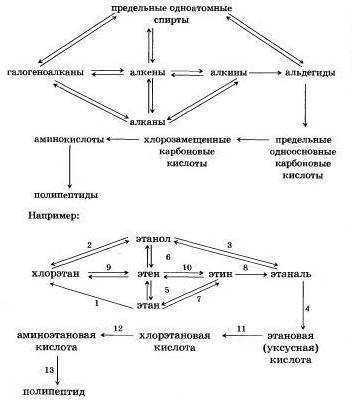
Каждой цифре над стрелкой соответствует определенное уравнение реакции (уравнение обратной реакции обозначено цифрой со штрихом):
Контроль знаний:
1.Дать определение амидной связи.
2. Дать характеристику структурам белка, составу аминокислот.
3.Какие элементы входят состав белка?
4.Опишите физические и химические свойства белков.
5.Какие вещества образуются при гидролизе белков?
6.Укажите число возможных изомерных аминов, имеющих молекулярную формулу СзН9N: а) два; б) три; в) четыре; г) пять.
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л1. Стр.169-173, Л1. Стр.174-177,178-183, пересказ конспекта лекции №14.
Лекция № 15.
Тема: Химия в повседневной жизни. Правила безопасной работы со средствами бытовой химии. Бытовая химическая грамотность. Химическое загрязнение окружающей среды и его последствия.
Основные понятия и термины по теме: правила безопасной работы со средствами бытовой химии, понятие бытовой химической грамотности.
План изучения темы
(перечень вопросов, обязательных к изучению):
1.Бытовые химикаты.
2.Правила безопасной работы со средствами бытовой химии. Бытовая химическая грамотность.
3.Химическое загрязнение окружающей среды и его последствия.
Содержание лекции:
В любой отрасли человеческой деятельности мы неизбежно соприкасаемся с веществами и используем их свойства и взаимодействие между собой. Химия, обладая огромными возможностями, умножает плодородие почвы, создает невиданные ранее материалы, облегчает труд человека, экономит время, создает ему уют и комфорт, одевает, сохраняет его здоровье, изменяет внешность людей. Использование людьми достижений современной химии требует общей культуры, большой ответственности и знаний.
1.Бытовые химикаты.
К товарам бытовой химии относят клеи, абразивные
материалы, средства для стирки и мытья, средства для чистки,
лакокрасочные товары, средства по уходу за жильем. предметами быта,
садом и огородом и др.
Клеи - это полимеры, или соединения на их основе, применяемые для
соединения различных материалов. Действие клея основано на
образовании между ними и клюющим материалом адгезии. В состав клея
входят полимеры (клеящие вещества), растворители, наполнители,
пластификаторы и др. Безопасность клея зависит от свойств
полимеров, растворителей, пластификаторов и др. Функциональных
свойств клеев относят их клеящую способность, термическую и
химическую устойчивость и универсальность. Надежность определяется
долговечностью склеенных соединений, хранением клеев и др.
Эластичные свойства зависят от их цвета, прозрачности, упаковки,
четкости маркировки.
Косметика, духи, растворители, лекарства,
пищевые добавки, пестициды (препараты для сельского хозяйства),
средства бытовой химии - это все химикаты. Полный учет и оценка
качества химикатов никогда не проводились.
Ежегодно к торговле поступают одна-две тысячи новых названий
химикатов, большинство из которых не проходят предварительной
апробации и не получают оценки к возможного влияния на окружающую
среду. Данные, необходимые для полной оценки воздействия на
окружающую среду, здоровье людей, охватывают всего 10% пестицидов,
18% лекарств, 80% химических веществ, используемых в торговле и
технологических процессах, не всесторонне проверено на токсичность.
Ряд химикатов ежегодно изымается из продажи после испытаний национальными контрольными органами. В развитых странах учреждения, которые осуществляют контроль за химическими веществами, обмениваются результатами исследований и сообщают о новых ограничениях в ассортименте химикатов. Импортеры среди стран, не включены в эту систему и не получают соответствующей информации. Они также не имеют собственной службы контроля (к тому же имеет место контрабанда химикатов). Вследствие недостаточной информированности персонала предприятий и населения о токсичные вещества, отсутствия соответствующей маркировки, нередко наблюдается нарушение гигиенических и экологических требований во время их использования на производстве и в быту, что приводит к острым и хроническим отравлениям, загрязнения окружающей среды. Покупая химикаты, обращайте внимание на наличие экологической маркировки. Пусть этот указатель станет для вас не менее важным, чем эффективность и стоимость химиката.
Во время использования химикатов в своей квартире защищайте органы дыхания, по крайней мере, повязкой, а в случае использования лаков, клеев и «сильных» растворителей - респиратором или противогазом, защищайте руки резиновыми перчатками. Все, что стираете, чистите, моете, используя средства бытовой химии, прополощите достаточным количеством проточной воды. Остатки этих веществ на белье, панелях, т.п. в виде микрочастиц: попадают в органы дыхания и пищеварения и могут вызвать аллергии, постепенно провоцировать развитие хронических заболеваний, нарушения обмена веществ и т.д.
2.Правила безопасной работы со средствами бытовой химии. Бытовая химическая грамотность.
М.В. Ломоносов сказал: «Широко простирает химия руки свои в дела человеческие». И это действительно так.
Кажется, что со средствами бытовой химии обращаться легко и просто. Но далеко не всем известно о вреде, который они могут причинить нашему здоровью. Чтобы обезопасить себя и своих близких, следуйте ряду правил.
Бытовая химия, несмотря на свою относительную безобидность, все-таки химия. Поэтому обращаться с ней нужно осторожно. Хранить обязательно следует в герметично закрытых емкостях вдали от источников тепла и прямого солнечного света.
Основные правила техники безопасности при хранении и применении препаратов бытовой химии:
1. Все препараты следует применять только по прямому назначению, строго соблюдая инструкции и рекомендации по их использованию.
2.Применять можно только препараты, купленные в магазине и имеющие этикетку на упаковке.
3. Все средства бытовой химии, даже если это обычный стиральный порошок или сода, следует хранить в недоступных для детей местах и обязательно отдельно от пищевых продуктов.
4. При работе с пожароопасными средствами нельзя зажигать газовые горелки, спички, нельзя курить, пользоваться электронагревательными приборами; особо пожаро- и взрывоопасны пары горючих жидкостей (бензина и других растворителей), с ними лучше работать на воздухе.
5. Химические вещества нельзя разогревать на
открытом пламени, а лучше ставить в горячую воду или на разогретый
песок.
6. При воспламенении емкость с этими веществами следует накрыть
плотной шерстяной тканью, а по прекращении горения вынести из
помещения.
7. После завершения работ обязательно следует проветрить помещение
и только после этого можно курить или пользоваться нагревательными
приборами;
8. При работе с препаратами, содержащими агрессивные химические
вещества (кислоты, щелочи и др.) , надо надевать резиновые
перчатки, очки.
9. Жидкие химические вещества следует переливать, обязательно
пользуясь воронкой, а сыпучие - пересыпать ложкой; при этом надо
беречь глаза и дыхательные пути от попадания в них брызг или пыли;
воронку и ложку после употребления следует тщательно вымыть и
высушить; хранить их лучше всего в том же месте, где хранятся
химические препараты.
10. Нельзя наклоняться низко над сосудами с химическими веществами,
нюхать их, сильно втягивая воздух; нельзя наклоняться низко над
кипящей жидкостью, особенно при вливании в нее новой порции
жидкости или высыпании порошка.
11. При разбавлении крепкой серной кислоты ее
надо постепенно лить в воду, а не наоборот; учтите, что при этом
вода будет сильно разогреваться.
12. Горячие жидкости нельзя вливать в обычную толстостенную
стеклянную посуду.
13. При работе с инсектицидами использовать защитные очки,
респиратор и резиновые перчатки.
14. До обработки ядовитыми веществами помещения
из него надо обязательно удалить пищевые продукты, всех домашних
животных, птиц и аквариумы; после обработки рекомендуется сразу же
тщательно помыть руки и покинуть помещение, закрыв окна и двери в
нем. Спустя несколько часов после обработки, помещение надо
проветрить, а поверхность обеденного и кухонного столов лучше всего
вымыть теплой водой с мылом.
15. В стеклянной, металлической, пластмассовой или картонной
упаковке, освободившейся от препаратов бытовой химии, пищевые
продукты хранить нельзя, как бы тщательно вы ее ни вымыли; но и
выбрасывать ее не обязательно; например, вымытые пластмассовые
банки можно использовать для хранения других препаратов (пересыпав
их из картонных коробок или полиэтиленовых мешочков).
Следует иметь в виду, что некоторые химические
вещества при смешении могут энергично реагировать друг с другом,
иногда с выделением тепла, с разбрызгиванием и т. д. Такие вещества
называются несовместимыми и смешение их недопустимо. Так, серная,
соляная другие кислоты несовместимы с кальцинированной и питьевой
содой, мелом, известью, щелочами; алюминиевые квасцы несовместимы
со щелочами, нашатырным спиртом, столярным клеем, желатином, бурой.
Нашатырный спирт и хлорид аммония несовместимы с йодом и
формалином. Перманганат калия (марганцевокислый калий) несовместим
со спиртами, глицерином, серой, йодом, углем, нашатырным спиртом и
хлористым аммонием, а сера, в свою очередь - с перманганатом калия
и хлорной известью. Хлорную известь нельзя смешивать со скипидаром,
жирами, маслами, глицерином, нашатырным спиртом, хлористым аммонием
и органическими растворителями.
Некоторые дополнительные меры предосторожности необходимо соблюдать
при пользовании аэрозольными баллонами.
Хранение и утилизация.
-
перед началом применения средства нужно внимательно изучить его состав;
-
применять химические товары нужно используя индивидуальные средства защиты - повязку и перчатки;
-
химию необходимо применять только по назначению;
-
химическую продукцию нельзя подвергать воздействию прямых солнечных лучей или открытого пламени;
-
при использовании бытовой химии рекомендации по дозировке и периодичности применения являются обязательными к соблюдению;
-
химические средства с просроченным сроком годности категорически запрещено использовать, так как они способны нанести вред.
Не храните нечто без названия и внятной инструкции по эксплуатации. Все баночки и коробочки с неизвестным содержимым безжалостно выбрасывайте - это ваша безопасность. Также не стоит хранить средства, которых осталось совсем мало. Это может показаться излишней расточительностью, однако в полувысохшем состоянии многие вещества меняют свои свойства и в лучшем случае станут просто бесполезными.
Помните одно - вашу безопасность производители средств гарантируют только при соблюдении правил его применения.
3.Химическое загрязнение окружающей среды и его последствия.
За последние десятилетия стало очевидным, что человек перенасытил природу загрязняющими веществами. Согласно расчетам, поступление их из антропогенных источников в 10, а то и в 1000 раз, чем из естественных, в зависимости от вещества.
Остро встает проблема - уберечь окружающую среду и здоровье человека.
В условиях возрастающего антропогенного воздействия на природу увеличиваются техногенные потоки различных загрязняющих веществ, усиливается их давление на все компоненты биосферы и слагающие ее наземные и водные экосистемы. Однако, несмотря на повсеместно проявляемое беспокойство по поводу загрязнения окружающей среды, по-прежнему ежегодно многие миллионы тонн различных экологически вредных веществ выбрасываются в атмосферу, в океан, заносятся во внешние слои литосферы. Известно, что менее 10% добываемого сырья превращается в готовую продукцию; остальное - отходы, загрязняющие природную среду. Уже сегодня в банке данных Chemical Abstract Services (США) имеются сведения о почти 8 млн. различных химических соединений, причем несколько десятков тысяч из этого количества находят широкое применение в многообразных сферах жизни и постоянно используются людьми.
Экологически Опасные Факторы (ЭОФ) представляют
собой такие воздействия окружающей среды, которые способствуют
и/или приводят к качественным и количественным нарушениям в
экосистемах (от любого сообщества живых существ и среды их
обитания, вплоть до биосферы в целом), к тем изменениям, которые
оказывают влияние на жизнеспособность и адаптацию популяций,
размножение, рост. поведение и выживание отдельных особей (В. В.
Худолей, И. В. Мизгирев).
ЭОФ химической природы - это химические вещества, которые в
определенных концентрациях приводят к качественным и количественным
нарушениям в экосистемах. К ЭОФ химической природы относятся, в
первую очередь, следующие группы веществ:
- тяжелые металлы,
- диоксины и диоксиноподобные соединения,
- ДДТ и другие пестициды,
- нитриты, нитраты и нитрозосоединения,
- полициклические ароматические углеводороды.
Без угарного газа не смогут существовать многие отрасли промышленности: в технике CO - ценное топливо, в металлургии мы используем его восстановительные свойства для получения чистых металлов, в военной промышленности он применяется для приготовления фосгена.
Летальный исход для человека может наступить при 10-минутном вдыхании воздуха, содержащего 5,7г/м3 угарного газа. Ядовитость CO обусловлена тем, что этот оксид соединяется с гемоглобином крови, в результате чего кровь не способна переносить достаточно кислорода из легких к тканям. Сродство гемоглобина к угарному газу гораздо больше, чем к кислород. Поэтому достаточно самой ничтожной концентрации CO, чтобы значительно понизить способность крови воспринимать кислород и тем самым вызвать удушье.
Однако при вдыхании чистого воздуха или, еще лучше, чистого кислорода угарный газ постепенно удаляется из крови.
Малозаметная «вуаль», состоящая из диоксида углерода, воды, озона и метана, является в атмосфере своеобразным фильтром: пропуская около 70% солнечного излучения, она задерживает отражаемые Землей тепловые лучи. Вследствие этого у поверхности нашей планеты, словно под стеклянной крышей оранжереи, температура поддерживается более или менее на одном ровне - - 40 до 40 О С. Однако все возрастающее количество сжигаемого топлива приводит к тому, что содержание углекислого газа в атмосфере неуклонно увеличивается и достигает сейчас 0,6% в составе воздуха при скорости 2мг/м3 в год, что неизбежно приводит к повышению средней температуры поверхности Земли на 2 - 4оС. Если не остановить это губительное для человечества увеличение содержания углекислого газа в атмосфере, то под море уйдут Гамбург и Гонконг, Лондон и Копенгаген, Европа станет засушливой зоной с массой вредных насекомых и болезнетворных микроорганизмов.
Термин «кислотные дожди» ввел английский химик А.Смит более 100 лет. Еще 200 лет назад дождевая и снеговая вода была практически нейтральной с рН = 7. Причиной возникновения кислотных дождей являются массовые промышленные выбросы диоксида серы и оксидов азота в атмосферу. Взаимодействуя с атмосферной влагой, SO2 создает кислую среду. Растворимость его в воде достаточно велика и составляет 40 объемов на один объем воды. В районах сосредоточения промышленных производств 60% кислотности дождевой воды дает серная кислота, 30% - азотная, 5% - соляная и только 2% - углекислый газ.
Диоксид серы, попавший в атмосферу, претерпевает
химические превращения, которые ведут к образованию кислот.
Частично диоксид серы в результате окисления превращается в
триоксид серы (серный ангидрид) SO3:
2SO2 + О2 → 2SO3
который реагирует с водяным паром атмосферы, образуя серную кислоту (при наличии катализатора V2O5) :
SO3 + Н2О → H2SO4.
Основная часть диоксида серы, выбрасываемого в влажном воздухе образует аэрозоль сернистой кислотой и изображают условной формулой Н2SO3:
SO2 + H2O → H2SO3
Сернистая кислота во влажном воздухе постепенно
окисляется до серной:
2H2SO3 + O2 →
2H2SO4
Вдыхание влажного воздуха, содержащего диоксид серы опасно для людей, страдающих сердечно-сосудистыми и легочными заболеваниями, в тяжелых случаях может возникнуть отек легких. Кислотные дожди разъедают изделия из металлов, краски, синтетические соединения, разрушают архитектурные памятники.
Мировой рекорд по выпадению кислотного дождя пока принадлежит шотландскому городу Питлохри, где 10 апреля 1974 года выпал дождь с рН = 2,4! Это же что-то у столового уксуса.
Первым шагом в предотвращении загрязнения окружающей среды, обеспечении безопасности жизнедеятельности человека является контроль содержания загрязняющих веществ (загрязнителей) в объектах окружающей среды - в воздухе, почве, воде, продуктах питания.Одна из особенностей ситуации на сегодняшний день заключается в том, что изменения в окружающей среде, возникающие при химическом загрязнении, опережают темпы развития методов контроля и прогнозирования ее состояния. Необходим качественно новый подход к описанию состояния окружающей среды как динамической химико-биологической системы. Необходимы данные о том, как ведут себя, какие испытывают превращения, к каким последствиям приводят те или иные химические вещества, попадающие в биосферу. При этом традиционные методы химического и биологического анализов служат основой для количественной оценки состояния и динамических характеристик природных экосистем.
Кроме того, необходимо иметь в виду, что в основе процессов жизнедеятельности, как и в основе изменения химического состава окружающей среды, лежат химические взаимодействия (реакции), представляющий собой превращение исходных веществ в продукты трансформации. Любой химико-биологический процесс представляет собой совокупность химических актов, определяющих механизмы процессов. Соответственно для описания и управления динамически равновесным состоянием экосистем в условиях возрастающих масштабов человеческой деятельности необходимо знание химических механизмов взаимодействия между человеком, средой обитания и отдельными экологическими подсистемами.
Экономическое развитие общества тесно связано с потреблением энергии в растущем количестве. Основные источники энергии - уголь, нефть, природный и попутный нефтяной газы. Ресурсы ископаемого топлива сокращаются, что заставляет нас думать о повышении эффективности их использования. В то же время необходимость защиты окружающей среды заставляет приложить усилия, направленных на совершенствование технологий использования природного сырья, а также на создание новых источников энергии. В решении этих проблем ведущая роль принадлежит химии.
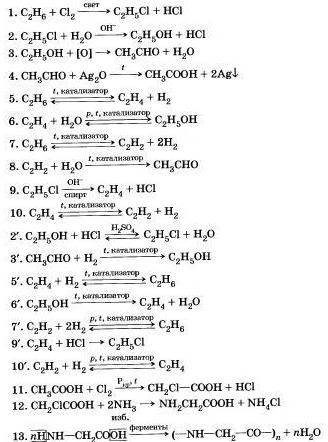
Пример генетической взаимосвязи:

Контроль знаний:
1.Перечислите основные правила химической безопасности в быту.
2. Что является причиной загрязнения атмосферы, гидросферы и литосферы и каковы его последствия?
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л2.стр.209-214,214-217, пересказ конспекта лекции №15.