- Учителю
- Статья ЕГЭ по химии. Задание 39 Методика решения задач.
Статья ЕГЭ по химии. Задание 39 Методика решения задач.
Готовимся к ЕГЭ по химии
(Задание 39)
Практика сдачи ЕГЭ по химии показывает, что больше всего затруднений у школьников вызывают комбинированные задачи. Это обусловлено слабым умением анализировать условия задачи и проводить необходимые расчёты.
Приведём несколько методических рекомендаций по анализу и решению комбинированных задач.
Начинать решение задач следует с тщательного анализа условий. При этом необходимо определить:
-
числовые данные задачи, которые при необходимости приводятся в единую систему единиц (количественная сторона задачи);
-
перечень химических веществ и явлений в их взаимосвязи и взаимообусловленности, основные теоретические положения, необходимые для решения задачи (качественная сторона задачи);
-
соотношения между качественными и количественными данными задачи в виде формул, уравнений, пропорций и законов;
В процессе анализа условий задачи необходимо чётко уяснить, что требуется определить:
-
массу (объем, количество) продуктов реакции;
-
массовые или объемные доли выхода продукта реакции от теоретически возможного;
-
массовые доли (массы) химического соединения в смеси.
На основе проведённого анализа условий составляется алгоритм решения задачи - последовательность действий, начиная с данных по условию и до конечного вопроса задачи.
После составления алгоритма решения, приступаем к его выполнению.
Записываем кратно условие задачи, используя для этого общепринятые обозначения и сокращения. Каждое действие задачи оформляем вопросом, результат вычисляем с необходимой точностью с обозначением единиц. По окончании решения записываем ответ.
При решении задач пользуются следующими формулами основных величин:
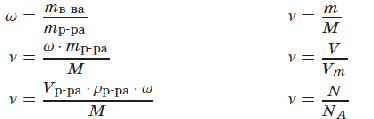
Рассмотрим конкретные примеры решения комбинированных задач (задание 39).
Пример 1. Какую массу серы необходимо сжечь в кислороде, чтобы растворив полученный оксид в 1 л воды, получить раствор сернистой кислоты с массовой долей 0,01?
1) Напишем уравнения реакций:
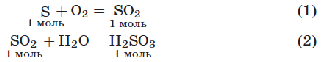
2) Пусть сожгли х моль серы, тогда
![]()
3) Массовую долю растворенного вещества определяют по формуле:
![]()
4) Массовая доля сернистой кислоты по условию равна 0,01. Масса вещества кислоты:
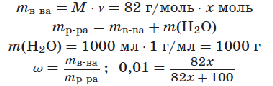
Решим уравнение: Х = 0,123 моль
5) Найдем массу серы:
![]()
Ответ: m (S) = 3,94г.
Пример 2. Какой объем 30%-го раствора аммиака (плотностью 0,892 г/мл) необходимо добавить к 200 мл 40%-го раствора соляной кислоты (плотностью 1,198 г/мл), чтобы массовая доля кислоты уменьшилась вчетверо?
1) Составим уравнение реакции:
![]()
2) Рассчитаем количество вещества соляной кислоты (исходное)
![]()
3) Пусть добавили х моль аммиака, тогда прореагировало х моль соляной кислоты
![]()
4) Рассчитаем количество вещества соляной кислоты, которое осталось
![]()
5) Массовая доля соляной кислоты уменьшилась вчетверо и стала 0,1
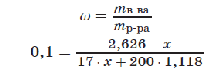
Х = 1,703 моль
6) Найдем объем аммиака по формуле:
![]()
Ответ: 108,2 мл.
Задачи для самостоятельного решения
1. Рассчитайте, какую массу оксида серы (VI) добавили в 120 мл раствора серной кислоты (плотностью 1,025 г/мл) с массовой долей 4%, если массовая доля серной кислоты стала 10%.
(6,56 г)
2. Какую массу фосфора необходимо сжечь в кислороде, чтобы растворив полученный оксид в 1000 г раствора фосфорной кислоты с массовой долей 50%, получить раствор этой кислоты с массовой долей 75%?
(173,29 г)
3. Какую массу карбоната кальция следует добавить к 600 г раствора азотной кислоты с массовой долей 31,5 %, чтобы массовая доля кислоты уменьшилась до 10,5%?
(96 г)
4. Смешали 100 мл 30% -го раствора хлорной кислоты (плотностью 1,11 г/мл) и 300 мл 20%-го раствора натрия (плотностью 1,10 г/мл). Какой объём воды следует добавить к полученной смеси, чтобы массовая доля перхлората натрия в ней составила бы 8%?
(64 мл)