- Учителю
- Открытый урок по химии в 9 классе по теме Скорость химических реакций
Открытый урок по химии в 9 классе по теме Скорость химических реакций
Тема Скорость химических реакций и факторы на нее влияющие.
Тип урока: изучение нового материала
Вид урока: лекция
Класс: 9
Учитель химии ГБОУ СОШ № 1 города Байконур Гузикова Оксана Александровна
Цели урока.
Обучающие:
Дать понятие о скорости химических реакций и единицах ее измерения. Показать влияние на скорость реакций таких факторов как природа реагирующих веществ, их концентрация, площадь соприкосновения, использование катализаторов и температура. Познакомить учащихся с классификацией химических реакций по признаку фазности (агрегатного состояния): гомо- и гетерогенные.
Развивающие:
Привитие навыков определения скорости химической реакции, используя закон действующих масс. Продолжение развитие общеучебных и предметных умений: анализировать, сравнивать, делать выводы. Развитие логико-смыслового мышления учащихся, памяти, химического языка.
Воспитательные:
Расширение кругозора, умение применять полученные знания на практике, самоусвоение лекционного материала. Воспитание культуры умственного труда.
Оборудование и реактивы:
Плакат по технике безопасности, формулы на ПП, проектор, лист-памятка с планом лекции.
Для демонстрационного эксперимента: раствор тиосульфата натрия, раствор серной кислоты, вода, пробирки.
Для лабораторного эксперимента: раствор соляной кислоты, порошок цинка, гранулы цинка, магний, железо, пробирки.
ДЕВИЗ УРОКА:
«Химическое превращение, химическая реакция - есть главный предмет химии» Н.Н. Семенов.
-
ОРГАНИЗАЦИОННЫЙ МОМЕНТ
Учитель
Здравствуйте ребята, садитесь.
Учитель
Дежурные назовите отсутствующих сегодня на уроке.
(учитель отмечает отсутствующих на уроке).
-
ОБЪЯСНЕНИЕ НОВОГО МАТЕРИАЛА
Учитель
Сегодня мы переходим к изучению нового раздела «Скорость химических реакций. Химическое равновесие».
На этом уроке мы поговорим о том, как определяется скорость химической реакции, и какие факторы могут ее изменить.
УЧИТЕЛЬ
На доске написаны две химические реакции.
-
Взаимодействие раствора соляной кислоты и цинка.
-
Взаимодействие раствора серной кислоты и раствора хлорида бария.
Учитель
Чем они отличаются?
Ученик
Они отличаются тем, что одна протекает между растворами, а вот во второй есть и раствор - соляная кислота, и металл - цинк.
Учитель
Значит, первая реакция протекает в одной среде, и эта реакция называется гомогенной, а во второй реакции принимают участие вещества разного агрегатного состояния, она носит название - гетерогенная. Примером гомогенных сред будут газ-газ, жидкость-жидкость. Перечислите примеры гетерогенных сред.
УЧЕНИК
Газ - твердое вещество, газ - жидкость, твердое вещество - газ.
УЧИТЕЛЬ
Правильно. Мы определим скорость химической реакции, запишем определение и соответствующие формулы.
Предмет изучения химии - химическая реакция. В результате химической реакции исчезают одни и образуются другие вещества. В процессе реакции изменяются количества вещества как реагентов (исходных веществ), так и продуктов (конечных веществ). Скорость этого изменения называется скоростью химической реакции. Химическая кинетика - учение о скоростях и механизмах химических реакций. (запишем это определение)
Таким образом, скорость химической реакции можно описать уравнением
r = / (1)
где r - скорость реакции (от англ. rate - скорость процесса, в отличие от ранее используемого обозначения для скорости реакции - velocity - скорость перемещения), (прописная греч. дельта) - синоним слов «конечное изменение», (греч. ню) - количество (моль) вещества-реагента или вещества продукта, (греч. тау) - время (с), за которое произошло данное изменение.
При таком определении скорость реакции зависит от того, количество какого из участников реакции мы наблюдаем и измеряем. Очевидно, что для реакции, например:
2H2 + O2=2H2O.
количество вещества превращающегося водорода в два раза больше, чем кислорода. Поэтому
r(H2) = 2r(O2) = r(H2O).
Уравнение реакции связывает величины скоростей, определенных по любому из веществ. Поэтому выбор последнего зависит от удобства и легкости экспериментального измерения его количества в реакционной системе.
На качественном уровне реакции могут быть классифицированы на быстрые, для измерения скорости которых необходимы специальные методы, например, взрыв гремучего газа, реакции в растворах электролитов; медленные, для измерения скорости которых нужны большие промежутки времени, например коррозия железа; и реакции, за течением которых мы можем наблюдать непосредственно, например взаимодействие цинка с соляной кислотой.
Описываемая уравнением (1) скорость реакции зависит от количеств взятых веществ-реагентов. Если мы проводим одну и ту же реакцию с разными объемами или поверхностями соприкосновения реагентов, то для одной и той же реакции мы получим разные значения скорости, тем большие, чем больше вещества взято или чем лучше оно измельчено. Поэтому используют другое определение скорости реакции.
Скорость химической реакции - это изменение количества вещества какого-либо участка реакции в единицу времени в единице реакционного пространства (запишем это определение).
В гомогенной системе реакция происходит во всем объеме V системы (в газовой фазе или растворе). В такой реакции единицей реакционного пространства является единица объема, и если этот объем не изменяется в процессе реакции, то уравнение имеет вид:
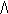
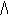 V=
c / t (2)
V=
c / t (2)
где с - молярная концентрация вещества (моль/л).
Скорость реакции - изменение концентрации вещества в единицу времени.
В гетерогенной системе (например, при горении твердого тела в газе или при взаимодействии металла с кислотой) реакция происходит на границе раздела между компонентами. Если площадь этой границы S, то уравнение скорости имеет вид:

 V=
n / S t (3)
V=
n / S t (3)
Очевидно, что при таком определении (см. уравнения (2) и (3)) величина скорости реакции не зависит от объема в гомогенной системе и от площади соприкосновения реагентов (степени измельчения) в гетерогенной системе.
Далее, если не будет оговариваться противное, все сказанное будет относиться к реакциям в гомогенных системах - растворах.
Какие же факторы влияют на скорость химической реакции?
ЗАПИШЕМ ОСНОВНЫЕ
-
Природа реагирующих веществ.
-
Концентрация реагирующих веществ.
-
Влияние температуры.
-
Площадь поверхности соприкосновения.
-
Наличие катализатора.
На каждый случай приведем пример.
1. Влияние природы реагентов
Первым, и достаточно очевидным, фактором, определяющим скорость реакции, является природа реагентов. Выше на этой основе мы привели примеры реакций, текущих с разной скоростью.
Теперь проведем опыт, который экспериментально докажет это.
Лабораторный опыт. Памятка по соблюдению правил техники безопасности.
Учитель предлагает ребятам выполнить лабораторный опыт.
Для этого в 3 пробирки наливаем 1-2 мл раствора соляной кислоты и опускаем в каждую примерно по одинаковому кусочку металла: в первую - магний, во вторую - цинк, а в третью - железо.
Учитель
Во всех ли пробирках скорость выделения газа одинакова?
Ученик
Нет, в пробирках интенсивность выделения пузырьков разная. В первой пробирке газ выделяется очень быстро, во второй медленней, а в третье еще медленнее.
Учитель
Сделаем вывод
Ученик
Скорость химической реакции зависит от природы реагирующих веществ.
2. Влияние концентраций реагентов
Второй, и тоже достаточно очевидный, фактор - концентрация реагентов.
Проведем опыт
Учитель проводит демонстрационный опыт.
В три пробирки наливаем раствор тиосульфата натрия. В первую - 5 мл, во вторую - 2,5 мл, в третью - 1 мл. Далее во вторую и третью пробирки добавим по 5 мл воды. Затем вовсе пробирки, начиная с третьей, добавляем по 3 мл раствора серной кислоты. По времени появления и интенсивности выделившейся коллоидной серы и судят о влиянии концентрации тиосульфата натрия на скорость реакции.
Ученик
Скорость химической реакции зависит от концентрации реагентов
Учитель
А почему так происходит? Чем выше концентрация вещества, тем больше частиц в единице объема, тем чаще они сталкиваются. Количество это выражается так называемым законом действующих масс - скорость реакции пропорциональна концентрациям реагентов в некоторых степенях. Например, для следующих ниже уравнений реакций выражения скорости такие:
A = X, r = kcA ;
A + B = X, r = kcAcB;
A + 2B = X, r = kcAcBcB = kcAcB2.
Величина k - коэффициент пропорциональности - называется константой скорости реакции и не зависит от концентраций. Численно этот коэффициент равен скорости реакций, если произведение концентраций реагентов равно 1. Когда сравнивают скорости разных реакций, то сравнивают именно их константы скоростей.
Важно отметить, что показатели степеней при концентрациях в приведенных ниже выражениях для скоростей химических реакций равны стехиометрическим коэффициентам только в редких случаях, когда реакция протекает в одну стадию (для так называемых элементарных реакций). На самом деле отдельная химическая реакция является такой же абстракцией, как и совершенно чистое химическое вещество. Другими словами, реальные химические превращения практически всегда включают в себя несколько реакций.
Скорость реакций, протекающих в несколько последовательных стадий, определяется самой медленной из этих стадий. Вспомним арабскую поговорку: «Караван идет со скоростью самого медленного верблюда».
Например, реакция
2Fe2+ + H2O2 = 2FeOH2+
протекает по следующим стадиям:
1) 2Fe2+ + H2O2 = 2FeOH2+ + OH.
k1 = 60 л/(моль . с);
2) OH. + Fe 2+ = FeOH2+, k2 = 60 000 л/(моль . с).
Более медленная стадия - первая. Поэтому уравнение скорости данной реакции -
r = k1c(Fe2+)c(H2O2),
а не r = kc2(Fe2+)c(H2O2).
О таких сложных процессах мы будем еще говорить более подробно в 11 классе.
3. Влияние температуры.
Учитель
Влияние температуры на протекание химической реакции двояко. Во- первых температура может влиять на состав продуктов, а во-вторых - подавляющее большинство реакций ускоряются при увеличении температуры. Почему? Потому что с повышением температуры быстро растет число, так называемых «активных» молекул, т.е. молекул, обладающих энергией, большей, чем энергия активации.
Энергия активации - разность между средней энергией молекул при данной температуре и той энергией, которой они должны обладать, чтобы вступить в химические реакции.
Влияние температуры на скорость химической реакции иллюстрирует правило Вант - Гоффа
ОПРЕДЕЛЕНИЕ
При изменении температуры реакции на каждые 10 градусов скорость реакции изменяется в 2-4 раза (Формула на доске)
Учитель
Если температуру увеличивать, что произойдет со скоростью химической реакции.
Ученик
Скорость реакции увеличится при повышении температуры на каждые 10 градусов в 2-4 раза.
Учитель
Если температуру уменьшить, что произойдет со скоростью химической реакции.
Ученик
Скорость уменьшится при понижении температуры на каждые 10 градусов в 2-4 раза.
4. Площадь поверхности соприкосновения.
Учитель
Теперь перейдем к площади поверхности соприкосновения.
Лабораторный опыт. Памятка по соблюдению правил техники безопасности.
В две пробирки нальем соляную кислоту, в первую добавим порошок цинка, а во вторую гранулу. Запишите уравнение реакции. Определите ее тип. Где реакция проходит быстрее? Почему?
Ученик записывает реакцию. Она является реакцией замещения.
Реакция проходит быстрее в первой пробирке. Ведь там больше площадь поверхности соприкосновения.
Учитель
Правильно.
5. Катализатор
Последний фактор - это наличие специальных веществ - катализаторов. Химическая реакция - сложный процесс, в котором могут принимать участие не только вещества реагенты, но и другие присутствующие в системе вещества. Если они заметно изменяют скорость химической реакции, то их и называют катализаторами. Об этих веществах и о катализе мы подробно погорим на следующем уроке.
-
ЗАКРЕПЛЕНИЕ МАТЕРИАЛА
Учитель
Какую новую величину мы изучили на сегодняшнем уроке?
Ученик
Мы ознакомились со скоростью химической реакции.
Учитель
Какие виды сред вы узнали?
Ученик
Гомогенную и гетерогенную.
Учитель
Одинаково ли определяется скорость в разных средах?
Ученик
Нет, по разному.
Учитель
Как определяется скорость в гомогенной среде?
Ученик
В гомогенной системе реакция происходит во всем объеме V системы (в газовой фазе или растворе). В такой реакции единицей реакционного пространства является единица объема, и если этот объем не изменяется в процессе реакции
Учитель
В каких единицах она измеряется?
Учитель
Как определяется скорость в гетерогенной среде?
В гетерогенной системе реакция происходит на границе раздела между компонентами. Если площадь этой границы S.
Учитель
В каких единицах она измеряется?
Какие факторы влияют на скорость химической реакции? Перечислите их.
Ученик
Природа реагирующих веществ.
Концентрация реагирующих веществ.
Температура.
Площадь поверхности соприкосновения.
Наличие катализатора.
IY. ОБОБЩЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА
Сегодня на уроке мы изучили понятие скорость химической реакции. Рассмотрели как определяется скорость химической реакции в гомогенной и гетерогенной системах. Определили факторы, которые могут повлиять на скорость химической реакции.
Y. ДОМАШНЕЕ ЗАДАНИЕ
Основные определения дома выучить. А так же на столах у вас есть задания, они трехуровневые. Как всегда, каждый для себя выбирает соответствующий уровень, который на данном этапе обучения вам под силу выполнить.