- Учителю
- Конспект урока по теме: Свойства оксидов (10 - 11 класс), 2 часа
Конспект урока по теме: Свойства оксидов (10 - 11 класс), 2 часа
Уроки в 10 ( 11кл) Общая химия
Уроки № 1 - 2 Оксиды - классификация, химические свойства, получение оксидов
Цели:
Познакомить учащихся с полной классификацией оксидов, их номенклатурой; повторить типы химической связи и основные их характеристики; проследить изменение характера оксида и типа связи в нем по периодической системе элементов. Актуализировать знания учащихся о свойствах оксидов, а также содержание понятия «амфотерность»; продолжить совершенствование навыков составления ионных уравнений реакций; углубить понятие «переходный металл».
Обобщить, дополнить знания учащихся о способах получения оксидов; продолжить формирование понятий о свойствах и взаимосвязи основных классов неорганических соединений.
1. Оксиды - бинарные соединения, содержащие атомы кислорода со степенью окисления (-2):
Переоксиды - особая группа:
+1 -1 +1 -1 +1
Н2О2 Н - О - О - Н
 +2
-1 +2 O -1
+2
-1 +2 O -1
 ВаО2
Ba
ВаО2
Ba
О-1
(-О-О-) пероксо-группа
Названия по IUPAC: латинский корень от названия более ЭО-элемента+ суфикс -ид; если данный элемент образует несколько оксидов - обязательно валентность в скобках.
Примеры:
N2O - оксид азота (I); исторические названия: закись озота (min валентность!); «веселящий газ» - название по свойствам.
NO - оксид азота (II); историческое название: окись азота.
N2O3 - оксид азота (III); историческое название: трехокись, триоксид - по составу; азотистый ангидрид - название по свойствам.
И далее: NO2, N2O5.
2. Классификация оксидов по свойствам

 ОКСИДЫ
ОКСИДЫ
солеобразующие несолеобразующие
имеют соответствующие нет соответствующих
гидроксиды - гидроксидов;
по степени окисления нет общих свойств;
и характеру свойств специфические свойства

 (3
группы) N2O, NO, CO, SiO
(3
группы) N2O, NO, CO, SiO
Основные Кислотные Амфотерные
им соответствуют им соответствуют им соответствуют
основания кислоты амфотерные гидроксиды
I-II групп V-VII групп II - III - IV групп
МеХОУ МеХОУ; НемХОУ МеХОУ
переходный металл переходный металл
+1 +1 +6 +6 +3 +3
Na2O3 - NaOH CrO3 - H2CrO4 Al2O3 - Al(OH)3
+2 +2 +4 +4 +3 +3
CuO - Cu(OH)2 SO2 - H2SO3 Cr2O3 - Cr(OH)3
+5 +5 +2 +2
N2O5 - HNO3 ZnO - Zn(OH)2
Можно доказать генетическую (родственную) связь оксидов и гидроксидов:
 Na2O
+ H2O 2NaOH
Na2O
+ H2O 2NaOH
 CaO + H2O Ca(OH) 2
CaO + H2O Ca(OH) 2
н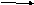
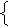 ерастворимые
Cu(OH)2 CuO + H2O
ерастворимые
Cu(OH)2 CuO + H2O
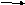 основания
CuO + H2O нет реакции
основания
CuO + H2O нет реакции
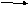 CrO3+H2O
H2CrO4
CrO3+H2O
H2CrO4
 N2O5 + H2O 2HNO3
N2O5 + H2O 2HNO3
 H2SiO3
H2O + SiO2
H2SiO3
H2O + SiO2
 Исключения
H2O + SiO2 нет реакции
Исключения
H2O + SiO2 нет реакции
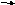
 Zn(OH)2
tо ZnO + H2O
Zn(OH)2
tо ZnO + H2O
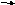
 2Al(OH)3 tо Al2O3 +
3H2O
2Al(OH)3 tо Al2O3 +
3H2O
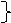
нет реакцииZnO + H2O
Al2O3 + H2O
I. Опрос
а) Как изменяются свойства элементов по периоду и подгруппе, в связи с чем? Почему все элементы вставных декад - переходные металлы? В чем суть термина «переходность»? Как это вытекает из строения их атомов?
б) Между атомами каких элементов образуется ионная и ковалентная полярная связь? Почему четкой границы между этими видами связи не существует? Примеры соединений. Что такое «полярность» ковалентной связи», «степень ионизации ковалентной связи»? Что показывают эти величины?
Проследим изменение характера свойств оксидов по Периодической системе и сопоставим это с типом химической связи в их молекулах. Помним: кислород - это второй по ЭО элемент после фтора.
1. По периоду (II-й период):
+1 +2 +3 +4 +5 +2 -1
Li2O BeO B2O3 CO2 N2O5 O2 OF2
несолеобраз..
 ЭО
(элемента) - увеличивается, ΔЭО - уменьшается
ЭО
(элемента) - увеличивается, ΔЭО - уменьшается
уменьшается степень полярности связи.
сильноосновной амфот. слабокисотн. среднекислот. сильнокислотн.
LiOH Be(OH)2 H3BO3 (HBO2) H2CO3 HNO3
2. По подгруппе (I подгруппа, главная подгруппа):
Li2O Na2O K2O Rb2O Cs2O
ЭО (элемента) - уменьшается,
 ΔЭО
- увеличивается усиливается степень ионности связи
ΔЭО
- увеличивается усиливается степень ионности связи
3. Вывод: чем больше химическая связь в оксиде приближается к ионной, тем более вероятно, что это по характеру свойств основной оксид.
Оксиды с резким различием в полярности связи (и характере свойств) взаимодействуют между собой.
L2O + N2O5 -- LiNO3
основной кислотный
ковалентная
ионная связь малополярная связь
N2O5 + CO2 ≠ нет реакции
кислотный кислотный Оксиды похожи и по
ковалентная ковалентная типу химической связи
малополярная связь средне полярная связь и по характеру свойств.
Металлы
характерные
(I, II группы, главные подгруппы)
Металлы
переходные
(III - IV группы, главные подгруппы + все Ме побочных подгрупп)
Неметаллы
Валентность I-II
+1, +2
Валентность V-VII
+1, +2

основные МеХОУ
кислотные ЭХОУ
соотв. основания
соотв. кислоты
ионная связь
ковалентная полярная связь
ионная кристаллическая
 решетка
решетка
молекулярная кристаллическая решетка
( исключение
SiO2 -атомная
исключение
SiO2 -атомная
твердые нелетучие
тугоплавкие
летучие легкоплавкие
CO2,SO2 - газы
N2O3, SO3 - жидкости
P2O5, N2O5 - твердые ве-ва
(кроме SiO2 - твердое тугоплавкое нелетучее вещество
Химические свойства/ все оксиды - не электролиты
1. Взаимодействие с Н2О
Только оксиды Ме I, II групп главных подгрупп (им соответствуют
щелочи)
N a2O
+ H2O 2NaOH
a2O
+ H2O 2NaOH
_
 Na2O
+ H2O 2Na+ + 2OH
Na2O
+ H2O 2Na+ + 2OH
а) образование нестойких кислот:
с оксидами CO2; SO2
C
 O2
+ H2O H2CO3 (нет такой молекулы)
O2
+ H2O H2CO3 (нет такой молекулы)
реально
_ 2-
C

 O2
+ H2O H+ + HCO3 2H+ +
CO3
O2
+ H2O H+ + HCO3 2H+ +
CO3

Равновесная система - конденсация компонентов зависит от условий.
+6 +6
б )
SO3 + H2O H2SO4
)
SO3 + H2O H2SO4
+ 2-
 SO3
+ H2O 2H + SO4
SO3
+ H2O 2H + SO4
в) SiO2 + H2O ≠ исключение
г) двойные оксиды
+4 +5 +3
 NO2
+ H2O HNO3 + HNO2
NO2
+ H2O HNO3 + HNO2
Вряд ли можно говорить о соответствии этого оксида кислотам
+5 +5
А
 нгидриды
- N2O5 HNO3
нгидриды
- N2O5 HNO3
и м
соответствуют +3 +3
м
соответствуют +3 +3
к ислоты
N2O3 HNO2
ислоты
N2O3 HNO2
2. Взаимодействие с кислотами (НR)
М
 еО
+ HR МеR + H2O соль + H2O
еО
+ HR МеR + H2O соль + H2O
(избыток соли - кислая соль)
CuO + 2H+ + SO2-4 = Cu2+ + SO42- + H2O
1 моль : 1 моль
 CuO
+ 2H2SO4 Cu(HSO4)2 +
H2O
CuO
+ 2H2SO4 Cu(HSO4)2 +
H2O
1 : 2
Нет реакций
3. Взаимодействие с основаниямиЭ О
+ МеОН МеR + H2O
О
+ МеОН МеR + H2O
раствор
(избыток кислотного оксида - кислая соль)
 CO2
+ 2NaOH Na2CO3 + H2O
CO2
+ 2NaOH Na2CO3 + H2O
_ 2-
 CO2
+ 2OH CO2 + H2O
CO2
+ 2OH CO2 + H2O
1моль : 2моль
 CO2
+NaOH NaHCO3
CO2
+NaOH NaHCO3
1моль:1моль
4. Взаимодействие между оксидами
М
сольеО + кислотный оксид
МеО + амфотерный оксид
Э
сольО + основной оксид
ЭО + амфотерный оксид
 СaO
+ CO2 CaCO3
СaO
+ CO2 CaCO3
Амфотерные оксиды в зависимости от условий проявляют основные или кислотные свойства, то есть имеют двойственный характер.
Амфотерные оксиды
BeO, ZnO,Al2O3,
Cr2O3
 Соль+H2O
оксид, гидроксид оксид, гидрокс оксид, гидроксид соль
+H2O
Соль+H2O
оксид, гидроксид оксид, гидрокс оксид, гидроксид соль
+H2O
Вода обладает двойственными свойствами: _
Н
 2О
Н+ + ОН
2О
Н+ + ОН
(и кислотными: Н+, и основными: ОН-), поэтому с амфотерными оксидами не взаимодействует.
С основными и кислотными оксидами и гидроксидами взаимодействие будет тем лучше, чем более ярко выражен их характер. Это относится к соединениям металлов I и II групп главных подгрупп Периодической системы и характерных неметаллов.
1 .
ZnO + 2HCl ZnCl2 + H2O
.
ZnO + 2HCl ZnCl2 + H2O
 ZnO
+ 2H+ Zn2+ + H2O
ZnO
+ 2H+ Zn2+ + H2O
основные свойства
2 .
ZnO + 2NaOH + H2O Na2[Zn(OH)4]
.
ZnO + 2NaOH + H2O Na2[Zn(OH)4]
комплексная соль
тетрагидроксоцинкат натрия
 ZnO
+ 2Na+ + 2OH- + H2O
2Na+ + [Zn(OH)4]2-
ZnO
+ 2Na+ + 2OH- + H2O
2Na+ + [Zn(OH)4]2-
кислотные
свойства
В реакциях получены две различные соли:
 ZnCl2
Zn2+ + 2Cl-
ZnCl2
Zn2+ + 2Cl-
Катион
и Na2[Zn(OH)4] 2Na+ +
[Zn(OH)4]2-
Na2[Zn(OH)4] 2Na+ +
[Zn(OH)4]2-
Zn входит в состав аниона
Запомним! Амфотерным оксидам (и гидроксидам) соответствуют два вида солей, где переходный металл, образующий эти амфотерные соединения, находятся в катионной и анионной формах. Это еще одно доказательство переходности его свойств:
Простое Оксиды Соли
вещество: и гидроксиды
п
 ереходный
Ме различного различных типов -
ереходный
Ме различного различных типов -
свойства металла характера, катионные
и неметалла свойств и анионные
Получение оксидов
1
1
1
 .
Ме Нем
.
Ме Нем
+О2
+О2
3
4
MeXOУ
НeмXOУ
 МеХЭУ
НемХЭУ
МеХЭУ
НемХЭУ
2
4
3
2





 Ме(ОН)n соль HnЭOm
Ме(ОН)n соль HnЭOm
2. Уточняем особенности взаимодействия:А. MeXOУ
В. НeмXOУ
1) Au, Ag, Pt + O2 ≠
Al, Zn, Cr, Ni - оксидная пленка
(реакция с поверхностью)
 2Zn
+ O2 2ZnO
2Zn
+ O2 2ZnO
 щелочные
металлы Ме + О2
щелочные
металлы Ме + О2
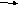 пероксиды
(кроме Li)
пероксиды
(кроме Li)
оксиды - в недостатке О2
2) Только для нерастворимых оснований:
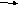
 Cu(OH)2
to CuO + H2O
Cu(OH)2
to CuO + H2O
1) галогены - не окисляются,
т.к. ΔЭО (Hal - О) - мала
2. Нестойкие кислоты:
H2CO3, H2SO3, H2SiO3(to), HClO, HIO3
200o+5 +5
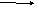 2H
I O3 I2O5 + H2O
2H
I O3 I2O5 + H2O
получаются соответствующие ангидриды
(электронно-статические реакции)
Особый случай:
+5 +4
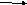 4HNO3
4NO2 + O2 + 2H2O (OBP!)
4HNO3
4NO2 + O2 + 2H2O (OBP!)
3) Разложение солей нестойких кислот:CaCO3 --- CaO +CO2
Особый случай - нитраты:
to

 до
Mg Me(NO2)n + O2
до
Mg Me(NO2)n + O2
 Me(NO3)n
(Mg - Cu) MeXOУ + NO2 +
O2 OBP!
Me(NO3)n
(Mg - Cu) MeXOУ + NO2 +
O2 OBP!
 Me + NO2 + O2
Me + NO2 + O2
N H4NO3
N2O + 2H2O
H4NO3
N2O + 2H2O
4) Обжиг сульфитов:
 2CuS
+ 3O2 2CuO + 2SO2
2CuS
+ 3O2 2CuO + 2SO2
4) Окисление большинства летучих
водородных соединений (кроме HHal)
 SiH4
+ 2O2 SiO2 + 2H2O
SiH4
+ 2O2 SiO2 + 2H2O
Домашнее задание ( 1урок)
1. Как осуществить превращения:
 Pb
S
Pb
S
-
 PbS
PbO PbCO3 б) BaSO3 SO2
H2S
PbS
PbO PbCO3 б) BaSO3 SO2
H2S
Pb(OH)2 H2SO3
2. Всеми возможными способами получить оксиды MgO, FeO, CO2
3. Какие из приведенных оксидов будут взаимодействовать: а) с раствором гидроксида калия; б) с раствором хлороводородной кислоты?
а) SO2, SiO2, ZnO, MgO б) SO3, CaO, CuO, Cr2O3
Домашнее задание (2 урок)
1. Только из оксидов получить соли KMnO4, KClO3, Ba(NO2)2, Ca(ClO)2, NaClO4. Дать название оксидам.
2. Составить уравнения реакций в молекулярной и ионной форме:
 Al(OH)3
Al2O3
Al2(SO4)3
Al(OH)3
Al2O3
Al2(SO4)3
Na[Al(OH)4]
3. Какое количество веществ (моль) соли образуют при полном взаимодействии оксида алюминия с 400 г 15%-ного раствора азотной кислоты?
4. Составить формулы оксидов переходных металлов: Cr (+2, +3, +6), Mn(+2, +3, +6, +7). Сделать выводы о характере их свойств, привести формулы соответствующих им гидроксидов.
3
 .
Осуществить цепочку превращений Li Li2O LiOH
Li2CO3 и вычислить массу исходного лития,
зная, что в итоге получено 3,7 г карбоната лития.
.
Осуществить цепочку превращений Li Li2O LiOH
Li2CO3 и вычислить массу исходного лития,
зная, что в итоге получено 3,7 г карбоната лития.
Даны оксиды: MgO, Cl2O7, Na2O, SO3, Al2O3. Используя только эти вещества, получить все возможные соли, напишите уравнения этих реакций.
</