- Учителю
- Изучение белков и их свойств.
Изучение белков и их свойств.
Государственное бюджетное профессиональное образовательное учреждение
Департамента здравоохранения города Москвы
«Медицинский колледж №1» Филиал №3
Методическое пособие
Тема: Изучение белков и их свойств.
Дисциплина: Химия
Курс: 1
Семестр: 2
Составила: Поливанова Т.В., преподаватель химии, первой квалификационной категории
Москва
2016
Одобрена Согласовано
Заведующая учебным отделом
предметно-цикловой
комиссией: математических ___________/ Пажильцева В.Д.
и общих естественно-научных
дисциплин
Протокол №___8___
от «_8_»апреля_2016 г.Председатель ПЦК №2
_________________Увакина А.Ю.
Составитель (автор): Поливанова Т.В., преподаватель химии первой квалификационной категории
Предназначение: Для проведения теоретического и практического занятий по дисциплине «Химия»
Содержание:
-
Мотивация темы ………………… …..стр.4
-
Цели и задачи..………………………. .стр. 4
-
Информационный блок ……………... стр.5
-
Контролирующий блок ……………….стр. 26
"Жизнь - это форма существования белка"
1.Мотивация темы
Белки, или протеины (в переводе с греческого означает «первые» или «важнейшие»), присутствуют во всех клетках. На их долю у животных приходится около половины сухой массы, у растений - 20-35 %. В белках массовая доля углерода в среднем составляет ~ 50 %, водорода ~ 7 %, кислорода ~ 23 %, азота ~ 16 %, серы ~ 1-3 %. В их составе также встречаются и другие химические элементы.
Белки - наиболее многочисленные и исключительно многообразные по функциям макромолекулы, играющие фундаментальную роль в формировании и поддержании структуры и функций живых организмов. С белками в живом организме связаны такие биологические процессы, как рост, деление, размножение и развитие клеток, реализация наследственной информации, мышечные сокращения, нервная деятельность, обмен веществ и т.д.
2.Цели и задачи
Цель: приобретение системных знаний о белках, их строении и свойствах. Обозначить роль белков в организме человека.
Задачи:
Обучающие:
1. Изучить белки (состав, строение, свойства, функции и значение).
2. Формировать навыки выполнения лабораторных опытов.
Воспитывающие:
1. Воспитание сознательного отношение к учебному труду.
2. Развитие интереса к знаниям.
3. Формирование адекватной самооценки.
4. Развитие умений участвовать в общем диалоге.
5. Формирование собственной компетентности.
Развивающие:
1. Формировать умение анализировать, сравнивать и делать выводы.
2. Формировать умение и навыки устной речи.
3. Развивать навыки работы в группе.
-
Информационный блок
Белки - это высокомолекулярные биополимеры, структурную основу которых составляют полипептидные цепи, состоящие из аминокислотных остатков, связанных друг с другом пептидной связью.
При их гидролизе образуются аминокислоты. В составе белков встречаются двадцать стандартных аминокислот. Для каждой стандартной аминокислоты существует генетический код, при помощи которого в генах записана информация о кодируемом белке. Кроме двадцати стандартных аминокислот, в составе белка встречаются и другие аминокислоты, они образуются в результате модификации стандартных аминокислот, после того как последние были включены в состав молекулы белка.
Кроме аминокислотных остатков, в состав белков могут входить и другие компоненты: ионы металлов, углеводы, липиды, нуклеиновые кислоты и др. Многообразие белков определяется не только их качественным составом, но и числом аминокислотных остатков, и прежде всего порядком их чередования в молекуле. Потенциально разнообразие белков безгранично.
3.1 История открытия и исследования белков
Впервые белки стали выделять из массы других веществ в XVIII веке, и с тех пор ведётся их беспрерывное изучение и совершенствование знаний о них. К началу XIX столетия появляются первые работы по химическому изучению белков. Уже в 1803г. Джордж Дальтон даёт первые формулы белков- альбумина и желатина, как веществ, содержащих азот.
В 1810 г. Ж. Гей-Люссак проводит химические анализы белков - фибрина крови, казеина и отмечает сходство их элементного состава. Решающее значение для понимания химической природы белков имело выделение при их гидролизе аминокислот. Первым это сделал А. Браконно в 1820 г., когда, действуя на белки серной кислотой, при кипячении он получил «клеевой сахар», или глицин, при гидролизе фибрина из мяса - лейцин и при разложении шерсти - также лейцин и смесь других продуктов гидролиза. Первой открытой аминокислотой был, видимо, аспарагин, выделенный Л. Вокленом из сока спаржи Asparagus (1806). В это же время Ж. Пруст получил лейцин при разложении сыра и творога. Затем из продуктов гидролиза белка были выделены многие другие аминокислоты.
В 1903 году немецкий ученый Э.Г.Фишер предложил пептидную теорию, которая стала ключом к тайне строения белка. Он предположил, что белки представляют собой полимеры, состоящие из остатков аминокислот, соединенных между собой пептидной связью H-N-C =O и экспериментально это подтвердил. Ему удалось синтезировать полипептид, состоящий их 19 остатков аминокислот. Идея о том, что белки - это полимерные образования, высказывалась еще в 1888 году русским ученым А.Я.Данилевским.
Из-за сложности в выделении чистых белков и слабого развития медицинских наук Нового времени, ключевая роль белков в теле человека не была до конца доказана вплоть до 1926 года, когда американский химик Джеймс Самнер показал, что фермент уреаза является белком, после чего начинается их активное изучение. В XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные очищенные белки, но и одновременное изменение количества и посттрансляционных модификаций большого числа белков отдельных клеток, тканей или целых организмов. Эта область биохимии называется протеомикой. С помощью методов биоинформатики стало возможно не только обработать данные рентгеноструктурного анализа, но и предсказать структуру белка, основываясь на его аминокислотной последовательности.
В настоящее время криоэлектронная микроскопия крупных белковых комплексов и предсказание пространственных структур белковых доменов с помощью компьютерных программ приближаются к атомарной точности.
3.2 Классификация белков
Белки классифицируют:
По составу: простые (состоят только из аминокислот) и сложные (содержат белковую и небелковую части).
По растворимости: растворимые и нерастворимые.
По агрегатному состоянию: жидкие и твердые.
Простые белки (протеины)
Альбумины - глобулярные белки. Растворимы в чистой воде и солевых
растворах. Осаждаются при насыщении раствора сернокислым аммонием.
Типичные представители: яичный альбумин, альбумин сыворотки крови.

Глобулины - глобулярные белки, но более высокого молекулярного веса. Растворимы в разведенных растворах солей, не растворимы в чистой воде. Осаждаются в полунасыщенном растворе сернокислого аммония. К этой группе относятся глобулины сыворотки крови, молока, эдестин конопли и ряд других животных и растительных белков.
Проламины (глиадины) - белки семян злаков. Растворимы в 70-80% спирте и не растворимы в воде. Относительно богаты пролином и глютаминовой кислотой. Типичные представители: глиадин пшеницы, гордеин ячменя, зеин кукурузы.
Глютелины - белки злаков. Растворимы в разведенных кислотах или щелочах, но не в нейтральных растворах.
Склеропротеины (альбуминоиды, протеиноиды) - нерастворимые в воде, солевых растворах, разведенных кислотах и щелочах Б., главным образом животного происхождения, несущие структурные (чаще опорные) функции.
Склеропротеины - обычно фибриллярные белки, весьма устойчивые к действию пищеварительных ферментов. К ним относятся фибриллярные белки соединительной ткани, коллагены, содержащиеся в костях, коже, сухожилиях. Для коллагенов характерно образование при нагревании с водой желатины, которая застывает в гель при охлаждении, плавится при нагревании. Коллагены содержат много пролина и особенно оксипролина. Другую группу соединительнотканных белков представляют эластины. К склеропротеинам относятся также кератины волос, шерсти, богатые цистином, и фиброины шелка, паутины и т. п.
Протамины - белки основного характера, содержащиеся в сперме некоторых рыб и других животных в виде комплексов с ДНК. Имеют сравнительно небольшой мол. вес, содержат очень много аргинина и немного некоторых моноаминомонокарбоновых кислот. Иногда в их состав входят лизин и гистидин. Наиболее изучены клупеин (протамин из спермы сельди), сальмин (из спермы лосося).
Гистоны - белки менее выраженного основного характера, богатые диаминомонокарбоновыми кислотами. Входят в состав нуклеопротеидов клеточных ядер.
Сложные белки (протеиды)
Нуклеопротеиды - комплексы Б. с нуклеиновыми кислотами. Имеют
очень высокий молекулярный вес. Играют важнейшую роль в биосинтезе
Б. в организме, в передаче наследственных признаков и т. п.
Мукопротеиды - белки, содержащие мукополисахариды - углеводные группировки кислого характера (муцины, мукоиды). Содержатся главным образом в слизях, слюне, синовиальной жидкости и т. п.
Фосфопротеиды содержат фосфорную кислоту, обычно в виде сложного эфира с оксигруппой серина. Главные представители: казеин молока, вителлин яичного желтка.
Металлопротеиды - комплексы белков с металлами или органическими группировками, содержащими атомы металлов. К ним относятся многие хромопротеиды (белки, содержащие окрашенные группировки), например гемоглобин (см.) и другие пигменты крови, многие ферменты, например оксидазы, содержащие железо или медь, и др.
Липопротеиды - комплексы белков с различными липидами. В крови играют большую роль в переносе липидов. Входят в состав клеточных оболочек и внутренних мембран клеточных структур.
3.3 Строение белков
Белки имеют сложную структуру. Развитие новых экспериментальных методов исследования в органической химии обусловило успехи в изучении структуры белка.
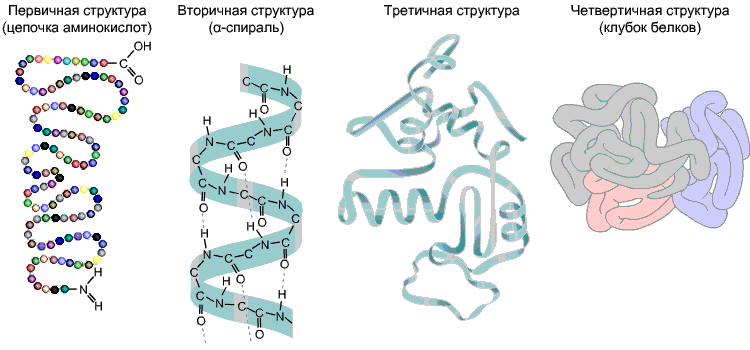
В настоящее время различают первичную, вторичную, третичную и четвертичную структуры белковой молекулы
1.Последовательность чередования различных аминокислотных звеньев в полипептидной цепи молекул - это первичная структура белка.
2.Вторичная структура - возникает за счет скручивания первичной структуры в спираль или в гармошку за счет водородных связей между соседними витками или звеньями.
3.Третичная структура - реальная трёхмерная конфигурация, которую принимает в пространстве закрученная в спираль полипептидная цепь. Поддерживается взаимодействием между функциональными группами радикалов полипептидной цепи:
· дисульфидный мостик (-S-S-) между атомами серы,
· сложноэфирный мостик - между карбоксильной группой (-СО-) и гидроксильной (-ОН),
· солевой мостик - между карбоксильной (-СО-) и аминогруппами (NH2).
Обуславливает специфическую биологическую активность белковой молекулы.
4.Четвертичная структура - представляет собой объединение нескольких глобул с третичной структурой в единый конгломерат.
3.4 Свойства белков
Несмотря на внешнее несходство, различные представители белков обладают некоторыми общими свойствами.
Так, поскольку все белки являются коллоидными частицами (размер молекул лежит в пределах 1 мкм до 1 нм), в воде они образуют коллоидные растворы. Эти растворы характеризуются высокой вязкостью, способностью рассеивать лучи видимого света, не проходят сквозь полупроницаемые мембраны.
Вязкость раствора зависит от молекулярной массы и концентрации растворенного вещества. Чем выше молекулярная масса, тем раствор более вязкий. Белки как высокомолекулярные соединения образуют вязкие растворы. Например, раствор яичного белка в воде.
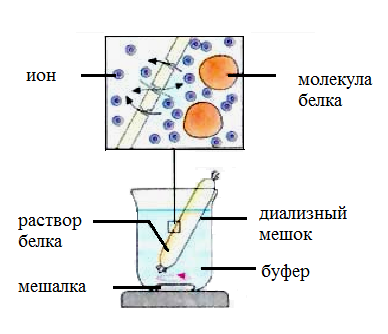
Коллоидные частицы не проходят через полупроницаемые мембраны (целлофан, коллоидную пленку), так как их поры меньше коллоидных частиц. Непроницаемыми для белка являются все биологические мембраны. Это свойство белковых растворов широко используется в медицине и химии для очистки белковых препаратов от посторонних примесей. Такой процесс разделения называется диализом. Явление диализа лежит в основе действия аппарата "искусственная почка", который широко используется в медицине для лечения острой почечной недостаточности.
Белки способны к набуханию, характеризуются оптической активностью и подвижностью в электрическом поле, некоторые растворимы в воде. Белки имеют изоэлектрическую точку.
Важнейшим свойством белков является их способность проявлять как кислые, так и основные свойства, то есть выступать в роли амфотерных электролитов. Это обеспечивается за счет различных диссоциирующих группировок, входящих в состав радикалов аминокислот. Например, кислотные свойства белку придают карбоксильные группы аспарагиновой и глутаминовой аминокислот, а щелочные -- радикалы аргинина, лизина и гистидина. Чем больше дикарбоновых аминокислот содержится в белке, тем сильнее проявляются его кислотные свойства и наоборот.
Эти же группировки имеют и электрические заряды, формирующие общий заряд белковой молекулы. В белках, где преобладают аспарагиновая и глутаминовая аминокислоты, заряд белка будет отрицательным, избыток основных аминокислот придает положительный заряд белковой молекуле. Вследствие этого в электрическом поле белки будут передвигаться к катоду или аноду в зависимости от величины их общего заряда. Так, в щелочной среде (рН 7-14) белок отдает протон и заряжается отрицательно (движение к аноду), тогда как в кислой среде (рН 1-7)
Свойство амфотерности лежит в основе буферных свойств белков и их участии в регуляции рН крови. Величина рН крови человека отличается постоянством и находится в пределах 7,36-7,4 , несмотря на различные вещества кислого или основного характера, регулярно поступающие с пищей или образующиеся в обменных процессах, следовательно, существуют специальные механизмы регуляции кислотно-щелочного равновесия внутренней среды организма.
Белки активно вступают в химические реакции. Это свойство связано с тем, что аминокислоты, входящие в состав белков, содержат разные функциональные группы, способные реагировать с другими веществами. Важно, что такие взаимодействия происходят и внутри белковой молекулы, в результате чего образуется пептидная, водородная, дисульфидная и другие виды связей. К радикалам аминокислот, а, следовательно, и белков, могут присоединяться различные соединения и ионы.
Осаждение белков. У белков есть гидратная оболочка, заряд, препятствующий склеиванию. Для осаждения необходимо снять гидратную оболочку и заряд.
Реакции осаждения делят на два вида.
1.Высаливание.
Растворимость белков сильно зависит от
концентрации солей (от ионной силы). В дистиллированной воде белки
чаще всего растворяются плохо, однако их растворимость возрастает
по мере увеличения ионной силы. При этом все большее количество
гидратированных неорганических ионов (светло-синие кружочки)
связывается с поверхностью белка и тем самым уменьшается степень
его агрегации (засаливание). При высокой ионной силе молекулы
белков лишаются гидратирующих оболочек, что приводит к агрегации и
выпадению белка в осадок (высаливание). Используя различие в
растворимости, можно с помощью обычных солей, например
(NН4)2SО4, разделить
(фракционировать) смесь белков. 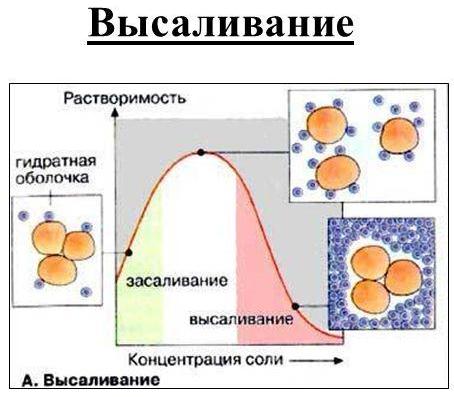
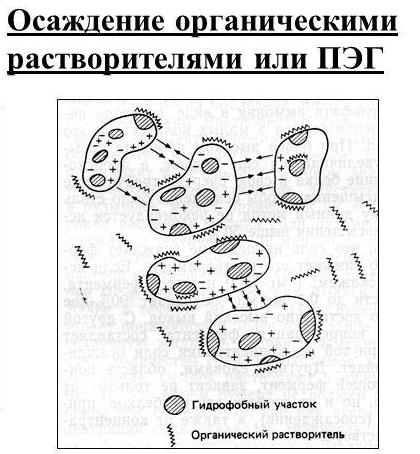
2.Осаждение.
Осаждения с потерей нативных свойств белка - процесс необратимый. С белка снимается гидратная оболочка и заряд, нарушаются различные свойства в белке. Например соли меди, ртути, мышьяка, железа, концентрированные неорганические кислоты - HNO3, H2SO4, HCl, органические кислоты, алкалоиды - танины, йодистая ртуть.
3.Гидролиз-это основа процесса пищеварения. В желудке под действием ферментов и соляной кислоты белковые молекулы распадаются на аминокислоты.
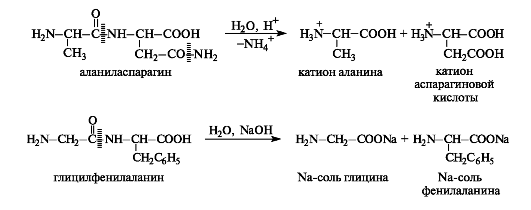
4.Денатурация - процесс свёртывания белка под воздействием нагревания или кислот, щелочей, солей тяжёлых металлов.
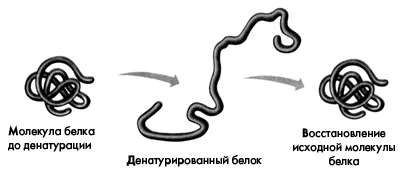
Белок может ренатурировать. Для этого необходимо очень короткое воздействие агентов.
5.Существуют химические реакции, служащие для распознавания белков - это цветные реакции.
-
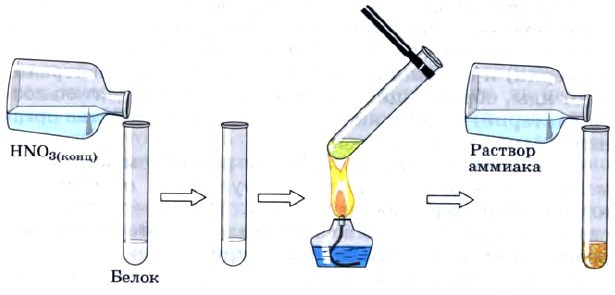
Ксантопротеиновая реакция.
В пробирку поместили 2 мл раствора белка и несколько капель концентрированной НNO3. Нагреть. Появляется желтый осадок, значит, присутствует белок.
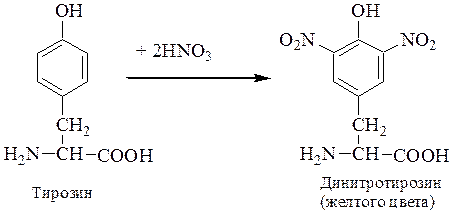
-
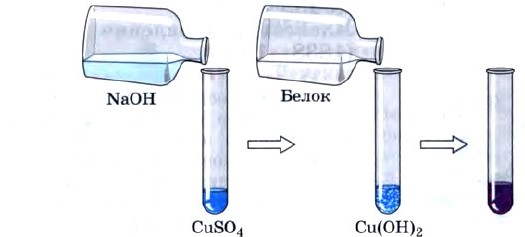
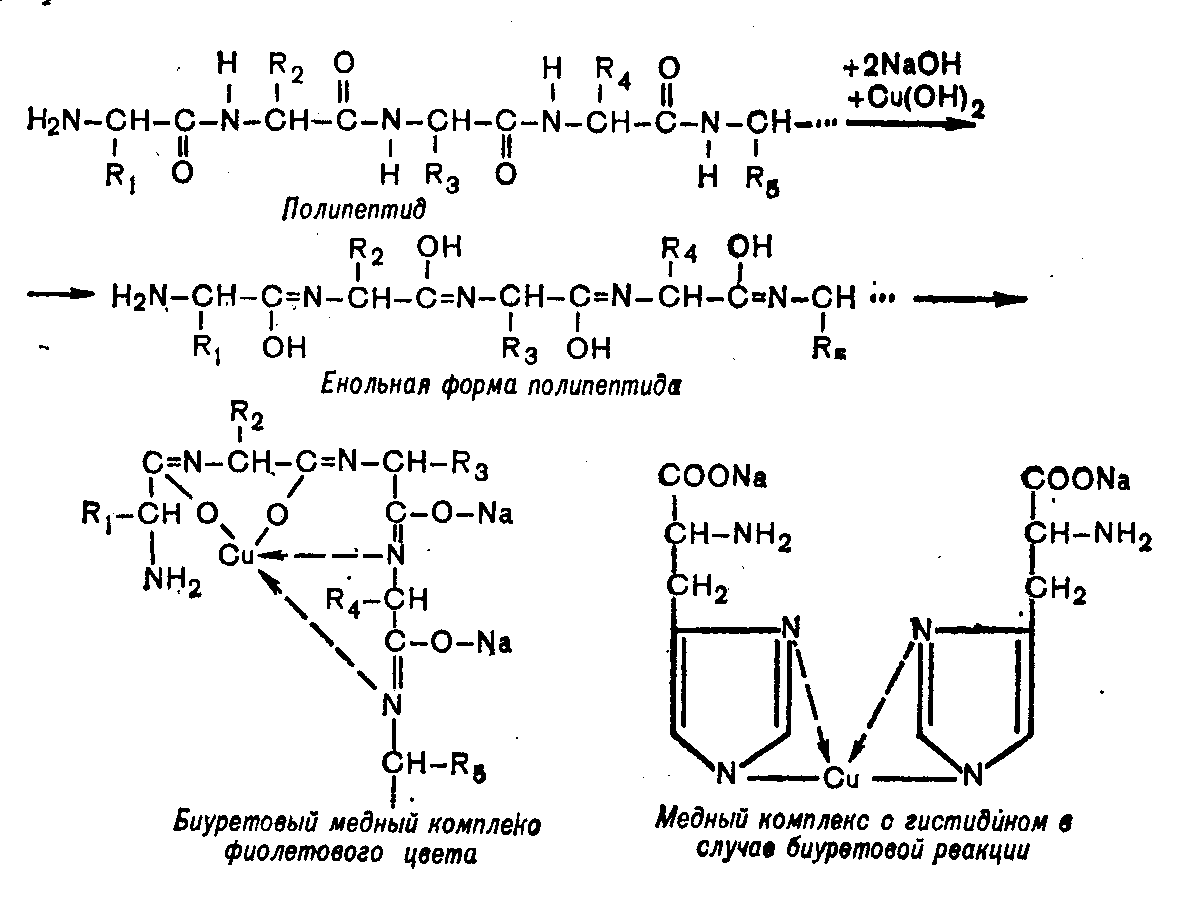
Биуретовая реакция.
В пробирку налить 2 мл раствора белка и 2 мл раствора гидроксида натрия, затем 1 мл раствора медного купороса. Появляется фиолетовое окрашивание.
6. Диализ
Для отделения низкомолекулярных примесей или замены состава среды используют диализ. Метод основан на том, что молекулы белка из-за своих размеров не могут проходить через полупроницаемые мембраны, в то время как низкомолекулярные вещества равномерно распределяются между объемом, ограниченныммембраной, и окружающим раствором. После многократной замены внешнего раствора состав среды в диализном мешочке (концентрация солей, величина pH и др.) будет тот же, что и в окружающем растворе</<font size="4">.
3.4 Функции белков
Строительная
Как строительный материал белки входят в состав всех клеточных мембран, геолаплазмы, органоидов, ядерного сока, хромосом и ядрышек.
Ферментативная
Каталитическую функцию выполняют белки-ферменты, в десятки и сотни тысяч раз ускоряющие течение биохимических реакций в клетках при нормальном давлении температуре около 37°С. Каждый фермент может катализировать только одну реакцию, т.е. действие ферментов строго специфично.
Специфичность ферментов обусловлена наличием одного или нескольких активных центров, в которых происходит тесный контакт между молекулами фермента и специфического вещества (субстрата). Некоторые ферменты применяются в медицинской практике и пищевой промышленности.
Международный биохимический съезд (Москва, 1961 г.) учредил классификацию ферментов, в основу которой положен тип реакции, катализируемой данным ферментом. В названии фермента обязательно присутствует название субстрата, на который воздействует данный фермент, и окончание -аза. Например, целлюлаза катализирует гидролиз целлюлозы до моносахаридов, а протеаза гидролизует белки до аминокислот. По этому принципу все ферменты были разделены на 6 классов .
Большая часть ферментов связана с определенными клеточными структурами (ядро, митохондрии, пластиды, лизосомы и др.), где и осуществляется их функция.
Двигательная
Двигательная функция белков состоит в том, что все виды двигательных реакций клеток и организмов обеспечиваются специальными сократительными белками - актином и миозином. Они содержатся во всех мышцах, ресничках и жгутиках. Их нити сокращаются с использованием энергии АТФ.
Транспортная
Транспортная функция белков заключается в переносе веществ, например, кислорода (гемоглобин), и некоторых биологически активных веществ (гормонов). В мышцах транспортную функцию берет на себя белок миоглобин.
В этом случае четко проявляется кооперативное взаимодействие всех функциональных групп биополимера. Молекула гемоглобина состоит из двух пар полипептидных цепочек, каждая из которых связана с гемом (железосодержащее соединение - красящее вещество гемоглобина). Каждый гем способен присоединять одну молекулу кислорода, а весь гемоглобин - до четырех молекул. Присоединение каждой из них облегчает присоединение следующей, а потеря одной из них - потерю следующей. Благодаря этому, гемоглобин крови легко насыщается кислородом, когда кровь течет по легочным капиллярам, и легко отдает его в тканях, где концентрация кислорода снижается.
Белки сыворотки крови способствуют переносу липидов и жирных кислот, различных биологически активных веществ. Молекулы белков, входящие в состав плазматической мембраны, принимают участие в транспорте веществ в клетку.
Энергетическая
Энергетическая функция белков заключается в их способности быть источником энергии в клетке (как правило, при отсутствии других). При полном ферментативном расщеплении 1 грамма белка выделяется 17, 6 кДж энергии.
Защитная
Защитная функция белков связана с выработкой лейкоцитами особых белковых веществ - иммуноглобулинов (антител) в ответ на проникновение в организм чужеродных белков или микроорганизмов. Антитела связывают, нейтрализуют и разрушают несвойственные организму соединения. Примером защитной функции белков может служить превращение фибриногена в фибрин при свертывании крови.
Внешнюю защитную функцию выполняют также некоторые токсичные для других организмов белки (например, содержащиеся в яде змей).
Сигнальная
Сигнальная (рецепторная) функция осуществляется белками благодаря способности их молекул изменять свою структуру под влиянием многих химических и физических факторов, вследствие чего клетка или организм воспринимают эти изменения.
Регуляторная
Гормоны поддерживают постоянные концентрации веществ в крови и клетках, участвуют в росте, размножении и других жизненно важных процессах. Одним из наиболее известных белков-гормонов является инсулин, который снижает содержание сахара к крови. При стойком недостатке инсулина концентрация сахара увеличивается и развивается сахарный диабет.
3.5 Роль белков пищи и их переваривание в организме человека
Для удовлетворения потребностей организма существенным является не только количество, но и качество белков в пище. Различные белки отличаются друг от друга процентным содержанием аминокислот. В зависимости от аминокислотного состава, организму требуется одного белка больше, а другого меньше. В этом смысле можно говорить о различной биологической ценности белков. Биологическая ценность белка определяется также степенью усвоения его организмом. Белки, находящиеся в продуктах питания, потребляемых человеком, содержат в тех или иных количествах все аминокислоты.
Белки пищи прежде, чем быть использованы для построения тканей тела, предварительно расщепляются. Организмом используется для питания не сам пищевой белок, а его структурные элементы - аминокислоты и, может быть, частично простейшие пептиды, из которых затем в клетках синтезируются специфические для данного вида организма белковые вещества. Каждый вид организма, каждый орган и каждая ткань содержат свои характерные белки, и при усвоении чужеродных белков пищи организм, прежде всего, лишает их видовой специфичности. Перед тем, как быть усвоенными, белки должны быть разложены на индифферентный материал. Разложение белковых веществ на более простые, лишенные видовой специфичности соединения, способные всасываться в кровь через стенки кишечника, осуществляется в пищеварительных органах человека и животных путем последовательного действия ряда ферментов.
В полости рта белки никаким изменениям не подвергаются, так как в состав слюны необходимые для этого протеолитические ферменты не входят. Переваривание белков начинается в желудке. В этом процессе решающую роль играют два фактора: сильнокислая реакция желудочного сока и присутствие в нем протеолитического фермента, действующего на белки.
При переваривании белков в желудке роль протеолитического фермента играет пепсин, содержащийся в желудочном соке. Клетки слизистой желудка выделяют неактивный пепсиноген, который под влиянием соляной кислоты желудочного сока превращается в активный пепсин.
Одни белки поддаются действию пепсина весьма легко, другие - труднее, а третьи совсем не перевариваются. Легко расщепляются пепсином альбумины и глобулины как животного, так и растительного происхождения.
Особый интерес представляют те изменения, которые претерпевают в желудке важнейшие белки молока, в частности казеиноген. Казеиноген молока относится к группе сложных белков - фосфопротеидов, в состав которых входит довольно значительное количество ортофосфорной кислоты. Под влиянием желудочного сока казеиноген молока превращается в казеин.
Установлено, что наиболее важную роль в стимуляции секреции желудочного сока высокой кислотности играет гастрин - полипептид, который называют «пищеварительным гормоном». Образование гастрина и поступление его в кровь резко усиливается под влиянием пищи, вводимой в желудок.
Превращения белков в организме
Содержание белка в продуктах питания:
3.6 Применение белков в медицине
Зная о роли белков в организме трудно было бы представить, что они не используются в современной медицине. И действительно, лечение человека с использованием белков как животного, так и искусственного происхождения в XXI века очень распространено, в самых разных направлениях.
Белковые иммунные сыворотки крови
Один из самых ранних методов лечения с использованием белков. Их вводят больному в лечебных целях или в качестве временной защиты (для создания пассивного иммунитета) от различных заболеваний.
Гормональная терапия
Очень распространённый вид лечения, основанный на введении больному готовых гормонов, которые или вырабатываются в недостаточных количествах, или же не вырабатываются совсем.
Видов гормональной терапии так же несколько:
А) Заместительная терапия. Применяется как раз в тех случаях, когда железы не способны сами выделять гормоны. При данном типе лечения пациент употребляет гормоносодержащие препараты. Данный вид лечения дает результат только до тех пор, пока гормон поступает в организм извне, так как лечение не воздействует на первоисточник заболевания. В пример можно привести людей, больных сахарным диабетом, вынужденных применять подобные препараты всю жизнь.
Б) Тормозящий вид лечения. Применяется при активной работе какой-либо железы, а также для терапии некоторых видов новообразований. В таких случаях либо вводят гормон - антагонист избыточного гормона, либо вещество, тормозящее работу слишком активной железы. Помимо медикаментозной разновидности существует и хирургическая, связанная с удалением черезмерно активной железы.
В) Стимулирующее лечение. Как видно из названия призвано активизировать самостоятельную выработку гормонов самой железой.
Г) Гормонотерапия при заболеваниях, не связанных с нарушением функций эндокринных желез. Применяется для непосредственного гормонального воздействия на патологические процессы в организме. Однако, терапевтический эффект при этом виде гормонотерапии связан с изменением физиологических отношений во внутренней среде организма и может сопровождаться более или менее выраженными побочными явлениями, обусловленными поступлением в организм избытка гормонального вещества.
Литература:
-
Пустовалова Л.М., Никанорова И.Е. Общая химия. - Ростов н/Д: Феникс, 2012.
-
Стромберг А.Г., Семченко Д.П. Физическая химия. - М.: Высшая школа, 2013.
-
Филлпович Ю.Б. Основы биохимии.- М.:Высшая школа,2009.
-
Шамин А.Н. История химии белка. --Москва : «Наука», 1997.
-
Якубке Х.-Д., Ешкайт Х. Аминокислоты, пептиды, белки. Москва: «Мир», 1995.
-
Доронькин В.Н., Бережная А.Г., Сажнева Т.В., Февралева В.А. Тематические тесты для подготовки к ЕГЭ. Ростов-на -Дону, Легион., 2011.
-
Контролирующий блок
Контрольные вопросы по теме «Белки»
1.Что общего между белками и аминокислотами ? Почему белки называют биополимерами ?
2.Охарактеризуйте 3 структуры белка ? Какие связи их образуют ?
3. Охарактеризуйте физические свойства белков. Перечислите функции белков в растительном и животном организме.
4.Что такое денатурация ? Какие внешние факторы могут вызвать еѐ ? 5. Какие «цветные реакции» на белок вы знаете ? Где они могут быть применены ?
6.Как с помощью одного и того же реактива распознать растворы белка, глюкозы и глицерина ?
7.Предложите способы распознавания изделия из натуральной шерсти и искусственного волокна.
8.Как проходит гидролиз белков ? Для чего его применяют в промышленности и как он осуществляется в организмах животных и человека ?
9.Что вы знаете о биосинтезе белков в животной клетке? Какие органоиды клетки участвуют в нѐм ?
10. В 1963 г. молекулу гормона белковой природы инсулина синтезировали с помощью биохимических методов. Однако осуществить в промышленном масштабе столь дорогостоящий и сложный синтез, включающий 170 химических реакций, оказалось сложно. В клетках же поджелудочной железы на синтез инсулина тратятся доли секунды. Почему ? Как получают инсулин в наши дни ?
ТЕСТ №1 ПО ТЕМЕ «БЕЛКИ»
Вариант 1
Выбери один ответ:
-
Вторичная структура белка поддерживается
1 - Пептидными связями 2 - Водородными связями
3 - Дисульфидными ковалентными связями
2. Наиболее энергоемкими являются:
1 - Жиры 2 - Нуклеиновые кислоты 3 - Белки 4- углеводы
3. Первичная структура белка зависит от:
1 - Количества аминокислотных остатков
2 - Последовательности аминокислотных остатков и их количества
3 - От видов аминокислот и их количества
4. Фермент:
1- ускоряет сразу несколько типов реакций
2- работает в узких температурных пределах
3- может работать только при определенном значении рН среды.
5. При выработке иммунитета в крови образуются:
1- антитела 2- антигены 3- гемоглобин 3- инсулин
6. Функции углеводов в животных клетках:
1- каталитическая 2- энергетическая 3- транспортная. 4- регуляторная
7. Клетчатка и хитин - это примеры:
1- полисахаридов 2- моносахаридов 3- дисахаридов.
8. Мономеры белков - это:
1- аминокислоты 2- моносахариды 3- нуклеотиды. 4- глицерин и 3 жирные кислоты
9. Водородные связи не встречаются в:
1- белках 2- нуклеиновых кислотах 3- липидах.
10. Некоторые белки вырабатывают антитела. Тем самым они
выполняют функцию:
1 - каталитическую; 2 - сократительную; 3- иммунную;
4- пластическую.
Вариант 2
Выбери один ответ:
1. Какие связи стабилизируют первичную структуру?
1- пептидные 2- гидрофобные 3- водородные 4- дисульфидные
2. В процессе биохимических реакций ферменты:
1- ускоряют реакции и сами при этом не изменяются
2- ускоряют реакции и сами изменяются
3- замедляют химические реакции, не изменяясь
4- замедляют реакции , а сами изменяясь.
3. Молекулы белков отличаются друг от друга:
1- последовательностью чередования аминокислот
2- количеством аминокислот
3- структурой
4-все ответы верны
4. Какое из соединений построено из аминокислот?
1- целлюлоза 2- гликоген 3- инсулин 4- хитин
5. Изменяемыми частями аминокислот являются:
1- аминогруппа и карбоксильная группа 2- радикал
3- карбоксильная группа 4 - радикал и карбоксильная группа.
6. Строительный углевод растительных клеток
1- хитин 2- крахмал 3- целлюлоза 4 - гликоген
7. Для лечения тяжелых форм сахарного диабета больным необходимо вводить:
1 - гемоглобин 2- инсулин 3 - антитела 4 - гликоген
8. Биологические катализаторы - это:
1- антигены 2 - антитела 3 - ферменты
9. Укажите элементарный состав белков:
1 - С, Н; 2 - С, Н, О, N, S, P; 3- C, H, N, O; 4- вся таблица
Менделеева.
10. Какая структура белковой молекулы определяет специфическую
биологическую активность белка?
а) Четвертичная; б) третичная; в) вторичная; г) первичная.
ТЕСТ №2 ПО ТЕМЕ «БЕЛКИ»
Вариант 1
А1.Структурным звеном белков являются:А2. Образование спирали характеризует: А3. Действие каких факторов вызывает необратимую денатурацию белка? А4. Укажите, что наблюдается при действии на растворы белков концентрированной азотной кислоты: А5. Белки, выполняющие каталитическую функцию, называются: А6. Белок гемоглобин выполняет следующую функцию:
Часть Б
Б1. Соотнесите:
Б2. Белки:
Часть С
С1. Напишите уравнения реакций, с помощью которых из этанола и неорганических веществ можно получить глицин.
Вариант 2
Часть А
А1. Массовая доля какого элемента в белках наибольшая?А2.Укажите, к какой группе веществ относится гемоглобин: А3.Свертывание спирали в клубок-«глобулу» характеризует: А4. При горении белков ощущается запах: А5. Появление желтой окраски при взаимодействии раствора белка с концентрированной азотной кислотой указывает на наличие в белке остатков аминокислот, содержащих: А6.Белки, защищающие от проникающих в клетку бактерий:
Часть Б
Б1. Белки можно обнаружить:Б2. Какие утверждения о белках верны?
Часть С
С1. Осуществить превращения:
+Н2О/Hg2+ +Ag2O/NH3(р-р) +Cl2 NH3 (изб.)
С2Н2 → Х1 → Х2 → Х3 → Х4
Вариант 3
Часть А
А1.Первичная структура белка представляет собой:А2.Витки спирали вторичной структуры белка скреплены главным образом за счет связей: А3. Денатурация белков приводит к разрушению: А4. Укажите общую качественную реакцию на белки: А5. Изготовление безе на основе белков основано на способности белков к: А6.Антитела и антитоксины выполняют следующую функцию белков:
Часть Б
Б1. Соотнесите:Б2. При гидролизе белков могут образоваться вещества:
Часть С
С1.Напишите уравнения реакций образования дипептида из:
а) аспарагиногвой кислоты (2-аминобутандиовой кислоты);
б) из аминоуксусной кислоты и аланина.
Вариант 4
Часть А
А1.Вторичная структура белка обусловлена:А2. Объединение четырех глобул в молекулу гемоглобина характеризует: А3.Для белков не характерна реакция: А4. Для проведения биуретовой реакции потребуется реагент: А5. Белки являются одним из важнейших компонентов пищи. В основе усвоения белка лежит реакция: А6.Белок крови, ответственный за транспорт кислорода:
Часть Б
Б1. Для белков характерно:
Б2. При гидролизе белков могут образоваться:
Часть С
С1. Осуществить превращения:
+Ag2O/NH3(р-р) +Cl2 NH3 (изб.) аланин
СН3СОН → Х1 → Х2 → Х3 → Х4
Технологическая карта (план) занятия
Дисциплина: Химия
Курс: 1
Семестр: 2
Тема: «Изучение свойств белков»
Время: 90 минут
Вид занятия: лабораторное
Методы занятия: беседа, контроль знаний
Форма занятия: индивидуальная
Цели занятия:
Обучающие:
Студент должен знать:
- свойства белков;
Студент должен знать:
- свойства белков
Развивающие:
- развивать умение извлекать информацию из устного сообщения;
- развивать умение анализировать данные;
- концентрировать внимание и выделять главное;
Воспитательные:
- умение работать в коллективе;
- формировать и аргументировать свое мнение;
- воспитывать интерес к предмету и выбранной профессии;
- прививать навыки самостоятельной работы, уметь четко и грамотно выражать свои мысли.
Общие компетенции:
ОК 2: Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их выполнение и качество.
ОК 6: Работать в коллективе и команде, эффективно общаться с коллегами, руководством, потребителями.
Обеспечение занятия: учебник, инструктивная карта
Литература: Габриелян О.С., Остроумов И.Г. Химия. М., 2009. с. 313
Задает вопросы студентам:
- Что такое белки?
- Каково строение белков?
- Какова роль белков?
- С какими химическими соединениями реагируют белки?
- Какие качественные реакции используют для определения белков?
Отвечают на вопросы преподавателя.
3
Изучение нового материала
20
Объяснительно-иллюстративный и репродуктивный
Мотивирует студентов к изучению материала.
Отвечают на вопросы преподавателя.
4
Актуализация полученных умений
35
Проблемно-поисковый
Инструктирует студентов, раздает задания для самостоятельной работы
Выполняют работу, участвуют в обсуждении результатов, отвечают на вопросы преподавателя.
5
Подведение итогов
5
Объясняет домашнее задание.
Рефлексия.
Записывают домашнее задание.
Технологическая карта (план) занятия
Дисциплина: Химия
Курс: 1
Семестр: 2
Тема: «Аминокислоты. Белки»
Время: 90 минут
Вид занятия: комбинированное
Методы занятия: беседа, контроль знаний
Форма занятия: коллективная с элементами индивидуальногозадания
Цели занятия:
Обучающие:
Студент должен знать:
- определение аминокислоты;
- классификацию аминокислот;
- физические свойства;
- химические свойства;
- определение белки;
- классификацию белков;
- физические свойства белков;
- химические свойства;
- способы получения.
Студент должен уметь:
- давать определение аминокислоты;
- объяснять классификацию аминокислот;
- объяснять физические свойства;
- объяснять химические свойства;
- объяснять образование пептидной связи;
- давать определение белки;
- объяснять классификацию белков;
- объяснять понятия денатурация и ренатурация;
- объяснять химические свойства;
- характеризовать качественные реакции;
- способы получения.
Развивающие:
- развивать умение извлекать информацию из устного сообщения;
- развивать умение анализировать данные;
- концентрировать внимание и выделять главное;
- прививать навыки самостоятельной работы, уметь четко и грамотно выражать свои мысли.
Воспитательные:
- умение работать в коллективе;
- формировать и аргументировать свое мнение;
- воспитывать интерес к предмету и выбранной профессии.
Общие компетенции:
ОК 2: Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их выполнение и качество.
ОК 4: Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
Обеспечение занятия: учебник, мультимедийная презентация
Литература: Габриелян О.С., Остроумов И.Г. Химия. М., 2009. с. 304-314
Ход занятияЗадает вопросы студентам:
- Что такое белки?
- Каково строение белков?
- Какова роль белков?
- С какими химическими соединениями реагируют белки?
- Какие качественные реакции используют для определения белков?
- Что такое аминокислоты?
- Какова классификация аминокислот?
- Каковы химические свойства аминокислот?
- Какие качественные реакции используют для определения аминокислот?
Отвечают на вопросы преподавателя.
3
Изучение нового материала
50
Объяснительно-иллюстративный и репродуктивный
Мотивирует студентов к изучению материала при помощи мультимедийной презентации.
Отвечают на вопросы преподавателя.
4
Закрепление полученных знаний
20
Проблемно-поисковый
Инструктирует студентов, раздает задания для работы
Выполняют работу, участвуют в обсуждении результатов, отвечают на вопросы преподавателя.
5
Подведение итогов
5
Объясняет домашнее задание. Дает задание для внеаудиторной самостоятельной работы.
Рефлексия.
Записывают домашнее задание.