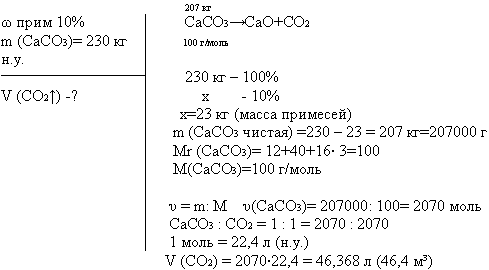- Учителю
- Урок химии на тему Соли угольной кислоты. Жесткость воды.
Урок химии на тему Соли угольной кислоты. Жесткость воды.
|
Тема: Соли угольной кислоты. Жесткость воды. | |||
|
Цель урока: Изучить химические свойства солей угольной кислоты - карбонатов и гидрокарбонатов; приобрести навыки в решении расчетных задач. создать условия для развития умений учащихся анализировать, обобщать, делать выводы, сравнивать.
| |||
|
|
Деятельность учителя |
Деятельность обучающихся |
наглядности |
|
3 мин. |
I. Организационный момент. Приветствие. - Повернитесь друг к другу, улыбнитесь. Работать на уроке будет веселее, когда у всех замечательное настроение. |
Ученики осмысливают поставленную цель. Поворачиваются друг к другу и улыбаются. |
|
|
5 мин. |
II. Проверка пройденного материала. По методу «Ромашка Блума» осуществляет проверку пройденного материала. Тест-экспресс.
|
Ученики отвечают на уровневые вопросы. |
Ромашка Блума |
|
20 мин. |
III. Актуализация знаний Работают у доски. Демонстрируют свои знания.
Соли угольной кислоты- карбонаты. Угольная кислота - двухосновная и поэтому может образовывать два вида солей: Na2CO3 NaHCO3 CaCO3 Ca(HCO3)2 почти все карбонаты, кроме карбонатов все гидрокарбонаты растворимы щелочных металлов- нерастворимы
Карбонаты легко превращаются в гидрокарбонаты и наоборот: СаСO3 + H2O + CO2Ca(HCO3)2 t Ca(HCO3)2 Са СO3 + H2O + CO2
Качественная реакция на соли угольной кислоты (СО32- или карбонат-ион) - взаимодействие с разбавленной кислотой, например соляной: Na2CO3 + HCl
учащиеся записывают уравнение реакции в молекулярной и ионной форме Na2CO3 + 2HCl CO2 + 2NaCl + H2O 2Na++ CO32- + 2H+ + 2Cl- CO2 + 2Na+ +2Cl- + H2O CO32- + 2H+ CO2 + H2O
Жёсткость воды. Использование жёсткой воды приводит к образованию накипи. Анализ показывает, что жёсткая вода содержит большое количество растворимых солей кальция и магния. Различают временную жёсткость воды и постоянную жёсткость воды. Ca(HCO3)2 и Mg(HCO3)2 или СaCl2 и MgCl2
временную жёсткость постоянную жёсткость Временная жёсткость воды или карбонатная, обусловлена присутствием в воде гидрокарбонатов кальция и магния. Она легко устраняется кипячением: t Ca(HCO3)2 Са СO3 + H2O + CO2 или действием известкового молока или соды Ca(HCO3)2 +Ca(OH)2 Ca(HCO3)2 + Na2CO3
учащиеся записывают уравнения в молекулярной и ионной форме Ca(HCO3)2 +Ca(OH)2 CaCO3 +2H2O Ca2+ +2(HCO3)- + Ca2+ +2OH- CaCO3 +2H2O
Ca(HCO3)2 + Na2CO3 CaCO3 + 2NaHCO3 Ca2+ +2(HCO3)- + 2Na+ +CO32- CaCO3 + 2Na+ + 2HCO3- Ca2+ +CO32- CaCO3 Постоянная или некарбонатная жёсткость, обусловлена присутствием в воде других растворимых солеё кальция или магния. Она устраняется добавлением соды CaCl2+ Na2CO3
учащиеся записывают уравнения в молекулярной и ионной форме CaCl2+ NaCO3 CaCO3 + 2NaCl Ca2+ + 2Cl- + 2Na+ + CO32- CaCO3 + 2Na+ + 2Cl- Ca2+ +CO32- CaCO3 Опыт 1: СО2 + Ca(OH)2 = CaCO3↓ + H2O Выпадет белый творожистый осадок - CaCO3. СаСO3 + H2O + CO2Ca(HCO3)2 Осадок исчезает. t Ca(HCO3)2СаСO3 + H2O + CO2 Осадок снова появляется. Опыт 2: CaCO3 +2 HCl= CaCl2 +CO2 +H2O
Na2CO3 +2 HCl= 2NaCl +CO2 +H2O При добавлении в обе пробирки соляной кислоты, выделяется углекислый газ. Почему? Углекислый газ не поддерживает горение. Вывод: Для обнаружения карбонат -иона СО3 надо использовать кислоты более сильные, чем угольная. Временная жёсткость воды или карбонатная, обусловлена присутствием в воде гидрокарбонатов кальция и магния. Она легко устраняется кипячением: t Ca(HCO3)2 или действием известкового молока или соды Ca(HCO3)2 +Ca(OH)2
Ca2+ +2(HCO3)-
+ Ca2+ +2OH-
Ca(HCO3)2
+Na2CO3 Ca2+ +2(HCO3)-
+ 2Na+
+CO32- Ca2+ +CO32- Постоянная или некарбонатная жёсткость, обусловлена присутствием в воде других растворимых солеё кальция или магния. Она устраняется добавлением соды. CaCl2+ NaCO3 Ca2+ + 2Cl- +
2Na+ + CO32- Ca2+ +CO32-
Б) По желанию к доске выходит ученик и решает цепочку превращений: 1) СО2 + Ca(OH)2 = CaCO3↓ + H2O 2) СаСO3 + H2O + CO2Ca(HCO3)2 t
. Определите объем (н. у.) оксида углерода (IV), в котором содержится столько же атомов кислорода, сколько их содержится в 48 г карбоната кальция. Дано:Решение: m (CaCO3) = 48 г1. Найдем количество вещества карбоната кальция: V (CO2) -?n (CaCO3) = 2. НайдемчисломолекулCaCO3: N (CaCO3) = n (CaCO3)*NA = 0, 48* 6, 02* 1023моль-1 = 2, 89*1023 3. Найдем число атомов кислорода в образце CaCO3 (N1): = 4. По условию задачи такое же число атомов кислорода N2(O) содержится в оксиде углерода (IV), следовательно: N1(O) = N2(O) = 8, 669* 1023 Найдем число молекул CO2, содержащее данное число атомов кислорода: N (CO2) = = 4, 334*1023 5. Найдем количество вещества оксида углерода (IV): n (CO2) = = = 0, 72 моль 6. Найдем объем оксида углерода (IV): V (CO2) = n (CO2)*Vm = 0, 72 моль* 22, 4 л/ моль = 16, 12 л Ответ: V (CO2) = 16, 12 л.
2. Вычислите молярную и массовую долю (в %) оксида углерода (II) в смеси, содержащей 16, 8 л (н. у.) оксида углерода (II) и 13, 44 л (н. у.) оксида углерода (IV). Дано:Решение: V (CO) = 16, 8 л 1. Найдем количество веществ оксидов углерода (II) и (IV): М (CO2) = 13, 44 л x (CO) - ? w (CO) -? 2. Найдем общее количество вещества газов в смеси: n (смеси) = n (CO) + n (CO2) = 0, 75 моль + 0, 6 моль = 1, 35 моль 3. Найдем молярную долю оксида углерода (II) в смеси: x (CO) = * 100% = * 100% = 55, 56% 4. Найдем массы оксида углерода (II) и оксида углерода (IV): m (CO) = n (CO)* M(CO) = 0, 75 моль* 28 г/моль = 21 г m (CO2) = n (CO2)* M (CO2) = 0, 6 моль* 44 г/моль = 26, 4 г 5. Вычислим массу смеси: m (смеси) = m (CO) + m (CO2) = 21 г+ 26, 4 г = 47, 4 г 6. Вычислим массовую долю СО в смеси: w (CO) = Ответ: x(CO) = 55, 56 %, w(CO) = 44, 3%.
3. Газ, образовавшийся при сгорании 18, 6 г угля в избытке кислорода, пропустили через избыток раствора гидроксида кальция. Какова масса образовавшегося при этом осадка? Дата: Решение: m (C) = 18, 6 г 1. Запишем уравнения реакций: m (осадка) - ? 1) С + О2 = СО2 2) СО2 + Са (ОН)2 = СаСО3+ Н2О В данном случае вещество, количество которого известно, уголь, участвует в одной реакции, а вещество, количетсво вещества которого необходимо найти, образуется в результате второй реакции. В этом случае перейти от исходного вещества к продукту, количество которого необходимо найти, можно через количетсво вещества, которое образуется в первой реакции и затем участвует во второй. В данной задаче это вещество - СО2. 2. Вычислим количество вещества сгоревшего углерода: n (C ) = 3. По уравнению реакции 1) определим количество вещества углекислого газа:
n (CO2) = n (C ) = 1, 55 моль 4. Так как весь углекислый газ, образовавшийся в первой реакции, затем вступил в реакцию с гидроксидом кальция, получим: n1 (CO2) = n2 (CO2) = 1, 55 моль 5. По уравнению реакции 2) найдем количество вещества карбоната кальция: , следовательно, n (CaCO3) = n (CO2) = 1, 55 моль 6. Найдем массу карбоната кальция: m (CaCO3) = n (CaCO3)* M(CaCO3) = 1, 55 моль * 100 г/ моль = 155 г. Ответ: m (CaCO3) =155 г. | ||
|
10 мин. |
IV. Закрепление урока. С помощью приема «З-Х-У» проводит закрепление урока. Решение задачи Какой объем СО2 выделится (при н.у.) при обжиге 230 кг известняка, содержащего 10 % примесей.
|
Ученики заполняют таблицу «З-Х-У» |
Таблица «З-Х-У» |
|
5 мин. |
V. Итог урока. Этап рефлексии: Стратегия «Телеграмма» Кратко написать самое важное, что уяснил с урока с пожеланиями соседу по парте и отправить. |
Оценивают работу своих одноклассников, пишут телеграммы. |
фишки
стикеры |
|
2 мин. |
VI. Домашнее задание. Объясняет особенности выполнения домашней работы. |
Записывают домашнюю работу в дневниках. |
|