- Учителю
- Инструкции к практическим работам по химии 8 класс
Инструкции к практическим работам по химии 8 класс
Существенная роль в изучении базового курса химии принадлежит химическому эксперименту, выполнение которого формирует у учащихся умение правильного обращения с веществами, служит основой для проверки гипотез, средством закрепления умений.
Предлагаемое пособие содержит инструктивные карточки к проведению практических работ за курс химии 8 класса и лабораторных опытов к первой теме «Основные химические понятия». Изучая инструкцию по проведению опыта, которая содержит план наблюдений, учащиеся должны чётко определять объект наблюдения, то есть то, на что будет обращено внимание - конкретное вещество, его свойство, то или иное превращение вещества.
Любое умение, в том числе и умение, выполнять эксперимент, формируется не сразу. Выполняя задания по инструктивным карточкам, учащиеся от занятия к занятию научаться самостоятельно планировать и грамотно проводить химический эксперимент. Также можно проследить формирование умений учащихся описывать наблюдения, анализировать данные, составлять отчёт о работе, делать выводы.
Проводя эксперимент, необходимо строго соблюдать все правила техники безопасности при работе в химическом кабинете. Особое внимание в инструктивных карточках уделяется вопросам правил работы с конкретными веществами, назначению химической посуды, простейших приборов и оборудования.
Работая в химической лаборатории (в школьном кабинете химии), очень важно неукоснительно выполнять правила техники безопасности.
Инструктивная карточка №1.
Практическая работа: Правила техники безопасности (ТБ) в химическом кабинете.
Цель: изучить «Инструкцию по охране труда для учащихся».
Утверждаю:
Директор школы №__________
____________________________
«___» __________________20___г.
Утверждено:
Постановлением профсоюзного
комитета школы №__________
____________________________
«___» __________________20___г.
Инструкция по охране труда для учащихся
при работе в кабинете химии.
-
Общие положения.
-
Соблюдение требований настоящей инструкции обязательно для видов учащихся, работающих в кабинете химии.
-
Учащиеся могут находиться в кабинете только в присутствии учителя; пребывание учащихся в помещении лаборантской не допускается.
-
В кабинете химии запрещается принимать пищу и напитки.
-
Учащимся запрещается выносить из кабинета и вносить в него любые вещества без разрешения учителя.
-
Не допускается загромождение проходов портфелями и сумками.
-
Во время работы в кабинете химии учащиеся должны соблюдать чистоту, порядок на рабочем месте, а также чётко следовать правилам техники безопасности.
-
Учащимся запрещается бегать по кабинету, шуметь и устраивать игры.
-
Учащиеся, присутствующие на лабораторной или практической работе без халата, непосредственно к проведению эксперимента не допускаются.
-
Требование безопасности перед началом работы.
-
Перед началом экспериментальной работы каждый учащийся должен надеть халат.
-
Учащиеся, имеющие длинные волосы, не должны оставлять их в распущенном виде, чтобы исключить возможность их соприкосновения с лабораторным оборудованием, реактивами и тем более - с открытым огнём.
-
Прежде, чем приступить к выполнению эксперимента, учащиеся должны по учебнику или инструктивной карточке изучить и уяснить порядок выполнения предстоящей работы.
-
Учащиеся должны внимательно выслушать инструктаж учителя по технике безопасности в соответствии с особенностями предстоящей работы. Текущий инструктаж по технике безопасности перед практической работой регистрируется, собственноручно учащимися в тетрадях для практических работ. Текущий инструктаж перед лабораторной работой не регистрируется.
-
Приступать к проведению эксперимента учащиеся могут только с разрешения учителя.
-
Требования безопасности во время работы.
-
Во время работы в кабинете химии учащиеся должны быть максимально внимательными, дисциплинированными, строго следовать указаниям учителя, соблюдать тишину, поддерживать чистоту и порядок на рабочем месте.
-
Во время демонстрационных опытов учащиеся должны находиться на своих рабочих местах или пересесть по указанию учителя на другое, более безопасное место.
-
При выполнении лабораторных и практических работ учащиеся должны неукоснительно соблюдать правила техники безопасности, следить, чтобы вещества не попадали на кожу лица и рук, так как многие из них вызывают раздражение кожи и слизистых оболочек.
-
Никакие вещества в кабинете химии нельзя пробовать на вкус! Нюхать вещества можно, лишь осторожно направляя на себя их пары или газы лёгким движением руки, а не наклоняясь к сосуду и не вдыхая полной грудью.
-
При выполнении лабораторных работ учащиеся должны точно повторять действия учителя, показывающего, как нужно правильно проводить эксперимент.
-
Подготовленный к работе прибор учащиеся должны показать учителю или лаборанту.
-
По первому требованию учителя учащиеся обязаны немедленно прекратить выполнение работы (эксперимента). Возобновление работы возможно только с разрешения учителя.
-
Учащимся запрещается самостоятельно проводить любые опыты, не предусмотренные в данной работе.
-
Учащимся запрещается выливать в канализацию растворы и органические жидкости.
-
Обо всех разлитых и рассыпанных реактивах учащиеся должны немедленно сообщить учителю или лаборанту. Учащимся запрещается самостоятельно убирать любые вещества.
-
Обо всех неполадках в работе оборудования учащиеся обязаны сообщить учителю или лаборанту. Учащимся запрещается самостоятельно устранять неисправности.
-
При получении травм (порезы, ожоги и т.п.). а также при плохом самочувствии учащиеся должны немедленно сообщить об этом учителю.
-
Во время работы учащимся запрещается переходить на другое рабочее место без разрешения учителя.
-
Учащимся запрещается брать вещества и какое-либо оборудование с незадействованных на данный момент рабочих мест.
-
Недопустимо во время работы перебрасывать друг другу какие-либо вещи (учебники, тетради, ручки и др.)
-
Запрещается зажигать горелки и спиртовки без надобности.
-
Требования безопасности по окончанию работы.
-
Уборка рабочих мест по окончанию работы производиться в соответствии с указаниями учителя.
-
Учащиеся должны привести в порядок своё рабочее место, сдать учителю или лаборанту дополнительные реактивы и оборудование. Грязную посуду также необходимо сдать учителю или лаборанту.
-
Аварийные ситуации.
При возникновении аварийных ситуаций во время занятий в кабинете химии (пожар, появление посторонних запахов), не допускать паники и подчиняться только указаниям учителя.
Зав. кабинетом химии
____________________________
Согласовано
Ответственный за охрану труда и технику
безопасности
______________________________________-
Инструктивная карточка №2.
Практическая работа: Ознакомление с лабораторным оборудованием.
Цель: ознакомить учащихся с основным лабораторным оборудованием, его назначением и приёмам работы с ним.
Оборудование: стеклянная посуда общего и специального назначения, мерная посуда, фарфоровая и высокоогнеупорная посуда.
Стеклянная химическая посуда подразделяется на три основных группы:
-
посуда общего назначения, применяемая в любой химической лаборатории для разнообразных целей;
-
посуда специального назначения, предназначенная для какой-нибудь одной цели (неорганический или органический синтез);
-
мерная посуда, предназначенная для отмеривания точных объёмов жидкостей, растворов.
Посуда общего назначения.
Пробирки - стеклянные трубки, запаянные с одного конца. Применяется для проведения опытов. Для проведения опытов общий объём реактивов не должен превышать половины объёма пробирки. Нельзя закрывать отверстие пробирки пальцем и встряхивать её.
Химические воронки служат для переливание жидкостей, для фильтрования и т.д.
Капельные воронки применяются при монтировании приборов, когда необходимо вводить в реакционную смесь какой-нибудь реактив небольшими порциями.
Делительные воронки похожи на капельные, но чаще бывают цилиндрической формы со значительно укороченным концом. Применяют их для разделения несмешивающихся жидкостей.
Химические стаканы - тонкостенные цилиндры различной ёмкости. Бывают двух видов: с носиком и без него.
Плоскодонные колбы применяют при многих работах, для хранения растворов, дистиллированной воды.
Конические колбы (Эрленмейера) применяются главным образом для титрования.
Холодильники - приборы для охлаждения и конденсации паров, образующихся при нагревании или кипячении веществ.
Посуда специального назначения.
Круглодонные колбы применяют при органических и неорганических синтезах.
Колбы для перегонки (дистилляции): колбы Вюрца, Клайзена - круглодонные с раздвоенным горлом.
Аппарат Киппа - прибор для получения водорода и других газов.
Мерная посуда.
Мерные цилиндры и мензурки служат для отмеривания с небольшой точностью объёмов жидкостей.
Пипетки - приспособления для отмеривания точных объёмов жидкостей.
Бюретки служат для отмеривания точных объёмов жидкостей, преимущественно при титровании.
Мерные колбы служат для приготовления растворов точной концентрации.
Фарфоровая посуда.
Стаканы, выпарительные чашки, тигли - для прокаливания веществ, ступки, ложки-шпатели.
План работы.
-
Рассмотрите оборудование, размещенное в пластмассовых лотках.
-
Оформите в практической тетради отчёт о работе «Лабораторное оборудование». Для этого зарисуйте схематично пробирку, коническую колбу, химический стакан, химическую воронку, мерный цилиндр и укажите их назначение.
Инструктивная карточка №3.
Практическая работа: Приёмы работы с лабораторным штативом, нагревательными приборами.
Цель работы: научиться приемам обращения с лабораторным штативом, приемам обращения с нагревательным прибором. Изучение строения пламени.
Оборудование: лабораторный штатив, пробирка, колба, воронка, спиртовка, свеча, спички, фарфоровая чашка, тигельные щипцы.
План работы.
-
Внимательно посмотрите, как пользуется штативом учитель, демонстрируя его вам.
-
Ознакомьтесь с устройством и назначением лабораторного штатива. Найдите основные детали: стержень, подставка, зажим (муфта), лапка, кольцо. Соберите штатив.
-
По разрешению учителя закрепите в лапке штатива сначала пробирку, затем - колбу.
-
Закрепите в штативе воронку помощью кольца.
-
Сделайте в своей тетради рисунок штатива, обозначив его основные детали.
Устройство спиртовки и приёмы работы с ней.
-
Ознакомьтесь с устройством спиртовки. Основные детали спиртовки: резервуар, трубка с диском, колпачок, фитиль.
-
Приемы работы со спиртовкой:
-
откройте колпачок;
-
расправьте фитиль;
-
проверьте, чтобы диск плотно прилегал к горлышку спиртовки;
-
зажгите спиртовку спичкой;
-
как только закончите работу, связанную с нагреванием, потушите спиртовку (тушите спиртовку только колпачком)
Категорически запрещается:
-зажигать спиртовку от другой спиртовки;
-переносить горящую спиртовку на другое рабочее место;
- дуть на горящую спиртовку;
- оставлять без присмотра горящую спиртовку.
Приёмы безопасного нагревания в открытом пламени.
1. Закрепите лапку штатива или зажима в 1,5-2 см от отверстия пробирки. Пробирка должна поворачиваться при незначительном усилии работающего. Помните: стекло при нагревании расширяется, возможно, повреждение пробирки!
2. Сначала прогрейте всю пробирку (пробирку держите наклонно) и только потом - ту её часть, где находиться исследуемое вещество. Отверстие пробирки должно быть направлено в сторону от работающего.
3. Без специального указания учителя не доводите исследуемое вещество до кипения, тем более не кипятите!
4. Нагревание производите в самой горячей (верхней ) части пламени.
5. В течение всего процесса нагревания, выпаривания запрещается наклоняться над сосудами, заглядывать в них!
Изучение строения пламени.
План работы.
-
Зажгите свечу и внимательно рассмотрите её пламя. Обратите внимание на три части пламени, различающиеся по окраске.
Во внутренней части пламени горючие вещества разогреваются и испаряются. Температура этой части пламени самая низкая: внесённая сюда спичка загорается не сразу. Проверьте это на опыте.
Средняя - светящаяся - часть пламени содержит раскалённые, но не полностью сгоревшие частицы. Если захватить край фарфоровой чашки тигельными щипцами и внести её в эту часть пламени, дно чашки покроется копотью, состоящей из частичек несгоревшего углерода. Проверьте это опытным путём.
Наружная часть пламени почти бесцветна, в ней полностью сгорают частички парафина: при этом образуется бесцветный углекислый газ и вода. Температура этой части пламени самая высокая, поэтому рекомендуется нагревать вещества в верхней части пламени.
-
Сравните пламя спиртовки с пламенем свечи. Убедитесь, что наружная часть пламени наиболее жаркая. Проделайте для этого следующий опыт. Две спички одновременно внесите в пламя спиртовки: одну поместите в наружную часть пламени, а другую - во внутреннюю часть. Опыт проводите вдвоём. Спички для удобства закрепите на тонкой проволочке.
-
Заполните в практической тетради таблицу:
Ход работы
Рисунок
Вывод
Устройство спиртовки.
Строение пламени.
(учащиеся должны привести рисунок спиртовки с указанием составных частей и рисунок пламени с указанием зон)
(какая зона пламени самая горячая и почему)
Инструктивная карточка №4.
Практическая работа: Очистка загрязнённой поваренной соли.
Цель работы: освоить простейшие способы очистки веществ (фильтрование и выпаривание).
Оборудование: лабораторный штатив, два химических стакана, стеклянная палочка, ложечка, воронка, фильтровальная бумага, мерный цилиндр, фарфоровая чашка, загрязнённая поваренная соль.
План работы.
-
Растворение загрязнённой соли.
В стакан вместимостью 50 мл налейте 10-15 мл воды и добавьте при перемешивании одну ложечку загрязнённой поваренной соли. Помешивание проводите стеклянной палочкой.
-
Приготовление фильтра.
Вставьте углом в воронку фильтровальную бумагу, сложенную вчетверо. Срежьте края фильтра так, чтобы они не доходили до края воронки на 0,5 см.
-
Фильтрование.
Вначале смочите фильтр, чтобы он пристал к стенкам воронки. Для этого налейте на фильтровальную бумагу, вставленную в воронку, немного чистой воды и путём вращения воронки смочите весь фильтр. Воронку с фильтром вставьте в кольцо штатива, подставьте стакан так, чтобы конец воронки соприкасался с внутренней стенкой стакана. В этом случае жидкость стекает по стенке и не разбрызгивается. Загрязнённый раствор соли наливайте на фильтр по стеклянной палочке, нижний конец которой направьте к стенке воронки, не притрагиваясь к фильтру. Жидкость приливайте небольшими порциями, она не должна доходить до краёв фильтра на 5 мм.
-
Выпаривание очищенного раствора соли.
В фарфоровую чашку налейте 5мл очищенного раствора соли и выпарьте его. Сравните полученную соль с той, которая была выдана.
-
В практической тетради заполните таблицу:
-
Этап работы (название и рисунок приборов)
Что наблюдали?
Выводы
Растворение загрязнённой соли
Фильтрование
Выпаривание очищенного раствора соли.
Инструктивная карточка №5.
Практическая работа: Получение кислорода и изучение его свойств.
Цель работы: получить кислород в лаборатории и изучить его химическое свойство - поддерживать горение веществ; научиться собирать газ методом вытеснения воздуха.
Оборудование: лабораторный штатив, две пробирки, пробка с газоотводной трубкой, спиртовка, комочек ваты, лучинка.
Реактивы: перманганат калия, уголёк.
План работы.
-
В сухую пробирку поместите перманганат калия (примерно 1/4 часть), вложите небольшой рыхлый комочек ваты и закройте пробкой с газоотводной трубкой. Внимание: комочек ваты должен находиться возле пробки!
-
Закрепите пробирку в штативе в горизонтальном положении.
-
Сначала прогрейте всю пробирку, затем нагревайте только ту её часть, где находиться перманганат калия.
-
Через полминуты начинайте проверять тлеющей лучинкой заполнение пробирки-приемника кислорода. Для этого лучинку поднесите к отверстию пробирки. Что наблюдаете?
-
Раскалите в пламени горелки уголёк (воспользуйтесь металлической ложечкой для сжигания) и быстро внесите его в пробирку с кислородом. Что наблюдаете?
-
Оформите отчёт в виде таблицы:
-
Оборудование, реактивы
Зарисовка опыта
Что наблюдали в ходе проведения опыта
Уравнения реакций
Вывод:
Сделать вывод вам помогут следующие вопросы:
а) Из каких веществ можно получить кислород?
б) С помощью какого метода собирали газ, на каком физическом свойстве основывается данный метод?
в) Для чего лучинку и уголёк перед началом опыта необходимо нагреть?
г) К какому классу соединений относят продукты сгорания веществ?
д) Какое важное химическое свойство кислорода вы подтвердили, проводя эту практическую работу?
Инструктивная карточка №6.
Практическая работа: Реакция обмена между оксидом металла меди (II) и раствором кислоты.
Цель работы: провести реакцию обмена между оксидом металла и кислотой, выделить из смеси кристаллы полученной соли.
Оборудование: шпатель, пробирка, спиртовка, пробиркодержатель, химический стакан, воронка, фильтр, фарфоровая чашка, стеклянная палочка.
Реактивы: оксид меди (II), серная кислота.
План работы.
-
Получение медного купороса.
-
Возьмите шпателем 1/2 см2 (с горошину) порошка оксида меди (II) и аккуратно поместите его в пробирку.
-
Налейте в пробирку с оксидом меди (II) 4-5 мл раствора серной кислоты.
-
Нагрейте осторожно смесь в течение 1 минуты. Раствор не кипятить!
-
Прекратите нагревание, как только раствор станет однородным. Обратите внимание на цвет раствора. Дайте раствору остыть.
-
Получение кристаллов медного купороса.
-
Налейте в химический стакан 1/4 пробирки воды и слейте туда остуженный раствор медного купороса.
-
Профильтруйте полученный раствор.
-
Перелейте полученный фильтрат в фарфоровую чашку и выпаривайте до появления первых кристалликов соли. Дальнейшая кристаллизация соли происходит при остывании раствора.
-
Оформите отчёт о работе в тетрадях для практических работ.
-
Оборудование, реактивы
Зарисовка опытов
Наблюдения
Уравнение реакции
(нагревание смеси оксида меди и серной кислоты)
(выпаривание раствора медного купороса)
Выполните задание.
Какие реакции вы могли бы провести, чтобы исходя из оксида меди (II) и других реактивов (каких?), получить:
а) металл;
б) соль бескислородной кислоты?
Составьте необходимые уравнения химических реакций.
Инструктивная карточка №7.
Практическая работа: Приготовление растворов солей с определённой массовой долей растворённого вещества.
Цель работы: научиться готовить растворы с определённой массовой долей растворённого вещества; производить необходимые расчёты, используя расчётную формулу для определения массовой доли растворённого вещества.
Оборудование: электронные весы, химический стакан, мерный цилиндр,
ложечка для сыпучих веществ, стеклянная палочка, колба под приготовленный раствор.
Реактивы: хлорид натрия (NaCl) - кристаллический.
Пример решения задачи
Вычислите массы соли и воды, которые потребуются для приготовления 50 г раствора хлорида натрия, содержащего 0,1 массовой доли соли.

План работы.
-
Решите задачу.
Рассчитайте, какую массу хлорида натрия и какой объём воды надо взять для приготовления 50 г 5%-ного раствора хлорида натрия
(см. пример решения задачи).
-
Вычислите, сколько соли и воды потребуется для приготовления указанного раствора с заданной массовой долей.
-
Взвесьте на электронных весах соль. Соль поместите в колбу.
Жидкости на весах не взвешивают!
-
Отмерьте требуемый объём воды, используя мерный цилиндр.
-
Влейте её в колбу с солью.
-
Перемешайте содержимое колбы стеклянной палочкой до полного растворения соли.
-
Оформите результаты работы.
Примерный образец оформления результатов работы.
Какие массы гидрокарбоната натрия и воды надо взять, чтобы приготовить раствор массой 50 г с массовой долей соли 10%? Где используют данный раствор?
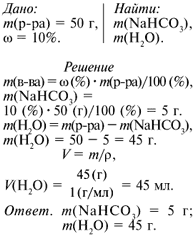

Взвешиваю 5 г гидрокарбоната натрия и помещаю в химический стакан вместимостью 50 мл (или 100 мл). Добавляю воды до метки 50 мл. Вещество растворяется. Для его полного растворения перемешиваю раствор стеклянной палочкой. Получила 10%-й раствор NaHCO3. Переливаю раствор в склянку с этикеткой.
Полученный раствор используют для обработки кожного покрова в случае попадания на него кислоты.
*Добавьте к полученному раствору 150 г воды. Рассчитайте концентрацию нового раствора. Запишите в тетрадь необходимые расчёты. Сделайте вывод, как измениться массовая доля растворённого вещества.
Инструктивная карточка №8.
Практическая работа: Решение экспериментальных задач по теме «Обобщение сведений в важнейших классах неорганических соединений».
Цель работы: применить знания о свойствах основных классов неорганических соединений при экспериментальном решении задач.
Оборудование: пробирки, стеклянные палочки.
Реактивы: оксид кальция, оксид меди (II), соляная кислота, гидроксид калия, железный гвоздь, гидроксид меди (II), медь, железо, древесные опилки, фенолфталеин, лакмус, серная кислота, магний, оксид магния.
План работы.
Вам впервые предоставляется возможность решать химические задачи экспериментально. На этом уроке вы должны проявить свою самостоятельность: составить план решения задачи, определить перечень необходимых для этого реактивов и оборудования, реализовать свой план и составить отчет о проделанной работе.
Соблюдайте требования безопасности во время работы.
-
Необходимо соблюдать чистоту, тишину и порядок на рабочем месте.
-
В процессе работы необходимо следить, чтобы вещества не попадали на кожу лица и рук.
-
Никакие вещества в кабинете химии нельзя пробовать на вкус! Нюхать вещества можно, лишь осторожно направляя на себя их пары или газы лёгким движением руки, а не наклоняясь к сосуду и не вдыхая полной грудью.
-
Опыты проводить только в чистой посуде.
-
Склянки с веществами или растворами необходимо брать одной рукой за горлышко, а другой снизу поддерживать за дно.
-
Растворы необходимо наливать из сосудов так, чтобы при наклоне этикетка оказывалась сверху. Каплю оставшуюся на горлышке сосуда, снимают верхним краем той посуды, куда наливается жидкость.
Особенностью экспериментального решения задач является то, что для опыта берут не все вещество, а часть, т. е. отливают или отсыпают порцию (пробу) примерно 1 см3.
При распознавании веществ, при проведении нескольких разных опытов с одним веществом или при решении задачи разными способами берут несколько проб. Чтобы их не перепутать, необходимо ставить пробирки с растворами одну за другой в штатив для пробирок.
Каждому из Вас за время работы необходимо решить любых 4 задачи из 5-ти предложенных.
Задача 1
Вариант I. В двух склянках без этикеток находятся порошки: в одной - оксид кальция, в другой - оксид меди(II).
Как различить эти вещества, не проводя химических опытов?
Как химическими опытами подтвердить наличие в склянках именно этих веществ?
Вариант II. В двух склянках без этикеток находятся растворы: в одной - соляной кислоты, в другой - гидроксида калия.
Как опытным путем определить, в какой склянке находится каждое из веществ?
Задача 2
Вариант I. Очистите химическим способом железный гвоздь от ржавчины, считая, что в состав ржавчины входят оксид железа(III) и гидроксид железа(III).
Вариант II. Химическим способом отмойте пробирку, загрязненную на практическом занятии гидроксидом меди(II).
Задача 3
Вариант I. Разделите любым способом выданную вам смесь медных и железных опилок.
Вариант II. Разделите выданную вам смесь железных и древесных опилок, на основе их физических свойств.
Задача 4
Вариант I. После практической работы остался розовый раствор. Лаборант предполагает, что это раствор лакмуса в кислой среде. Проведите несколько опытов для проверки этого предположения.
Вариант II. В склянке без этикетки находится бесцветный раствор. Предполагают, что это раствор фенолфталеина. Проведите опыт, подтверждающий или опровергающий это предположение.
Задача 5
Вариант I. Из имеющихся на столе реактивов получите несколькими способами сульфат меди(II).
Вариант II. В вашем распоряжении есть магний, оксид магния, гидроксид магния, соляная кислота. Сколькими способами вы сможете получить хлорид магния, используя эти реактивы? Подберите необходимое для эксперимента оборудование и получите хлорид магния.
Отчёт о проделанной работе представьте в виде таблицы:
№ задачи
Что делаю
Наблюдения
Уравнения реакций
Вывод
По программе 8 класса в теме «Основные химические понятия» предусмотрено проведение 3-х лабораторных опытов:
-
ознакомление с образцами простых и сложных веществ;
-
разложение гидрокарбоната меди (малахита) или карбоната аммония;
-
замещение меди (II) в растворе железом или цинком.
Лабораторная работа №1.
Ознакомление с образцами простых и сложных веществ.
Цель: изучить физические свойства простых и сложных веществ. Оборудование: пробирки, стеклянные палочки, шкала Мооса, таблица температур кипения и плавления веществ (справочные материалы).
Коллекция простых и сложных веществ: железо, медная проволока, алюминиевая фольга, сера, уголь, медный купорос, пищевая соль, малахит.
План работы:
-
Изучите физические свойства выданных веществ по плану:
-
Агрегатное состояние вещества (твёрдое, жидкое, газообразное) при комнатной температуре.
-
Цвет.
-
Запах вещества (для определения запаха не подносите сосуд близко к лицу, так как вдыхание газов и паров веществ может вызвать раздражение дыхательных путей). Для определения запаха достаточно ладонью руки сделать движение от отверстия сосуда к носу.
-
Твёрдость - определяется по шкале Мооса (приложение 1).
-
Плотность (справочные материалы).
-
Температуры плавления и кипения (справочные материалы).
-
Растворимость вещества в воде.
В пробирку помещается небольшое количество вещества (одна неполная ложечка) и приливается 8-10 мл воды. Содержимое пробирки необходимо осторожно перемешать. При перемешивании веществ нельзя встряхивать пробирку.
-
Составьте отчёт о проделанной работе, заполнив таблицу:
-
Название вещества
Физические свойства
Агре-
гатное состояние
Цвет
Запах
Твёр-дость
Плот-
ность
Температура
Раство-
римость
в воде
Т к.
Тпл.
железо
медь
алюминий
сера
уголь
медный купорос
пищевая соль
малахит
Вывод: (перечислите основные физические свойства вещества)
Лабораторная работа №2.
Разложение гидроксокарбоната меди (малахита).
Цель: научиться определять признаки химической реакции и условия её проведения.
Оборудование: пробирка, пробка с газоотводной трубкой, химический стакан, штатив, спиртовка, спички.
Реактивы: гидроксокарбонат меди (малахит), известковая вода.
План работы:
-
Рассмотрите порошок гидроксокарбоната меди (малахита). Какого он цвета?
-
Положите немного порошка в пробирку (1 см). Разровняйте порошок малахита по пробирке так, чтобы он тонким слоем доходил от дна пробирки до её середины.
-
Закройте пробирку пробкой с газоотводной трубкой. Закрепите пробирку в штативе так, чтобы отверстие пробирки было немного ниже, чем дно пробирки.
-
Налейте в стакан немного известковой воды. Газоотводную трубку от пробирки опустите в стакан с известковой водой.
-
Прогрейте всю пробирку, а потом нагревайте малахит. Внимательно наблюдайте за изменениями, происходящими с малахитом и известковой водой.
-
После прекращения выделения газа, выньте газоотводную трубку из стакана с известковой водой. Прекратите нагревание.
-
Заполните таблицу:
-
Цвет малахита до опыта
Цвет малахита после опыта
Вещество, образовавшееся на стенках пробирки
Газ, образовавшейся в известковой воде
Уравнение реакции
Вывод: (К какому явлению относится разложение малахита и почему?)
*Лабораторный опыт №2 можно провести в виде демонстрации.
Лабораторная работа №3.
Реакция замещение меди в растворе хлорида меди (II) железом.
Цель: закрепить умение определять признаки химической реакции и условия её проведения.
Оборудование: пробирки, штатив для пробирок.
Реактивы: хлорид меди (II), железный гвоздь на ниточке.
План работы:
-
Налейте в две пробирки по 4 мл раствора хлорида меди (II).
-
Осторожно поместите в одну из пробирок железный гвоздь, привязанный на нитке.
-
Через 5 минут извлеките гвоздь из раствора. Обратите внимание на происходящие изменения.
-
Опишите цвет образовавшегося раствора и сравните его с цветом раствора исходного вещества.
-
Заполните таблицу.
Цвет хлорида меди (II) до опыта
Цвет хлорида меди (II) после опыта
Изменения, происходящие с железным гвоздём.
Уравнение реакции.
Вывод: (почему проведённую реакцию относят к типу реакций замещения?)
Приложение.
Определение твёрдости вещества по шкале Мооса.
Шкала твёрдости была разработана австрийским минералогом Фредериком Моосом в 1820 г. Для измерения твёрдости минералов. В основу её положено определение твёрдости как сопротивления, оказываемого минералом при его царапании. В качестве эталонных, с помощью которых определяют относительную твёрдость, выбрано 10 распространённых минералов, расположенных в порядке возрастания их твёрдости:
-
тальк (1);
-
гипс (2);
-
кальцит (3);
-
флюорит (4);
-
апатит (5);
-
ортоклаз (6);
-
кварц (7);
-
топаз (8);
-
корунд (9);
-
алмаз (10).
Минерал меньшей твёрдости царапается последующим минералом, обладающим большей твёрдостью.
Твёрдость любого испытываемого материала характеризуется по его сопротивлению царапанию этими минералами. Например, минерал царапает минералы 1-6, сам же царапается минералами 7-10, следовательно, твёрдость его между 6-7.
Помимо эталонных минералов можно использовать и другие индикаторы твёрдости. Вещества, имеющие твёрдость меньше 1, жирные на ощупь. Вещества с твёрдостью меньше 2 царапаются ногтём, с твёрдостью ниже 5 - ножом, с твёрдостью ниже 6 - оконным стеклом, вещества с твёрдостью выше 8 царапают стекло, выше 9 - режут стекло.
Литература
-
Ахмедова Т.И., Фандо Р.А. Начало экспериментальной химии.
М., 2006
2. Габриелян О.С., Яшукова А.В. Тетрадь для лабораторных и
практических работ. М., 2006
3. Зуева М.В., Гара Н.Н. Школьный практикум. М., 1999
4. Чертков И.Н., Жуков П.Н. Химический эксперимент с малыми
Количествами реактивов. М., 1989