- Учителю
- Урок по химии для 9 класса на тему Щелочные металлы
Урок по химии для 9 класса на тему Щелочные металлы
Щелочные металлы
Цель урока:
Дать общую характеристику щелочных металлов.
Задачи:
Обучающая:
Продолжить развитие умения характеризовать химические элементы на основе их положения в периодической таблице; составлять уравнения реакций. Познакомить учащихся с применением соединений 1 группы главной подгруппы в быту и
на производстве.
Развивающая:
Способствовать совершенствованию навыков самостоятельной работы; развивать логическое мышление учащихся, памяти, химического языка, а также умение самостоятельно делать выводы; развивать монологическую речь.
Воспитывающая:
Способствовать развитию познавательного интереса к предмету, расширению кругозора учащихся. Воспитывать культуру умственного труда, культуру общения.
Тип урока:
Урок изучения нового материала.
Методы:
-
По источнику передачи и восприятия информации:
А) словесные (рассказ, беседа, объяснение);
Б) наглядные (наблюдение опыта, использование таблиц: периодическая
система Д.И. Менделеева, сравнительная характеристика щелочных металлов).
2. По степени самостоятельности мышления учащихся:
А) репродуктивный (объяснительно - иллюстративный);
Б) продуктивный (частично - поисковый).
3. По характеру управления учебной работой:
А) под руководством учителя;
Б) самостоятельная работа.
4. По стимулированию интереса к учению - создание ситуации занимательности.
5. Методы контроля:
А) самоконтроль;
Б) контроль учителя.
Средства обучения:
1) Учебно - технические (мультимедийное оборудование)
2) Дидактико - методические (карточки - задания)
Форма организации учебной работы: фронтальная, индивидуальная, парная.
Хронометраж:
-
Оргмомент-(1 мин)
-
Актуализация знаний -(2мин)
-
Целеполагание - (2мин)
4. Изучение нового материала- (25 мин)
5. Закрепление -(7 мин)
6. Подведение итогов занятия и выставление оценок -(3 мин)
Содержание
и ход урока
Обоснование деятельности учителя
Прогнозирование деятельности учащихся
-
Оргмомент.
Учитель приветствует учеников, отмечает отсутствующих, оценивает готовность учащихся к уроку.
-
Актуализация знаний.
У каждого из нас есть свой адрес: это улица, дом, квартира. У химических элементов то же есть свой «дом».
Как он называется? (периодическая таблица химических элементов Д.И. Менделеева).
Какие адреса имеют химические элементы? (группу, подгруппу, период).
Какой номер квартиры у каждого из них? (порядковый номер).
3. Целеполагание.
Сегодня мы познакомимся с удивительными жильцами этого большого дома.
По цвету серебристо - белые
Ножом разрежутся металлы
И мягкие и легкие. Вывод сделаем
Такого раньше не встречали мы.
Итак, тема сегодняшнего урока «Щелочные металлы».
Сейчас мы отправляемся в путешествие, чтобы лучше познакомиться с химическими элементами. Для этого нам понадобится маршрутная карта (у учителя заранее заготовленная на доске, а у каждого ребенка свой маршрутный лист. Сегодня мы побываем на следующих станциях: («Происхождение элемента», «Степень окисления» «Физические свойства», «Химические свойства», «Значение»). Каждая их этих станций поможет нам раскрыть особенности щелочных металлов таким образом, что некоторые поделятся с нами новым материалом, на других мы будем самостоятельно выполнять задания.
4. Изучение нового материала.
С танция №
1.
танция №
1.
«Открытие элемента».
Слово учителя:
Щелочные металлы располагаются в 1 группе главной подгруппе. Это литий, натрий, калий, рубидий, цезий, франций.
А называются они так потому, что при взаимодействии с водой они превращаются в щелочи - хорошо растворимые, сильные основания. Потассий и Содий , а современное название натрий и калий - это «дети» английского химика Гемфри Дэви, полученным им в 1807 году. Открытие было призвано выдающимся. Десять лет спустя в 1817 году шведский химик Ю.А. Арфведсон обнаружил литий, «литос» в переводе с греческого означал камень. Чрезвычайно редкие щелочные металлы рубидий и цезий(в старину это слово употребляли для обозначения голубизны верхней части небосвода) удалось открыть только через 30 с лишним лет после смерти Г.Дэви. В 1861 году это сделали немецкие химики Роберт Бунзен и Густав Кирхгоф. Последний из щелочных металлов был обнаружен в 1939 г. Маргаритой Пере и назван исследовательницей в честь ее родины францием. Этот радиоактивный элемент никогда не получали в количествах, достаточных для того, чтобы увидеть невооруженным глазом. В целом не Земле имеется менее килограмма этого элемента, поэтому о Франции даже ученые могут рассказать не очень много.
Итак, теперь мы знаем, как и кем были открыты щелочные металлы, давайте выясним, какова систематика этих элементов. Переходим на станцию №2.
С танция
№2
танция
№2
«Положение элемента в периодической таблице Д.И. Менделеева».
Перед вами стоит следующая задача:
Определить местоположение элемента в периодической таблице Д.И. Менделеева по следующему плану.
-
Заряд ядра
-
Количество электронов
-
Распределение электронов по уровням.
Давайте вспомним, чему равняется заряд ядра? Количество электронов и число уровней?
Делаете задание самостоятельно, используя таблицу Д.И. Менделеева, а
к доске по очереди, начиная с первого ряда, выходят ученики. Задание сразу проверяется.
Знания, полученные на этой станции, помогут ответить на вопросы следующей станции. Таким образом, мы уже с вами оказались на станции №3
Настроить учащихся на рабочий ритм урока.
Обеспечить комфортную обстановку на уроке, снять напряжение, активизировать познавательную деятельность учащихся.
Подготовить к постановке цели урока.
Постановка темы урока способствует положительному настрою на работу.
Ученики должны осознать, что именно им придется изучить и освоить, какова основная задача предстоящей работы.
Активизировать познавательную деятельность учащихся.
Использовать репродуктивный метод, с целью формирования умения давать характеристику элемента.
Осуществить обратную связь с учащимися с целью корректировки неточности в усвоении понятий.
Готовность класса к уроку.
Вспоминают необходимые знания, используя ранее изученный материал.
Анализируют сказанное, делают свои предположения.
Создается ясная и четкая перспектива работы. Учащиеся принимают учебную задачу.
На этом этапе реализуются образовательная задача. Учащиеся узнают новые факты, связанные с открытием щелочных металлов.
Внимательно слушают, анализируют, запоминают.


от греч. литос - камень

от араб. натрун - сода

От араб. алкали - щелочь
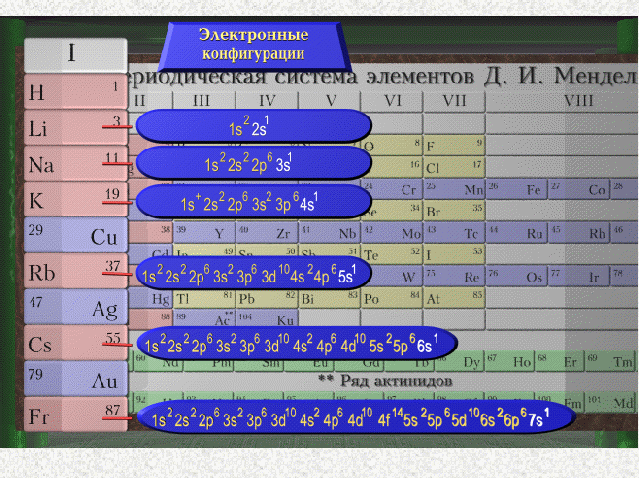
Отрабатывают навыки работы с периодической таблицей Д.И. Менделеева
Самоконтроль учащихся.
Станция №3
«Степень окисления элемента»
Давайте посмотрим на внешний энергетический уровень этих элементов Сколько электронов содержится там?(1). Как вы думаете, щелочным металлам легче отдать 1 электрон до завершения внешнего уровня или присоединить 7? (отдать 1 электрон). А раз так, то значит эти элементы являются продолжите - сильными восстановителями. Металлические свойства сверху вниз - усиливаются. Какова же степень окисления этих элементов ? (+1, она равна номеру группы). Из всего выше сказанного следует, что элементы обладают высокой химической активностью.
С танция
№4
танция
№4
«Физические свойства».
Высокая химическая активность щелочных металлов требует особой осторожности при их хранении и применении. В лабораторных условиях литий, натрий, калий обычно хранятся под слоем керосина, защищающего их от контакта с воздушной средой. Рубидий и цезий не используют в лабораториях: это весьма редкие и дорогие вещества; их чрезвычайно высокая химическая активность усложняет работу с ними. Поверхность всех щелочных металлов покрыта пленкой. Эти пленки пористые и рыхлые, именно поэтому они не защищают металлы от дальнейшего окисления. Щелочные металлы серебристо - белые, мягкие, легкие и легкоплавкие. Давайте посмотрим на сравнительную характеристику этих элементов: что вы скажете об их плотности, температуре кипения и температуре плавления? ( с увеличение порядкового номера их плотность возрастает, а температура кипения и температура плавления уменьшаются. Давайте посмотрим, что же представляют из себя эти металлы. (на экране физические свойства)
Теперь постараемся выяснить способность щелочных металлов вступать в химические реакции. Переходим на станцию №5.
С танция №
5
танция №
5
«Химические свойства»
Щелочные металлы способны вступать во взаимодействие с 1)неметаллами 2)водой 3)кислотами (хотя уравнения реакций обычно не пишут, так как щелочные
металлы реагируют как с молекулами воды, так и с молекулами кислоты).
Натрий и калий реагируют с водой, образуя пероксиды.
Давайте составим генетический ряд металлов 1 группы. (Ме-Ме2О-МеОН)
А теперь вспомним типичные свойства основных оксидов и оснований.
Вопрос:
Что получается при взаимодействии
1.основного оксида с водой?
2.основного оксида с кислотным оксидом?
3.основного оксида с кислотой ?
4.основания с кислотой?
5.основания с солью?
7.основания с кислотным оксидом?
К доске идет 1 человек, а все остальные учатся составлять самостоятельно в тетради с дальнейшей проверкой. Мы с вами выяснили физические, химические свойства щелочных металлов, их систематическое положение. Возникает вопрос:
а каково значение их в жизни человека? Чтобы это выяснить, мы переходим на станцию № 6.
С танция №
6
танция №
6
«Значение».
Не сразу в дом пришел металл,
Не сразу ложкой, вилкой стал.
Не сразу стал он кружкой и заводской игрушкой.
Был путь металла долог:
Сперва пришел геолог.
Нашел он гору - в ней руда.
И горняки пришли туда.
И машинист дает гудок -
К печам руду доставит в срок.
И металлический ручей
Течет из огненных печей.
Еще в работе не конец:
Придут и токарь, и кузнец,
Слесарь и штамповщик,
Сварщик, фрезеровщик.
И каждый вложит труд в металл,
Чтобы металл трудиться стал.
Он в проводах несет нам свеи,
Металл - коньки, велосипед,
Метро, трамвай, будильник,
Утюг и холодильник.
Посмотрите внимательно на лист (области применения щелочных металлов). Давайте ответим на вопрос:
где же нашли применение металлы?
(производство мыла, бумаги, применение в медицине, производство искусственных волокон, синтез органических и неорганических веществ.
-
Закрепление
Давайте попробуем вспомнить все, что было сказано на уроке и выполнить задание.
(у каждого ученика карточка с заданием, работа на 2 варианта).
Давайте проверим то, что вы написали. Поменяйтесь своим вариантом с соседом и проверьте правильность написания работы (на обратной стороне доски готовые задания, с помощью которых учащиеся сверяют написанное). Поставьте 5 баллов, если ни одной ошибки в работе, 4 балла - 1 ошибка, 3 балла - 2 ошибки, 2 балла - 3 ошибки.
-
Подведение итогов занятия. Выставление оценок.
Загляните внимательно к себе в тетрадь. У вас получился небольшой опорный конспект. Давайте теперь вспомним тему нашего урока. Скажите:
-
Что вам было интересно на уроке?
-
С какими трудностями столкнулись?
-
Имеют ли для вас знания полученные на уроке?
Спасибо за урок.
Развить у учащихся логическое мышление (на основе причинно - следственной связи) путем создание проблемной ситуации.
Обратить внимание учащихся к уже имеющимся знаниям.
Подготовить учащихся к формулировке вывода путем наводящих вопросов.
Дать возможность сформулировать ответ наилучшим образом.
Подкрепить эмоциональный настрой учащихся, который способствует дальнейшему выполнению заданий.
Способствовать дальнейшему развитию функций анализа, обобщения.
Осуществить обратную связь с учащимися с целью корректировки неточности в усвоении понятий.
Усилить эмоциональный аспект при изучении химии.
Повысить мотивацию у учащихся к изучению химии. Показать возможность использования полученных знаний на уроке в жизни.
Познакомить с областями применения щелочных металлов.
Способствовать развитию функций обобщения.
Снизить эмоциональное напряжение, дать возможность сосредоточиться на выполнение задания.
Осуществить обратную связь с учащимися с целью корректировки понятий.
Продолжить развивать умения составлять уравнения химических реакций
Придать логическую завершенность работе на уроке с помощью обращения детей к теме, поднятой в начале урока. Выявить степень усвоения учащимися материала на уроке.
Выставление оценок учащимся, активно работавшим на уроке.
Анализируют предложенную работу. Формируется навык построения доказательных рассуждений.
Научить применять теоретические знания при выполнении заданий.
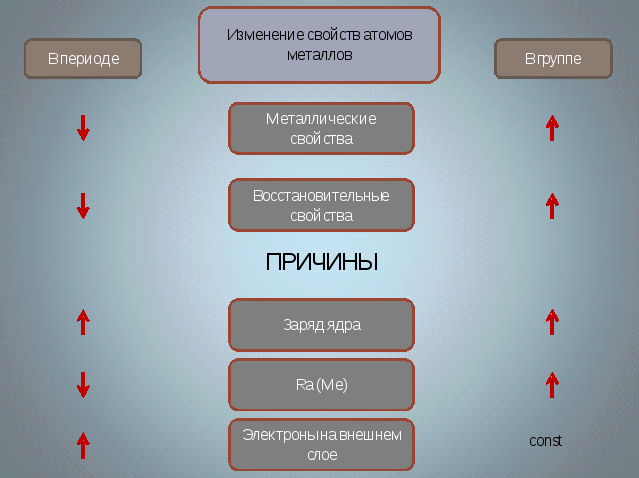



Анализируют задание, делают самостоятельно выводы.
Добавляя новые факты, у учащихся поддерживается интерес к обучению.
Наблюдают, анализируют увиденное на экране, закрепляют материал в памяти.
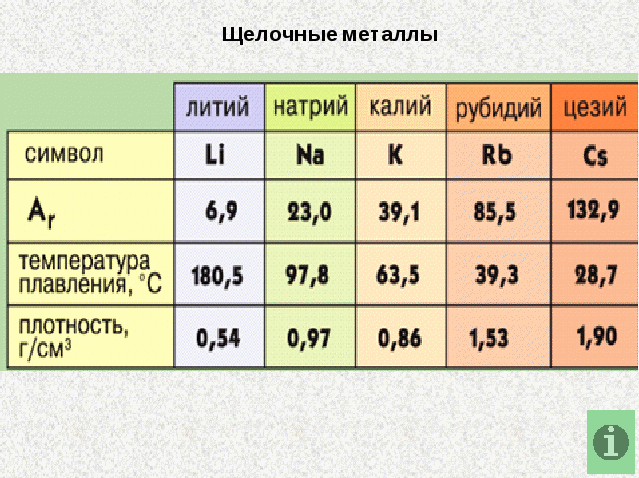

Вспоминают необходимые сведения, составляют внутренний план действий.
Во время устных ответов учащиеся внимательно слушают друг друга, дополняют ответы, развивая тем самым монологическую речь.
Припоминают необходимые сведения, которые помогут в дальнейшем написать уравнения химических реакций.
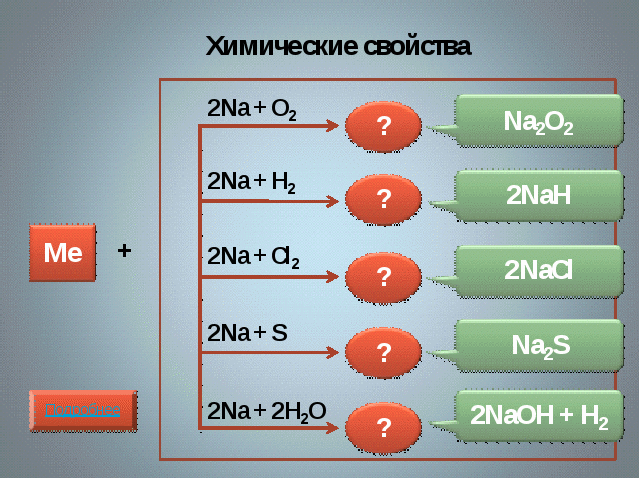
Ребята оценивают работу своих товарищей, осознают значимость урока.
Проет урока
«Щелочные металлы»
11