- Учителю
- Разработка урока'Окислительно-восстановительные свойства соединений неметаллов на примере соединений серы' (5 класс)
Разработка урока'Окислительно-восстановительные свойства соединений неметаллов на примере соединений серы' (5 класс)








МБОУ «Яковлевская средняя общеобразовательная школа»
Открытый урок
Окислительно-восстановительные свойства соединений неметаллов на примере соединений серы
(для 11 класса)
Разработала и провела
в методический день
учитель химии высшей
квалификационной категории
Галлямова В. М.
Яковлево, 18 февраля 2015 года
Неметаллы
Тема: окислительно-восстановительные свойства соединений неметаллов на примере соединений серы
Цель: познакомить с особыми свойствами соединений серы
Задачи:
- совершенствование умений классифицировать химические реакции по химическим свойствам, выявлять суть окислительно-восстановительных процессов
- дальнейшее формирование практических навыков, безопасного обращения с веществами и лабораторным оборудованием
- развитие умений анализа и синтеза, классифицировать
Вид урока
Урок изучения нового материала
Методы обучения
-проблемно - поисковый
-экспериментальный
-наглядный
Формы организации познавательной деятельности
-индивидуальная
-парная
Формы контроля
- устный опрос
- письменный опрос
- самопроверка
- взаимопроверка
- лабораторный
Оборудование:
- интерактивная доска, мультимедийный компьютер
-папки с таблицами растворимости, электроотрицательности
-карточки с заданиями
- оборудование: пробирки, наборы реактивов, темные палочки, пробки к пробиркам, прибор для сжигания веществ
- реактивы: Na2S, Na2S2О3, НCl, Н2SO4, K2SO4, CuSO4, FeS, MnSO4, ZnSO4, KMnO4, KI(к), S
Организационный момент, вопросы, возникшие при выполнении домашнего задания?
Актуализация знаний, тема и цели урока
Индивидуальное задание: зарисовать энергетическую диаграмму атома серы, валентные возможности, степени окисления.
-Что общего у этих веществ? (Все они содержат атомы серы)
Na2S, Na2S2О3, Н2SO4, K2SO4, Н2SO3, CuSO4, SO2, Н2S, MnSO4, К2S, ZnSO3, SO3, Cu2S, FeS2 (Все они содержат атомы серы)
Как вы думаете, какова тема сегодняшнего урока? (Соединения серы)
- Разделите данные вещества на группы (Соли, оксиды, кислоты)
- Можно ли разделить кислоты на группы? Какие?
- А оксиды?
- А соли?
Изучение нового материала
Можем ли предложить другую классификацию? Какие затруднения испытали? (Na2S2О3, FeS2)
- Проставьте степени окисления серы во всех соединениях.
- На какие группы можем разделить все эти вещества? (На соединения со степенью окисления -2, +2, +4, +6)
Таким образом, сегодня мы в основном будем говорить о соединениях серы с различными степенями окисления. Начнем с соединений серы со степенью окисления -2.
- К ним относятся … .
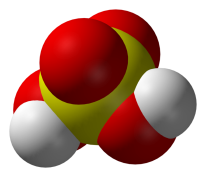
Охарактеризуйте строение и свойства имеет сероводород? (Демонстрация опыта с получением сероводорода) (Газ с запахом тухлых яиц, ядовит)
- Какое строение имеет? (Молекулярное)
- Почему газ, ведь вода - жидкость? (В воде между молекулами воды существуют водородные связи, в сероводороде их нет)
- Растворяется ли сероводород в воде? Что случиться, если сероводород растворить в воде? (Кислота)
- Какая это кислота? (Слабая)
- Какие соли она образует? (Сульфиды, гидросульфиды)
- Как можно обнаружить сульфиды в растворе? (По полученным осадкам)
-Проведите реакции с получением осадков с сульфидом натрия (Какие осадки получили, какого цвета?)
- К какому типу химических реакций относятся эти реакции (К ионным)
Сделаем вывод: реактивами для обнаружения сульфидов могут служить…,…,… .
А теперь, подумаем какое строение имеет пирит FeS2, который служит сырьем для получения серной кислоты?
Оказывается атомы серы, как и атомы углерода способны соединяться друг с другом, образуя полисульфиды.

Полисульфиды - многосернистые соединения общей формулы Me2Sn, например, полисульфид (NH4)2Sn. В структуре этих соединений имеются (димерные/полимерные) цепи атомов -S-S(n)-S-.
Выполним №5 с на с. 56
2KMnO4 + 5 Н2S = 5 S0 + 2MnO2 + 2KOH + 4 H2O
Mn+7 + 5е → Mn+2 2
S-2 - 2 е → S0 5
Давайте сделаем вывод: чем будут являться соединения серы в степени окисления -2 (Восстановителем)
Перейдем к соединениям серы со степенью окисления +6.
- Как вы думаете, они химических процессах будут окислителями или восстановителями? Почему? Окислителями, т.к. могут только забирать электроны)
Рассмотрим строение и свойства триоксида серы:

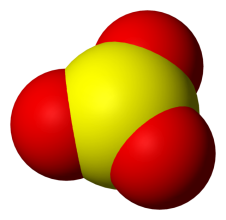
- Какое строение имеет?
Запишем физические свойства: жидкость, при 16° превращается в прозрачные кристаллы состава S3O9 (с. 61)
Выполним № 12 с. 63 (с сероводородом)
SO3 + Н2S = SО2 + H2O
S+6 + 2 е → S+4
S-2 - 2 е → S+4
Мы доказали, что триоксид серы яляется окислителем.
Что произойдет при растворении триоксида серы в воде?
Запишите уравнение реакции.
SO3 + Н2О = H2SО4
Тип реакции? (Кислотно-основная реакция)
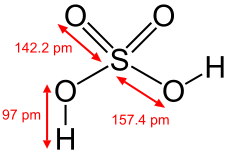
Значит, следующим веществом со степнью окисления +6 являются серная кислота и ее соли. Свойства серной кислоты: бесцветная маслообразная жидкость, весьма гигроскопичная, неограниченно смешивается c водой (раствор сильно разогревается), в водном растворе - сильная кислота, при нагревании выше 296 °C начинает разлагаться на SO3 и Н2О. Таким образом, мы уравнении реакции можем вместо равно поставить стрелки в противоположных направлениях.
Вызывает ожоги кожи.
А вы знаете, что серная кислота неограниченно растворяет триоксид серы?

О О О О
׀׀ ׀׀ ׀׀ ׀׀
Н-О-S- О- S- О- S- О- S-О-Н
׀׀ ׀׀ ׀׀ ׀׀
О О О О
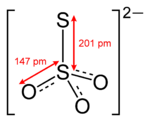
Запишите посередине формулу серной кислоты, проведите две стрелки, запишите какие соли образует серная кислота.
Мы изучали особые свойства серной кислоты в 9 классы. Сегодня проведем реакцию, которую не выполняли. Выполним практически № 10 с. 69 (3 у доски)
5H2S+6О4 + 8KI- = 4K2SО4 + 4I20 + H2S-2 +4H2O
S+6 + 8 е → S-2
2 I- - 2 е → I20 4
2H2S+6О4 + 2KI = K2SО4 + I20 + SO2 +2H2O
S+6 + 2 е → S+4
2 I- - 2 е → I20
4H2S+6О4 + 6KI = 3K2SО4 + 3I20 + S +4H2O
S+6 + 6 е → S0
2 I- - 2 е → I20 3
Вывод: соединения серы со степенью окисления +6 являются окислителями.
А как вы думаете, окислительные или восстановительные свойства будут проявлять соединения серы со степенью окисления +4? (В зависимости от условий и окислителями и восстановителями)
- Например, сернистый газ при реакции с сернистый газ будет …?
Демонстрация: проедем реакцию.
- При сжигании серы образуется сернистый газ. Запишите реакцию
S0 + О2 = SO2
При растворении газа в растворе перманганата калия получаем …?
SO2+ H2O = Н2SО3
Таким образом, с марганцовкой могут реагировать как SO2, так и Н2SО3
2KMn+7O4 + 5 S+4O2 + 2H2O = 2Mn+2S+6O4 + 2Н2S+6О4 + K2S+6O4
Mn+7 + 5е → Mn+2 2
S+4 - 2 е → S+6 5
2KMnO4 + 5Н2S+4 О3 = 2Mn+2S+6O4 + 2Н2S+6О4 + K2S+6O4 + 3H2O
Mn+7 + 5е → Mn+2 2
S+4 - 2 е → S+6 5
Мы сегодня встретились еще с одной степенью окисления серы +2. Каким веществом является тиосульфат?
Проведем реакцию тиосульфата с соляной кислотой.
Na2S+2 2О3 + 2НCl= S0+ 2NaCl + S+4O2 + H2O
S+2 - 2 е → S+4
S+2 +2 е → S0
Оказывается строение тиосульфат - иона похоже настроение сульфата, но один атом кислорода заменен на ион серы, т.е. атомы серы в сульфат- ионе имеют разные степени окисления, а степень окисления +2 - это среднее значение 2-х степеней окисления.
Подведение итогов урока
Какими свойствами обладают соединения серы? (Кислотно-основными, окислительно-восстановительными)
Какое основное правило необходимо знать при записи окислительно-восстановительных реакций? (Окислители реагируют с восстановителями)
Рефлексия
Оцените свою работу на уроке, поставив общую оценку за весь урок. Почему?
Домашнее задание: просмотреть § 8-10, задания 10 с. 57, 8 с. 63
Литература
1.Кузнецова ЛМ. Химия. 10 класс: учеб. для общеобразоват. учреждений/Л.М. Кузнецова.- 2-е изд.- М.: Мнемозина, 2007.- 279 с.
2.
3. hhttp://ido.tsu.ru/schools/chem/