- Учителю
- Ферменты – биологические катализаторы.
Ферменты – биологические катализаторы.
18
Оглавление
Введение………………………………………………………………………….2
Основная часть.
Глава 1. Что такое ферменты?
1.1. Ферменты - биологические катализаторы…….…………………….2-3
1.2. Типы ферментов……………………………………………………..…3
1.3. Структура ферментов………………………………………………..…3
1.4. Специфичность ферментов и условия их активности...………….… 4
Глава 2. Значение ферментов в живых организмах.
2.1. Роль ферментов в организме ……………………………………......4-5
2.2. Местонахождение ферментов в
организме..........................................5
Глава 3. Исследовательская работа.
3.1. Химические результаты исследования ………………………..........5-6
3.2. Механизм работы ферментов………….………………………………6
3.3. Исследовательский опрос…………………………………………....6-7
Глава 4. Заключение.
4.1. Получение ферментов………………………………………………. 7-9
4.2 Болезни и ферменты . …………………………..……………………9-10
4.3. Медицинское значение ферментов…………….……………….……10
4.4. Применение ферментов……………………………………………10-12
Библиографический список.……………………………………………………………………… 12
Приложения…………………………………………………………………13-16
Введение.
Актуальность: Известно, ферменты играют важнейшую роль в регуляции химических превращений обмена веществ. Ферменты обнаружены у всех живых существ, начиная от самых примитивных микроорганизмов. Получено около 600 ферментов. Ферменты способны управлять сложнейшими процессами разрушения и сотворения новых веществ в организме. В настоящее время знания о работе ферментов человек поставил себе на службу в медицине, промышленности, сельском хозяйстве и других сферах жизни.
Цель проекта: Провести исследование по обнаружению ферментов в живых организмах, рассмотреть их значение.
Что такое ферменты?
Ферменты - это биологические катализаторы белковой природы, ускоряющие химические реакции в живых организмах и вне их.
Ферменты присутствуют во всех живых клетках и способствуют превращению одних веществ (субстратов) в другие (продукты). Ферменты выступают в роли катализаторов практически во всех биохимических реакциях, протекающих в живых организмах. К 2013 году было описано более 5000 разных ферментов. Они играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ организма.
Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Каждая молекула фермента способна выполнять от нескольких тысяч до нескольких миллионов «операций» в секунду.
Например, одна молекула фермента ренина, содержащегося в слизистой оболочке желудка телёнка, створаживает около 106 молекул казеиногена молока за 10 мин при температуре 37 °C.
При этом эффективность ферментов значительно выше эффективности небелковых катализаторов - ферменты ускоряют реакцию в миллионы и миллиарды раз, небелковые катализаторы - в сотни и тысячи раз.
Типы ферментов
Все ферменты разделяются на три основных группы: амилаза, липаза и
протеаза.
Фермент амилаза необходим для переработки углеводов. Под воздействием амилазы углеводы разрушаются и легко всасываются в кровь. Амилаза присутствует как в слюне, так и в кишечнике. Амилаза тоже бывает разной. Для каждого вида сахаров существует собственный вид этого фермента.
Липаза - это ферменты, которые присутствуют в желудочном соке и вырабатываются поджелудочной железой. Липаза необходима для усвоения организмом жиров.
Протеаза - это группа ферментов, которые присутствуют в желудочном соке и тоже вырабатываются поджелудочной железой. Кроме этого, протеаза присутствует и в кишечнике. Протеаза необходима для расщепления белков.
Структура ферментов
Активность ферментов определяется их трёхмерной структурой.
Как и все белки, ферменты синтезируются в виде
линейной цепочки аминокислот, которая сворачивается определённым
образом. Каждая последовательность аминокислот сворачивается особым
образом, и получающаяся молекула (белковая глобула) обладает
уникальными свойствами. Несколько белковых цепей могут объединяться
в белковый комплекс. Третичная структура белков разрушается при
нагревании или воздействии некоторых химических веществ.
Специфичность ферментов
Ферменты обычно проявляют высокую специфичность по отношению к
своим субстратам (субстратная специфичность). Это достигается
частичной комплементарностью формы, распределения зарядов и
гидрофобных областей на молекуле субстрата и в центре связывания
субстрата на ферменте. Ферменты обычно демонстрируют также высокий
уровень стереоспецифичности (образуют в качестве продукта только
один из возможных стереоизомеров или используют в качестве
субстрата только один стереоизомер), региоселективности (образуют
или разрывают химическую связь только в одном из возможных
положений субстрата) и хемоселективности (катализируют только одну
химическую реакцию из нескольких возможных для данных условий).
Несмотря на общий высокий уровень специфичности, степень
субстратной и реакционной специфичности ферментов может быть
различной. Например, эндопептидаза трипсин разрывает пептидную
связь только после аргинина или лизина, если за ними не следует
пролин, а пепсин гораздо менее специфичен и может разрывать
пептидную связь, следующую за многими аминокислотами.
Влияние условий среды на активность ферментов
Активность ферментов зависит от условий в клетке или организме -
давления, кислотности среды, температуры, концентрации растворённых
солей (ионной силы раствора) и др.
Роль ферментов в организме
Ферменты участвуют в осуществлении всех процессов обмена веществ, в
реализации генетической информации. Переваривание и усвоение
пищевых веществ, синтез и распад белков, нуклеиновых кислот, жиров,
углеводов и других соединений в клетках и тканях всех организмов -
все эти процессы невозможны без участия ферментов. Любое проявление
функций живого организма - дыхание, мышечное сокращение,
нервно-психическая деятельность, размножение и др. - обеспечивается
действием ферментов. Индивидуальные особенности клеток, выполняющих
определенные функции, в значительной мере определяются уникальным
набором ферментов, производство которых генетически
запрограммировано. Отсутствие даже одного фермента или какой-нибудь
его дефект могут привести к серьезным отрицательным последствиям
для организма.
Местонахождение ферментов в организме
В клетке часть ферментов находится в цитоплазме, но в основном
ферменты связаны с определенными клеточными структурами, где и
проявляют свое действие. В ядре, например, находятся ферменты,
ответственные за репликацию - синтез ДНК(ДНК-полимеразы), за ее
транскрипцию - образование РНК (РНК-полимеразы). В митохондриях
присутствуют ферменты, ответственные за накопление энергии, в
лизосомах - большинство гидролитических ферментов, участвующих в
распаде нуклеиновых кислот и белков.
Химические результаты исследования
Нами был проведен опыт по изучению механизма действия ферментов на
примере вареного куриного филе и сырого.
В результате добавления в пробирки с перекисью водорода образцов продуктов животного происхождения наблюдается результат каталитической функции белков. Каталитическая функция белков играет исключительно важную роль для нашего организма. Все биологические катализаторы - ферменты - вещества белковой природы. Их функция заключается в ускорении химической реакции, протекающих в клетке, в десятки и сотни тысяч раз.
1. Активность фермента проявилась в пробирке с живыми тканями и не проявилась в пробирке с мёртвыми тканями, потому что в результате денатурации белка, нарушается структура молекулы фермента, её активность снижается, затем прекращается.
2. Измельчение ткани влияет на активность фермента из-за увеличения площади прикосновения, таким образом скорость протекания реакции увеличивается.
3. Каталаза - фермент, имеющийся практически во всех клетках, разрушает пероксид водорода с невероятной скоростью (более 5-ти миллионов молекул в минуту).
2H2O2 = 2H2O + O2 ↑
Важные отличия ферментов и неорганических катализаторов в том, что реакции с участием неорганических катализаторов протекают, как правило, при высоких давлениях, а ферменты работают при нормальном давлении. Самое главное отличие в том, что скорости реакций, катализируемых ферментами, во много раз больше.
При биологическом окислении в клетках растений и животных ядовитое вещество - перекись водорода, которая под действием ферментов каталазы или пероксиды расщепляется до воды и кислорода.
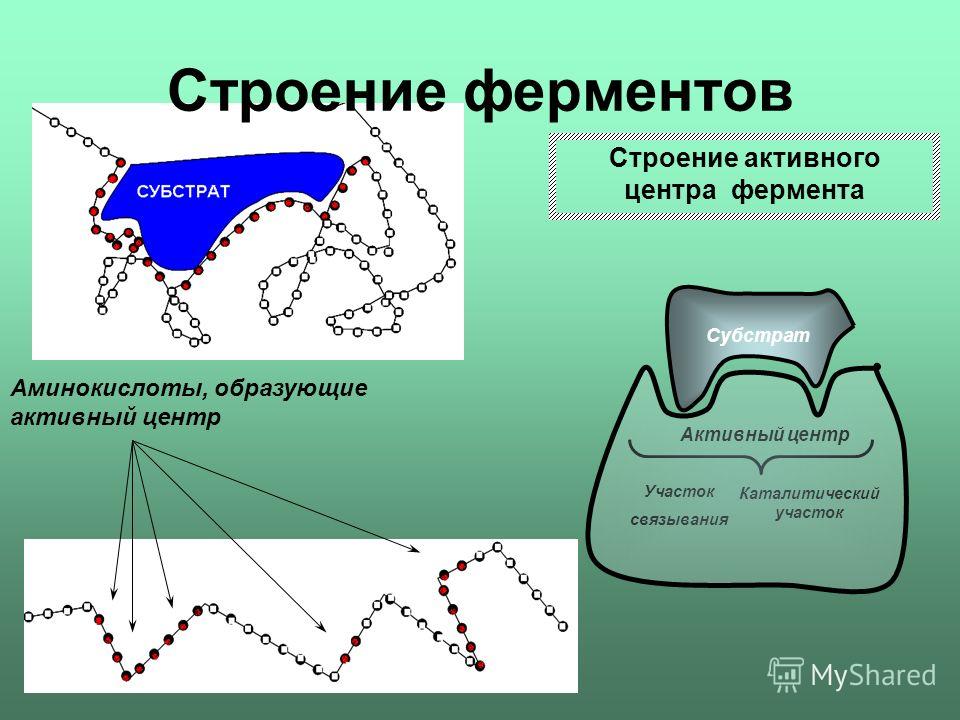
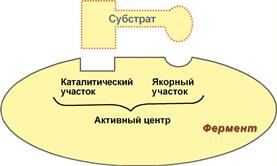
Механизм работы ферментов
Фермент, соединяясь с субстратом, образует фермент - субстратный
комплекс. В таком комплексе шансы на то, что реакция произойдёт,
значительно возрастают. По завершению реакции фермент (субстратный
комплекс) распадается на продукты и фермент. Результаты
исследования показали, что молекулы большинства ферментов во много
раз больше, чем молекулы тех субстратов, которые атакуют данный
фермент, и что в контакте с субстратом находится лишь небольшая
часть молекулы фермента (от 3 до 12 аминокислотных остатков). Эту
часть называют активным центром фермента. Роль остальных
аминокислотных остатков состоит в том, чтобы обеспечить молекуле
фермента правильную глобулярную форму, чтобы активный центр мог
работать наиболее активно.
Исследовательская опрос
Мы провели опрос, среди учащихся МАОУ СШ №55 «Лингвист» по
следующим вопросам:
-
Что такое ферменты?
-
Какова их роль в организме?
-
Что влияет на активность ферментов?
-
Какова химическая природа ферментов?
-
Чьи работы положили начало ферментологии, как самостоятельному разделу биологической химии?
Из 20 человек лишь 3 ответили правильно на все вопросы. 4 и 5 вопросы оказались самыми трудными для ребят.
Ферменты являются посредниками между организмом и окружающей средой, обеспечивают адаптацию организма к изменяющимся условиям (авторегуляторы).
Ферменты участвуют в осуществлении всех процессов обмена веществ, в реализации генетической информации. Переваривание и усвоение пищевых веществ, синтез и распад белков, нуклеиновых кислот, жиров, углеводов и других соединений в клетках и тканях всех организмов - все эти процессы невозможны без участия ферментов. Любое проявление функций живого организма - дыхание, мышечное сокращение, нервно-психическая деятельность, размножение и др. - обеспечивается действием ферментов. Индивидуальные особенности клеток, выполняющих определенные функции, в значительной мере определяются уникальным набором ферментов, производство которых генетически запрограммировано. Отсутствие даже одного фермента или какой-нибудь его дефект могут привести к серьезным отрицательным последствиям для организма.
Получение ферментов
Обычно ферменты выделяют из тканей животных, растений, клеток и
культуральных жидкостей микроорганизмов, биологических жидкостей
(кровь, лимфа и др.). Для получения некоторых труднодоступных
ферментов используются методы генетической инженерии. Из исходных
материалов ферменты экстрагируют солевыми растворами. Затем их
разделяют на фракции, осаждая солями [обычно
(NH4)2SO4] или, реже,
органическими растворителями, и очищают методами гельпроникающей и
ионообменной хроматографии. На заключительных этапах очистки часто
используют методы аффинной хроматографии. Контроль за ходом очистки
ферментов и характеристику чистых препаратов осуществляют, измеряя
каталитическую активность ферментов с применением специфических
(обычно дающих цветные реакции) субстратов. За единицу количества
фермента принимают такое его количество, которое катализирует
превращение 1 мк моля субстрата в 1 мин в стандартных условиях.
Число единиц фермента, отнесенное к 1 мг белка, называется удельной
активностью.
Получение ферментов с помощью микроорганизмов более выгодно, чем из растительных и животных источников. Микробные клетки продуцируют более 2 тысяч ферментов, катализирующих биохимические реакции, связанные с ростом, дыханием и образованием продуктов. Многие из этих ферментов могут быть выделены и проявляют свою активность независимо от клетки. Для получения ферментных препаратов используют как микроскопические грибы, так и бактерии и дрожжи. Иногда получение технического ферментного препарата кончается проведением процесса ферментации, однако активность ферментов в культуральной жидкости быстро снижается. Поэтому широко практикуют получение сухих технических ферментных препаратов.
В мире производится около 20 ферментов в объеме 65 тыс. тонн (а существует, как предполагают 25000 ферментов). Например, промышленным способом производят такие ферменты как амилаза, глюкоамилаза, протеаза, инвертаза, пектиназа, каталаза, стрептокиназа, целлюлаза и другие.
Амилазы и протеазы используют в текстильной, хлебопекарной и кожевенной промышленности. Пектолитические ферменты могут быть использованы для мацерации тканей при переработке растительного сырья, например при получении льноволокна. Щелочные протеазы, особенно иммобилизованные, очень эффективно используются в составе моющих средств. Кроме протеолитических ферментов в состав моющих средств вводят липазу, целлюлазу, оксидазу и амилазу для удаления загрязнений крахмального происхождения. Использование иммобилизованной глюкозоизомеразы для непрерывного получения глюкозы является наиболее крупным процессом такого рода в мире.
Микробные ферменты активно используют в клинической диагностике при определении уровня холестерина в крови и мочевой кислоты. Ферменты предлагают использовать для очистки канализационных и водопроводных труб и т.д. и т.п. Ферменты для медицинских или аналитических целей должны быть высокоочищенными.
В биологических объектах ферменты обычно находятся в фиксированном состоянии на поверхности различных клеточных структур - наиболее часто на мембранах. Благодаря этому ферменты сохраняют свою активность длительное время. В технологии долгое время применялись препараты свободных ферментов; в таком состоянии срок их использования был коротким - один производственный цикл. Для повышения стабильности выделенных ферментов используют технику иммобилизации, т.е. связывания ферментов на поверхности нерастворимого в воде носителя, например, органических полимеров, стекла, минеральных солей, силикатов и т.п. Иммобилизованные ферменты можно длительное время использовать в биохимических реакторах в условиях непрерывного процесса.
Иммобилизация и получение связанных ферментных препаратов стало возможным благодаря детальному изучению строения многих ферментов. Раскрыт аминокислотный состав ряда ферментных белков, их пространственная конфигурация, выявлены активные центры, значение различных функциональных групп в проявлении каталитической активности фермента и так далее.
Примеры использования иммобилизованных ферментов - изомеризация глюкозы во фруктозу, гидролиз белков, трансформация стероидов, гормонов и т.д. Новая область применения иммобилизованных ферментов - создание на их основе бессеребряных фотоматериалов. На основе действия ферментов построены биолюминесцентные и иммуноферментные методы анализа, отличительной чертой которых является высокая чувствительность и абсолютная специфичность.
Болезни, связанные с нарушением выработки ферментов
Отсутствие или снижение активности какого-либо фермента (нередко и
избыточная активность) у человека приводит к развитию заболеваний
(энзимопатий) или гибели организма. Так, передаваемое по наследству
заболевание детей - галактоземия (приводит к умственной отсталости)
- развивается вследствие нарушения синтеза фермента, ответственного
за превращение галактозыв легко усваиваемую глюкозу. Причиной
другого наследственного заболевания - фенилкетонурии,
сопровождающегося расстройством психической деятельности, является
потеря клетками печени способности синтезировать фермент,
катализирующий превращение аминокислоты фенилаланинав тирозин.
Определение активности многих ферментов в крови, моче,
спинно-мозговой, семенной и других жидкостях организма используется
для диагностики ряда заболеваний. С помощью такого анализа
сыворотки крови возможно обнаружение на ранней стадии инфаркта
миокарда, вирусного гепатита, панкреатита, нефрита и других
заболеваний.
Медицинское значение
Если происходит мутация в гене, кодирующем определенный фермент,
может измениться аминокислотная последовательность фермента. При
этом в результате большинства мутаций его каталитическая активность
снижается или полностью пропадает. Если организм получает два таких
мутантных гена (по одному от каждого из родителей), в организме
перестает идти химическая реакция, которую катализирует данный
фермент. Например, появление альбиносов связано с прекращением
выработки фермента тирозиназы, отвечающего за одну из стадий
синтеза темного пигмента меланина. Фенилкетонурия связана с
пониженной или отсутствующей активностью фермента
фенилаланин-4-гидроксилазы в печени.
В настоящее время известны сотни наследственных заболеваний, связанные с дефектами ферментов. Разработаны методы лечения и профилактики многих из таких болезней.
Практическое использование
На сегодняшний день в различных отраслях хозяйства применение
ферментов является передовым достижением. Особое значение ферменты
нашли в пищевой промышленности. Ведь именно из-за наличия ферментов
в тесте происходит его поднятие и разбухание. Как известно,
разбухание теста происходит под действием углекислого газа
CO2, который в свою очередь образуется в результате
разложения крахмала под действием фермента амилазы, которая уже
содержится в муке. Но в муке этого фермента не достаточно, его,
обычно, добавляют. Ещё один фермент протеазы, придающий тесту
клейковину, способствует удержанию углекислого газа в тесте.
Изготовление алкогольных напитков также не
обходится без участия ферментов. В этом случае широко применяются
ферменты, которые находятся в дрожжах. Разнообразие сортов пива
получают именно различными комбинациями комплексных соединений
ферментов. Ферменты, также участвуют в растворении осадков в
спиртных напитках, например, чтобы в пиве не появлялся осадок в
него добавляют протеазы (папаин, пепсин), которые растворяют
выпадающие в осадок белковые соединения.
Производство кисломолочных продуктов, например, простокваши,
основана на химическом превращении лактозы (то есть молочного
сахара) в молочную кислоту. Кефир производят подобным образом, но
производственной особенностью является то, что берут не только
кисломолочные бактерии, но и дрожжи. В результата переработки
лактозы образуется не только молочная кислоты, но ещё и этиловый
спирт</. При получении кефира происходит ещё одна достаточно
полезная для организма человека реакция - это гидролиз белков, что
в последствии употребления человеком кефира способствует его
лучшему усвоению.
Производство сыра тоже связано с ферментами. Молоко содержит белок
- казеин, который в процессе химической реакции под действием
протеаз изменяется, и в результате реакции выпадает в осадок.
Протеазы широко используют для обработки кожевельного сырья. Его
способность производить гидролиз белков (расщепление белков) широко
применяют для выведения стойких пятен от шоколада, соусов, крови и
т.д. Фермент целлюлаза - используется в стиральных порошках. Он
способен удалять "катышки" с поверхности тканей. Важной
особенностью стирки с порошками, содержащими целые комплексы
ферментов, является то, что стирка в должна выполняться в тёплой,
но не горячей воде, так как горячая вода для ферментов является
губительной.
Применение ферментов в медицине связано с их способностью заживлять
раны, растворять образующиеся тромбы. Иногда ферменты умышленно
вводят в организм для их активизации, а иногда из-за излишней
активности ферментов, могут вводить вещества, которые действуют как
ингибиторы (вещества, замедляющие протекание химических реакций).
Например, под действием отдельных ингибиторов, бактерии теряют
способность размножаться и расти.
Применение ферментов в медицине также связано с проведением
различных анализов по определению заболеваний. В этом случае
ферменты играют роль веществ, вступающих в химическое
взаимодействие или способствующие химическим превращениям в
физиологических жидкостях организма. В результате получаются
определённые продукты химических реакций, по которым в лабораториях
распознают наличие того или иного возбудителя заболевания. Среди
таких ферментов и их применения наиболее известен фермент
глюкозооксидаза, который позволяет определить наличие сахара в моче
или крови человека. Кроме того, наравне с отмеченным, существуют
ферменты, которые способны определять наличие алкоголя в крови.
Этот фермент называется алкогольдегидрогеназа
.
Литература:
1. Тарханов И. Р., Ферменты, в физиологии //
Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4
доп.). - СПб., 1890-1907.
2. Энзимы // Энциклопедический словарь Брокгауза и Ефрона: В 86
томах (82 т. и 4 доп.).
3. Фершт Э. Структура и механизм действия ферментов. М., 1980.
4. Страйер Л. Биохимия. М., 1984-1985. Т. 1. С. 104-131. O. 2. С. 23-94.
5. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохомия человека. Т. 1. М., 1993.
6. Ферменты и нуклеиновые кислоты. - СПб.: Изд-во С.-Петерб. ун-та, 1997.
7. Молекулярная динамика ферментов. - М.: Изд-во Моск. ун-та, 2000.
8. Кислухина О. В. Ферменты в производстве пищи и кормов. - М.: ДеЛи принт, 2002.
9. Федоренко Б. Н. Ферменты и мембраны: научные основы взаимодействия. - М.: МГУПП, 2002.
10. Ферменты микроорганизмов. - Казань: Унипресс, 1998.
11. Николаев А.Я. Биологическая химия. М.: «Высшая школа», 1998,
с.53-58, 70-73, 78, 81-83. 12. Березов Т.Т., Коровкин Б.Ф.
Биологическая химия. М.: «Медицина», 1990, с. 92-93, 95-97,
105-108, 112-115, 126-128, 131-132.
13. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. М.: «Медицина», 2004, с. 114-116, 118-120, 129-134, 139-143, 159-163, 165-168.
14. Кушманова О.Д., Ивченко Г.М. Руководство к лабораторным занятиям по биологической химии. М.: М. Медицина, 1983, раб 24 (п. 1), 25.
15. Учебник Химии 11 класс, Кузнецова Н.Е., Литвинова Т.Н., Лёвкин А.Н. с.132.
Приложения:
Приложение №1
Приложение №2
Приложение №3

Опыт с сырым куриным филе. Наблюдаем большое образование пузырьков.
Это и есть выделение кислорода.
Приложение №4

Опыт с вареным куриным филе. Реакция не идет.