- Учителю
- Урок по химии для 9 класса
Урок по химии для 9 класса
Урок по химии для 9 класса « Кислород. Озон».
Автор : Щедрина Ольга Сергеевна (olga.schedrina1963@ya.ru)
Место работы: Муниципальное общеобразовательное учреждение средняя общеобразовательная школа № 11 Раменского муниципального района (МОУ СОШ № 11)
Предмет: Химия, урок -ознакомление с новым материалом
Продолжительность: (1 урок - 45 минут).
Класс: 9 класс
Технологии: ИКТ, здоровье сберегающие технологии и групповые.
«Кислород является центром, вокруг которого вращается вся химия.» (Берцелиус)
Цель урока:
Изучить и систематизировать знания по теме «Кислород. Озон».
Задачи:
- обучающие: закрепить знания по теме «Строение атома». Скорость химических реакций и их классификация;
показать метапредметные связи
-развивающие: развить познавательный интерес, информационную культуру учащихся, развитие коммуникативных навыков;
-воспитательные: воспитать стремление к саморазвитию, навыков самоорганизации, формировать ответственное отношения к учению, навыки здорового и безопасного образа жизни.
показать взаимосвязь человека с окружающей средой, охрана природы
Тип урока: урок - ознакомление с новым материалом.
Формы работы учащихся: индивидуальная, индивидуально - групповая (в парах).
Необходимое оборудование: мультимедийный проектор, компьютеры, раздаточный материал, прибор для получения и собирания газа, лучинка, спички, KMnO8, Н2О2, MnO2.
Метод обучения: лекция с элементами беседы.
Требования к знаниям, умениям и навыкам: Учащиеся должны знать состав, свойства кислорода и озона, составлять уравнения реакций. Анализировать, делать выводы. Применять полученные знания в повседневной жизни.
Ход урока:
-
Организационный момент.
-
Изучение нового материала.
-
Вступительное слово учителя:
Сегодня с вами мы говорим
О том, чем дышим мы,
А он невидим.
Но разве можно б было дети,
Без газа этого прожить на свете?
Жизнь без него тяжёлой бы была
Вернее, не было её бы никогда.
Да и вода состоит из него,
А без воды на Земле- ничего.
Итак, урок о …(кислороде)
-
Путешествие в историю открытия (выступление ученика)
-
Положение кислорода в Периодической системе Д.И. Менделеева. Строение атома (самостоятельно). Нуклиды кислорода. Электроотрицательность. Степень окисления.
Кислород в природе представлен 3-мя нуклидами (изотопами ): 16О, 17О, 18О, атомы отличаются по числу содержащихся в них нейтронов: соответственно 8, 9 и 10.
-
К
 ислород в природе
ислород в природе


Вывод: кислород - самый распространённый элемент на Земле.
-
Получение кислорода
Как можно получить кислород??? Основываясь на методах Шееле, Пристли и Лавуазье.
Вывод: в лаборатории кислород получаем разложением кислородсодержащих веществ:
а) термическое разложение перманганата калия (марганцовки).
2 KMnO4t= K2MnO4 + MnO2 + O2
KMnO4t= K2MnO4 + MnO2 + O2
б) разложение пероксида водорода (перекиси водорода) в присутствии MnO2.
 2Н2О2MnO2= 2Н2О + О2
2Н2О2MnO2= 2Н2О + О2
Демонстрационный опыт- соблюдение ТБ. Собирание кислорода методом вытеснения воздуха и воды. Доказательство наличия кислорода - по вспыхиванию тлеющей лучины.
Характеристика реакций и условия протекания.
В промышленности - ректификация воздуха.
Почему, несмотря на расходование огромных количеств кислорода, его общее содержание в воздухе заметно не меняется??? (дети отвечают - фотосинтез).
В природе :
6 СО2 + 6Н2О = С6Н12О6 (глюкоза) + 6О2
СО2 + 6Н2О = С6Н12О6 (глюкоза) + 6О2
-
Аллотропия кислорода: кислород и озон.

 О
О
О2 О3
Кислород Озон
Аллотропия-явление, когда один и тот же химический элемент образует несколько простых веществ.
Кислород и озон-аллотропные модификации химического элемента кислорода.
6)Получение озона (см. учебник стр.97 рис.27.Озонатор)
7)Физические свойства модификаций кислорода (работа с учебником с.95,99)
Физкультминутка.
-
Химические свойства:
Кислорода: в молекуле О2 химическая связь прочная, при образовании 1 моль О2 из атомов выделяется 493,57 кДж. Поэтому кислород при обычных условиях сравнительно малоактивен.
Без нагревания с щелочными металлами и щелочно земельными металлами
4Li + O2 =2Li2O + Q (но Na2O2 , KO2 (K2O4))
При нагревании способность резко возрастает.
При нагревании реагирует с большинством простых веществ, кроме инертных газов и благородных металлов.
S + O2 = SO2 + Q
C + O2 = CO2 + Q
4Fe + 3O2 = 2Fe2O3 + Q (реагирует с кислородом воздуха)
2Fe + O2 = 2FeO + Q (кислород пропускают через расплавленное железо )
Рассмотренные выше реакции - реакции горения, являются экзотермическими, в результате них выделяется свет и тепло.
Каковы условия протекания данной реакции, если кислород, находящийся в атмосфере весь не расходуется?
N2 + O2 = 2NO - Q (реакция эндотермическая - с поглощением тепла, протекает в электрическом разряде или при очень высоких температурах).
Вывод: В химических реакциях в большинстве случаев кислород - окислитель.
Следовательно, скорость реакции с участием кислорода зависит:
-
От природы реагирующих с кислородом веществ;
-
От доступа и концентрации кислорода;
-
От температуры.
Озона: озон неустойчив, его молекула легко разлагается
О3 = О2 + О
О3 более сильный окислитель, чем кислород из - за образования атомарного кислорода.
PbS + 4О3 = PbSO4 + 4О2
2КI + O3 + H2O = 2KOH + I2 + O2 - качественная реакция на озон (бумажка смоченная раствором КI и крахмала - синеет).
Воздействие озона на организм человека: несколько мкг озона в литре воздуха - раздражение дыхательных путей, головокружение, усталость; несколько млг - смертельно опасно.
Озон - яд!!!
-
Роль кислорода и озона в природе. Применение. (см.учебник стр.96,99).
-
Рефлексия. Лабиринт.
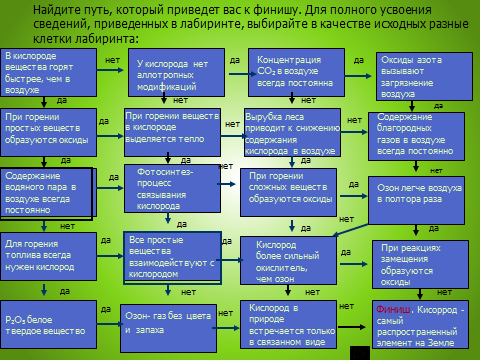
Оценить результаты. 8 шагов-«5»; 6,7-«4»; 4,5-«3»
4.Домашнее задание: п. 22-23 , задание 1,3-5
Литература:
-
И.И. Новошинский, Н.С. Новошинская «Химия 9 класс». Учебник для общеобразовательных учреждений. Москва «ОНИКС 21 век» «Мир и Образование», 2004 год, с.256
-
С.С. Бердоносов, Е.А. Менделеева «Особенности содержания и методики преподавания некоторых избранных тем курса химии 8 - 9 классов» Лекции 1-4. Москва Педагогический университет «Первое сентября» 2006 год, с.76
-
М.Н. Давыдова, Е.В. Савинкина «Кислород». Сценарии уроков 8 класс. Москва «Чистые пруды» 2006 год, с.32