- Учителю
- Урок по химии Окислительно-восстановительные реакции 11 класс
Урок по химии Окислительно-восстановительные реакции 11 класс
Урок по теме:
Окислительно-восстановительные реакции.
11 класс
Габриелян
Цель урока: Обобщить, систематизировать и расширить знания учащихся об окислительно-восстановительных реакциях, важнейших окислителях и продуктах их восстановления.
Задачи:
-
Закрепить умение определять степени окисления элементов, окислитель и восстановитель, расставлять коэффициенты методом электронного баланса.
-
Совершенствовать умение определять окислительно-восстановительные свойства веществ, прогнозировать продукты реакций в зависимости от активности металлов, концентрации кислот и реакции среды раствора.
-
Выработать умение составлять уравнения химических реакций, протекающих в различных средах на примере соединений марганца.
-
Показать разнообразие и значение ОВР в природе и повседневной жизни.
-
Продолжить подготовку к ЕГЭ по химии.
Ход урока
1. Организационный момент
Добрый день!
Тема нашего урока: «Окислительно - восстановительные реакции» (Презентация. слайд 1)
Какие по типу химические реакции вы знаете? (соединения, разложения, замещения, обмена, экзо и эндотермические, обратимые и необратимые, окислительно-восстановительные каталитические)
Окислительно-восстановительные реакции принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Важнейшие процессы на планете связаны с этим типом химических реакций. Человечество давно пользовалось ОВР, вначале не понимая их сущности. Лишь к началу XX века была создана электронная теория окислительно - восстановительных процессов. На уроке предстоит вспомнить основные положения этой теории, метод электронного баланса, научиться составлять уравнения химических реакций, протекающих в растворах, и выяснить от чего зависит механизм таких реакций.
2. Повторение и обощение изученного ранее материала
Для вас тема ОВР не нова, она проходит красной нитью через весь курс химии. Поэтому предлагаю повторить некоторые понятия и умения по данной теме.
Первый вопрос: «Что такое степень окисления?». Без этого понятия и умения расставлять степени окисления химических элементов не возможно рассмотрение данной темы.
Предполагаемы ответы учащихся /Степень окисления - это условный заряд атома химического элемента в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов. Степень окисления может быть положительной, отрицательной или равняться нулю, что зависит от природы соответствующих соединений./
Одни элементы имеют постоянные степени окисления, другие - переменные.
Например, к элементам с постоянной положительной степенью окисления относят щелочные металлы: Li+1, Na+1, K+1, Rb+1, Cs+1, Fr+1, следующие элементы II группы периодической системы: Ве+2, Mg+2, Ca+2, Sr+2, Ва+2, Ra+2, Zn+2, а также элемент III А группы - А1+3 и некоторые другие. Металлы в соединениях всегда имеют положительную степень окисления.
Из неметаллов постоянную отрицательную степень окисления (-1) имеет F.
В простых веществах, образованных атомами металлов или неметаллов, степени окисления элементов равны нулю, например: Na°, Al°, Fe°, Н20, О20, F20, Cl20, Br20.
Для водорода характерны степени окисления: +1 (Н20), -1 (NaH).
Для кислорода характерны степени окисления: -2 (Н20), -1 (Н2О2), +2 (OF2).
Следует помнить, что в целом молекула электронейтральна, поэтому в любой молекуле алгебраическая сумма степеней окисления равна нулю, а в сложном ионе - заряду иона.
Например, рассчитаем степень окисления хрома в дихромате калия K2Cr2O7.
-
Степень окисления калия +1, кислорода -2.
-
Подсчитаем число отрицательных зарядов: 7 • (-2) = -14
-
Число положительных зарядов должно быть + 14. На калий приходится два положительных заряда, следовательно, на хром - 12.
-
Так как в формуле два атома хрома, 12 делим на два: 12 : 2 = 6.
-
+ 6 - это степень окисления хрома.
Проверка: алгебраическая сумма положительных и отрицательных степеней окисления элементов равна нулю, молекула электронейтральна.
Самостоятельная работа № 1 по инструктивной карте: пользуясь приведенными сведениями, рассчитайте степени окисления элементов в соединениях: MnO2, H2SO4, K2SO3, H2S, KMnO4.
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА
-
NH3
В)
KNO2
Г)
NO
- 3 -
- 2
-
+2
-
+ 3
-
+4
-
+5
Ответы: 6143
Что же представляют собой окислительно - восстановительные реакции с точки зрения понятия «степень окисления химических элементов»? (слайд 2)
Предполагаемы ответы учащихся / Окислительно - восстановительные реакции - это такие реакции, в которых одновременно протекают процессы окисления и восстановления и, как правило, изменяются степени окисления элементов./
-
Выберите из уравнений реакций только окислительно-восстановительные:
-
Br2 + KI → I2 + KBr
-
SO3 + 2NaOН = Na2SO4 + Н2О
-
H2SO4 + Zn = ZnSO4 + H2
-
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Ответ:1,3
Рассмотрим процесс на примере взаимодействия цинка с разбавленной серной кислотой:

При составлении этого уравнения используется метод электронного баланса. Метод основан на сравнении степеней окисления атомов в исходных веществах и продуктах реакции. Основное требование при составлении уравнений этим методом: число отданных электронов должно быть равно числу принятых электронов.
-
Окислительно - восстановительные реакции - это такие реакции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим.
-
Окисление - это процесс отдачи электронов, степень окисления при этом повышается.
-
Восстановление - это процесс присоединения электронов, степень окисления при этом понижается.
-
Атомы, молекулы или ионы, отдающие электроны, окисляются; являются восстановителями.
Атомы, ионы или молекулы, принимающие электроны, восстанавливаются; являются окислителями. -
Окисление всегда сопровождается восстановлением, восстановление связано с окислением.
-
Окислительно - восстановительные реакции - единство двух противоположных процессов: окисления и восстановления.
Самостоятельная работа № 2 по инструктивной карте: методом электронного баланса найдите и поставьте коэффициенты в следующей схеме окислительно -восстановительной реакции:
MnO2 + H2SO4 → MnSO4 + O2 + H2O (2MnO2 + 2H2SO4 → 2MnSO4 + O2 +2H2O)
Однако научиться находить коэффициенты в ОВР еще не значит уметь их составлять. Нужно знать поведение веществ в ОВР, предусматривать ход реакций, определять состав образующихся продуктов в зависимости от условий реакции.
Для того чтобы разобраться, в каких случаях элементы ведут себя как окислители, а в каких - как восстановители, нужно обратиться к периодической системе Д.И.Менделеева. Если речь идет о простых веществах, то восстановительные свойства должны быть присущи тем элементам, которые имеют больший по сравнению с остальными атомный радиус и небольшое (1 - 3) число электронов на внешнем энергетическом уровне. Поэтому они могут сравнительно легко их отдавать. Это в основном металлы. Наиболее сильными восстановительными свойствами из них обладают щелочные и щелочноземельные металлы, расположенные в главных подгруппах I и II групп (например, натрий, калий, кальций и др.).
Наиболее типичные неметаллы, имеющие близкую к завершению структуру внешнего электронного слоя и значительно меньший по сравнению с металлами того же периода атомный радиус, довольно легко принимают электроны и ведут себя в окислительно-восстановительных реакциях как окислители. Наиболее сильными окислителями являются легкие элементы главных подгрупп VI - VII групп, например фтор, хлор, бром, кислород, сера и др.
Вместе с тем надо помнить, что деление простых веществ на окислители и восстановители так же относительно, как и деление на металлы и неметаллы. Если неметаллы попадают в среду, где присутствует более сильный окислитель, то они могут проявлять восстановительные свойства. Элементы в разных степенях окисления могут вести себя по-разному.
Если элемент имеет свою высшую степень окисления, то он может быть только окислителем. Например, в HN+5O3 азот в состоянии + 5 может быть только окислителем и принимать электроны.
Только восстановителем может быть элемент, находящийся в низшей степени окисления. Например, в N-3Н3 азот в состоянии -3 может отдавать электроны, т.е. является восстановителем.
Элементы в промежуточных положительных степенях окисления могут, как отдавать, так и принимать электроны и, следовательно, способны вести себя как окислители или восстановители в зависимости от условий. Например, N+3, S+4 . Попадая в среду с сильным окислителем, ведут себя как восстановители. И, наоборот, в восстановительной среде они ведут себя как окислители.
По окислительно - восстановительным свойствам вещества можно разделить на три группы:
-
окислители
-
восстановители
-
окислители - восстановители
Самостоятельная работа № 3 по инструктивной карте: в какой из приведенных схем уравнений реакций MnO2 проявляет свойства окислителя, а в какой - свойства восстановителя:
-
2MnO2 + O2 + 4KOH = 2K2MnO4 + 2H2O (MnO2 - восстановитель)
-
MnO2 + 4HCI = MnCI2 + CI2 + 2H2O (MnO2 - окислитель)
3. Углубление и расширение знаний
Важнейшие окислители и продукты их восстановления
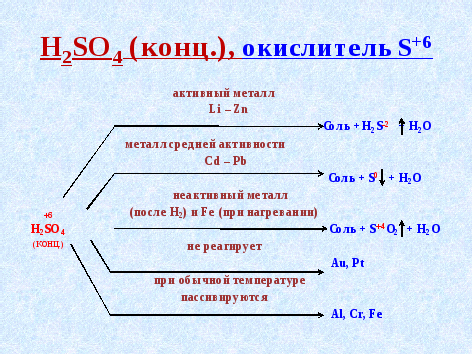
1. Серная кислота - Н2SO4 является окислителем
А) Уравнение взаимодействия цинка с разбавленной Н2SO4 (слайд 3)
Какой ион является окислителем в данной реакции? (H+)
Продуктом восстановления металлом, стоящим в ряду напряжения до водорода, является H2.
Б) Рассмотрим другую реакцию - взаимодействие цинка с концентрированной Н2SO4 (слайд 4)
Какие атомы меняют степень окисления? (цинк и сера)
Концентрированная серная кислота (98%) содержит 2% воды, и соль получается в растворе. В реакции участвуют фактически сульфат - ионы. Продуктом восстановления является сероводород.
В зависимости от активности металла продукты восстановления концентрированной Н2SO4 разные: H2S, S, SO2.
Чем выше активность металла, тем дальше (глубже) идет восстановление серы (вплоть до низшей степени окисления - 2) (слайд 5)
На схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот
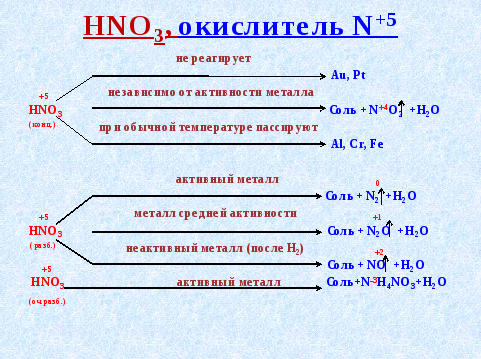
2. Другая кислота - азотная - также окислитель за счет нитрат - иона NO3-. Окислительная способность нитрат - иона значительно выше иона H+, и ион водорода не восстанавливается до атома, поэтому при взаимодействии азотной кислоты с металлами, никогда не выделяется водород, а образуются различные соединения азота. Это зависит от концентрации кислоты и активности металла. Разбавленная азотная кислота восстанавливается глубже, чем концентрированная (для одного и того же металла) (слайд 6)
На схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот
Золото и платина не реагируют с HNO3, но эти металлы растворяются в «царской водке» - смеси концентрированных соляной и азотной кислот в соотношении 3 : 1.
Au + 3HCI (конц.) + HNO3 (конц.) = AuCI3 + NO + 2H2O
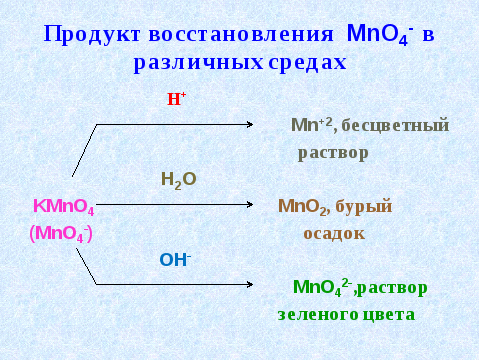
3. Наиболее сильным окислителем из числа простых веществ является фтор. Но он слишком активен, и его трудно получить в свободном виде. Поэтому в лабораториях в качестве окислителя используют перманганат калия KMnO4. Его окислительная способность зависит от концентрации раствора, температуры и среды.
Реакции окисления - восстановления могут протекать в различных средах. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами: среда влияет на изменение степеней окисления атомов.
Обычно для создания кислотной среды добавляют серную кислоту. Соляную и азотную применяют реже, т.к. первая способна окисляться, а вторая сама является сильным окислителем и может вызвать побочные процессы. Для создания щелочной среды применяют гидроксид калия или натрия, нейтральной - воду.
Продукты восстановления KMnO4 (MnO4-):
-
в кислой среде - Mn+2 (соль), бесцветный раствор;
-
в нейтральной среде - MnO2, бурый осадок;
-
в щелочной среде - MnO42- , раствор зеленого цвета. (слайд 9,)
К схемам реакций:
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O
KMnO4 + Na 2SO 3 + H2O → MnO2↓ + Na2SO4 + KOH
KMnO4 + Na 2SO3 + КOH → Na2SO4 + K2MnO4 + H2O
Подберите коэффициенты методом электронного баланса. Укажите окислитель и восстановитель (слайд 10)
(Задание разноуровневое: сильные учащиеся записывают продукты реакции самостоятельно)
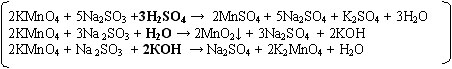
(слайд 11)
Значение окислительно - восстановительных реакций
В рамках одного урока невозможно рассмотреть все многообразие окислительно-восстановительных реакций. Но их значение в химии, технологии, повседневной жизни человека трудно переоценить.
Ученик: Окислительно-восстановительные реакции лежат в основе получения металлов и сплавов, водорода и галогенов, щелочей и лекарственных препаратов.
С окислительно - восстановительными реакциями связано функционирование биологических мембран, многие природные процессы: обмен веществ, брожение, дыхание, фотосинтез. Без понимания сущности и механизмов протекания окислительно-восстановительных реакций невозможно представить работу химических источников тока (аккумуляторов и батареек), получение защитных покрытий, виртуозную обработку металлических поверхностей изделий.
Для целей отбеливания и дезинфекции пользуются окислительными свойствами таких наиболее известных средств, как пероксид водорода, перманганат калия, хлор и хлорная, или белильная, известь.
Хлор как сильный окислитель используют для стерилизации чистой воды и обеззараживания сточных вод.
4. Закрепление изученного материала
Тест:
-
В кислой среде KMnO4 восстанавливается до:
-
соль Mn+2
-
MnO2
-
K2MnO4
-
-
Концентрированная H2SO4 при обычной температуре пассивирует:
-
Zn
-
Сu
-
AI
-
-
Концентрированная HNO3 не реагирует с металлом:
-
Ca
-
Au
-
Mg
-
-
Разбавленная HNO3 с активными металлами восстанавливается до:
-
NO
-
N2
-
N2O
-
-
Какой продукт восстановления KMnO4 пропущен: 2KMnO4 + 3K2SO 3 + H2O = + 3K2SO4 + 2KOH
-
MnO2
-
2MnSO4
-
K2MnO4
-
(взаимопроверка тестов в парах)
5. Домашнее задание
Используя схемы, данные на уроке, закончите уравнения реакций и расставьте в них коэффициенты методом электронного баланса:
-
AI + H2SO4 (конц.) →
-
Ag + HNO3 (конц.) →
-
KBr + KMnO4 + H2SO4 → …….. + Br2 + K2SO4 + H2O (слайд 13)
6.Подведение итогов урока
Инструктивная карта
I. Повторение и обобщение изученного ранее материала
Задание 1: Рассчитайте степени окисления элементов в соединениях:
MnO2, H2SO4, K2SO3, H2S, KMnO4 .
Задание 2: Методом электронного баланса найдите и поставьте коэффициенты в следующей схеме окислительно - восстановительной реакции:
MnO2 + H2SO4 → MnSO4 + O2 + H2O
Задание 3: В какой из приведенных схем уравнений реакций MnO2 проявляет свойства окислителя, а в какой - свойства восстановителя:
А) 2MnO2 + O2 + 4KOH = 2K2MnO4 + 2H2O Б) MnO2 + 4HCI = MnCI2 + CI2 + 2H2O
II. Углубление и расширение знаний:
Задание: К схемам реакций:
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O
KMnO4 + Na 2SO 3 + H2O → MnO2↓ + Na2SO4 + KOH
KMnO4 + Na 2SO3 + КOH → Na2SO4 + K2MnO4 + H2O
Подберите коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
III. Закрепление изученного материала
Тест:
1.В кислой среде KMnO4 восстанавливается до:
А) соль Mn+2 Б) MnO2 В) K2MnO4
2.Концентрированная H2SO4 при обычной температуре пассивирует:
А) Zn Б) Сu В) AI
3.Концентрированная HNO3 не реагирует с металлом:
А) Ca Б) Au В) Mg
4.Разбавленная HNO3 с активными металлами восстанавливается до:
А)NO Б) N2 В) N2O
5. Какой продукт восстановления KMnO4 пропущен:
2KMnO4 + 3K2SO 3 + H2O = + 3K2SO4 + 2KOH
А) MnO2 Б) 2MnSO4 В) K2MnO4
Оценка за тест (по результатам взаимопроверки)
IV. Домашнее задание
Используя схемы, данные на уроке, закончите уравнения реакций и расставьте в них коэффициенты:
1. AI + H2SO4 (конц.) →
2. Ag + HNO3 (конц.) →
3. KBr + KMnO4 + H2SO4 → …….. + Br2 + K2SO4 + H2O