- Учителю
- 10 химия сабақ жоспары
10 химия сабақ жоспары
Бастапқы бақылау жұмысы
І нұсқа
1.Соңына дейін жүретін реакцияларды аяқта а) кальций оксидімен натрий гидроксиді; б) магний нитраты мен күміс; в) барий гидроксиді мен күкірттісутек қышқылы; г) темір(ІІ) бромиді мен калий гидроксиді. Бір теңдеудің иондық теңдеулерін жаз
2. Мына өзгерістерді орында: S → H2S → FeS → H2S →SO2
3.10г аммиак пен 10г тұз қышқылымен әрекеттескенде түзілген тұздың массасын есепте
ІІ нұсқа
1.Мына тұздардың ортасын анықтаңдар: а) магний сульфаты; ә) темір (ІІІ) нитраты; б) мырыш карбонаты; в) алюминий хлориді; г)калий сульфаты
2.10г хлорсутек газының көлемін есепте
3.0,5моль әктас 10% 150г тұз қышқылымен әрекеттескенде түзілген газдың көлемін есептеңдер
І нұсқа
1.Соңына дейін жүретін реакцияларды аяқта а) кальций оксидімен натрий гидроксиді; б) магний нитраты мен күміс; в) барий гидроксиді мен күкірттісутек қышқылы; г) темір(ІІ) бромиді мен калий гидроксиді. Бір теңдеудің иондық теңдеулерін жаз
2. Мына өзгерістерді орында: S → H2S → FeS → H2S →SO2
3.10г аммиак пен 10г тұз қышқылымен әрекеттескенде түзілген тұздың массасын есепте
ІІ нұсқа
1.Мына тұздардың ортасын анықтаңдар: а) магний сульфаты; ә) темір (ІІІ) нитраты; б) мырыш карбонаты; в) алюминий хлориді; г)калий сульфаты
2.10г хлорсутек газының көлемін есепте
3.0,5моль әктас 10% 150г тұз қышқылымен әрекеттескенде түзілген газдың көлемін есептеңдер
І нұсқа
1.Соңына дейін жүретін реакцияларды аяқта а) кальций оксидімен натрий гидроксиді; б) магний нитраты мен күміс; в) барий гидроксиді мен күкірттісутек қышқылы; г) темір(ІІ) бромиді мен калий гидроксиді. Бір теңдеудің иондық теңдеулерін жаз
2. Мына өзгерістерді орында: S → H2S → FeS → H2S →SO2
3.10г аммиак пен 10г тұз қышқылымен әрекеттескенде түзілген тұздың массасын есепте
ІІ нұсқа
1.Мына тұздардың ортасын анықтаңдар: а) магний сульфаты; ә) темір (ІІІ) нитраты; б) мырыш карбонаты; в) алюминий хлориді; г)калий сульфаты
2.10г хлорсутек газының көлемін есепте
3.0,5моль әктас 10% 150г тұз қышқылымен әрекеттескенде түзілген газдың көлемін есептеңдер
І нұсқа
1.Соңына дейін жүретін реакцияларды аяқта а) кальций оксидімен натрий гидроксиді; б) магний нитраты мен күміс; в) барий гидроксиді мен күкірттісутек қышқылы; г) темір(ІІ) бромиді мен калий гидроксиді. Бір теңдеудің иондық теңдеулерін жаз
2. Мына өзгерістерді орында: S → H2S → FeS → H2S →SO2
3.10г аммиак пен 10г тұз қышқылымен әрекеттескенде түзілген тұздың массасын есепте
ІІ нұсқа
1.Мына тұздардың ортасын анықтаңдар: а) магний сульфаты; ә) темір (ІІІ) нитраты; б) мырыш карбонаты; в) алюминий хлориді; г)калий сульфаты
2.10г хлорсутек газының көлемін есепте
3.0,5моль әктас 10% 150г тұз қышқылымен әрекеттескенде түзілген газдың көлемін есептеңдер
І нұсқа
1.Соңына дейін жүретін реакцияларды аяқта а) кальций оксидімен натрий гидроксиді; б) магний нитраты мен күміс; в) барий гидроксиді мен күкірттісутек қышқылы; г) темір(ІІ) бромиді мен калий гидроксиді. Бір теңдеудің иондық теңдеулерін жаз
2. Мына өзгерістерді орында: S → H2S → FeS → H2S →SO2
3.10г аммиак пен 10г тұз қышқылымен әрекеттескенде түзілген тұздың массасын есепте
ІІ нұсқа
1.Мына тұздардың ортасын анықтаңдар: а) магний сульфаты; ә) темір (ІІІ) нитраты; б) мырыш карбонаты; в) алюминий хлориді; г)калий сульфаты
2.10г хлорсутек газының көлемін есепте
3.0,5моль әктас 10% 150г тұз қышқылымен әрекеттескенде түзілген газдың көлемін есептеңдер
І нұсқа
1.Соңына дейін жүретін реакцияларды аяқта а) кальций оксидімен натрий гидроксиді; б) магний нитраты мен күміс; в) барий гидроксиді мен күкірттісутек қышқылы; г) темір(ІІ) бромиді мен калий гидроксиді. Бір теңдеудің иондық теңдеулерін жаз
2. Мына өзгерістерді орында: S → H2S → FeS → H2S →SO2
3.10г аммиак пен 10г тұз қышқылымен әрекеттескенде түзілген тұздың массасын есепте
ІІ нұсқа
1.Мына тұздардың ортасын анықтаңдар: а) магний сульфаты; ә) темір (ІІІ) нитраты; б) мырыш карбонаты; в) алюминий хлориді; г)калий сульфаты
2.10г хлорсутек газының көлемін есепте
3.0,5моль әктас 10% 150г тұз қышқылымен әрекеттескенде түзілген газдың көлемін есептеңдер
Гальваникалық элементтер. Гальваникалық элементтер негізі-нен мына төмендегі екі белгі бойынша сипатталып, бөлінеді:
1. Гальваникалық элементтің негізгі әрекеті болып есептелетін ондағы процестер қосындысыньщ сипаты бойынша топтасады.
108
Мұндай процестер химиялық реакциялар бір электролиттің екі ерітіндісіндегі әр түрлі концентрацияны теңеуге бағытталған про-цестер болуы мүмкін. Осы топтағы белгі бойынша біріккен электродтар химиялық және концентрациялық болып өзара онан әрі бөлінеді.
2. Гальваникалық элементтердегі екі ерітіндіні қосатын сұйық жалғастырушының жоқ немесе бар болуына орай топтасады. Егер гальваникалық элементте ондағы екі ерітінді арасын қоса-тын сұйық жалғастырушысы болса, онда мұндай гальваникалық элементтерді тасымалдаушысы бар не тасымалды тізбек деп атай-ды. Ал, егер сұйық жалғастырушысы жоқ болса, оны тасымалсыз тізбек дейді.
Химиялық элемент. Химиялық процестердің энергиясын бірден және тікелей электр энергиясына түрлендіріп жіберетін электро-химиялық элементтерді химиялық деп атайды. Олар әр түрлі екі элементтен тұратындықтан, оларға әр түрлі табиғи сипаттағы электоодты реакциялар тән. Екі электродтағы ерітінді бірдей болса, яғни екі электрод бір электролит ерітіндісіне батырылса, онда мұндай элементті тасымалсыз элемент деп атайды. Әрине, мұндай электродтарда диффузиялық потенциал айырымы болуы мүмкін емес. Процесс бұған кері болса, айталық, екі электрод не екіге бөлінген, не екі ыдыстағы екі электролит ерітіндісіне баты-рылса, онда осы электролит ерітінділерінің арасын жалғастыру-шысы бар элементті тасымалды дейді.
Тасымалды химиялық элементтер қатарына Якоби-Даниэль элементі жатады:
(-)Zп|ZпSО4||СиSО4|Си( + )
Бұл элементте электрохимиялық механизм бойынша, өздіпнен Zп + СиSО4->-Си + ZпSО4 химиялық процесс жүреді. Бір электродта Zп->-Zп2+ + Zе реакция бойынша мырыш тотықса, ал екінші мыс электродында Си2+ + 2е->-Си реакция бойынша мыс тотықсызда-нады. Ал, егер жалпы элементтегі электрод потенциалын салыс-тырғанда, мырыш электроды теріс, мыс электроды оң зарядта-лады екен. Егер екі электролит ерітіндісіндегі диффузиялық по-тенциалды болдырмаса, онда бұл элементтің электр қозғаушы күші келесі тендеумен анықталады:
Сыныбы - 10 а күні________Тақырыбы
§ 2.8. Элементтердің периодты түрде өзгеретін қасиеттері.
Білімділік мақсаты:
дамытушылық
тәрбиелік:
Химиялық элемент атомының қауызына байланысты элементтердің қасиеттерінің топ пен период бойынша периодты түрде өзгеруі(атом радиусы,электронтартқыштық,электртерітілік,иондану энергиясы) туралы білімдерін қалыптастыру;
химиялық элементтің топ,период бойынша периодты өзгеретін қасиеттерін сипаттай білу,қорытындылай білу,көңіл аудару,есте сақтау білік- дағдыларын дамыту;
сабақ уақытын бағалауға үйрету,еңбекқорлыққа және пәнге қызығушылығын арттыру.
Сабақ типі:
Жаңа сабақ түсіндіру.
Сабақ өткізілу түрі:
фронталды әңгімелесу,қорытынды жасау,жаттығулар орындау, кітаппен өзбетінше жұмыс істеу, 10-ЕТЖ-1,
Құралдар мен реактивтер:
Кітап, дәптер, интерактивті тақта . Д.И.Менделеевтің ХЭПЖ , 10-ЕТЖ-1.
Ұйымдастыру
кезеңі:
(Сабақтың мақсаты мен кезеңдерін анықтау.)
-сабақта қалыпты жұмыс істеуге мүмкіндік жасау ;
-оқушыларды психологиялық дайындау.
.Оқушылардың сабаққа дайындығын тексеру. Оқушылардың көңілін сабаққа аудару. Сабақтың жалпы мақсатын ашу ,оны өткізу жоспарын көрсету.
Үй тапсырмасын тексеру кезеңі:
1.Ауызша сұрақтар: № 23,25,44,57,87 элементтердің сипаттамалары
2. Өзіндік жұмыс
Натрий сульфиді, аммоний сульфатындағы азот және күкірттің электрондық формулаларын жазыңдар
Жаңа сабақ түсіндіру кезеңі:
Атом радиусы..
Атом радиусы элементтің қасиетіне әсер етеді. Радиус неғұрлым үлкен болса, сыртқы деңгейдің электрондары соғұрлым әлсіз тартылады. Керісінше атом радиусы кемігенде электрондар ядроға күшті тартылады.
Период бойынша атом радиусы солдан оңға қарай кемиді. Мұны ядро заряды артқанда электрондардың тартылу күшінің өсуімен түсіндіреді. Топшада жоғырыдан төмен қарай атом радиусы артады, өйткені қосымша электрондық қабаттың қосылуы нәтижесінде атомның көлемі ұлғаяды. (2.20-сурет).
Иондану энергиясы.
Иондану энергиясы j - бұл атомнан тиісті электрондарды жұлып алуға жұмсалатын энергия. Ол әдетте электронвольтпен өрнектеледі. Атомнан электронды үзіп алғанда, соған сәйкес катион түзіледі: мұндағы j-иондану энергиясы.
Элементтердің химиялық қасиеттері иондану энергиясына тәуелді. Мысалы, иондану энергиясы аз сілтілік металдардың (2.22-сурет), айқын металдық қасиеттері бар. Бейметалдардың атомдарында металдарға қарағанда иондану энергиясының мәні үлкендеу. Бекзат газдардаң химиялық инерттігі оларлың иондану энергиясының мәнінің жоғары болуымен түсіндіріледі.
Электронтартқыштық. Атомдар электрондарды тек қана беріп қоймай, қосып алып соған сәйкес аниондар түзеді. Атомға бір электрон қосылғанда бөлінетін энергияны электронтартқыштық Е деп атайды.
Электронтартқыштық әдетте иондану энергиясы сияқты электронвольтпен өрнектеледі. Әр түрлі атомдардың электронтартқыштық мәндерінің өзгеруінде заңдылық бар. Ол сыртқы деңгейінде 7 электроны бар галогендерде едәуір жоғары болады. Галогендер бір электронды қосып алып, инертті газдар сияқты сыртқы деңгейі 8 электрон болатын тұрақты конфигурацияға ие болуға ұмтылады:
0 _
Cl+e = Cl-+ E ,
мұндағы Е - электронтартқыштық.
Электртерістілік. Элементтердің бейметалдық немесе металдық қасиеттері электртерістілік деп аталатын шамамен сипатталады, ол атомның иондану энергиясы мен электронтартқыштық мәндеріне сүйеніп есептеледі.
Электртерістілік ұғымын 1932 ж. америкалық ғалым Л.Полинг енгізген. Электртерістілік - бұл қосылыстағы атомның өзіне электрондарды тарту қабілеті. Электртерістіктің алғашқы шкаласын құрған да Л. Полинг.
|
Жаңа сабақты қалай қабылдағанын алғашқы тексеру кезеңдері: |
Білімділік мақсаты: - оқылған материалды оқушылардың дұрыс өз мәнінде қабылдағанын анықтау; -алғашқы берілген түсінікте кеткен кемшілікті анықтау; - кеткен кемшілікті жою жұмыстары; 1.Жаттығу орындау Жат 1-4 .кітаптың 74 беті (4 тапсырма- 4 нұсқа) |
|
Білімді жүйелеу және қорытындылау |
1. Дәптерге қорытынды жазу:
2. 10-ЕТЖ-1жұмыс істеу (21), 1-нұсқа. |
|
Бақылау және өзбетінше бақылау кезеңдері |
- оқылған материалды оқушылардың дұрыс меңгергенін анықтау; -алғашқы берілген түсінікте кеткен кемшілікті анықтау; - кеткен кемшілікті жою жұмыстары; .Жаттығуды тексеру 1-5 |
|
Үй тапсырмасын беру кезеңі: |
Білімділік міндеттері: -оқушыларға үй тапсырмасының берілу мақсаты ,мазмұны шығарылу жолы түсінікті болуын қамтамасыз ету 1. Үй тапсырмасын орындауға берілетін нұсқаулар. Параграф 2.8 -оқу ,№ 6-8 жазбаша 74 бет. 2. Күнделікке жазғанын тексеру. |
|
Сабақ қорытынды сын шығару кезеңі. |
- жекелеген оқушылар мен сынып жұмысына баға беру.Сабақтың кемшілігі мен қорытындысын шығару. Баға қою. |
|
Рефлексия кезеңі: |
Білімділік міндеттері: -оқушы мен мұғалім арасындағы дұрыс қарым қатынасты тудыру. -оқушылардыңөзін өзі басқару және басқа адамдармен дұрыс қарым -қатынас принципін үйрету.Өздерің сабақта не істеп үлгердіңіздер?Сыныптастарыңызға немен көмектесе алдыңыздар. қызықты болды ма? Білгендеріңнің маңызы қандай? |
Жеке жұмыс
1.Мына заттардың құрамындағы элементтердің валенттілігін табыңдар.
СІ О2, ВаН2, РbО, ТіO2, АІ4 С3
2. Zn3( PO4)2 - құрамындағы азоттың массалық үлесін есепте.
3.Тотығу дәрежесін анықта
H2CO3 , KCl, H3PO4 , Mg, N2 , Na2SO4 , CaS, H2Cr2O7
4. 5моль әктастың массасын, молекулалар санын есепте
5.Атом мен ионның айырмашылығы
6.№11 және 12 элементтердің иондану энергиясын салыстыр
7.№17 және 35 элементтердің электронтартқыштық қасиеттерін салыстыр
Жұптық жұмыс
1.ІҮ А топшасындағы элементтердің қасиеттерінің периодтылығы
2.ІҮ периодтың А топшасындағы элементтердің қасиеттерінің периодтылығы
Сыныбы - 10 а күні________Білімділік мақсаты:
Дамытушылық
тәрбиелік:
Оқушыларға d -элемент мырыш атомының құрылысы мен кристалл торларының ерекшеліктері туралы білімді қалыптастыру; мырыш,оның табиғатта кездесуі,қасиеттері,қолданылуы,алынуы;
d -элемент мырыш атомының құрылысы мен кристалл торларының ерекшеліктерін басқа элементтерден ажырата білу, электрондық формула құрастыру ,жеке атомға сипаттама беру,әр топтың атомдарының айырмашылығын түсіндіре білу ,қорытынды жасау,жүйелеу, сөздік қорын молайту білім-білік дағдыларын дамыту.
сабақ уақытын бағалауға үйрету,еңбекқорлыққа және пәнге қызығушылығын арттыру.
Сабақ типі:
Аралас сабақ
Құралдар мен реактивтер:
Кітап, дәптер, интерактивті тақта ,10-ЕТЖ-1, ХЭПЖ.
Ұйымдастыру
кезеңі:
-сабақта қалыпты жұмыс істеуге мүмкіндік жасау ; -оқушыларды психологиялық дайындау. Оқушылардың сабаққа дайындығын тексеру. Оқушылардың көңілін сабаққа аудару. Сабақтың жалпы мақсатын ашу ,оны өткізу жоспарын көрсету.
Үй тапсырмасын тексеру кезеңі:
Жеке папсырма 1.5%60г мырыш хлоридінің ертіндісіне 2г мырыш хлориді қосылды , мырыш хлоридінің массалық үлесі қандай? 2. 20г мырыш натрий гидроксидімен әрекеттескенде түзілген тұздың зат мөлшері 3.Мыстың табиғи қосылыстары 4. Мыстың алу әдістері. 5. Мыстың химиялық қасиеттері. 6. Мыстың қолданылуы Сыныпқа тапсырма 15г мырыш пен мыстан тұратын құймаға күкірт қышқылымен әсер еткенде 3л газ түзілді . Құймадағы мыстың массасы қандай?
Жаңа сабақты түсіндіру кезеңі
Жаңа сабақ -кітаппен өз бетінше жұмыс : параграф 7.2оқу (178-179 бет). Мырыш Цинкит -ZnО Мырыш алдамшысы ZnS Цинк шпаты ,галмей- ZnСО3 Мырыш - бірінші топтың қосымша топшасының.Тотығу дәрежесі- ( +2). Табиғатта кездесуі: мырыш жер қыртысындағы массасы бойынша мөлшері 0,001 % Ол көбінесе, қосылыстар түрінде кездеседі. Кен орындары: Жезқазған ,Оңтүстік Қазақстан, , Кенді Алтайда бар. Шымкент,Өскемен металлургия зауытында өндіріледі. Алынуы:Сульфидті кендерден: пирометаллургиялық әдіс
Оттекті құрамды кендерінен: гидрометаллургиялық жолмен
2ZnS +3О2------- 2ZnO +2 SO2
2ZnO + C------CO +Zn
ZnO+Н 2SO4------------ ZnSO4+ Н 2O
электролиз
2ZnSO4+ 2Н 2O --------------------
-----------2Н2SO4+2 Zn +O2
Цинк екідайлы. Zn +H2О- t --- ZnO
+H2 Zn + 2NaOH(кристалды)--- t
---Na2[Zn(OH)4H2 Zn + 2NaOH+
2H2О --- t
---Na2[Zn(OH)4]+H2
Zn(OH)2 + 2HCI - ZnCI2 +2 H2 O
Zn(OH)2 +2NaOH---- Na2[Zn(OH)4]
Қосылыстары: цинк оксиді ZnO - қызыл мырыш кені -цинкит, түссіз
суда ерімейді,қышқылда және сілтіінің артық мөлшерінде оңай ериді;
мырыш гидроксиді ақ түсті іртік тұнба, Zn(ОН)2, цинк купоросы
ZnSO4*7Н 2O, цинка сульфиді ZnS.
Мырыштың биологиялық маңызы : адам ағзасында жетіспеген жағдайда дәм және иіс сезуі нашарлайды. Қолданылуы: көбінесе құймаларда (жез, нейзильбер, цинкаль). 2. 9-В-3көрсету.
Білімді жүйелеу және қорытындылау
1.Хабарлама «Цинк» 2.№1-4 жаттығулар(ауызша) 3.№6 есеп
Үй тапсырмасын беру кезеңдері:
1. Параграф 7.2- оқу . № 5,7 есеп
2. Шығармашылық жұмыс есептер тақырыпқа сәйкес шығару
Сабақ қорытындысын шығару:
- жекелеген оқушылар мен сынып жұмысына баға беру.Сабақтың кемшілігі мен қорытындысын шығару. Баға қою
Рефлексия кезеңі
Білімділік міндеттері:
-оқушы мен мұғалім арасындағы дұрыс қарым қатынасты тудыру.
-оқушылардыңөзін өзі басқару және басқа адамдармен дұрыс қарым -қатынас принципін үйрету.Өздерің сабақта не істеп үлгердіңіздер?Сыныптастарыңызға немен көмектесе алдыңыздар. қызықты болды ма? Білгендеріңнің маңызы қандай? Сабақтың қай кезеңі ұнады?
Сыныбы - 10 а күні________Білімділік мақсаты:
дамытушылық
тәрбиелік:
Хром,оның табиғатта кездесуі,қасиеттері,қолданылуы,алынуы;
хромның электрондық формуласын құрастыру ,оның атомына сипаттама беру,әр топтың атомдарының айырмашылығын түсіндіре білу ,қорытынды жасау,жүйелеу, сөздік қорын молайту білім-білік дағдыларын дамыту.
Ізденуге, қайталау жұмыстарын жүргізуге , еңбекқорлыққа және пәнге қызығушылығын арттыру.
Сабақ типі:
Аралас сабақ
Құралдар мен реактивтер:
Кітап, дәптер, интерактивті тақта ,10-ЕТЖ-1, ХЭПЖ.
Ұйымдастыру
кезеңі:
-оқушыларды психологиялық дайындау.
Оқушылардың сабаққа дайындығын тексеру. Оқушылардың көңілін сабаққа аудару. Сабақтың жалпы мақсатын ашу ,оны өткізу жоспарын көрсету.
Үй тапсырмасын тексеру кезеңі:
*Үй жұмысы 5-7 жаттығу есептерді тексеру
*Жеке тапсырмалар: 1. Галмей құрамындағы мырыштың массалық үлесін анықта 2. 0,6моль мырыш алдамшысының массасын есепте 3. Мырыш ионын мырыш хлоридін калий гидроксидімен әрекеттестіріп анықтауға болады. Осы реакцияның толықжәне қысқартылған иондық теңдеулерін жаз. 4. Мырыштың периодтық жүйедегі орны , атом құрылысына сипаттама бер, табиғатта кездесуін сипатта. 5.Мырыш, мырыш қосылыстарының екідайлы қасиеттерін сипатта. 6.200г цинкиттің зат мөлшерін, молекулалар санан анықта 7. Мырыштың физикалық қасиеттері,алу әдістерін сипатта
*Сыныпқа тапсырма: 5 120г натрий гидроксиді мен 2 80г мырыш нитраты әрекеттескенде түзілген тұздың массасын ,зат мөлшерін есепте.
* Бағалау
Жаңа сабақ
Жаңа сабақ -кітаппен өз бетінше жұмыс : параграф 7.3оқу Хром Хром - алтыншы топтың қосымша топшасының элементі,тотыңу дәрежесі-(+2,+3,+6) Табиғатта кездесуі: хром жер қыртысындағы массасы бойынша мөлшері 0,03 % Ол көбінесе, қосылыстар түрінде кездеседі. Хромит немесе хромды теміртас FeCr2 O4 (Ақтөбе обл) және Cr2 O3 хром (ІІІ) оксиді кең таралған. Ақтөбе және Ақсу ферроқұйма зауыттарында өндіріледі. Хром космоста, жұлдызда, метеориттердебар екені анықталған. Алынуы: Алюминотермия: FeO* Cr2 O3 +C -------- 2Cr +Fe + 4CO
Cr2 O3 + 2Al ------- Al2 O3 + 2Cr Қасиеттері: күмістей -ақ түсті жылтыр,ең қатты,шыныға сызат түсіретін металл.Хромның беті мөлдір оксид қабықшасымен қапталған,ол өте жұқа ,бірақ химиялық өте тұрақты,тіпті қышқылдың өзі қиындықпен бұзады.Осы қабықшаға байланысты хром жемірілуге тұрақты,тіпті ылғал ауадада бұзылмайды. Сұйылтылған қышқылдардың өзі біраз уақыттан кейін ғана әрекеттесе бастайды. Азот қышқылы хромды пассивтейді. Хром қосылыстары: хром оксиді CrO-пирофорлы ұнтақ, негіздік оксид, тұз қышқылында ериді, қыздырғанда хром(3) оксидіне айналады ; Cr2 O3 -қиын балқитын күңгірт жасыл түсті ұнтақ,қаттылығы корундқа жақын амфотерлі оксид; CrO3- қанық -қызыл түсті кристалды зат,күшті тотықтырғыш,қышқылдық оксид, ( хром қышқылын түзеді Н2 CrO4; гидроксидтері Cr(OН)2, Cr(OН)3 *Хром (ІІІ) қосылыстары тотықсыздандырғыштар , олар күшті тотықтырғыштардың(СІ2 , Br2, H2 O2, KMnO4) әсерінен тотығады Сr2(SO4)3 +2 KMnO4 +7 H2 O = K2 Cr2 O7 + 2Mn(OH)4 + 3H2 SO4
Қолданылуы : хром және оның құймалары қара металлургияда қолданылатын қазіргі жаңа техниканың бағалы легирлеуші элементі. Таттанбайтын болат-18% хром және 8% никелден тұрады. Хром қосылыстарын тері илеуде,бояулар жасауда қолданады.
Білімді жүйелеу және қорытындылау
Оқулықтағы: *5жаттығу *6-есеп *Хабарлама «Хром»
Үй тапсырмасын беру кезеңдері:
1. Үй тапсырмасын орындауға берілетін нұсқаулар.
Параграф 7.3- оқу . № 2.3,4,7,8
2. Күнделікке жазғанын тексеру
Сабақ қорытындысын шығару:
- жекелеген оқушылар мен сынып жұмысына баға беру.Сабақтың кемшілігі мен қорытындысын шығару. Баға қою
Рефлексия кезеңі
-оқушы мен мұғалім арасындағы дұрыс қарым қатынасты тудыру.
-оқушылардыңөзін өзі басқару және басқа адамдармен дұрыс қарым -қатынас принципін үйрету.Өздерің сабақта не істеп үлгердіңіздер?Сыныптастарыңызға немен көмектесе алдыңыздар. қызықты болды ма? Білгендеріңнің маңызы қандай? Сабақтың қай кезеңі ұнады?
Сыныбы - 10 а күні________§7.4.Темір.
Білімділік мақсаты:
дамытушылық
тәрбиелік:
Темір,оның табиғатта кездесуі,қасиеттері,қолданылуы,алынуы;
темір атомының электрондық формуласын құрастыру , темір атомына сипаттама беру,әр топтың атомдарының айырмашылығын түсіндіре білу ,қорытынды жасау,жүйелеу, сөздік қорын молайту білім-білік дағдыларын дамыту.
сабақ уақытын бағалауға үйрету,еңбекқорлыққа және пәнге қызығушылығын арттыру.
Сабақ типі:
Аралас сабақ
Құралдар мен реактивтер:
Кітап, дәптер, интерактивті тақта , ХЭПЖ мыс ,темір, мырыш тұздарының ерітіндісі,сілті.
Ұйымдастыру
кезеңі:
-оқушыларды психологиялық дайындау.
Оқушылардың сабаққа дайындығын тексеру. Оқушылардың көңілін сабаққа аудару. Сабақтың жалпы мақсатын ашу ,оны өткізу жоспарын көрсету.
Жаңа сабақ
Цинк және хром атом құрылысы,қасиеттер, алынуы мен қолданылуын салыстырыңдар.
Кластер бойынша: оқушылардың өз бетінше жұмысы: ХЭПЖ орны: 4 период, 8топ,қосымша топша , 26 протон, 30 нейтрон, 26 электрон. Табиғатта кездесуі : гематит - триоксид дитемір - қызыл теміртас; магнетит - магнитті теміртас - тетраоксид тритемір; лимонит, пирит, сидерит. Соколов-Сарбай кен орны . Алынуы: алюмотермия, сутекпен немесе көміртек (2) оксидімен тотықсыздандыру
-
Қолданылуы: құймаларында магнитсіздену қасиеті.
-
Темірдің химиялық қасиеттері:
Неге темір көптеген қосылыстармен әрекеттеседі? (активтілігі жоғары) *+О2, +Н2О, +С12, +С, +күкірт, +қышқыл, +солтұз: Тотықсыздандырғыш бола алады. Дәлелдеңдер. Электрондық баланс.
4Fe + 3О2 ---------2Fe2О3 4Fe + 2 Н2О+3О2 ------4Fe(OH)3 2Fe +3С12 ------2FeС13 3Fe + С-------Fe3С Fe +S -----FeS 3Fe +4Н2О ------2Fe3О4 +4Н2
Fe + 4НNО3 (p)-------Fe(NO3)3 +NO+2H2O Fe + H2SO4--------FeSO4 +H2 Fe +2HCl ----------FeCl2 + H2 Fe +CuSO4--------- FeSO4 + Fe *Темір қосылыстары:FeO
Қара түсті ұнтақ, суда ерімейді. Негіздік қасиет көрсетеді
Fe2O3
Күрең, қоңыр ұнтақ, суда ерімейді. Бұл оксидке де негіздік қасиет тән.Бірақ жоғары температурада ол екідайлы оксидтер сияқты негіздік оксидтермен және балқытқанда сілтімен қосылады.
Fe(OH)2
жасыл тұнба
Fe(OH)3
қызыл қоңыр тұнба
Темірдің табиғи қосылыстары
гематит
магнетит
қасиеттері
Fe2O3, қызыл теміртас қатты зат
Fe3O4 магнитті теміртас қатты зат
*Темірдің биологиялық маңызы
*Лабораториялық тәжірибе «Мыс,темір, мырыш иондарын сапалық анықтау» *Мыс,мырыш хлориттері + сілті ==көкілдір және ақ түсті қоймалжың тұнбалар *Үш валентті темір иондарын анықтау үшін калий тиоцианатын да реактив ретінде қолданады: FeCl3 + 3KSCN = Fe(SCN)3 + 3KCl калий тиоцианаты темір тиоцианаты(қан қызыл түсті) Fe3+ катиондарын анықтау үшін сары қан тұзы калий (ll) гексацианоферратын K4[Fe(CN)6] қолданады. 4FeCl3 + K4[Fe(CN)6] ↔ Fe4[Fe(CN)6]3↓ + KCl Гексацианоферрат (ll) иондары [Fe(CN)6]4- темір Fe3+ катиондарымен әрекеттескенде қара көк тұнба - темір (lll) гексацианоферраты(ll) (берлин көгілдірі) түзіледі: 3[Fe(CN)6]4- + 4Fe3+ ↔ Fe4[Fe(CN)6]3↓
Fe2+ иондарын анықтау үшін калий гексацианоферрат (lll) - [Fe(CN)]3- иондары Fe2+ катиондарымен әрекеттескенде де, қара көк тұнба - темір (ll) гексацианоферраты (lll) (турнбуль көгі) түзіледі: 2[Fe(CN)6]3- + 3Fe2+ = Fe3[Fe(CN)6]2↓
Білімді жүйелеу және қорытындылау
*Хабарлама «Темір» , * 3-жаттығу, *4-жаттығу , *5-жаттығу
Үй тапсырмасы
* Параграф 7.5- оқу * Күнделікке жазғанын тексеру
Сабақ қорытындысын шығару:
- жекелеген оқушылар мен сынып жұмысына баға беру.Сабақтың кемшілігі мен қорытындысын шығару. Баға қою
Рефлексия кезеңі
Білімділік міндеттері:
-оқушы мен мұғалім арасындағы дұрыс қарым қатынасты тудыру.
-оқушылардыңөзін өзі басқару және басқа адамдармен дұрыс қарым -қатынас принципін үйрету.Өздерің сабақта не істеп үлгердіңіздер?Сыныптастарыңызға немен көмектесе алдыңыздар. қызықты болды ма? Білгендеріңнің маңызы қандай? Сабақтың қай кезеңі ұнады?
Сыныбы - 10 б күні________Білімділік мақсаты:
дамытушылық
тәрбиелік:
Темір,оның табиғатта кездесуі,қасиеттері,қолданылуы,алынуы;
темір атомының электрондық формуласын құрастыру , темір атомына сипаттама беру,әр топтың атомдарының айырмашылығын түсіндіре білу ,қорытынды жасау,жүйелеу, сөздік қорын молайту білім-білік дағдыларын дамыту.
сабақ уақытын бағалауға үйрету,еңбекқорлыққа және пәнге қызығушылығын арттыру.
Сабақ типі:
Аралас сабақ
Құралдар мен реактивтер:
Кітап, дәптер, интерактивті тақта , ХЭПЖ мыс ,темір, мырыш тұздарының ерітіндісі,сілті.
Ұйымдастыру
кезеңі:
-оқушыларды психологиялық дайындау.
Оқушылардың сабаққа дайындығын тексеру. Оқушылардың көңілін сабаққа аудару. Сабақтың жалпы мақсатын ашу ,оны өткізу жоспарын көрсету.
Жаңа сабақ
«Ой қозғау» *ХЭПЖ орны *Табиғатта кездесуі *Алынуы *Физикалық қасиеттері *Темірдің маңызы
*Темір қосылыстары:FeO
Қара түсті ұнтақ, суда ерімейді. Негіздік қасиет көрсетеді
Fe2O3
Күрең, қоңыр ұнтақ, суда ерімейді. Бұл оксидке де негіздік қасиет тән.Бірақ жоғары температурада ол екідайлы оксидтер сияқты негіздік оксидтермен және балқытқанда сілтімен қосылады.
Fe(OH)2
жасыл тұнба
Fe(OH)3
қызыл қоңыр тұнба
Темірдің табиғи қосылыстары
гематит
магнетит
қасиеттері
Fe2O3, қызыл теміртас қатты зат
Fe3O4 магнитті теміртас қатты зат
*Темірдің биологиялық маңызы
*Лабораториялық тәжірибе «Мыс,темір, мырыш иондарын сапалық анықтау» *Мыс,мырыш хлориттері + сілті ==көкілдір және ақ түсті қоймалжың тұнбалар *Үш валентті темір иондарын анықтау үшін калий тиоцианатын да реактив ретінде қолданады: FeCl3 + 3KSCN = Fe(SCN)3 + 3KCl калий тиоцианаты темір тиоцианаты(қан қызыл түсті) Fe3+ катиондарын анықтау үшін сары қан тұзы калий (ll) гексацианоферратын K4[Fe(CN)6] қолданады. 4FeCl3 + K4[Fe(CN)6] ↔ Fe4[Fe(CN)6]3↓ + KCl Гексацианоферрат (ll) иондары [Fe(CN)6]4- темір Fe3+ катиондарымен әрекеттескенде қара көк тұнба - темір (lll) гексацианоферраты(ll) (берлин көгілдірі) түзіледі: 3[Fe(CN)6]4- + 4Fe3+ ↔ Fe4[Fe(CN)6]3↓
Fe2+ иондарын анықтау үшін калий гексацианоферрат (lll) - [Fe(CN)]3- иондары Fe2+ катиондарымен әрекеттескенде де, қара көк тұнба - темір (ll) гексацианоферраты (lll) (турнбуль көгі) түзіледі: 2[Fe(CN)6]3- + 3Fe2+ = Fe3[Fe(CN)6]2↓
Білімді жүйелеу және қорытындылау
*Хабарлама «Темір» , * 2-жаттығу, *4-жаттығу , *5-жаттығу
Үй тапсырмасы
* Параграф 5,8- оқу 3,6 жаттығу * Күнделікке жазғанын тексеру
Сабақ қорытындысын шығару:
- жекелеген оқушылар мен сынып жұмысына баға беру.Сабақтың кемшілігі мен қорытындысын шығару. Баға қою
Рефлексия кезеңі
Білімділік міндеттері:
-оқушы мен мұғалім арасындағы дұрыс қарым қатынасты тудыру.
-оқушылардыңөзін өзі басқару және басқа адамдармен дұрыс қарым -қатынас принципін үйрету.Өздерің сабақта не істеп үлгердіңіздер?Сыныптастарыңызға немен көмектесе алдыңыздар. қызықты болды ма? Білгендеріңнің маңызы қандай? Сабақтың қай кезеңі ұнады?
Білімділік мақсаты:
Дамытушылық
тәрбиелік:
Темір,оның табиғатта кездесуі,қасиеттері,қолданылуы,алынуы;
темір атомының электрондық формуласын құрастыру , темір атомына сипаттама беру,әр топтың атомдарының айырмашылығын түсіндіре білу ,қорытынды жасау,жүйелеу, сөздік қорын молайту білім-білік дағдыларын дамыту.
сабақ уақытын бағалауға үйрету,еңбекқорлыққа және пәнге қызығушылығын арттыру.
Сабақ типі:
Аралас сабақ
Құралдар мен реактивтер:
Кітап, дәптер, интерактивті тақта , ХЭПЖ мыс ,темір, мырыш тұздарының ерітіндісі,сілті. Тлапсырмалар. Слайдтар
Ұйымдастыру
кезеңі:
-оқушыларды психологиялық дайындау.
-Оқушылардың сабаққа дайындығын тексеру. Оқушылардың көңілін сабаққа аудару. Сабақтың жалпы мақсатын ашу ,оны өткізу жоспарын көрсету.
-топқа топтастыру : Алюминий; Магний; Кальций
Білу
Үй тапсырмасын тексеру кезеңі:
Жеке тапсырмалар: Ітоп *Магнийдің табиғи қосылыстары *Кальций табиғи қосылыстары *Магний мен кальцийдің химиялық қасиеттері
ІІ топ
*Магний мен қальцидің қосылыстары *Ғаныштағы кальцийдің массалық үлесін есепте *Магнезиттің 2молінің массасын есепте
ІІІ топ * Алюминийдің алу әдістері *Алюминий қосылыстарының қасиеттері * Алюминий хлориді, магний хлориді, кальций хлориді ертінділерін бір-бірінен ажырат
Түсіну
Жаңа сабақ
Талдау
Оқушылардың өз бетінше жұмысы: І топ ХЭПЖ орны: 4 период, 8топ,қосымша топша , 26 протон, 30 нейтрон, 26 электрон. Табиғатта кездесуі : гематит - триоксид дитемір - қызыл теміртас; магнетит - магнитті теміртас - тетраоксид тритемір; лимонит, пирит, сидерит. Соколов-Сарбай кен орны . ІІ топ
Алынуы: алюмотермия, сутекпен немесе көміртек (2) оксидімен тотықсыздандыру
Сутектермия FeO+H2→ H2O + Fe
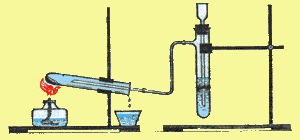
-
Қолданылуы: құймаларында магнитсіздену қасиеті.
ІІІ тол
Темірдің химиялық қасиеттері:
Неге темір көптеген қосылыстармен әрекеттеседі? (активтілігі жоғары) *+О2, +Н2О, +С12, +С, +күкірт, +қышқыл, +солтұз: Тотықсыздандырғыш бола алады. Дәлелдеңдер. Электрондық баланс. 4Fe + 3О2 ---------2Fe2О3 4Fe + 2 Н2О+3О2 ------4Fe(OH)3 2Fe +3С12 ------2FeС13 3Fe + С-------Fe3С Fe +S -----FeS 3Fe +4Н2О ------2Fe3О4 +4Н2 Fe + 4НNО3 (p)-------Fe(NO3)3 +NO+2H2O Fe + H2SO4--------FeSO4 +H2 Fe +2HCl ----------FeCl2 + H2 Fe +CuSO4--------- FeSO4 + Fe
*Темірдің биологиялық маңызы
Темірдің ең көп мөлшері мына өсімдіктер, тағамдар құрамында:
Итмұрын тұнбасы Орамжапырақ алма Қара шие Сиыр еті Малдың бауырында болады
Дін: Құранда темір туралы «Сондай-ақ темірді түсірдік. Онда мықты күш, әрі адамзат үшін қажеттер бар…»
Лаборатормяялық жұмыс
*Үш валентті темір иондарын анықтау үшін калий тиоцианатын да реактив ретінде қолданады: FeCl3 + 3KSCN = Fe(SCN)3 + 3KCl калий тиоцианаты темір тиоцианаты(қан қызыл түсті) Fe3+ катиондарын анықтау үшін сары қан тұзы калий (ll) гексацианоферратын K4[Fe(CN)6] қолданады. 4FeCl3 + K4[Fe(CN)6] ↔ Fe4[Fe(CN)6]3↓ + KCl Гексацианоферрат (ll) иондары [Fe(CN)6]4- темір Fe3+ катиондарымен әрекеттескенде қара көк тұнба - темір (lll) гексацианоферраты(ll) (берлин көгілдірі) түзіледі: 3[Fe(CN)6]4- + 4Fe3+ ↔ Fe4[Fe(CN)6]3↓
Fe2+ иондарын анықтау үшін калий гексацианоферрат (lll) - [Fe(CN)]3- иондары Fe2+ катиондарымен әрекеттескенде де, қара көк тұнба - темір (ll) гексацианоферраты (lll) (турнбуль көгі) түзіледі: 2[Fe(CN)6]3- + 3Fe2+ = Fe3[Fe(CN)6]2↓
Қолдану
Білімді жүйелеу және қорытындылау
-
*Хабарлама «Темір» Эйфель мұнарасы
1889 жылы Парижде француз инженері Гюстов Эйфель алып мұнара құрылысын аяқтады. Париж эмблемасына айналған мұнара биіктігі 300 метр, таза темір металынан тұрады.
-
Тест
1. Гематиттің формуласын көрсетіңдер?
а) Ғе2О3 в) Na2SO4 с) Ғе(ОН)2 д) Ғе3О4 е) Ғе2О3* пН2О
2. Ғе3О4 қосылысында темір қандай тотығу дәрежесін көрсетеді?
а) +3 в) +2 с) +1 д) +3,+4 е) +2 , +3
3 Темірдің балқу температурасы
а) 10830С в) 13390С с) 15390С д) 16830С е) 16390С
4. Қай реакция жүрмейді? а) Zn+НСІ→ в) Сu+НСІ→ с) Ғе+НСІ→ д) Hg+НСІ→ е) Pb +НСІ→
5. Темірдің нейтрон саны а) 26 в) 28 с) 30 в) 56 с) 32
3. Оқулықпен жұмыс
І топ * 3- есеп Массасы 32 г темір(ІІІ) оксидін тотық-сыздандыру үшін қанша алюминий қажет?
ІІ топ *4- есеп Гематиттегі (Ғе2О3) темірдің массалық үлесі қандай?
ІІІ топ *5-жаттығу Өзгерісті жүзеге асырыңыз
Ғе → ҒеСІ3 → Ғе(ОН)3→ Ғе2( SО4)3
Үй тапсырмасын беру кезеңдері:
* Параграф 5,8- оқу
*№ 6-8 жаттығу, есеп * Күнделікке жазғанын тексеру
Сабақ қорытындысын шығару:
Сұрақтар
1.Жер қыртысында таралуы бойынша төртінші орында
2. Ақ түсті күміс тәрізді металл
3. Бұл металдың қосылысы қаттылығы бойынша алмаздан кейін екінші орын алады.
4. Валентілігі 2,3,6-ға тең
5. Бұл металды алғашқы кезде " Аспан тасы" деп атаған
6.Тоқ пен жылуды жақсы өткізеді
**жекелеген оқушылар мен сынып жұмысына баға беру.. Баға қою
Рефлексия кезеңі
-оқушы мен мұғалім арасындағы дұрыс қарым қатынасты тудыру.
-оқушылардыңөзін өзі басқару және басқа адамдармен дұрыс қарым -қатынас принципін үйрету.Өздерің сабақта не істеп үлгердіңіздер?Сыныптастарыңызға немен көмектесе алдыңыздар. қызықты болды ма? Білгендеріңнің маңызы қандай? Сабақтың қай кезеңі ұнады?
Тақырыбы
ІІ топтың негізгі топша металдарының жалпы сипаттамасы
Білімділік мақсаты:
дамытушылық
тәрбиелік:
ІІ топтың негізгі топша металдарының жалпы сипаттамасы , магний және кальцийдің ХЭПЖ орны, атом құрылысы,, қасиеттері, қолданылуы, алынуы туралы білімді қалыптастыру;
магний және кальцийдің химиялық қасиеттері мен алынуын сипаттайтын реакция теңдеуін құрастыра білу біліктіліктерін дамыту, қорытынды жасау,жүйелеу, сөздік қорын молайту білім-білік дағдыларын дамыту.
сабақ уақытын тиімді пайдалану,еңбекқорлыққа және пәнге қызығушылығын арттыру.
Сабақ типі:
Аралас сабақ
Құралдар мен реактивтер:
Кітап, дәптер, интерактивті тақта , кесте №5.4, спирт шамы, тұз қышқылының ерітіндісі, сымтемір, натрий, калий, литий, кальций тұздары
Ұйымдастыру
кезеңі:
(Сабақтың мақсаты мен кезеңдерін анықтау.) -сабақта қалыпты жұмыс істеуге мүмкіндік жасау ; -оқушыларды психологиялық дайындау. Оқушылардың сабаққа дайындығын тексеру. Оқушылардың көңілін сабаққа аудару. Сабақтың жалпы мақсатын ашу ,оны өткізу жоспарын көрсету.
Білу
Үй тапсырмасын тексеру кезеңі:
Жеке тапсырмалар: 1.Сілтілік металдар сипаттамасы 2.Натрий мен калийдің периодтық жүйедегі орны, атом құрылысы 3. Натрийдің қосылыстары 4. Калийдің қосылыстары 5.Натрий мен калийдің алу әдістері
Түсіну
Жаңа сабақ
Қолдану
1.Жаңа сабақты түсіндіру: кестені толтыру:Металл-р
магний
кальций
Атом құр
2е 8е 2е
2е 8е 8е 2е
Табиғат та кездесуі:
Таралуы бойынша сегізінші орында,200 минералдың құрамына кіреді: MgCO3 магнезит, MgCO3*CaCO3 доломит, KCl*MgCl2*6H2O карналлит, Mg2SiO4 оливин, 3MgO*2H2O*2SiO2 асбест. Қазақстанда доломит пен, асбесттің қоры бар. Мұхит,теңіз,тұзды көлдер суларында магнийдің көп мөлшері бар. Магний фотосинтез процесі жүргізеді , адам ағзасына магний қажет.
Жер шарында кең таралған элемент, жер қыртысындағы таралуы бойынша 5 орында,ал табиғатта кальций қосы-лыс тарын бар жерде кездестіруге болады:тау жыныстары,сазды кендер,мұхит,теңіз,өзен сула рында,өсімдікпен жануар организмдерінде. Кең таралған қосылыстары: кальций карбонаты - бор, мрамор, әктас,ұлу тас, кальцит, маржан, коралдар,ғанышСаSО4*2Н2О; фосфорит -апатит Са3(РО4)2, флюорит СаF2.
Физикалық қасиет тері кесте №5,4
Ақ түсті,жеңіл,ауада тез арада оксид қабықшасымен қапталатын металл, балқу температурасы -651 С, кальцийден аздап қаттылау.
Күмістей ақ түсті металл,қатты лау тығыздығы(1,55) балқу температурасы- 840С,сілтілік металдар сияқты сақтайды.
Химия лық қасиет тері
Сілтілік металдармен салыстырғанда белсендігі аз төмен Галогендермен: Mg + Cl2== MgCl2 Күкіртпен: Mg +S== MgS Жанады: 2Mg + О2== 2MgО Сумен:Mg+Н2О=t=МgО+Н2 Қышқылдармен конц Н2SО4 енжарланады. Көптеген метал лдарды тотықсыздандырады: TiCl4+ 2Mg==2MgCl2 +Ti
Сілтілік металдармен салыстырғанда белсендігі аз төмен Галогендермен: Ca + Cl2== СаCl2. Күкіртпен: Са +S== СаS Жанады: 2Са + О2== 2СаО сумен :Са +2Н2О== Са(ОН)2+Н2
Көптеген металлдарды тотықсыздандырады:Ti,Zr,V,Uоксидтері мен хлоридтерінен таза металл алады.
Алынуы
Балқыманың электролизі
Балқыманың электролизі
Қолданылуы
Магний құймалары авиацияда, машина жасауда қолданылады
Кальций құймалары авиацияда, машина жасауда қолданылады
Анықтау
Ақ тұнба Mg (ОН)2
Жалынды кірпіш-қызыл түске бояйды
2. Лабораториялық тәжірибеНатрий
Сары түс
Калий
Күлгін түс
Кальций
Кірпіш-қызыл түсті
Деңгейлік жұмыс І деңгей 1-жаттығу ІІ деңгей 2- жаттығу ІІІ деңгей 3-жаттығу
Сабақ қорытындысын шығару:
.Сабақтың кемшілігі мен қорытындысын шығару. Баға қою Үйге тапсырма§5,5 оқу 4-5 -жаттығулар
Рефлексия кезеңі
-оқушы мен мұғалім арасындағы дұрыс қарым қатынасты тудыру. -оқушылардыңөзін өзі басқару және басқа адамдармен дұрыс қарым -қатынас принципін үйрету. Сыныптастарыңызға немен көмектесе алдыңыздар. қызықты болды ма? Білгендеріңнің маңызы қандай? Сабақтың қай кезеңі ұнады?
Сілтілік металдардың маңызды қосылыстары.
Білімділік мақсаты:
дамытушылық
тәрбиелік:
Оқушыларға натрий ,калийдің қосылыстары,гидроксидтер,тұздары туралы білімді қалыптастыру; натрий ,калийдің қосылыстары,гидроксидтер,тұздарының қасиеттерін түсіндіре білу,салыстыра білу,есеп шығара білу дағдысын ,реакция теңдеуін құрастыра білу біліктіліктерін дамыту, қорытынды жасау,есте сақтау,жүйелеу, сөздік қорын молайту білім-білік дағдыларын дамыту. сабақ уақытын бағалауға үйрету,еңбекқорлыққа және пәнге қызығушылығын арттыру.
Сабақ типі:
Аралас сабақ
Құралдар мен реактивтер:
Кітап, дәптер, интерактивті тақта ,10-ЕТЖ-1 натрий хлоридінің, калий перманганатының, натрий карбонатының үлгілері
Ұйымдастыру
кезеңі:
-сабақта қалыпты жұмыс істеуге мүмкіндік жасау ; -оқушыларды психологиялық дайындау. Оқушылардың сабаққа дайындығын тексеру. Оқушылардың көңілін сабаққа аудару. Сабақтың жалпы мақсатын ашу ,оны өткізу жоспарын көрсету.
Үй тапсырмасын тексеру кезеңі:
Дидактикалық ойын «Кім көп біледі» 1.20г натриймен 90г су әрекеттескенде түзілген натрий гидроксидінің массалық үлесі қандай? 2.Сілтілік металдардың атом құрылысы? 3. Калийдің табиғатта таралуы 4. Натрийдің табиғатта таралуы 5. Натрий мен калийдің алу әдістері 6.Натриймен калийдің физикалық қасиеттері 7. 1,4г сілтілік металл сумен әрекеттескенде 4,8г гидроксид түзілді. Металды анықтаңдар.
Үйге берілген жаттығу есепті тексеру
Жаңа сабақты түсіндіру кезеңі
Меңгеру
Зерттеу
Білімді жаңғырту. (Актуализация ): «Ой қозғау» * Натрий және калийге салыстырмалы сипаттама беріңдер. * Натрий , калий керосинде немесе парафин майында сақтайды? * Натрий және калийдің химиялық қандай қасиеттері бар? * Неге олар техникада кең қолданылмайды? * Натрий және калийді өндірісте қалай алады?
Калий және натрий қосылыстары:гидридтер
Қатты кристаллдық заттар ,сумен негіздер сияқты әрекеттеседі
натрий пероксиді
Калий және натрий ауада жанғанда оттек көп қосылыстар түзеді,кәдімгі оксидтермен салыстырғанда Na2 O, K2 O. Мысалы:2Na +O2 ---Na2O2 Оттектің тотығу дәрежесі: (-1).
оксидтері
Ақ түсті зат ,күшті негіздік қасиет көрсетеді
гидрооксидтері
Типтік негіздер ,ақ түсті,гигроскопиялық суда жақсы ериді
натрий хлориді
Химия өнеркәсібінде,тұрмыста
натрий сульфаты
Глаубер тұзы медицинада,шыны өнекәсібінде қолданылады.
натрий карбонаты
Кальцинирленген сода,сабын қайнатуда,тігін, тері, фармацевтік өнеркәсібінде, шыны, алюминий өнеркәсібінде
натрий гидрокарбонаты
Ас немесе ішетін сода, медицинада, кондитер өнеркәсібінде қолданылады
натрий нитраты
Селитра, азот тыңайтқышы
калий хлораты
Бертоллет тұзы, сіріңке қорабында болады, күшті тотықтырғыш.
калий перманга наты
Кез-келген аптечкада болады.аптечке (марганцовка), лабораторияды оттек алу үшін қолданады.
Лабораториялық тәжірибе Натрий мен калийдің маңызды
үлгілерімен танысуАты
Форму ласы
Сыртқы түрі
Табиғатта кездесе ме жоқ химиялық әдіспен алады.
Қолданылуы
Натрий, хлориді ас тұзы
Ақ түсті
Табиғатта
Химия өнеркәсібінде тұрмыста
Натрий, карбонаты кальцинир ленген сода
Ақ түсті
Табиғатта,химия -лық жолмен
Сабын қайнатуда,тігін тері, фармацевтік, өнеркәсібінде, шыны алюминий өнеркәсібінде
Калий пермангана ты
Күлгін түсті
Химиялық жолмен
Медицинада , в лабораторияда оттек алуда
Білімді жүйелеу және қорытындылау
Сынып жұмысы 1. Глаубер тұзындағы судың мөлшері 2.15г кристалдық соданы110г суда еріткенде , сусыз тұздың үлесі қандай?
Үй тапсырмасын беру кезеңдері:
1. Үй тапсырмасын орындауға берілетін нұсқаулар. §5,4- оқу . № 1,2,5,6 - жаттығу, есептер(100бет) 2. Күнделікке жазғанын тексеру
Сабақ қорытындысын шығару:
- жекелеген оқушылар мен сынып жұмысына баға беру. Сабақтың кемшілігі мен қорытындысын шығару. Баға қою
Рефлексия кезеңі
-оқушы мен мұғалім арасындағы дұрыс қарым қатынасты тудыру.-оқушылардыңөзін өзі басқару және басқа адамдармен дұрыс қарым -қатынас принципін үйрету. Өздерің сабақта не істеп лгердіңіздер? Сыныптастарыңызға немен көмектесе алдыңыздар. қызықты болды ма? Білгендеріңнің маңызы қандай? Сабақтың қай кезеңі ұнады?
Сыныбы - 10 б күні________Білімділігі
дамытушылығы
тәрбиелілігі
Оқушылардың металдар туралы алған білімдерін бекіту;
Металдардың электрондық формуласын құрастыру, химиялық қасиеттерін,алынуын сипаттайтын химиялық реакция теңдеулерін құру білім-біліктілік, дағдысын жетілдіру талдау,қорытындылау біліктіліктерін дамыту,есте сақтау қабілеттерін дамыту;
сабақ уақытын бағалауға үйрету,еңбекқорлыққа және пәнге қызығушылығын арттыру.
Сабақ типі:
Бекіту сабағы
Құралдар мен реактивтер:
Кітап, дәптер, интерактивті тақта,. Интернет мәліметі. тапсырмалар
Ұйымдастыру
кезеңі:
-сабақта қалыпты жұмыс істеуге мүмкіндік жасау ; -оқушыларды психологиялық дайындау. Оқушылардың сабаққа дайындығын тексеру. Оқушылардың көңілін сабаққа аудару. Сабақтың жалпы мақсатын ашу ,оны өткізу жоспарын көрсету.
Үй тапсырмасын тексеру
*«Кім көп біледі» 1.Темірдің табиғатта кездесуі 2. Темір қосылыстары 3. Темірдің атом құрылысы, физикалық қаситтері 4. Темірдің химиялық қасиеттері 5. Темірдің ІІ валентті қосылыстары 6.Темірдің ІІІ валентті қосылыстары 7. Темір иондарын анықтау. 8. Темірдің құймалары және маңызы
*Үй ге берілген жаттығулар мен есептерді тексеру
Жаңа сабақ
*Тест жұмысы
*Есептер шығару
3.Массаы 1.8,1г алюминий мен галоген әрекетттескенде массасы 81,1г алюминий галогин галогениді түзілді. Алюминиймен реакция үшін қандай галоген алынған? болатын
4.8,1 2.алюминий мен 190,4г 20%-тік күйдіргіш калий ерітіндісінің әрекеттесуі нәтижес нәтижесінде жиналған газдың көлемін (қ.ж.) анықтаңдар.
Үй тапсырмасы
-
Ү тарауды қайталау
-
Бақылау жұмысына дайындық жүргізу
-
Есептер шығару 1-6
10-ЕТЖ-1 бойынша № 9-28- 9-31(196 бет)
Сабақ қоры-тындысын шығару кезеңі.
- жекелеген оқушылар мен сынып жұмысына баға беру.Сабақтың кемшілігі мен қорытындысын шығару. Баға қою.
Рефлексия кезеңі:
Білімділік міндеттері:
-оқушы мен мұғалім арасындағы дұрыс қарым қатынасты тудыру.
-оқушылардыңөзін өзі басқару және басқа адамдармен дұрыс қарым -қатынас принципін үйрету.
Сыныбы - 10 б күні________Білімділік мақсаты:
дамытушылық:
тәрбиелік:
Оқушылардың металдардың химиялық қасиетері мен алынуын тәжірибеде тексеру;
тәжірибе жасау ,химиялық реакция теңдеулерін құру білім-біліктілік, дағдысын тексеру,талдау,қорытындылау біліктіліктерін дамыту,есте сақтау қабілеттерін дамыту;
сабақ уақытын бағалауға үйрету,еңбекқорлыққа және пәнге қызығушылығын арттыру.
Сабақ типі:
Эксперимент
Құралдар мен реактивтер:
Кітап, дәптер, интерактивті тақта, сынауықтар,тұрғылар,құрғақ жанғыш зат,сіріңке, спирт шамдары,индикаторлар, цинк сульфаты, натрий карбонаты, натрий, хлориді ,темір(3) сульфаты, тұз қышқылының ,мыс хлоридінің ерітінділері темір, кальций, цинк түйіршіктері, тигель.
Ұйымдастыру
кезеңі:
-сабақта қалыпты жұмыс істеуге мүмкіндік жасау ; -оқушыларды психологиялық дайындау. Оқушылардың сабаққа дайындығын тексеру. Оқушылардың көңілін сабаққа аудару. Сабақтың жалпы мақсатын ашу ,оны өткізу жоспарын көрсету.
Жаңа сабақ Практикалық жұмысты орындау
1-есеп Индикаторларды пайдаланып магний сульфаты, натрий карбонаты, натрий хлориді ертінділерін анықтаңдар.
2-есеп Берілген тұз -натрий карбонаты екенін дәлелдеңдер.
3-есеп Ертіндісі бар сынауықтардың қайсысында мынадай тұздар: темір(ІІІ)хлориді, мыс(ІІ)хлориді, кальций хлориді бар екенін анықтаңдар.
3. Практикалық жұмыс қорытындысын жазу.
4. Жұмыс орнын ретке келтіру.
Үй тапсырмасын беру кезеңі:
1. Үй тапсырмасын орындауға берілетін нұсқаулар..
2.Дәптерге жазғандарын тексеру .
Үй тапсырмасын орындауға нұсқау беру. 5,1-5,8 тарауды қайталау.
Рефлексия кезеңі:
-оқушы мен мұғалім арасындағы дұрыс қарым қатынасты тудыру.
-оқушылардыңөзін өзі басқару және басқа адамдармен дұрыс қарым -қатынас принципін үйрету.
Сыныбы - 10 а күні________Білімділік мақсаты:
дамытушылық:
тәрбиелік:
Оқушылардың металдардың химиялық қасиетері мен алынуын тәжірибеде тексеру;
тәжірибе жасау ,химиялық реакция теңдеулерін құру білім-біліктілік, дағдысын тексеру,талдау,қорытындылау біліктіліктерін дамыту,есте сақтау қабілеттерін дамыту;
сабақ уақытын бағалауға үйрету,еңбекқорлыққа және пәнге қызығушылығын арттыру.
Сабақ типі:
Эксперимент
Құралдар мен реактивтер:
Кітап, дәптер, интерактивті тақта, сынауықтар,тұрғылар,құрғақ жанғыш зат,сіріңке, спирт шамдары,индикаторлар, цинк сульфаты, натрий карбонаты, натрий, хлориді ,темір(ІІІ) сульфаты, тұз қышқылының ,мыс хлоридінің ерітінділері темір, кальций, цинк түйіршіктері, тигель.
Ұйымдастыру
кезеңі:
-сабақта қалыпты жұмыс істеуге мүмкіндік жасау ; -оқушыларды психологиялық дайындау. Оқушылардың сабаққа дайындығын тексеру. Оқушылардың көңілін сабаққа аудару. Сабақтың жалпы мақсатын ашу ,оны өткізу жоспарын көрсету.
Жаңа сабақ Практикалық жұмысты орындау
1-есеп Индикаторларды пайдаланып магний сульфаты, натрий карбонаты, натрий хлориді ертінділерін анықтаңдар.
2-есеп Мырыштан мырыш гидроксидін алыңдар
3-есеп Берілген тұз -натрий карбонаты екенін дәлелдеңдер.
4-есеп Ертіндісі бар сынауықтардың қайсысында мынадай тұздар: темір(ІІІ)хлориді, мыс(ІІ)хлориді, кальций хлориді бар екенін анықтаңдар.
3. Практикалық жұмыс қорытындысын жазу.
4. Жұмыс орнын ретке келтіру.
Үй тапсырмасын беру кезеңі:
1. Үй тапсырмасын орындауға берілетін нұсқаулар..
2.Дәптерге жазғандарын тексеру .
Үй тапсырмасын орындауға нұсқау беру. 5,1-5,8 тарауды қайталау.
Рефлексия кезеңі:
-оқушы мен мұғалім арасындағы дұрыс қарым қатынасты тудыру.
-оқушылардыңөзін өзі басқару және басқа адамдармен дұрыс қарым -қатынас принципін үйрету.
Қазақстандағы түсті металдар[
"Мырыш кені"Қазақстанда түсті металдар шикізатының ірі базасы қалыптасқан. Олардың ішінде жетекші орынды мырыш, қорғасын және мыс кендері алады. Бұл металдардың республикадағы қоры бойынша тиісінше әлемде бірінші, екінші және үшінші орын алады. Олар Қазақстан түсті металлургиясы базалық кәсіпорындарының (Жезқазған, Балқаш, Ертіс мыс, Шымкент, Риддер, Өскемен қорғасын мен мырыш, Павлодар алюминий қорыту зауыттары) шикізат көзі болып табылады. Қазақстан әлемдегі ірі мыс өндіруші елдердің бірі. Республика аумағында мыс кентасының порфирлі, мысты құмтас, колчеданды, скарндық мысты-цеолитті, мысты-никельді, т.б. кен орындарының көптеген түрлері белгілі. Мыс кентасының ірі кен орындарына [[Жезқазған, Қоңырат,Ақтоғай, Айдарлы, Жаман-Айбат, Бозшакөл, Көксай, Қасқырмыс, Нұрқазған (Самара), т.б. жатады. Жекелеген кен орындарының (Жезқазған мыс кені,Жаманайбат мыс кені) мыс қоры 10 млн. тоннадан асады.
"Боксит"Қорғасын мен мырыштың 100-ден аса кен орындары анықталып, 58-і балансқа алынған. Олардың негізгі қоры Шығыс Қазақстанда (Кенді Алтай) және Орталық Қазақстанда шоғырланған, сондай-ақ, Оңтүстік Қазақстанда да (Қаратау) кездеседі. Қазір қорғасын мен мырыштың 30-ға жуық кен орындары игерілуде. Алюминий шикізаты ретінде ең көп таралғаны - боксит. Қазақстанда бокситтің қоры көп. Анықталған 200 кен орны мен кен білінімдерінің (есепке алынғаны) 50-ден астамы платформалық типті. Олардың ішіндегі ірілері: Краснооктябрь, Белинское, Тауынсор, Шығыс Әйет, Көктал, Наурызым, Жоғарғы Әйет, Арқалық кен орындары. Бұлардың барлығы Торғай ойысында орналасып, Батыс Торғай, Шығыс Торғай (Амангелді) және Орталық Торғай бокситті аудандарын құрайды.
"Вольфрам"Қазақстан сирек металдарға бай өлке. Молибден қоры жөнінен республика әлемде төртінші, Азия елдері арасында бірінші орын алады. Молибден кентастарының қоры 34 кен орны бойынша есепке алынған, олардың 26-сы баланстық. Ірілері: Көктіңкөлі, Оңтүстік, Шалқия, Жәнет, Батыстау, Жоғарғы Қайрақты, Қараоба, Ақшатау. Молибден кен орындары негізінен штокверктік (порфирлік) типті. Қазақстан КСРО-дағы жоғары сапалы тантал концентраты мен ниобийдің негізгі өндірушісі болды. Тантал бойынша өнеркәсіптік шикізат базасы төрт кен орында шоғырланды: Бәкен, Белогор, Юбилейное және Жоғарғы Баймырза. Кен орындарының барлығы Қалба жотасында орналасқан. Солтүстік Қазақстанда ірі Сырымбет пен Донецк қалайы кен орындарының ашылуы қалайы шикізат базасын айтарлықтай ұлғайтты. Оған дейін ілеспе қалайының 5 кен орны балансқа алынған болатын, негізгілері кешенді сирек металл кентасты Қалайы тапқан (жалпы қордың 70%-ға жуығы), Қараоба, Бәкен, Юбилейное және Ахметкин кен орындары.
Вольфрам қоры жөнінен Қазақстан әлемде бірінші орын алады. Вольфрам қорының 53%-дан астамы 16 кен орнында шоғырланған, оның 12-сі баланстық. Вольфрам кенінің басым типтері - кварц-желілі-грейзенді және штокверкті, оларға Қараоба, Ақшатау, Жоғарғы Қайрақты, Бұғыты, т.б. кен орындары жатады. Вольфрамға бай кентастар скарндық-грейзендік кен орындарында (Солтүстік Қатпар, Баян) немесе олардың мүжілген қатпарларында (Көктіңкөлі) кездеседі. Вольфрамның 16 кен орны есепке алынған. Оның 85%-на жуығы штокверк кендері (Шығыс Қайрақты, Бұғыты, Көктіңкөлі, Қараоба, т.б.), ондағы вольфрам триоксидінің мөлш. 0,12 - 0,19%. Негізгі қорлар 6 ірі және аса ірі: Жоғарғы Қайрақты, Бұғыты, Қараоба (штокверк), Солтүстік Қатпар, Көктіңкөлі, Баян, Ақсоран кен орындарында шоғырланған.
Бейметалл пайдалы қазбалар[өңдеу]Бейметалл (бейруда) қазбалар - құрамынан металдар өңдірілмейтін, табиғаты мен сипаты жағынан сан түрлі пайдалы қазба түрлерінің үлкен тобы.[1]
Бұл қазбалар халық шаруашылығындағы қолданылу салаларына орай бірнеше түрлерге бөлінеді: химиялық шикізаттар - апатит, фосфориттер, барит, минералды тұздар, күкірт, гипс т. с. е.; отқа төзімді шикізаттар - отқа төзімді саздар, тақтатастар, магнезит, талькті тас т. б.; электротехникалық пьезооптикалық жылу және дыбыстұмшалаушы, мұқалмас, қышқылға және сілтіге төзімді шикізаттар - слюдалар, флюорит, пьезокварц, корунд, хризотил және амфибол-талшықтастар, тальк, диатомит т. б.; құрылыс материалдары - граниттер, базальттар, диабаздар, ізбестастар, мергелдер, саздар, құмдар, кесектастар т. с. е.; асыл, зергерлік және техникалық тастар - алмас, замартас, ақық, халцедон т. б. Тау жыныстары мен минералдардың кейбір түрлері көп жағдайда әртүрлі салаларда колданылуы мүмкін.
Бейметалл пайдалы қазбалардың жіктелімі[өңдеу]
Бейметалл пайдалы ңазбалар өздерінің айрықша физикалық және физикалық-химиялық ңасиеттері, минералдық құрамының ерекшеліктері, сонымен қатар әр түрлі өнімдер мен материалдар алу мүмкіндігі бойынша кең пайдаланылады. Олар құрамынан металдар айырып алуға ( калий , магний , натрий , т.б. айтпағанда) және табиғи отын ретінде (зымыран отыны болатын бор қосылыстары мен фтор қосылыстарын санамағанда) қолданылмайды. Бейметалл пайдалы қазбалар тобы түрлерінің саны бойынша металл пайдалы қазбалар тобы мен жанғыш пайдалы қазбалардан әлдеңайда көп. Бейметалл пайдалы қазбалар табиғи түрінде немесе алдын ала өңдеуден кейін пайдаланылады. Табиғи күйде қолданылатындар - минералдар мен таужыныстар; асбест , қабаттас (слюда), тальк, исланд шпаты, алмас, оптикалық флюорит , асыл және әшекей тастар, анартас, корунд сияқты өнеркәсіптік минералдар; құм, гравий, ңүрылыс тастары (магмалық, метаморфтық және шөгінді таужыныстар); оттөзімді, жылуоқшаулауыш және байланыстырушы материалдар ретінде пайдаланылатын графит , диатомит, магнезит пен доломит; астұз , цеолит, бентонит және басқа табиғи сорбенттер. Өңделген күйде пайдаланылатындар - шыны (кварц құм, далашпат), керамика , қышқылтөзімді және жылуоқшаулауыш материалдар (саз, кремний таужыныстар, вермикулит, т.б.), байланыстырғыш заттар (әктас, бор, мергель, гипсит), минералдық тыңайтқыштар (фосфоит, апатит ) , химиялық өнімдер (күкірт , күкірт ті таужыныстар , бораттар, минералдық тұздар, барит , т.б.) алуға жарамды минералдар мен таужыныстар. Өнеркәсіптік өңдеу үдерісінде құнды химиялық элементтер, минералдар мен минералдық агрегаттар алу үшін пайдаланылатын бейметалл пайдалы қазба түрлеріне қатысты "кен" термині қолданылады. Оларға асбест ,графит , слюда (мусковит , флогопит ), апатит , фосфорит , күкірт , барит , калийлі және басқа да көптеген кендер жатады. Бейметалл пайдалы қазбалар металл және жанғыш пайдалы қазбалардан сапасын бағалау мен өнеркәсіптік қолдану бағыттары бойынша айрықшаланады. Оларды зерттегенде маңыздысы - құрамындағы пайдалы компоненттер мөлшерін анықтау ғана емес, бастысы - өңдеу технологиясы мен ақырғы өнеркәсіптік өнімнің сапасына әсер ететін техникалық және физикалық- химиялық қасиеттерін анықтау. Сондықтан бейметалл пайдалы қазбалардың сапасы стандарт, техникалық шарт пен кондиңиялар арқылы шектеліп, олардың әр түрінің, түрлесінің және шикізат сортының өнеркәсіптің белгілі бір саласында қолдану мүмкіндігін анықтайды. Бейметалл пайдалы қазбалар көбінесе көп мақсатта қолданылатын шикізат болып табылады. Мәселен, флюорит өзінің сапасының нақты көрсеткіштеріне байланысты оптикада, шыны, металлургия мен химия өнеркәсібінде; күкірт - ауыл шаруашылығында улы химикаттардың құрамдас бөлігі ретінде, химия , резеңке, қағаз бен тамақ өнеркәсібінде; неолиттер - ауыл шаруашылығында, газдарды, табиғи және ақаба суды тазартуға, металдар айырып алуға қолданылуы мүмкін. Сонымен қатар, көптеген бейметалл пайдалы қазба Қасиеттерінің ортақ болуына байланысты өнеркәсіпте бір-бірін алмастыруы мүмкін. Бұл жағдайлар бейметалл Пайдалы қазба кенорындарының зерттелуі мен өнеркәсіптік құндылығын бағалаудың күрделілігін білдіреді. Пайдалы қазбалар қорын, құнды компоненттер мөлшерін (бейметалл кен үшін), өндіру мен өңдеудің кен-технологияльщ жағдайларын анықтаумен қатар олардың физикалың-механикалық, физикалық- химиялық және технологиялық қасиеттерін зерттеу қажет. Осының негізінде шикізат сертификацияланады және әр сорт үшін өнеркәсіптік қолданылуының нақты бағыттары анықталады Бейметалл пайдалы қазбаларды өнеркөсіптік қолданылуы бойынша жіктеу, олардың әр түрлілігіне және пайдаланылуының көп мақсаттылығына байланысты күрделі мәселе болып табылады. Жіктелімдер ішінде ең белгілілері - П.М.Татаринов, Б.М.Крейтер, Б.Бейтс, И.Ф.Романович, В.М.Борзунов, Н.П.Ермаков пен В.И.Смирнов ұсынған нұсқалары. Олар бейметалл шикізаттың практикалық пайдалану салаларын минералогиялық-петрографиялық ерекшеліктері, пайдалы қасиеттерінің сипаты және өңдеу жағдайлары бойынша бөлуді қарастырады. Жіктелімдердің көпшілігінің басты кемшілігі - бір пайдалы қазбаны өр түрлі жіктелімдік топқа жатқызу қажеттілігіне байланысты болуында.
Қолданылуы[өңдеу
Бейметалл (бейруда) қазбалар - құрамынан металдар өңдірілмейтін, табиғаты мен сипаты жағынан сан түрлі пайдалы қазба түрлерінің үлкен тобы.[1]
Бұл қазбалар халық шаруашылығындағы қолданылу салаларына орай бірнеше түрлерге бөлінеді: химиялық шикізаттар - апатит, фосфориттер, барит, минералды тұздар, күкірт, гипс т. с. е.; отқа төзімді шикізаттар - отқа төзімді саздар, тақтатастар, магнезит, талькті тас т. б.; электротехникалық пьезооптикалық жылу және дыбыстұмшалаушы, мұқалмас, қышқылға және сілтіге төзімді шикізаттар - слюдалар, флюорит, пьезокварц, корунд, хризотил және амфибол-талшықтастар, тальк, диатомит т. б.; құрылыс материалдары - граниттер, базальттар, диабаздар, ізбестастар, мергелдер, саздар, құмдар, кесектастар т. с. е.; асыл, зергерлік және техникалық тастар - алмас, замартас, ақық, халцедон т. б. Тау жыныстары мен минералдардың кейбір түрлері көп жағдайда әртүрлі салаларда колданылуы мүмкін.
Бейметалл пайдалы қазбалардың жіктелімі[өңдеу]
Бейметалл пайдалы ңазбалар өздерінің айрықша физикалық және физикалық-химиялық ңасиеттері, минералдық құрамының ерекшеліктері, сонымен қатар әр түрлі өнімдер мен материалдар алу мүмкіндігі бойынша кең пайдаланылады. Олар құрамынан металдар айырып алуға ( калий , магний , натрий , т.б. айтпағанда) және табиғи отын ретінде (зымыран отыны болатын бор қосылыстары мен фтор қосылыстарын санамағанда) қолданылмайды. Бейметалл пайдалы қазбалар тобы түрлерінің саны бойынша металл пайдалы қазбалар тобы мен жанғыш пайдалы қазбалардан әлдеңайда көп. Бейметалл пайдалы қазбалар табиғи түрінде немесе алдын ала өңдеуден кейін пайдаланылады. Табиғи күйде қолданылатындар - минералдар мен таужыныстар; асбест , қабаттас (слюда), тальк, исланд шпаты, алмас, оптикалық флюорит , асыл және әшекей тастар, анартас, корунд сияқты өнеркәсіптік минералдар; құм, гравий, ңүрылыс тастары (магмалық, метаморфтық және шөгінді таужыныстар); оттөзімді, жылуоқшаулауыш және байланыстырушы материалдар ретінде пайдаланылатын графит , диатомит, магнезит пен доломит; астұз , цеолит, бентонит және басқа табиғи сорбенттер. Өңделген күйде пайдаланылатындар - шыны (кварц құм, далашпат), керамика , қышқылтөзімді және жылуоқшаулауыш материалдар (саз, кремний таужыныстар, вермикулит, т.б.), байланыстырғыш заттар (әктас, бор, мергель, гипсит), минералдық тыңайтқыштар (фосфоит, апатит ) , химиялық өнімдер (күкірт , күкірт ті таужыныстар , бораттар, минералдық тұздар, барит , т.б.) алуға жарамды минералдар мен таужыныстар. Өнеркәсіптік өңдеу үдерісінде құнды химиялық элементтер, минералдар мен минералдық агрегаттар алу үшін пайдаланылатын бейметалл пайдалы қазба түрлеріне қатысты "кен" термині қолданылады. Оларға асбест ,графит , слюда (мусковит , флогопит ), апатит , фосфорит , күкірт , барит , калийлі және басқа да көптеген кендер жатады. Бейметалл пайдалы қазбалар металл және жанғыш пайдалы қазбалардан сапасын бағалау мен өнеркәсіптік қолдану бағыттары бойынша айрықшаланады. Оларды зерттегенде маңыздысы - құрамындағы пайдалы компоненттер мөлшерін анықтау ғана емес, бастысы - өңдеу технологиясы мен ақырғы өнеркәсіптік өнімнің сапасына әсер ететін техникалық және физикалық- химиялық қасиеттерін анықтау. Сондықтан бейметалл пайдалы қазбалардың сапасы стандарт, техникалық шарт пен кондиңиялар арқылы шектеліп, олардың әр түрінің, түрлесінің және шикізат сортының өнеркәсіптің белгілі бір саласында қолдану мүмкіндігін анықтайды. Бейметалл пайдалы қазбалар көбінесе көп мақсатта қолданылатын шикізат болып табылады. Мәселен, флюорит өзінің сапасының нақты көрсеткіштеріне байланысты оптикада, шыны, металлургия мен химия өнеркәсібінде; күкірт - ауыл шаруашылығында улы химикаттардың құрамдас бөлігі ретінде, химия , резеңке, қағаз бен тамақ өнеркәсібінде; неолиттер - ауыл шаруашылығында, газдарды, табиғи және ақаба суды тазартуға, металдар айырып алуға қолданылуы мүмкін. Сонымен қатар, көптеген бейметалл пайдалы қазба Қасиеттерінің ортақ болуына байланысты өнеркәсіпте бір-бірін алмастыруы мүмкін. Бұл жағдайлар бейметалл Пайдалы қазба кенорындарының зерттелуі мен өнеркәсіптік құндылығын бағалаудың күрделілігін білдіреді. Пайдалы қазбалар қорын, құнды компоненттер мөлшерін (бейметалл кен үшін), өндіру мен өңдеудің кен-технологияльщ жағдайларын анықтаумен қатар олардың физикалың-механикалық, физикалық- химиялық және технологиялық қасиеттерін зерттеу қажет. Осының негізінде шикізат сертификацияланады және әр сорт үшін өнеркәсіптік қолданылуының нақты бағыттары анықталады Бейметалл пайдалы қазбаларды өнеркөсіптік қолданылуы бойынша жіктеу, олардың әр түрлілігіне және пайдаланылуының көп мақсаттылығына байланысты күрделі мәселе болып табылады. Жіктелімдер ішінде ең белгілілері - П.М.Татаринов, Б.М.Крейтер, Б.Бейтс, И.Ф.Романович, В.М.Борзунов, Н.П.Ермаков пен В.И.Смирнов ұсынған нұсқалары. Олар бейметалл шикізаттың практикалық пайдалану салаларын минералогиялық-петрографиялық ерекшеліктері, пайдалы қасиеттерінің сипаты және өңдеу жағдайлары бойынша бөлуді қарастырады. Жіктелімдердің көпшілігінің басты кемшілігі - бір пайдалы қазбаны өр түрлі жіктелімдік топқа жатқызу қажеттілігіне байланысты болуында.
Қолданылуы[өңдеу]
Қазіргі кезде бейметалл пайдалы қазбалар өздерінің жетекші пайдалы қасиеттері мен өнеркәсіпте қолданылуының басты бағыттары бойынша үш топқа бөлінуі мүмкін: 1) индустриялық шикізат: асыл, әшекей және техникалық тастар - алмас, лағыл (рубин), жақұт (сапфир), зүбаржат (изумруд), табас (топаз), анартас, малахит, ақық, т.б.; пьезооптикалың және электротехникалық шикізат - пьезокварц, исланд шпаты, оптикалық кварц, оптикалық флюорит , мусковит , флогопит ; жылу- және дыбысоқшаулауыш, қышқыл және сілтітөзімді, сонымен қатар оттөзімді материалдар мен металлургиядағы қоспа шикізат - графит , асбест (хризотил мен амфибал), тальк, магнезит, флюорит , ауыртас ( барит ), витерит; табиғи оптағыш-жұтқыштар (сорбенттер) - цеолит, бентонит, т.б.; 2) химиялық және агрономиялық шикізат: минералдық тұздар - калийлі, калий -[[ магнийлі, астұз , натрий сульфаты, табиғи сода; фосфор шикізаты - апатит пен фосфорит; күкірт пен бор шикізаты; 3) кұрылыс материалдар өнеркәсібі үшін минералдық шикізат: жеңіл бетон толтырғыштар мен жылуоқшауағыш материалдар өндірісі үшін - көбіктас (пемза), жанартау және әкті туф, диатомит, трепел, опока, перит, вермикулит; құрылыстық және қаптама тас - магмалық, шөгінді және метаморфтық таужыныстар; байланыстырушы материалдар өндірісінің шикізаты - карбонат таужыныстар, гипсит пен ангидрит; құрылыстық құм мен құм-гравий материал; керамикалық шикізатсаз бенкаолин , далашпат, пегматит; шыны шикізаты; тасқұю шикізаты; минералдық пигменттер. Индустриялық шикізатқа біріктірілген пайдалы қазбалар - айрықша физикалық қасиеттері бар (жылуға төзімді, оттөзімді, қаттылыгы жоғары, пьезоәлектрлік және оптикалық қасиеттері бар, т.б.) минералдар мен таужыныстар. Олар табиғи күйінде немесе байытылғаннан кейін пайдаланылады. Химиялық және агрономиялық кен құнды химиялық элементтер мен қосылыстар айырып алу үшін терең өңдеуден өтеді. Ал үшінші топқа жататындар - құрылыс материалдары өнеркәсібінде табиғи күйінде, сонымен қатар термикалық немесе физикалық - химиялық өңдеуден кейін қолданылатын тау-жыныстар. Бұл бөлінген топтардың шекарасы қатаң емес. Көп мақсатта қолданылатын бейметалл пайдалы қазбалардың жекелеген түрлері ( барит , магнезит , гипс, ангидрит, флюорит , кварц, далашпат, нефелин, т.б.) жіктелімнің әр түрлі тобына жатқызылуы мүмкін. [2]
Қазіргі кезде бейметалл пайдалы қазбалар өздерінің жетекші пайдалы қасиеттері мен өнеркәсіпте қолданылуының басты бағыттары бойынша үш топқа бөлінуі мүмкін: 1) индустриялық шикізат: асыл, әшекей және техникалық тастар - алмас, лағыл (рубин), жақұт (сапфир), зүбаржат (изумруд), табас (топаз), анартас, малахит, ақық, т.б.; пьезооптикалың және электротехникалық шикізат - пьезокварц, исланд шпаты, оптикалық кварц, оптикалық флюорит , мусковит , флогопит ; жылу- және дыбысоқшаулауыш, қышқыл және сілтітөзімді, сонымен қатар оттөзімді материалдар мен металлургиядағы қоспа шикізат - графит , асбест (хризотил мен амфибал), тальк, магнезит, флюорит , ауыртас ( барит ), витерит; табиғи оптағыш-жұтқыштар (сорбенттер) - цеолит, бентонит, т.б.; 2) химиялық және агрономиялық шикізат: минералдық тұздар - калийлі, калий -[[ магнийлі, астұз , натрий сульфаты, табиғи сода; фосфор шикізаты - апатит пен фосфорит; күкірт пен бор шикізаты; 3) кұрылыс материалдар өнеркәсібі үшін минералдық шикізат: жеңіл бетон толтырғыштар мен жылуоқшауағыш материалдар өндірісі үшін - көбіктас (пемза), жанартау және әкті туф, диатомит, трепел, опока, перит, вермикулит; құрылыстық және қаптама тас - магмалық, шөгінді және метаморфтық таужыныстар; байланыстырушы материалдар өндірісінің шикізаты - карбонат таужыныстар, гипсит пен ангидрит; құрылыстық құм мен құм-гравий материал; керамикалық шикізатсаз бенкаолин , далашпат, пегматит; шыны шикізаты; тасқұю шикізаты; минералдық пигменттер. Индустриялық шикізатқа біріктірілген пайдалы қазбалар - айрықша физикалық қасиеттері бар (жылуға төзімді, оттөзімді, қаттылыгы жоғары, пьезоәлектрлік және оптикалық қасиеттері бар, т.б.) минералдар мен таужыныстар. Олар табиғи күйінде немесе байытылғаннан кейін пайдаланылады. Химиялық және агрономиялық кен құнды химиялық элементтер мен қосылыстар айырып алу үшін терең өңдеуден өтеді. Ал үшінші топқа жататындар - құрылыс материалдары өнеркәсібінде табиғи күйінде, сонымен қатар термикалық немесе физикалық - химиялық өңдеуден кейін қолданылатын тау-жыныстар. Бұл бөлінген топтардың шекарасы қатаң емес. Көп мақсатта қолданылатын бейметалл пайдалы қазбалардың жекелеген түрлері ( барит , магнезит , гипс, ангидрит, флюорит , кварц, далашпат, нефелин, т.б.) жіктелімнің әр түрлі тобына жатқызылуы мүмкін. [2]
Сабақтың тақырыбы: Химиялық өндірістің жалпы ғылыми принциптері.
Қазақстандағы металлургия өндірісі, түсті және қара металдар және
оның құймаларын өндіру Сабақтың мақсаты: 1) жалпы құймалар туралы
түсінік беру. 2) өркениетті елде металдарды және олардың құймаларын
алу, пайдалану, сол арқылы техниканың, қнеркәсіптің дамуы туралы
айайту. 3) оқушыларды ұйымшылдыққа, тәртіптілікке, үнемшілдікке
тәрбиелеу.
Сабақтың түрі: жаңа тақырыпты түсіндіру.
Сабақтың әдісі: жекелей деңгейлік жұмыс, топпен жұмыс.
Сабақтың тәсілі: сұрақ - жауап, тест, Венн диаграммасы, есеп
шығару.
Сабақтың көрнекілігі: «кейбір құймалардың қасиеттері, қолданылуы,
құрамы» кестесі, тайқазан, алтын адам суреттері.
Пән аралық байланыс: география, тарих, информатика.
Сабақтың барысы: 1. Ұйымдастыру
2. Үй тапсырмасын тексеру
ІІІ. Жаңа сабақ: Жұмбақ: Екі немесе одан да көп металдан тұратын
жүйені қалай атайды?(құймалар). құймалар металдар мен кейбір
бейметалдардың бір-бірінде балқыған күйде еруінен түзіледі.
Тайқазан 1399 жылы Түркістанда 7 металдан құйылған: 1. Темір (Ғе)
2. Мырыш (Zn) 3. Қалайы (Sn) 4. Қорғасын (Рb) 5. Мыс (Сu) 6. Күміс
(Аg) 7. Алтын (Аu)
Алтын адам Б.з.д. V ғ.Есік қорғанынан табылған сақ жауынгер. Ол
4000 астам алтын әшекейлермен безендірілген. шойын ,темір құймалары
,болат
-
Еңбек ресурстарын,Еңбек ресурстарын, шикізатты, энергияны жәнешикізатты, энергияны және қаржыны мейлінше аз жұмсапқаржыны мейлінше аз жұмсап адам мен қоршаған ортағаадам мен қоршаған ортаға мейлінше аз зиян келтіремейлінше аз зиян келтіре отырып, мейлінше арзан өнімотырып, мейлінше арзан өнім алу.алу.
-
. Процестердің үздіксіз принципі Қарсы ағыс принципі Реакция жылуын іске жарату принципі Жалған қайнайтын қабат принципі Өндірістік қалдықтарды қолдану принципі Жалпы технологиялық принциптер
-
Пайдалы қазбалар - химиялықПайдалы қазбалар - химиялық өнеркәсіп шикізатыөнеркәсіп шикізаты Табиғи ресурстар Қалпына келетін Қалпына келмейтін
-
Пайдалы қазбаларды қолдану салалары І-топ Отын-энергетикалық минералды заттар (көмір, мұнай, табиғи газ, шымтезек, уран) V-топ Гидроминералды пайдалы қазбалар (жерасты тұщы сулары және минералды сулар)ІV- топ Құрылыс материалдары, жасанды және бағалы тастар (гранит, мәрмәр, яшма, агат, алмаз және т.б.) ІІІ-топ Химиялық шикізат: күкірт, калий тұздары, апатиттер, фосфориттер және т.б; ІІ-топ Металдар кендері: қара (темір), түсті(мыс, мырыш), сирек және асыл (ванадий, германий және т.б.)
ІҮ Сабақты бекіту: Жеке тапсырмалар: 1.Металлургия дегеніміз не?
(кен құрамынан металл өндірумен айналысатын өндіріс саласы).
2.Металлургия неше топқа бөлінеді, қандай? (2 топқа, қара және
түсті). 3.Металдар туралы қандай ғылым дамуда? (металл тану).
4.Асыл металдарға қандай металдар жатады? (алтын, күміс, платина).
5.Сирек металдар нешеге бөлінеді, қалай аталады, металл
мысалдарымен?(5-ке:1-қиын балқитындар:вольфрам, молибден, тантал,
ванадий, ниобий,цирконий; 2-жеңіл металдар:литий, берилий, рубидий;
3-шашыраңқы металдар:галлий, индий, таллий, гафний, рений, теллур;
4-сирек жер металдар:селен, иттрий, барий; 5-радиактивті металдар:
радий, уран, торий, актиний). 6.Металдарды алу неше топқа бөлінеді,
қалай аталады?(3 топқа:1-гидрометаллургия; 2-пирометаллургия;
3-электрометаллургия). 7.Металлотермия дегеніміз не? (қосылыстар
құрамынан металды басқа металдар арқылы тотықсыздандыру).
Ү. Қорытынды: бағалау.
ҮІ үй тапсырмасы: §9,2-9,3 тапсырмалар, есептер.
10а химия Сабақтың тақырыбы: Металдарды өндірудің электролиз
әдісі, жанасу әдісімен күкірт қышқылын өндіру, аммиак, азот
қышқылын өндіру. Қазақстандағы силикат өнеркәсібі. Сабақтың
мақсаты: 1) Металдарды өндірудің электролиз әдісі, жанасу әдісімен
күкірт қышқылын өндіру, аммиак, азот қышқылын өндіру туралы түсінік
беру. 2) өркениетті елде металдарды және олардың құймаларын алу,
пайдалану, сол арқылы техниканың, өнеркәсіптің дамуы туралы айту.
3) оқушыларды ұйымшылдыққа, тәртіптілікке, үнемшілдікке тәрбиелеу.
Сабақтың түрі: жаңа тақырыпты түсіндіру.
Сабақтың әдісі: жекелей деңгейлік жұмыс, топпен жұмыс.
Сабақтың тәсілі: сұрақ - жауап, тест, Венн диаграммасы, есеп
шығару.
Сабақтың көрнекілігі: суреттер, сызбанұсқалар Пән аралық байланыс:
география, тарих, информатика.
Сабақтың барысы: 1. Ұйымдастыру
2. Үй тапсырмасын тексеру
ІІІ. Жаңа сабақ: Жоспары
-
Металдарды өндірудің электролиз әдісі, жанасу әдісімен күкірт қышқылын өндіру,
-
Аммиак өндіру
-
Азот қышқылын өндіру.
-
Қазақстандағы силикат өнеркәсібі
*Еңбек ресурстарын, шикізатты, энергияны жәнешикізатты, энергияны және қаржыны мейлінше аз жұмсапқаржыны мейлінше аз жұмсап адам мен қоршаған ортағаадам мен қоршаған ортаға мейлінше аз зиян келтіремейлінше аз зиян келтіре отырып, мейлінше арзан өнімотырып, мейлінше арзан өнім алу.алу.
-
. Процестердің үздіксіз принципі Қарсы ағыс принципі Реакция жылуын іске жарату принципі Жалған қайнайтын қабат принципі Өндірістік қалдықтарды қолдану принципі Жалпы технологиялық принциптер
-
Пайдалы қазбалар - химиялықПайдалы қазбалар - химиялық өнеркәсіп шикізатыөнеркәсіп шикізаты Табиғи ресурстар Қалпына келетін Қалпына келмейтін
-
Пайдалы қазбаларды қолдану салалары І-топ Отын-энергетикалық минералды заттар (көмір, мұнай, табиғи газ, шымтезек, уран) V-топ Гидроминералды пайдалы қазбалар (жерасты тұщы сулары және минералды сулар)ІV- топ Құрылыс материалдары, жасанды және бағалы тастар (гранит, мәрмәр, яшма, агат, алмаз және т.б.) ІІІ-топ Химиялық шикізат: күкірт, калий тұздары, апатиттер, фосфориттер және т.б; ІІ-топ Металдар кендері: қара (темір), түсті(мыс, мырыш), сирек және асыл (ванадий, германий және т.б.)
ІҮ Сабақты бекіту: Жеке тапсырмалар: 1.Металлургия дегеніміз не?
(кен құрамынан металл өндірумен айналысатын өндіріс саласы).
2.Металлургия неше топқа бөлінеді, қандай? (2 топқа, қара және
түсті). 3.Металдар туралы қандай ғылым дамуда? (металл тану).
4.Асыл металдарға қандай металдар жатады? (алтын, күміс, платина).
5.Сирек металдар нешеге бөлінеді, қалай аталады, металл
мысалдарымен?(5-ке:1-қиын балқитындар:вольфрам, молибден, тантал,
ванадий, ниобий,цирконий; 2-жеңіл металдар:литий, берилий, рубидий;
3-шашыраңқы металдар:галлий, индий, таллий, гафний, рений, теллур;
4-сирек жер металдар:селен, иттрий, барий; 5-радиактивті металдар:
радий, уран, торий, актиний). 6.Металдарды алу неше топқа бөлінеді,
қалай аталады?(3 топқа:1-гидрометаллургия; 2-пирометаллургия;
3-электрометаллургия). 7.Металлотермия дегеніміз не? (қосылыстар
құрамынан металды басқа металдар арқылы тотықсыздандыру).
Ү. Қорытынды: бағалау.
ҮІ үй тапсырмасы: §9,7-9,12 тапсырмалар, есептер.
10б Сабақтың тақырыбы: Құймалар, коррозия түрлері және оның
алдын алу шаралары, металдардың қолданылуы және олардың тірі
ағзалар тіршілігіндегі маңызы
Сабақтың мақсаты: 1) жалпы құймалар туралы түсінік беру. 2)
өркениетті елде металдарды және олардың құймаларын алу, пайдалану,
сол арқылы техниканың, қнеркәсіптің дамуы туралы айайту. 3)
оқушыларды ұйымшылдыққа, тәртіптілікке, үнемшілдікке тәрбиелеу.
Сабақтың түрі: жаңа тақырыпты түсіндіру.
Сабақтың әдісі: жекелей деңгейлік жұмыс, топпен жұмыс.
Сабақтың тәсілі: сұрақ - жауап, тест, Венн диаграммасы, есеп
шығару.
Сабақтың көрнекілігі: «кейбір құймалардың қасиеттері, қолданылуы,
құрамы» кестесі, тайқазан, алтын адам суреттері.
Пән аралық байланыс: география, тарих, информатика.
Сабақтың барысы: 1. Ұйымдастыру
2. Үй тапсырмасын тексеру
Жеке тапсырмалар: 1.Металлургия дегеніміз не? (кен құрамынан металл
өндірумен айналысатын өндіріс саласы). 2.Металлургия неше топқа
бөлінеді, қандай? (2 топқа, қара және түсті). 3.Металдар туралы
қандай ғылым дамуда? (металл тану). 4.Асыл металдарға қандай
металдар жатады? (алтын, күміс, платина). 5.Сирек металдар нешеге
бөлінеді, қалай аталады, металл мысалдарымен?(5-ке:1-қиын
балқитындар:вольфрам, молибден, тантал, ванадий, ниобий,цирконий;
2-жеңіл металдар:литий, берилий, рубидий; 3-шашыраңқы
металдар:галлий, индий, таллий, гафний, рений, теллур; 4-сирек жер
металдар:селен, иттрий, барий; 5-радиактивті металдар: радий, уран,
торий, актиний). 6.Металдарды алу неше топқа бөлінеді, қалай
аталады?(3 топқа:1-гидрометаллургия; 2-пирометаллургия;
3-электрометаллургия). 7.Металлотермия дегеніміз не? (қосылыстар
құрамынан металды басқа металдар арқылы тотықсыздандыру).
ІІІ. Жаңа сабақ: Жұмбақ: Екі немесе одан да көп металдан тұратын
жүйені қалай атайды?(құймалар). құймалар металдар мен кейбір
бейметалдардың бір-бірінде балқыған күйде еруінен түзіледі.
Тайқазан 1399 жылы Түркістанда 7 металдан құйылған:
1. Темір (Ғе) 2. Мырыш (Zn) 3. Қалайы (Sn) 4. Қорғасын (Рb) 5. Мыс
(Сu) 6. Күміс (Аg) 7. Алтын (Аu)
Алтын адам
Б.з.д. V ғ.Есік қорғанынан
табылған сақ жауынгер. Ол 4000 астам алтын әшекейлермен
безендірілген.
шойын ,темір құймалары ,болат
ІҮ Сабақты бекіту: 2-нұсқада тест тапсырмасын орындату.
І-нұсқа
1. Термиттің жану реакциясының нәтижесінде 8АІ + 3Ғе3О4 ═ 4АІ2О3 +
9Ғе + 800 кДж 160 кДж жылу бөлінсе, қанша алюминий реакцияға
түскен? А.88,4г; Ә.8,6г; Б.43,2г; В.4,32г.
2. Алюминий мен мыстан тұратын қоспа 10г тұз қышқылымен
әрекеттескенде 6,72л (қ.ж.) сутек бөлінсе, қоспаның құрамы қандай?
А.46% Cu, 54% AI; Ә.50% Cu, 50% AI; Б.55% Cu, 45% AI; В.40% Cu, 60%
AI;
3. Массасы 2т глиноземнен (АІ2О3) 1т алюминий алынса, өнімнің
шығымы қандай? А.93,7%; Ә.95,24%; Б.98,2%; В.99,3%;
4. Массасы 2,1г магний мен алюминийден тұратын қоспа тұз қышқылымен
әрекеттескенде 2,24л (қ.ж.) сутек бөлінген. Бастапқы қоспаның
құрамы қандай? А.72% AI, 28% Mg; Ә.45% AI, 55% Mg; Б.50% AI, 50%
Mg; В.42% AI, 57,14% Mg.
5. Мына реакция нәтижесінде қандай зат түзіледі? АІ(ОН)СІ2 + 2NaOH
→ А.АІ(ОН)3; Ә.АІ(ОН)2СІ; Б.АІСІ3; В.NaАІО2.
6. Алюминийді электролиз әдісімен өндіргенде алюминий оксидіне -
криолит (Na3AIF6) не үшін қосылады? А.электр өткізгіштігін арттыру
үшін; Ә.АІ2О3 -дін еріту үшін; Б.АІ2О3 - нің балқу температурасын
төмендету үшін; В.электр өткізгіштігін азайту үшін;
7. Алюминий сульфатының ерітіндісіне соданың ерітіндісін қосқанда
не түзіледі? А.АІ2(СО3)3; Ә.АІ(ОН)3; Б.АІОНSО4; В.NaАІО2.
ІІ-нұсқа
1. Егер массасы 13г темір, мыс, алюминийден тұратын қоспаға натрий
гидроксиді ерітіндісімен әсер еткенде 6,72л газ бөлінсе, ал тұз
қышқылымен әсер еткенде 8,96л газ бөлінсе (қ.ж.) қоспа құрамы
қандай? А.5,4г АІ, 5,6г Ғе, 2г Сu; Ә.2,7г АІ, 5,6г Ғе, 4,7г Сu;
Б.2,7г АІ, 2,8г Ғе, 7,5г Сu; В.5,4г АІ, 2,8г Ғе, 4,8г Сu;
2. Массасы 10г темір (ІІ,ІІІ) сульфаттарының қоспасымен қышқыл
ортада (Н2SО4) әрекеттесу үшін 1ғ58г калий перманганаты
жұмсалды.Қоспа құрамы қандай болған? А.5г ҒеSО4, 5г Ғе2(SО4)3;
Ә2,5г ҒеSО4, 7,5г Ғе2(SО4)3; Б.7,6г ҒеSО4, 2,4г Ғе2(SО4)3; В.9г
ҒеSО4, 1г Ғе2(SО4)3;
3. Массасы 31,9г мыс (ІІ) оксиді мен темір (ІІІ) оксидінің қоспасын
термиялық тотықсыздандырғанда 9г су түзілсе, алынған қоспадағы
металдардың массалық үлестері қандай? А.22% Сu және 78%Ғе; Ә.12% Сu
және 88%Ғе; Б.50% Сu және 50%Ғе; В.75% Сu және 15%Ғе;
4. Массасы 31,9г мыс (ІІ) оксиді мен темір (ІІІ) оксидінің қоспасын
термиялық тотықсыздандырғанда 9г су түзілгендігі белгілі болса,осы
қоспадан неше моль темір алуға болады? А.0,2моль; Ә.2моль;
Б.0,1моль; В.1моль.
5. Мыс пен темір қоспасын концентрлі НNО3-пен өңдегенде 4,48л газ
бөлінген, ал сол қоспаға НСІ-мен әсер еткенде 2,24л газ бөлінген
(қ.ж.). Қоспа массасы қандай? А.5,6г; Ә.6,35г; Б.11,95г; В.18,3г.
6. Құрамында 10% қоспасы бар темір (ІІІ) оксидінен тұратын 200г
темір рудасын толық тотықсыздандыру үшін неше грамм көміртегі
қажет? А.40,5г; Ә.4,05г; Б.20,25г ; В.2,25г;
7. Құрамында 95% темірі бар 1т құйма алу үшін, құрамында 78% темір
оксиді бар қызыл теміртастан қанша кг қажет? А.950кг; Ә.1357кг;
Б.1600кг; В.1740кг.
Жауаптары: І-нұсқа ІІ-нұсқа
1)Б 1)А 2)А 2)Б 3)Ә 3)А 4)В 4)А 5)А 5)Б 6)Б 6)Б
7)Ә 7)Б
Ү. Қорытынды: бағалау.
ҮІ үй тапсырмасы: қосымша ақпарат есептер
10а химия Сабақтың тақырыбы: Құймалар, олардың атауы, құрамы,
қасиеті, қолданылуы. Шойын және болар өндіру. №8 көрсетілімдер
Сабақтың мақсаты: 1) жалпы құймалар туралы түсінік беру. 2)
өркениетті елде металдарды және олардың құймаларын алу, пайдалану,
сол арқылы техниканың, қнеркәсіптің дамуы туралы айайту. 3)
оқушыларды ұйымшылдыққа, тәртіптілікке, үнемшілдікке тәрбиелеу.
Сабақтың түрі: жаңа тақырыпты түсіндіру.
Сабақтың әдісі: жекелей деңгейлік жұмыс, топпен жұмыс.
Сабақтың тәсілі: сұрақ - жауап, тест, Венн диаграммасы, есеп
шығару.
Сабақтың көрнекілігі: «кейбір құймалардың қасиеттері, қолданылуы,
құрамы» кестесі, тайқазан, алтын адам суреттері.
Пән аралық байланыс: география, тарих, информатика.
Сабақтың барысы: 1. Ұйымдастыру
2. Үй тапсырмасын тексеру
Жеке тапсырмалар: 1.Металлургия дегеніміз не? (кен құрамынан металл
өндірумен айналысатын өндіріс саласы). 2.Металлургия неше топқа
бөлінеді, қандай? (2 топқа, қара және түсті). 3.Металдар туралы
қандай ғылым дамуда? (металл тану). 4.Асыл металдарға қандай
металдар жатады? (алтын, күміс, платина). 5.Сирек металдар нешеге
бөлінеді, қалай аталады, металл мысалдарымен?(5-ке:1-қиын
балқитындар:вольфрам, молибден, тантал, ванадий, ниобий,цирконий;
2-жеңіл металдар:литий, берилий, рубидий; 3-шашыраңқы
металдар:галлий, индий, таллий, гафний, рений, теллур; 4-сирек жер
металдар:селен, иттрий, барий; 5-радиактивті металдар: радий, уран,
торий, актиний). 6.Металдарды алу неше топқа бөлінеді, қалай
аталады?(3 топқа:1-гидрометаллургия; 2-пирометаллургия;
3-электрометаллургия). 7.Металлотермия дегеніміз не? (қосылыстар
құрамынан металды басқа металдар арқылы тотықсыздандыру).
ІІІ. Жаңа сабақ: Жұмбақ: Екі немесе одан да көп металдан тұратын
жүйені қалай атайды?(құймалар). құймалар металдар мен кейбір
бейметалдардың бір-бірінде балқыған күйде еруінен түзіледі.
Тайқазан 1399 жылы Түркістанда 7 металдан құйылған:
1. Темір (Ғе) 2. Мырыш (Zn) 3. Қалайы (Sn) 4. Қорғасын (Рb) 5. Мыс
(Сu) 6. Күміс (Аg) 7. Алтын (Аu)
Алтын адам
Б.з.д. V ғ.Есік қорғанынан
табылған сақ жауынгер. Ол 4000 астам алтын әшекейлермен
безендірілген.
шойын ,темір құймалары ,болат
ІҮ Сабақты бекіту: 2-нұсқада тест тапсырмасын орындату.
І-нұсқа
1. Термиттің жану реакциясының нәтижесінде 8АІ + 3Ғе3О4 ═ 4АІ2О3 +
9Ғе + 800 кДж 160 кДж жылу бөлінсе, қанша алюминий реакцияға
түскен? А.88,4г; Ә.8,6г; Б.43,2г; В.4,32г.
2. Алюминий мен мыстан тұратын қоспа 10г тұз қышқылымен
әрекеттескенде 6,72л (қ.ж.) сутек бөлінсе, қоспаның құрамы қандай?
А.46% Cu, 54% AI; Ә.50% Cu, 50% AI; Б.55% Cu, 45% AI; В.40% Cu, 60%
AI;
3. Массасы 2т глиноземнен (АІ2О3) 1т алюминий алынса, өнімнің
шығымы қандай? А.93,7%; Ә.95,24%; Б.98,2%; В.99,3%;
4. Массасы 2,1г магний мен алюминийден тұратын қоспа тұз қышқылымен
әрекеттескенде 2,24л (қ.ж.) сутек бөлінген. Бастапқы қоспаның
құрамы қандай? А.72% AI, 28% Mg; Ә.45% AI, 55% Mg; Б.50% AI, 50%
Mg; В.42% AI, 57,14% Mg.
5. Мына реакция нәтижесінде қандай зат түзіледі? АІ(ОН)СІ2 + 2NaOH
→ А.АІ(ОН)3; Ә.АІ(ОН)2СІ; Б.АІСІ3; В.NaАІО2.
6. Алюминийді электролиз әдісімен өндіргенде алюминий оксидіне -
криолит (Na3AIF6) не үшін қосылады? А.электр өткізгіштігін арттыру
үшін; Ә.АІ2О3 -дін еріту үшін; Б.АІ2О3 - нің балқу температурасын
төмендету үшін; В.электр өткізгіштігін азайту үшін;
7. Алюминий сульфатының ерітіндісіне соданың ерітіндісін қосқанда
не түзіледі? А.АІ2(СО3)3; Ә.АІ(ОН)3; Б.АІОНSО4; В.NaАІО2.
ІІ-нұсқа
1. Егер массасы 13г темір, мыс, алюминийден тұратын қоспаға натрий
гидроксиді ерітіндісімен әсер еткенде 6,72л газ бөлінсе, ал тұз
қышқылымен әсер еткенде 8,96л газ бөлінсе (қ.ж.) қоспа құрамы
қандай? А.5,4г АІ, 5,6г Ғе, 2г Сu; Ә.2,7г АІ, 5,6г Ғе, 4,7г Сu;
Б.2,7г АІ, 2,8г Ғе, 7,5г Сu; В.5,4г АІ, 2,8г Ғе, 4,8г Сu;
2. Массасы 10г темір (ІІ,ІІІ) сульфаттарының қоспасымен қышқыл
ортада (Н2SО4) әрекеттесу үшін 1ғ58г калий перманганаты
жұмсалды.Қоспа құрамы қандай болған? А.5г ҒеSО4, 5г Ғе2(SО4)3;
Ә2,5г ҒеSО4, 7,5г Ғе2(SО4)3; Б.7,6г ҒеSО4, 2,4г Ғе2(SО4)3; В.9г
ҒеSО4, 1г Ғе2(SО4)3;
3. Массасы 31,9г мыс (ІІ) оксиді мен темір (ІІІ) оксидінің қоспасын
термиялық тотықсыздандырғанда 9г су түзілсе, алынған қоспадағы
металдардың массалық үлестері қандай? А.22% Сu және 78%Ғе; Ә.12% Сu
және 88%Ғе; Б.50% Сu және 50%Ғе; В.75% Сu және 15%Ғе;
4. Массасы 31,9г мыс (ІІ) оксиді мен темір (ІІІ) оксидінің қоспасын
термиялық тотықсыздандырғанда 9г су түзілгендігі белгілі болса,осы
қоспадан неше моль темір алуға болады? А.0,2моль; Ә.2моль;
Б.0,1моль; В.1моль.
5. Мыс пен темір қоспасын концентрлі НNО3-пен өңдегенде 4,48л газ
бөлінген, ал сол қоспаға НСІ-мен әсер еткенде 2,24л газ бөлінген
(қ.ж.). Қоспа массасы қандай? А.5,6г; Ә.6,35г; Б.11,95г; В.18,3г.
6. Құрамында 10% қоспасы бар темір (ІІІ) оксидінен тұратын 200г
темір рудасын толық тотықсыздандыру үшін неше грамм көміртегі
қажет? А.40,5г; Ә.4,05г; Б.20,25г ; В.2,25г;
7. Құрамында 95% темірі бар 1т құйма алу үшін, құрамында 78% темір
оксиді бар қызыл теміртастан қанша кг қажет? А.950кг; Ә.1357кг;
Б.1600кг; В.1740кг.
Жауаптары: І-нұсқа ІІ-нұсқа
1)Б 1)А 2)А 2)Б 3)Ә 3)А 4)В 4)А 5)А 5)Б 6)Б 6)Б
7)Ә 7)Б
Ү. Қорытынды: бағалау.
ҮІ үй тапсырмасы: §9.4-9.6 оқу, қосымша ақпарат, есептер
Химия 10а Өтілген күні
Сабақтың тақырыбы:Сабақтың мақсаты:
білімділігі
дамытушылығы
тәрбиелілігі
Сабақтың көрнекілігі:
Сабақтың барысы:
«Білу» теориясы
«Білу» практикасы
«Жинақтау, білу»
№4 бақылау жұмысы
р-элементтері және олардың қосылыстарының қасиеттері, алу әдістері, маңызы жөніндегі білімдерін тексеру
Оқушылардың есте сақтау және логикалық ой-өрістерін дамыту
Тапсырмаларды түсініп, таза ұқыпты орындау
-
Интерактивті тақта
-
Бақылау тапсырмалары
І. Ұйымдастыру
ІІ..Жаңа сабақ
І нұсқа
1..Мына айналуларды жүзеге асыруға болатын реакциятеңдеулерін жазыңдар:
АІ(NO3)3 → АІ(OH)3
↑
AI → АІ(OH)3 →Na[АІ(OH)4]
↓
АІ2O3 → АІ2(SO4)3
Ион алмасу реакциялары үшін иондық теңдеулерді, ал тотығу - тотықсыздану
реакциялары үшін электрондық баланс теңдеулерін жазыңдар.
2.Нөмірленген үш сынауықта құрылыс материялдарының үлгілері берілген:
кварц құмы, сөндірілмеген әк, мәрмәр. Сәйкес реакциялардың көмегімен
әрбір затты қалай анықтауға болады? Жүретін реакция теңдеулерін жазыңдар.
3.Массасы 30г кремний оксидін 30г натрий гидроксидімен балқытқанда алыну
мүмкін натрий силикатының массасын (г) есептеңдер
4. Азот қышқылының массалық үлесі 42% болатын массасы 300 г ерітіндісі
арқылы аммиактың артық мөлшерін жібергенде, массасы 150 г аммоний нитраты алында. Аммоний нитраты шығымының массалық үлесін (%) анықтаңдар
2. 5.Күкірт (IV) оксиді мына заттардың қайсысымен әрекеттеседі?
Калий гидроксиді, тұз қышқылы, сутек, су, оттек, барий оксиді,
мырыш гидроксді,көмірқышқыл газы, литий оксиді, күкіртсутек.
Мүмкін болатын реакция теңдеулерін жазыңдар. Ион алмасу реакциялары үшін иондық
теңдеулерін, тотығу - тотықсыздану реакциялары үшін электрондық баланс теңдеулерін құрастырыңдар
ІІ нұсқа
2. 1.Мына айналуларды жүзеге асыруға болатын реакция теңдеулерін жазыңдар:
SiO2 Si Mg2Si SiH4 SiO4 Na2SiO3 H2SiO3
Ион алмасу реакциялары үшін иондық теңдеулеоді, ал тотығу-тотықсыздану
реакциялары үшін электрондық баланс теңдеулерін жазыңдар.
2.2. Нөмірленген үш сынауықта мына заттардың ерітінділері берілген :
аммоний нитраты, нарий фосфаты және натрий нитраты. Оларды қалай ажыратуға
болады? Жүретін реакция теңдеулерін жазыңдар.
3.Құрамында 93% таза кальций фосфаты бар 100 кг фосфориттен фосфор қыщқылын қандай массасын алуға болады?
4. 100г мыс тотияйынының ерітіндісіне натрий сульфиді ерітіндісінің артық мөлшері құйылды. Мұнда массасы 2,4г тұнба түзілді. Ерітіндідегі мыс сульфатының массалық үлесін (%) есептеңдер
5. Сұйытылған күкірт қышқылы мына заттардың қайсысымен
әрекеттеседі? Алюминий көмірқышқылы газы, кальций оксиді, оттек,
мыс гидроксиді,барий нитраты, күміс, калий нитраты, кальций карбонаты,
Мүмкін болатын реакция теңдеулерін жазыңдар. Ион алмасу реакциялары үшін
иондық теңдеулерін, тотығу - тотықсыздану реакциялары үшін электрондық
баланс теңдеулерін құрастырыңдар.
Бақылау жұмысын жинау, бағалау
Үйге тапсырма 1.ҮІІІ тарауды қайталау
2. Қосымша тапсырмалар орындау
І нұсқа
1..Мына айналуларды жүзеге асыруға болатын реакциятеңдеулерін жазыңдар:
АІ(NO3)3 → АІ(OH)3
↑
AI → АІ(OH)3 →Na[АІ(OH)4]
↓
АІ2O3 → АІ2(SO4)3
Ион алмасу реакциялары үшін иондық теңдеулерді, ал тотығу - тотықсыздану
реакциялары үшін электрондық баланс теңдеулерін жазыңдар.
2.Нөмірленген үш сынауықта құрылыс материялдарының үлгілері берілген:
кварц құмы, сөндірілмеген әк, мәрмәр. Сәйкес реакциялардың көмегімен
әрбір затты қалай анықтауға болады? Жүретін реакция теңдеулерін жазыңдар.
3.Массасы 30г кремний оксидін 30г натрий гидроксидімен балқытқанда алыну
мүмкін натрий силикатының массасын (г) есептеңдер
4. Азот қышқылының массалық үлесі 42% болатын массасы 300 г ерітіндісі
арқылы аммиактың артық мөлшерін жібергенде, массасы 150 г аммоний нитраты алында.
Аммоний нитраты шығымының массалық үлесін (%) анықтаңдар
. 5.Күкірт (IV) оксиді мына заттардың қайсысымен әрекеттеседі?
Калий гидроксиді, тұз қышқылы, сутек, су, оттек, барий оксиді,
мырыш гидроксді,көмірқышқыл газы, литий оксиді, күкіртсутек.
Мүмкін болатын реакция теңдеулерін жазыңдар. Ион алмасу реакциялары үшін иондық
теңдеулерін, тотығу - тотықсыздану реакциялары үшін электрондық баланс теңдеулерін құрастырыңдар
ІІ нұсқа
1.Мына айналуларды жүзеге асыруға болатын реакция теңдеулерін жазыңдар:
SiO2 Si Mg2Si SiH4 SiO4 Na2SiO3 H2SiO3
Ион алмасу реакциялары үшін иондық теңдеулеоді, ал тотығу-тотықсыздану
реакциялары үшін электрондық баланс теңдеулерін жазыңдар.
.2. Нөмірленген үш сынауықта мына заттардың ерітінділері берілген :
аммоний нитраты, нарий фосфаты және натрий нитраты. Оларды қалай ажыратуға
болады? Жүретін реакция теңдеулерін жазыңдар.
3.Құрамында 93% таза кальций фосфаты бар 100 кг фосфориттен фосфор қыщқылын қандай массасын алуға болады?
4. 100г мыс тотияйынының ерітіндісіне натрий сульфиді ерітіндісінің артық мөлшері құйылды. Мұнда массасы 2,4г тұнба түзілді. Ерітіндідегі мыс сульфатының массалық үлесін (%) есептеңдер
5. Сұйытылған күкірт қышқылы мына заттардың қайсысымен
әрекеттеседі? Алюминий көмірқышқылы газы, кальций оксиді, оттек,
мыс гидроксиді,барий нитраты, күміс, калий нитраты, кальций карбонаты,
Мүмкін болатын реакция теңдеулерін жазыңдар. Ион алмасу реакциялары үшін
иондық теңдеулерін, тотығу - тотықсыздану реакциялары үшін электрондық
баланс теңдеулерін құрастырыңдар.
І нұсқа
1..Мына айналуларды жүзеге асыруға болатын реакциятеңдеулерін жазыңдар:
АІ(NO3)3 → АІ(OH)3
↑
AI → АІ(OH)3 →Na[АІ(OH)4]
↓
АІ2O3 → АІ2(SO4)3
Ион алмасу реакциялары үшін иондық теңдеулерді, ал тотығу - тотықсыздану
реакциялары үшін электрондық баланс теңдеулерін жазыңдар.
2.Нөмірленген үш сынауықта құрылыс материялдарының үлгілері берілген:
кварц құмы, сөндірілмеген әк, мәрмәр. Сәйкес реакциялардың көмегімен
әрбір затты қалай анықтауға болады? Жүретін реакция теңдеулерін жазыңдар.
3.Массасы 30г кремний оксидін 30г натрий гидроксидімен балқытқанда алыну
мүмкін натрий силикатының массасын (г) есептеңдер
4. Азот қышқылының массалық үлесі 42% болатын массасы 300 г ерітіндісі
арқылы аммиактың артық мөлшерін жібергенде, массасы 150 г аммоний нитраты алында.
Аммоний нитраты шығымының массалық үлесін (%) анықтаңдар
. 5.Күкірт (IV) оксиді мына заттардың қайсысымен әрекеттеседі?
Калий гидроксиді, тұз қышқылы, сутек, су, оттек, барий оксиді,
мырыш гидроксді,көмірқышқыл газы, литий оксиді, күкіртсутек.
Мүмкін болатын реакция теңдеулерін жазыңдар. Ион алмасу реакциялары үшін иондық
теңдеулерін, тотығу - тотықсыздану реакциялары үшін электрондық баланс теңдеулерін құрастырыңдар
ІІ нұсқа
1.Мына айналуларды жүзеге асыруға болатын реакция теңдеулерін жазыңдар:
SiO2 Si Mg2Si SiH4 SiO4 Na2SiO3 H2SiO3
Ион алмасу реакциялары үшін иондық теңдеулеоді, ал тотығу-тотықсыздану
реакциялары үшін электрондық баланс теңдеулерін жазыңдар.
.2. Нөмірленген үш сынауықта мына заттардың ерітінділері берілген :
аммоний нитраты, нарий фосфаты және натрий нитраты. Оларды қалай ажыратуға
болады? Жүретін реакция теңдеулерін жазыңдар.
3.Құрамында 93% таза кальций фосфаты бар 100 кг фосфориттен фосфор қыщқылын қандай массасын алуға болады?
4. 100г мыс тотияйынының ерітіндісіне натрий сульфиді ерітіндісінің артық мөлшері құйылды. Мұнда массасы 2,4г тұнба түзілді. Ерітіндідегі мыс сульфатының массалық үлесін (%) есептеңдер
5. Сұйытылған күкірт қышқылы мына заттардың қайсысымен
әрекеттеседі? Алюминий көмірқышқылы газы, кальций оксиді, оттек,
мыс гидроксиді,барий нитраты, күміс, калий нитраты, кальций карбонаты,
Мүмкін болатын реакция теңдеулерін жазыңдар. Ион алмасу реакциялары үшін
иондық теңдеулерін, тотығу - тотықсыздану реакциялары үшін электрондық баланс теңдеулерін құрастырыңдар.
Химия 10б Өтілген күні
Сабақтың тақырыбы:Сабақтың мақсаты:
білімділігі
дамытушылығы
тәрбиелілігі
Сабақтың көрнекілігі:
Сабақтың барысы:
«Білу» теориясы
«Білу» практикасы
«Жинақтау, білу»
Жылдық бақылау жұмысы
р-элементтері және олардың қосылыстарының қасиеттері, алу әдістері, маңызы жөніндегі білімдерін тексеру
Оқушылардың есте сақтау және логикалық ой-өрістерін дамыту
Тапсырмаларды түсініп, таза ұқыпты орындау
1.Интерактивті тақта
2.Бақылау тапсырмалары
І. Ұйымдастыру
ІІ..Жаңа сабақ
І нұсқа
1..Мына айналуларды жүзеге асыруға болатын реакция теңдеулерін жазыңдар:
АІ(NO3)3 → АІ(OH)3
↑
AI → АІ(OH)3 →Na[АІ(OH)4]
↓
АІ2O3 → АІ2(SO4)3
2.Нөмірленген үш сынауықта құрылыс материялдарының үлгілері берілген:
кварц құмы, сөндірілмеген әк, мәрмәр. Сәйкес реакциялардың көмегімен
әрбір затты қалай анықтауға болады? Жүретін реакция теңдеулерін жазыңдар.
3.Массасы 30г кремний оксидін 30г натрий гидроксидімен балқытқанда алыну
мүмкін натрий силикатының массасын (г) есептеңдер
4. Азот қышқылының массалық үлесі 42% болатын массасы 300 г ерітіндісі
арқылы аммиактың артық мөлшерін жібергенде, массасы 150 г аммоний нитраты алында. Аммоний нитраты шығымының массалық үлесін (%) анықтаңдар
2. 5.Күкірт (IV) оксиді мына заттардың қайсысымен әрекеттеседі?
Калий гидроксиді, тұз қышқылы, сутек, су, оттек, барий оксиді,
мырыш гидроксді,көмірқышқыл газы, литий оксиді, күкіртсутек.
Мүмкін болатын реакция теңдеулерін жазыңдар.
ІІ нұсқа
2. 1.Мына айналуларды жүзеге асыруға болатын реакция теңдеулерін жазыңдар:
SiO2 Si Mg2Si SiH4 SiO4 Na2SiO3 H2SiO3
2.2. Нөмірленген үш сынауықта мына заттардың ерітінділері берілген :
аммоний нитраты, нарий фосфаты және натрий нитраты. Оларды қалай ажыратуға
болады? Жүретін реакция теңдеулерін жазыңдар.
3.Құрамында 93% таза кальций фосфаты бар 100 кг фосфориттен фосфор қыщқылын қандай массасын алуға болады?
4. 100г мыс тотияйынының ерітіндісіне натрий сульфиді ерітіндісінің артық мөлшері құйылды. Мұнда массасы 2,4г тұнба түзілді. Ерітіндідегі мыс сульфатының массалық үлесін (%) есептеңдер
5. Сұйытылған күкірт қышқылы мына заттардың қайсысымен
әрекеттеседі? Алюминий көмірқышқылы газы, кальций оксиді, оттек,
мыс гидроксиді,барий нитраты, күміс, калий нитраты, кальций карбонаты,
Мүмкін болатын реакция теңдеулерін жазыңдар.
Бақылау жұмысын жинау, бағалау
Үйге тапсырма 1. І-Ү тарауды қайталау
І нұсқа 1..Мына айналуларды жүзеге асыруға болатын реакция теңдеулерін жазыңдар:
АІ(NO3)3 → АІ(OH)3
↑
AI → АІ(OH)3 →Na[АІ(OH)4]
↓
АІ2O3 → АІ2(SO4)3
2.Нөмірленген үш сынауықта құрылыс материялдарының үлгілері берілген: кварц құмы, сөндірілмеген әк, мәрмәр.
Сәй кес реакциялардың көмегімен әрбір затты қалай анықтауға болады? Жүретін реакция теңдеулерін жазыңдар.
3.Массасы 30г кремний оксидін 30г натрий гидроксидімен балқытқанда алыну мүмкін натрий силикатының массасын (г) есептеңдер
4. Азот қышқылының массалық үлесі 42% болатын массасы 300 г ерітіндісі арқылы аммиактың артық мөлшерін жібергенде,
массасы 150 г аммоний нитраты алында. Аммоний нитраты шығымының массалық үлесін (%) анықтаңдар
5.Күкірт (IV) оксиді мына заттардың қайсысымен әрекеттеседі? Калий гидроксиді, тұз қышқылы, сутек, су, оттек, барий оксиді,
мырыш гидроксді,көмірқышқыл газы, литий оксиді, күкіртсутек. Мүмкін болатын реакция теңдеулерін жазыңдар.
ІІ нұсқа
. 1.Мына айналуларды жүзеге асыруға болатын реакция теңдеулерін жазыңдар:
SiO2 Si Mg2Si SiH4 SiO2 Na2SiO3 H2SiO3
.2. Нөмірленген үш сынауықта мына заттардың ерітінділері берілген :
аммоний нитраты, нарий фосфаты және натрий нитраты. Оларды қалай ажыратуға болады? Жүретін реакция теңдеулерін жазыңдар.
3.Құрамында 93% таза кальций фосфаты бар 100 кг фосфориттен фосфор қыщқылын қандай массасын алуға болады?
4. 100г мыс тотияйынының ерітіндісіне натрий сульфиді ерітіндісінің артық мөлшері құйылды. Мұнда массасы 2,4г тұнба түзілді. Ерітіндідегі мыс сульфатының массалық үлесін (%) есептеңдер
5. Сұйытылған күкірт қышқылы мына заттардың қайсысымен әрекеттеседі? Алюминий көмірқышқылы газы, кальций оксиді, оттек,
мыс гидроксиді,барий нитраты, күміс, калий нитраты, кальций карбонаты. Мүмкін болатын реакция теңдеулерін жазыңдар.
І нұсқа
1..Мына айналуларды жүзеге асыруға болатын реакция теңдеулерін жазыңдар:
АІ(NO3)3 → АІ(OH)3
↑
AI → АІ(OH)3 →Na[АІ(OH)4]
↓
АІ2O3 → АІ2(SO4)3
2.Нөмірленген үш сынауықта құрылыс материялдарының үлгілері берілген: кварц құмы, сөндірілмеген әк, мәрмәр.
Сәй кес реакциялардың көмегімен әрбір затты қалай анықтауға болады? Жүретін реакция теңдеулерін жазыңдар.
3.Массасы 30г кремний оксидін 30г натрий гидроксидімен балқытқанда алыну мүмкін натрий силикатының массасын (г) есептеңдер
4. Азот қышқылының массалық үлесі 42% болатын массасы 300 г ерітіндісі арқылы аммиактың артық мөлшерін жібергенде,
массасы 150 г аммоний нитраты алында. Аммоний нитраты шығымының массалық үлесін (%) анықтаңдар
5.Күкірт (IV) оксиді мына заттардың қайсысымен әрекеттеседі? Калий гидроксиді, тұз қышқылы, сутек, су, оттек, барий оксиді,
мырыш гидроксді,көмірқышқыл газы, литий оксиді, күкіртсутек. Мүмкін болатын реакция теңдеулерін жазыңдар.
ІІ нұсқа
. 1.Мына айналуларды жүзеге асыруға болатын реакция теңдеулерін жазыңдар:
SiO2 Si Mg2Si SiH4 SiO2 Na2SiO3 H2SiO3
.2. Нөмірленген үш сынауықта мына заттардың ерітінділері берілген :
аммоний нитраты, нарий фосфаты және натрий нитраты. Оларды қалай ажыратуға болады? Жүретін реакция теңдеулерін жазыңдар.
3.Құрамында 93% таза кальций фосфаты бар 100 кг фосфориттен фосфор қыщқылын қандай массасын алуға болады?
4. 100г мыс тотияйынының ерітіндісіне натрий сульфиді ерітіндісінің артық мөлшері құйылды. Мұнда массасы 2,4г тұнба түзілді. Ерітіндідегі мыс сульфатының массалық үлесін (%) есептеңдер
5. Сұйытылған күкірт қышқылы мына заттардың қайсысымен әрекеттеседі? Алюминий көмірқышқылы газы, кальций оксиді, оттек,
мыс гидроксиді,барий нитраты, күміс, калий нитраты, кальций карбонаты. Мүмкін болатын реакция теңдеулерін жазыңдар
І нұсқа
1..Мына айналуларды жүзеге асыруға болатын реакция теңдеулерін жазыңдар:
АІ(NO3)3 → АІ(OH)3
↑
AI → АІ(OH)3 →Na[АІ(OH)4]
↓
АІ2O3 → АІ2(SO4)3
2.Нөмірленген үш сынауықта құрылыс материялдарының үлгілері берілген: кварц құмы, сөндірілмеген әк, мәрмәр.
Сәй кес реакциялардың көмегімен әрбір затты қалай анықтауға болады? Жүретін реакция теңдеулерін жазыңдар.
3.Массасы 30г кремний оксидін 30г натрий гидроксидімен балқытқанда алыну мүмкін натрий силикатының массасын (г) есептеңдер
4. Азот қышқылының массалық үлесі 42% болатын массасы 300 г ерітіндісі арқылы аммиактың артық мөлшерін жібергенде,
массасы 150 г аммоний нитраты алында. Аммоний нитраты шығымының массалық үлесін (%) анықтаңдар
5.Күкірт (IV) оксиді мына заттардың қайсысымен әрекеттеседі? Калий гидроксиді, тұз қышқылы, сутек, су, оттек, барий оксиді,
мырыш гидроксді,көмірқышқыл газы, литий оксиді, күкіртсутек. Мүмкін болатын реакция теңдеулерін жазыңдар.
ІІ нұсқа
. 1.Мына айналуларды жүзеге асыруға болатын реакция теңдеулерін жазыңдар:
SiO2 Si Mg2Si SiH4 SiO2 Na2SiO3 H2SiO3
.2. Нөмірленген үш сынауықта мына заттардың ерітінділері берілген :
аммоний нитраты, нарий фосфаты және натрий нитраты. Оларды қалай ажыратуға болады? Жүретін реакция теңдеулерін жазыңдар.
3.Құрамында 93% таза кальций фосфаты бар 100 кг фосфориттен фосфор қыщқылын қандай массасын алуға болады?
4. 100г мыс тотияйынының ерітіндісіне натрий сульфиді ерітіндісінің артық мөлшері құйылды. Мұнда массасы 2,4г тұнба түзілді. Ерітіндідегі мыс сульфатының массалық үлесін (%) есептеңдер
5. Сұйытылған күкірт қышқылы мына заттардың қайсысымен әрекеттеседі? Алюминий көмірқышқылы газы, кальций оксиді, оттек,
мыс гидроксиді,барий нитраты, күміс, калий нитраты, кальций карбонаты. Мүмкін болатын реакция теңдеулерін жазыңдар
10б Сабақтың тақырыбы: Құймалар, коррозия түрлері және оның
алдын алу шаралары, металдардың қолданылуы және олардың тірі
ағзалар тіршілігіндегі маңызы
Сабақтың мақсаты: 1) жалпы құймалар туралы түсінік беру. 2)
өркениетті елде металдарды және олардың құймаларын алу, пайдалану,
сол арқылы техниканың, қнеркәсіптің дамуы туралы айайту. 3)
оқушыларды ұйымшылдыққа, тәртіптілікке, үнемшілдікке тәрбиелеу.
Сабақтың түрі: жаңа тақырыпты түсіндіру.
Сабақтың әдісі: жекелей деңгейлік жұмыс, топпен жұмыс.
Сабақтың тәсілі: сұрақ - жауап, тест, Венн диаграммасы, есеп
шығару.
Сабақтың көрнекілігі: «кейбір құймалардың қасиеттері, қолданылуы,
құрамы» кестесі, тайқазан, алтын адам суреттері.
Пән аралық байланыс: география, тарих, информатика.
Сабақтың барысы: 1. Ұйымдастыру
2. Үй тапсырмасын тексеру
Жеке тапсырмалар: 1.Металлургия дегеніміз не? (кен құрамынан металл
өндірумен айналысатын өндіріс саласы). 2.Металлургия неше топқа
бөлінеді, қандай? (2 топқа, қара және түсті). 3.Металдар туралы
қандай ғылым дамуда? (металл тану). 4.Асыл металдарға қандай
металдар жатады? (алтын, күміс, платина). 5.Сирек металдар нешеге
бөлінеді, қалай аталады, металл мысалдарымен?(5-ке:1-қиын
балқитындар:вольфрам, молибден, тантал, ванадий, ниобий,цирконий;
2-жеңіл металдар:литий, берилий, рубидий; 3-шашыраңқы
металдар:галлий, индий, таллий, гафний, рений, теллур; 4-сирек жер
металдар:селен, иттрий, барий; 5-радиактивті металдар: радий, уран,
торий, актиний). 6.Металдарды алу неше топқа бөлінеді, қалай
аталады?(3 топқа:1-гидрометаллургия; 2-пирометаллургия;
3-электрометаллургия). 7.Металлотермия дегеніміз не? (қосылыстар
құрамынан металды басқа металдар арқылы тотықсыздандыру).
ІІІ. Жаңа сабақ: Жұмбақ: Екі немесе одан да көп металдан тұратын
жүйені қалай атайды?(құймалар). құймалар металдар мен кейбір
бейметалдардың бір-бірінде балқыған күйде еруінен түзіледі.
Тайқазан 1399 жылы Түркістанда 7 металдан құйылған:
1. Темір (Ғе) 2. Мырыш (Zn) 3. Қалайы (Sn) 4. Қорғасын (Рb) 5. Мыс
(Сu) 6. Күміс (Аg) 7. Алтын (Аu)
Алтын адам
Б.з.д. V ғ.Есік қорғанынан
табылған сақ жауынгер. Ол 4000 астам алтын әшекейлермен
безендірілген.
шойын ,темір құймалары ,болат
ІҮ Сабақты бекіту: 2-нұсқада тест тапсырмасын орындату.
І-нұсқа
1. Термиттің жану реакциясының нәтижесінде 8АІ + 3Ғе3О4 ═ 4АІ2О3 +
9Ғе + 800 кДж 160 кДж жылу бөлінсе, қанша алюминий реакцияға
түскен? А.88,4г; Ә.8,6г; Б.43,2г; В.4,32г.
2. Алюминий мен мыстан тұратын қоспа 10г тұз қышқылымен
әрекеттескенде 6,72л (қ.ж.) сутек бөлінсе, қоспаның құрамы қандай?
А.46% Cu, 54% AI; Ә.50% Cu, 50% AI; Б.55% Cu, 45% AI; В.40% Cu, 60%
AI;
3. Массасы 2т глиноземнен (АІ2О3) 1т алюминий алынса, өнімнің
шығымы қандай? А.93,7%; Ә.95,24%; Б.98,2%; В.99,3%;
4. Массасы 2,1г магний мен алюминийден тұратын қоспа тұз қышқылымен
әрекеттескенде 2,24л (қ.ж.) сутек бөлінген. Бастапқы қоспаның
құрамы қандай? А.72% AI, 28% Mg; Ә.45% AI, 55% Mg; Б.50% AI, 50%
Mg; В.42% AI, 57,14% Mg.
5. Мына реакция нәтижесінде қандай зат түзіледі? АІ(ОН)СІ2 + 2NaOH
→ А.АІ(ОН)3; Ә.АІ(ОН)2СІ; Б.АІСІ3; В.NaАІО2.
6. Алюминийді электролиз әдісімен өндіргенде алюминий оксидіне -
криолит (Na3AIF6) не үшін қосылады? А.электр өткізгіштігін арттыру
үшін; Ә.АІ2О3 -дін еріту үшін; Б.АІ2О3 - нің балқу температурасын
төмендету үшін; В.электр өткізгіштігін азайту үшін;
7. Алюминий сульфатының ерітіндісіне соданың ерітіндісін қосқанда
не түзіледі? А.АІ2(СО3)3; Ә.АІ(ОН)3; Б.АІОНSО4; В.NaАІО2.
ІІ-нұсқа
1. Егер массасы 13г темір, мыс, алюминийден тұратын қоспаға натрий
гидроксиді ерітіндісімен әсер еткенде 6,72л газ бөлінсе, ал тұз
қышқылымен әсер еткенде 8,96л газ бөлінсе (қ.ж.) қоспа құрамы
қандай? А.5,4г АІ, 5,6г Ғе, 2г Сu; Ә.2,7г АІ, 5,6г Ғе, 4,7г Сu;
Б.2,7г АІ, 2,8г Ғе, 7,5г Сu; В.5,4г АІ, 2,8г Ғе, 4,8г Сu;
2. Массасы 10г темір (ІІ,ІІІ) сульфаттарының қоспасымен қышқыл
ортада (Н2SО4) әрекеттесу үшін 1ғ58г калий перманганаты
жұмсалды.Қоспа құрамы қандай болған? А.5г ҒеSО4, 5г Ғе2(SО4)3;
Ә2,5г ҒеSО4, 7,5г Ғе2(SО4)3; Б.7,6г ҒеSО4, 2,4г Ғе2(SО4)3; В.9г
ҒеSО4, 1г Ғе2(SО4)3;
3. Массасы 31,9г мыс (ІІ) оксиді мен темір (ІІІ) оксидінің қоспасын
термиялық тотықсыздандырғанда 9г су түзілсе, алынған қоспадағы
металдардың массалық үлестері қандай? А.22% Сu және 78%Ғе; Ә.12% Сu
және 88%Ғе; Б.50% Сu және 50%Ғе; В.75% Сu және 15%Ғе;
4. Массасы 31,9г мыс (ІІ) оксиді мен темір (ІІІ) оксидінің қоспасын
термиялық тотықсыздандырғанда 9г су түзілгендігі белгілі болса,осы
қоспадан неше моль темір алуға болады? А.0,2моль; Ә.2моль;
Б.0,1моль; В.1моль.
5. Мыс пен темір қоспасын концентрлі НNО3-пен өңдегенде 4,48л газ
бөлінген, ал сол қоспаға НСІ-мен әсер еткенде 2,24л газ бөлінген
(қ.ж.). Қоспа массасы қандай? А.5,6г; Ә.6,35г; Б.11,95г; В.18,3г.
6. Құрамында 10% қоспасы бар темір (ІІІ) оксидінен тұратын 200г
темір рудасын толық тотықсыздандыру үшін неше грамм көміртегі
қажет? А.40,5г; Ә.4,05г; Б.20,25г ; В.2,25г;
7. Құрамында 95% темірі бар 1т құйма алу үшін, құрамында 78% темір
оксиді бар қызыл теміртастан қанша кг қажет? А.950кг; Ә.1357кг;
Б.1600кг; В.1740кг.
Жауаптары: І-нұсқа ІІ-нұсқа
1)Б 1)А 2)А 2)Б 3)Ә 3)А 4)В 4)А 5)А 5)Б 6)Б 6)Б
7)Ә 7)Б
Ү. Қорытынды: бағалау.
ҮІ үй тапсырмасы: қосымша ақпарат есептер.
І-нұсқа
1. Термиттің жану реакциясының нәтижесінде 8АІ + 3Ғе3О4 ═ 4АІ2О3 +
9Ғе + 800 кДж 160 кДж жылу бөлінсе, қанша алюминий реакцияға
түскен? А.88,4г; Ә.8,6г; Б.43,2г; В.4,32г.
2. Алюминий мен мыстан тұратын қоспа 10г тұз қышқылымен
әрекеттескенде 6,72л (қ.ж.) сутек бөлінсе, қоспаның құрамы қандай?
А.46% Cu, 54% AI; Ә.50% Cu, 50% AI; Б.55% Cu, 45% AI; В.40% Cu, 60%
AI;
3. Массасы 2т глиноземнен (АІ2О3) 1т алюминий алынса, өнімнің
шығымы қандай? А.93,7%; Ә.95,24%; Б.98,2%; В.99,3%;
4. Массасы 2,1г магний мен алюминийден тұратын қоспа тұз қышқылымен
әрекеттескенде 2,24л (қ.ж.) сутек бөлінген. Бастапқы қоспаның
құрамы қандай? А.72% AI, 28% Mg; Ә.45% AI, 55% Mg; Б.50% AI, 50%
Mg; В.42% AI, 57,14% Mg.
5. Мына реакция нәтижесінде қандай зат түзіледі? АІ(ОН)СІ2 + 2NaOH
→ А.АІ(ОН)3; Ә.АІ(ОН)2СІ; Б.АІСІ3; В.NaАІО2.
6. Алюминийді электролиз әдісімен өндіргенде алюминий оксидіне -
криолит (Na3AIF6) не үшін қосылады? А.электр өткізгіштігін арттыру
үшін; Ә.АІ2О3 -дін еріту үшін; Б.АІ2О3 - нің балқу температурасын
төмендету үшін; В.электр өткізгіштігін азайту үшін;
7. Алюминий сульфатының ерітіндісіне соданың ерітіндісін қосқанда
не түзіледі? А.АІ2(СО3)3; Ә.АІ(ОН)3; Б.АІОНSО4; В.NaАІО2.
ІІ-нұсқа
1. Егер массасы 13г темір, мыс, алюминийден тұратын қоспаға натрий
гидроксиді ерітіндісімен әсер еткенде 6,72л газ бөлінсе, ал тұз
қышқылымен әсер еткенде 8,96л газ бөлінсе (қ.ж.) қоспа құрамы
қандай? А.5,4г АІ, 5,6г Ғе, 2г Сu; Ә.2,7г АІ, 5,6г Ғе, 4,7г Сu;
Б.2,7г АІ, 2,8г Ғе, 7,5г Сu; В.5,4г АІ, 2,8г Ғе, 4,8г Сu;
2. Массасы 10г темір (ІІ,ІІІ) сульфаттарының қоспасымен қышқыл
ортада (Н2SО4) әрекеттесу үшін 1ғ58г калий перманганаты
жұмсалды.Қоспа құрамы қандай болған? А.5г ҒеSО4, 5г Ғе2(SО4)3;
Ә2,5г ҒеSО4, 7,5г Ғе2(SО4)3; Б.7,6г ҒеSО4, 2,4г Ғе2(SО4)3; В.9г
ҒеSО4, 1г Ғе2(SО4)3;
3. Массасы 31,9г мыс (ІІ) оксиді мен темір (ІІІ) оксидінің қоспасын
термиялық тотықсыздандырғанда 9г су түзілсе, алынған қоспадағы
металдардың массалық үлестері қандай? А.22% Сu және 78%Ғе; Ә.12% Сu
және 88%Ғе; Б.50% Сu және 50%Ғе; В.75% Сu және 15%Ғе;
4. Массасы 31,9г мыс (ІІ) оксиді мен темір (ІІІ) оксидінің қоспасын
термиялық тотықсыздандырғанда 9г су түзілгендігі белгілі болса,осы
қоспадан неше моль темір алуға болады? А.0,2моль; Ә.2моль;
Б.0,1моль; В.1моль.
5. Мыс пен темір қоспасын концентрлі НNО3-пен өңдегенде 4,48л газ
бөлінген, ал сол қоспаға НСІ-мен әсер еткенде 2,24л газ бөлінген
(қ.ж.). Қоспа массасы қандай? А.5,6г; Ә.6,35г; Б.11,95г; В.18,3г.
6. Құрамында 10% қоспасы бар темір (ІІІ) оксидінен тұратын 200г
темір рудасын толық тотықсыздандыру үшін неше грамм көміртегі
қажет? А.40,5г; Ә.4,05г; Б.20,25г ; В.2,25г;
7. Құрамында 95% темірі бар 1т құйма алу үшін, құрамында 78% темір
оксиді бар қызыл теміртастан қанша кг қажет? А.950кг; Ә.1357кг;
Б.1600кг; В.1740
10б Сабақтың тақырыбы: Қазақстанда түсті және қара металдар мен
олардың құймаларын алу. Сан есептері
Сабақтың мақсаты: 1). Қазақстанда түсті және қара металдар мен
олардың құймаларын алу 2) өркениетті елде металдарды және олардың
құймаларын алу, пайдалану, сол арқылы техниканың, қнеркәсіптің
дамуы туралы айайту. 3) оқушыларды ұйымшылдыққа, тәртіптілікке,
үнемшілдікке тәрбиелеу.
Сабақтың түрі: жаңа тақырыпты түсіндіру.
Сабақтың әдісі: жекелей деңгейлік жұмыс, топпен жұмыс.
Сабақтың тәсілі: сұрақ - жауап, тест, Венн диаграммасы, есеп
шығару.
Сабақтың көрнекілігі: «кейбір құймалардың қасиеттері, қолданылуы,
құрамы» кестесі, тайқазан, алтын адам суреттері.
Пән аралық байланыс: география, тарих, информатика.
Сабақтың барысы: 1. Ұйымдастыру
2. Үй тапсырмасын тексеру
Жеке тапсырмалар: 1.Металлургия дегеніміз не? (кен құрамынан металл
өндірумен айналысатын өндіріс саласы). 2.Металлургия неше топқа
бөлінеді, қандай? (2 топқа, қара және түсті). 3.Металдар туралы
қандай ғылым дамуда? (металл тану). 4.Асыл металдарға қандай
металдар жатады? (алтын, күміс, платина). 5.Сирек металдар нешеге
бөлінеді, қалай аталады, металл мысалдарымен?(5-ке:1-қиын
балқитындар:вольфрам, молибден, тантал, ванадий, ниобий,цирконий;
2-жеңіл металдар:литий, берилий, рубидий; 3-шашыраңқы
металдар:галлий, индий, таллий, гафний, рений, теллур; 4-сирек жер
металдар:селен, иттрий, барий; 5-радиактивті металдар: радий, уран,
торий, актиний). 6.Металдарды алу неше топқа бөлінеді, қалай
аталады?(3 топқа:1-гидрометаллургия; 2-пирометаллургия;
3-электрометаллургия). 7.Металлотермия дегеніміз не? (қосылыстар
құрамынан металды басқа металдар арқылы тотықсыздандыру).
ІІІ. Жаңа сабақ: Жұмбақ: Екі немесе одан да көп металдан тұратын
жүйені қалай атайды?(құймалар). құймалар металдар мен кейбір
бейметалдардың бір-бірінде балқыған күйде еруінен түзіледі.
Тайқазан 1399 жылы Түркістанда 7 металдан құйылған:
1. Темір (Ғе) 2. Мырыш (Zn) 3. Қалайы (Sn) 4. Қорғасын (Рb) 5. Мыс
(Сu) 6. Күміс (Аg) 7. Алтын (Аu)
Алтын адам
Б.з.д. V ғ.Есік қорғанынан
табылған сақ жауынгер. Ол 4000 астам алтын әшекейлермен
безендірілген.
шойын ,темір құймалары ,болат
ІҮ Сабақты бекіту: 2-нұсқада тест тапсырмасын орындату.
І-нұсқа
1. Термиттің жану реакциясының нәтижесінде 8АІ + 3Ғе3О4 ═ 4АІ2О3 +
9Ғе + 800 кДж 160 кДж жылу бөлінсе, қанша алюминий реакцияға
түскен? А.88,4г; Ә.8,6г; Б.43,2г; В.4,32г.
2. Алюминий мен мыстан тұратын қоспа 10г тұз қышқылымен
әрекеттескенде 6,72л (қ.ж.) сутек бөлінсе, қоспаның құрамы қандай?
А.46% Cu, 54% AI; Ә.50% Cu, 50% AI; Б.55% Cu, 45% AI; В.40% Cu, 60%
AI;
3. Массасы 2т глиноземнен (АІ2О3) 1т алюминий алынса, өнімнің
шығымы қандай? А.93,7%; Ә.95,24%; Б.98,2%; В.99,3%;
4. Массасы 2,1г магний мен алюминийден тұратын қоспа тұз қышқылымен
әрекеттескенде 2,24л (қ.ж.) сутек бөлінген. Бастапқы қоспаның
құрамы қандай? А.72% AI, 28% Mg; Ә.45% AI, 55% Mg; Б.50% AI, 50%
Mg; В.42% AI, 57,14% Mg.
5. Мына реакция нәтижесінде қандай зат түзіледі? АІ(ОН)СІ2 + 2NaOH
→ А.АІ(ОН)3; Ә.АІ(ОН)2СІ; Б.АІСІ3; В.NaАІО2.
6. Алюминийді электролиз әдісімен өндіргенде алюминий оксидіне -
криолит (Na3AIF6) не үшін қосылады? А.электр өткізгіштігін арттыру
үшін; Ә.АІ2О3 -дін еріту үшін; Б.АІ2О3 - нің балқу температурасын
төмендету үшін; В.электр өткізгіштігін азайту үшін;
7. Алюминий сульфатының ерітіндісіне соданың ерітіндісін қосқанда
не түзіледі? А.АІ2(СО3)3; Ә.АІ(ОН)3; Б.АІОНSО4; В.NaАІО2.
ІІ-нұсқа
1. Егер массасы 13г темір, мыс, алюминийден тұратын қоспаға натрий
гидроксиді ерітіндісімен әсер еткенде 6,72л газ бөлінсе, ал тұз
қышқылымен әсер еткенде 8,96л газ бөлінсе (қ.ж.) қоспа құрамы
қандай? А.5,4г АІ, 5,6г Ғе, 2г Сu; Ә.2,7г АІ, 5,6г Ғе, 4,7г Сu;
Б.2,7г АІ, 2,8г Ғе, 7,5г Сu; В.5,4г АІ, 2,8г Ғе, 4,8г Сu;
2. Массасы 10г темір (ІІ,ІІІ) сульфаттарының қоспасымен қышқыл
ортада (Н2SО4) әрекеттесу үшін 1ғ58г калий перманганаты
жұмсалды.Қоспа құрамы қандай болған? А.5г ҒеSО4, 5г Ғе2(SО4)3;
Ә2,5г ҒеSО4, 7,5г Ғе2(SО4)3; Б.7,6г ҒеSО4, 2,4г Ғе2(SО4)3; В.9г
ҒеSО4, 1г Ғе2(SО4)3;
3. Массасы 31,9г мыс (ІІ) оксиді мен темір (ІІІ) оксидінің қоспасын
термиялық тотықсыздандырғанда 9г су түзілсе, алынған қоспадағы
металдардың массалық үлестері қандай? А.22% Сu және 78%Ғе; Ә.12% Сu
және 88%Ғе; Б.50% Сu және 50%Ғе; В.75% Сu және 15%Ғе;
4. Массасы 31,9г мыс (ІІ) оксиді мен темір (ІІІ) оксидінің қоспасын
термиялық тотықсыздандырғанда 9г су түзілгендігі белгілі болса,осы
қоспадан неше моль темір алуға болады? А.0,2моль; Ә.2моль;
Б.0,1моль; В.1моль.
5. Мыс пен темір қоспасын концентрлі НNО3-пен өңдегенде 4,48л газ
бөлінген, ал сол қоспаға НСІ-мен әсер еткенде 2,24л газ бөлінген
(қ.ж.). Қоспа массасы қандай? А.5,6г; Ә.6,35г; Б.11,95г; В.18,3г.
6. Құрамында 10% қоспасы бар темір (ІІІ) оксидінен тұратын 200г
темір рудасын толық тотықсыздандыру үшін неше грамм көміртегі
қажет? А.40,5г; Ә.4,05г; Б.20,25г ; В.2,25г;
7. Құрамында 95% темірі бар 1т құйма алу үшін, құрамында 78% темір
оксиді бар қызыл теміртастан қанша кг қажет? А.950кг; Ә.1357кг;
Б.1600кг; В.1740кг.
Жауаптары: І-нұсқа ІІ-нұсқа
Ү. Қорытынды: бағалау.
ҮІ үй тапсырмасы: қосымша ақпарат есептер.
10аБілімділік мақсаты
Дамытушылық
тәрбиелік:
Металдар мен бейметалдардың Қазақстандағы негізгі кен орындары , оларды өндіру және өңдеу кезінде туындайтын экологиялық проблемалардан қоршаған ортаны қорғау
әр топтың атомдарының айырмашылығын түсіндіре білу ,қорытынды жасау,жүйелеу, сөздік қорын молайту , білім-білік дағдыларын дамыту.
Металдар мен бейметалдардың қосылыстарын танып-білу, анықтай білу
Сабақ типі:
Педагогикадық менеджмент
Құралдар мен реактивтер:
Кітап, дәптер, интерактивті тақта , ХЭПЖ , электронды оқулық, хабарлама, презентация
Ұйымдастыру кезеңі:
Оқушылардың сабаққа дайындығын тексеру. Оқушылардың көңілін сабаққа аудару. Сабақтың жалпы мақсатын ашу ,оны өткізу жоспарын көрсету.
Жаңа ақпаратты өз бетінше меңгеру(5-7 мин)
Жоспар
1. Металдар Қазақстандағы негізгі кен орындары
2.Бейметалдардың Қазақстандағы негізгі кен орындары
3.Металдар оларды өндіру және өңдеу кезінде туындайтын экологиялық проблемалардан қоршаған ортаны қорғау
4.Бейметалдардың оларды өндіру және өңдеу кезінде туындайтын экологиялық проблемалардан қоршаған ортаны қорғау
**Презинтация
Металдардың Қазақстандағы негізгі кен орындары , оларды өндіру және өңдеу кезінде туындайтын экологиялық проблемалардан қоршаған ортаны қорғау
**презинтация
.Бейметалдардың Қазақстандағы негізгі кен орындары , оларды өндіру және өңдеу кезінде туындайтын экологиялық проблемалардан қоршаған ортаны қорғау
Оқу тапсырмаларын орындау(Білімді жүйелеу 35 мин) Оқушы үш қабатты үйді тұрғызуы қажет
Деңгейлік жұмыстар
І деңгей 1-жаттығу
ІІ деңгей 2,5,6- жаттығулар
ІІІ деңгей 7 -жаттығу
ІҮ деңгей 3- есеп
Ү деңгей 4-есеп
ҮІ деңгей 10 есеп
Сабақ қорытындысын шығару:
- жекелеген оқушылар мен сынып жұмысына баға беру. Сабақтың кемшілігі мен қорытындысын шығару. Баға қою
Үй тапсырмасы
§ 8.тарау оқу
8-10 -жаттығу,есеп
Рефлексия кезеңі
10бҚазақстанда түсті және қара металдар мен
олардың құймаларын алу. Сан есептері
Білімділік мақсаты
Дамытушылық
тәрбиелік:
Түсті металдардың Қазақстандағы негізгі кен орындары , оларды өндіру және өңдеу кезінде туындайтын экологиялық проблемалардан қоршаған ортаны қорғау
әр топтың атомдарының айырмашылығын түсіндіре білу ,қорытынды жасау,жүйелеу, сөздік қорын молайту , білім-білік дағдыларын дамыту.
Металдардың қосылыстарын танып-білу, анықтай білу
Сабақ типі:
Педагогикадық менеджмент
Құралдар мен реактивтер:
Кітап, дәптер, интерактивті тақта , ХЭПЖ , электронды оқулық, хабарлама, презентация
Ұйымдастыру кезеңі:
Оқушылардың сабаққа дайындығын тексеру. Оқушылардың көңілін сабаққа аудару. Сабақтың жалпы мақсатын ашу ,оны өткізу жоспарын көрсету.
Жаңа ақпаратты өз бетінше меңгеру(5-7 мин)
Жоспар
1. Металдар Қазақстандағы негізгі кен орындары
2.Бейметалдардың Қазақстандағы негізгі кен орындары
3.Металдар оларды өндіру және өңдеу кезінде туындайтын экологиялық проблемалардан қоршаған ортаны қорғау
4.Бейметалдардың оларды өндіру және өңдеу кезінде туындайтын экологиялық проблемалардан қоршаған ортаны қорғау
**Презинтация
Металдардың Қазақстандағы негізгі кен орындары , оларды өндіру және өңдеу кезінде туындайтын экологиялық проблемалардан қоршаған ортаны қорғау
**презинтация
.Бейметалдардың Қазақстандағы негізгі кен орындары , оларды өндіру және өңдеу кезінде туындайтын экологиялық проблемалардан қоршаған ортаны қорғау
Оқу тапсырмаларын орындау(Білімді жүйелеу 35 мин) Оқушы үш қабатты үйді тұрғызуы қажет
Деңгейлік жұмыстар
І деңгей 1-жаттығу
ІІ деңгей 2,5,6- жаттығулар
ІІІ деңгей 7 -жаттығу
ІҮ деңгей 3- есеп
Ү деңгей 4-есеп
ҮІ деңгей 10 есеп
Сабақ қорытындысын шығару:
- жекелеген оқушылар мен сынып жұмысына баға беру. Сабақтың кемшілігі мен қорытындысын шығару. Баға қою
Үй тапсырмасы
§ 8.тарау оқу
8-10 -жаттығу,есеп
Рефлексия кезеңі
Химия 10а Өтілген күніСабақтың тақырыбы:
Сабақтың мақсаты:
Білімділігі
дамытушылығы
тәрбиелілігі
Сабақтың көрнекілігі:
Сабақтың барысы:
«Білу» теориясы
«Білу» практикасы
«Жинақтау, білу»
Күкірт және оның оксиді мен қышқылы, сұйылтылған және концентрлі күкірт қышқылының қасиеттері, сульфаттар, олардың қасиеттері, сульфат ионын сапалық анықтау
Күкірт және оның оксиді мен қышқылы, сұйылтылған және концентрлі күкірт қышқылының қасиеттері, сульфаттар, олардың қасиеттері, сульфат ионын сапалық анықтау
Бейметалдардың және олардың қосылыстарының Қазақстанның аймақтарында таралуымен оқушыларды таныстыру, білімдерін , дүниетанымын кеңейту.
Оқушыларды өзбетінше білімдерін жетілдіруге дағдыландыру, оқушыларды адамгершілікке, табиғатты сүюге тәрбиелеу.
1.Интерактивті тақта 2.Тақырып тапсырмалары
3.Ерігіштік қатары 4. Кесте 5. Электрондық оқулық
І. Ұйымдастыру
ІІ. Үй тапсырмасын тексеру Жарыс
ІІІ..Жаңа сабақ
Жоспары
1.Күкірт және оның қосылыстары. Табиғатта бос күйінде (саф К.) және сульфидті (мыс., пирит, галенит, антимонит, т.б.), сульфатты (гипс, ангидрит, барит, мирабилит, т.б.), т.б. минералдар</ түрінде кездеседі
2.Күкірттің аллотропиялық түр өзгерістері Күкірттің бірнеше кристалдық түрлері белгілі, оның ішіндегі орнықтылары ромбылық α-күкірт және моноклинді β-күкірт. Күкірттің тығыздығы 2,07 г/см3 (α-түрі) және 1,96 г/см3 (β-түрі), балқу t 112,8°С, қайнау t 444,6°С, жылу өткізгіштігі 0,208 Вт/(м·град)..
3.күкірт (ІҮ, ҮІ)оксидтері
Күкірт (ІV оксиді) SO2, Түссізөткіриістігаз, Тойынған сулы ерітіндісі 10,3% -200C
SO2 + n H2 O = SO2 x n H2 O
SO2 +2H2S =3S +2 H2O тотықсыздандырғыш
5SO2 +2KMnO4+2H2O =2H2 SO4 +2 MnSO4+K2SO4 тотықтырғыш
4.Күкірт қышқылы түссіз, ұшпайтын, май тәріздес, суда жақсы еритін, сүйык зат. Тығыздығы 1,84 г/см3, массалык үлесі 98%. Ол 280°С-та қайнайды, ал 10,4°С-та кристалданады
Химиялық қасиеттері: Zn +H2SO4= ZnSO4+H2 (сұйық)
Cu +2H2SO4= CuSO4+SO2 +2H2O (концентрлі)
H2SO4 +CuO = CuSO4 +H2O
Cu(OH)2 +H2SO4= CuSO4 +2H2O
Сапалық реакция H2SO4 +BaCl2= 2HCl +BaSO4↓
5.Сульфаттар: Орта тұздар - сульфаттар, қышқыл тұздар - гидросульфаттар.
ғаныш минералы CaS04* 2Н2 0 Жамбыл, Na2 S04*10H2 0-минералын мирабилит н\е Глаубер тұзы- Арал, Балхаш, тотияйын CuS04*5H2 0, темір купаросы FeS04*7H2 0
Жаңа сабақты бекіту
Жаттығулар мен есептер
1.төмендегі айналуларды іске асыруға болатын реакция теңдеулерін жазыңдар:
H2S → S→SO2→H2SO СаSO3
2.Күкірт 4 оксидінің сутек және ауамен салыстырғандагы тығыздығы қандай?
3.SO3- оксиді қышқылдық оксид екендігін реакция теңдеулерін жазып дәлелдендер
Үйге тапсырма 1. §8.14- 8.19 оқу
2. 7,9,10 есептер
Химия 9а Өтілген күніСабақтың тақырыбы:
Сабақтың мақсаты:
Білімділігі
дамытушылығы
тәрбиелілігі
Сабақтың көрнекілігі:
Сабақтың барысы:
«Білу» теориясы
«Білу» практикасы
«Жинақтау, білу»
Күкірт қышқылы және оның тұздары
Күкірт қышқылы және оның тұздарының қасиеттері, алу әдістері, маңызы туралы түсінік беру, сульфат ионын анықтау
Күкірт және оның қосылыстары. Күкірттің аллотропиялық түр өзгерістері, күкіртсутек, күкірт (ІҮ, ҮІ)оксидтерінің қасиеттері, алу әдістері, маңызы туралы түсініктерін тереңдету. Дүниетанымын кеңейту.
Оқушыларды өзбетінше білімдерін жетілдіруге дағдыландыру, күкіртті сутек туралы мәлімет беру; оқушыларды адамгершілікке, табиғатты сүюге тәрбиелеу.
1.Интерактивті тақта
2.Тақырып тапсырмалары
3.Ерігіштік қатары
4. кесте
І. Ұйымдастыру
ІІ. Үй тапсырмасын тексеру
***Жеке тапсырмалар
1 Табиғаттағы күкірт
2.Күкірттің физикалық қасиеттері
3. Күкірттің химиялық қасиеттері
4. Күкіртсутек
5. Күкірт (ІҮ)оксиді
6. Күкірт ( ҮІ)оксиді
***Үй жұмысы
ІІІ.Жаңа сабақ
Жоспары
1.Құрылысы: Ол екінегізді күшті қышқыл, орта және қышқыл тұздар түзеді.
2.Алу әдісі SO3+H2O =H2 SO4
3.Физикалық қасиеттері: түссіз, ұшпайтын, май тәріздес, суда жақсы еритін, сүйык зат. Тығыздығы 1,84 г/см3, массалык үлесі 98%. Ол 280°С-та қайнайды, ал 10,4°С-та кристалданады
4.Химиялық қасиеттері: Zn +H2SO4= ZnSO4+H2
Cu +2H2SO4= CuSO4+SO2 +2H2O
H2SO4 +CuO = CuSO4 +H2O
Cu(OH)2 +H2SO4= CuSO4 +2H2O
Сапалық реакция H2SO4 +BaCl2= 2HCl +BaSO4↓
5.Сульфаттар: Орта тұздар - сульфаттар, қышқыл тұздар - гидросульфаттар.
ғаныш минералы CaS04* 2Н2 0 Жамбыл, Na2 S04*10H2 0-минералын мирабилит н\е Глаубер тұзы- Арал, Балхаш, тотияйын CuS04*5H2 0, темір купаросы FeS04*7H2 0
ІҮ Жаңа сабақты бекіту
Жаттығулар мен есептер
Жұмыс дәптерінен 28-32 тапсырмалар
Ү.Үйге тапсырма 1. §15 оқу
2.1-12 тақырыптарды қайталау
3.Оқулықтан А және В нұсқалары 79-80 беттер
10 сынып химия
І-ІІ топтар А топшасының s- элементтері: жалпы сипаттамасы, металдық және тотықсыздандырғыштық қасиеттерін салыстыру. Натрий және кальций: табиғатта таралуы, физикалық ,химиялық қасиеттері, алынуы, қолданылуы және олардың маңызды қосылыстары. №4 (4.1) көрсетілімдер
№6(6.1)лабораториялық тәжірибе
Білімділік мақсаты:
дамытушылық
тәрбиелік:
Оқушыларға натрий ,калийдің табиғатта кездесуі, қасиеттері қосылыстары,гидроксидтер,тұздары туралы білімді қалыптастыру; натрий ,кальцийдің қосылыстары,гидроксидтер,тұздарының қасиеттерін түсіндіре білу,салыстыра білу,есеп шығара білу дағдысын ,реакция теңдеуін құрастыра білу біліктіліктерін дамыту, қорытынды жасау,есте сақтау,жүйелеу, сөздік қорын молайту білім-білік дағдыларын дамыту.
Сабақта белсенділік танытуға, тапсырмаларды тиянақты орындауға тәрбиелеу
Сабақ типі:
Аралас сабақ
Құралдар мен реактивтер:
Кітап, дәптер, интерактивті тақта , Сызбанұсқа «Табиғатта кездесуі» №6 лабораториялық жұмыс Натрий , калий, кальций қосылыстарының үлгілері
Ұйымдастыру
кезеңі:
сабақта қалыпты жұмыс істеуге мүмкіндік жасау ; оқушыларды психологиялық дайындау. Оқушылардың сабаққа дайындығын тексеру. Оқушылардың көңілін сабаққа аудару. Сабақтың жалпы мақсатын ашу ,оны өткізу жоспарын көрсету.
Үй тапсырмасын тексеру кезеңі:
Жаттығулар мен есептердің орындалуын тексеру
Үйге берілген жаттығу есепті тексеру
Жаңа сабақты түсіндіру кезеңі
Меңгеру
Зерттеу
«Ширату»
1. Na+ - ионындағы электрондпр мен протондар саны 2. Атом радиусы үлкен s- элемент 3.s-элементтерді ашқан ғалымдар 4. Металдарда кездесетін кристалдық торлар 5. Табиғатта кездеспейтін s-элемент Жоспары:
1.Натрий, калийдің, кальцийдің табиғи қосылыстары 2. Натрий, кальцийдің физикалық ,химиялық қасиеттері 3. Натрий, калийдің қосылыстары Табиғатта таралуы бойынша натрий 6,7-ші орын алады, ол тек қосылыстар күйінде кездеседі: NaNО3 - чили селитрасы; NaCl - галит, ас тұзы; Na2CО3 • 10Н2О - сода; Na2SО4 • 10Н20 - глаубер тұзы; NaCl*KC1 - сильвинит, т.б. Ең маңызды қосылысы NaCl - ас тұзы, тұзды көлдердің негізгі құраушысы (Арал, Балқаш).Доломит, әктас, ғаныш, флюорит, фосфорит- кальцийдің табиғи қосылыстары
Физикалық қасиеттері - кітаппен өз бетінше жұмыс: 6.5 кесте бойынша (152бет)
-барлық сілтілік металдар күмістей ақ түсті,пышақпен оңай кесіледі,оңай балқиды;
Химиялық қасиеттері: Ең активті,күшті тотықсыздандырғыш,барлығы дерлік бейметалдармен әрекеттеседі,сумен,қышқылдармен,сұйық сынапта жақсы сақталады, еріп амальгамалар деп аталатын құймалар түзеді,олар таза металдарға қарағанда белсенділігі төмен.
**Көрсетілімдер 4.1 Натрий, кальцийдің сумен әрекеттесуі
Натрий, калий, кальций иондарына сапалық реакция
Натрий, кальций қосылыстары:
№6 лабораториялық тәжірибе
6.1 Натрий мен кальцийдің маңызды үлгілерімен танысуАты
Форму ласы
Сыртқы түрі
Табиғатта кездесе ме жоқ химиялық әдіспен алады.
Қолданылуы
Натрий, хлориді ас тұзы
Ақ түсті
Табиғатта
Химия өнеркәсібінде тұрмыста
Натрий, карбонаты кальцинир ленген сода
Ақ түсті
Табиғатта,химия -лық жолмен
Сабын қайнатуда,тігін тері, фармацевтік, өнеркәсібінде, шыны алюминий өнеркәсібінде
Кальций карбонаты
Ақ түсті
Химиялық жолмен
Медицинада , в лабораторияда оттек алуда
Білімді жүйелеу және қорытындылау
Сынып жұмысы «Мені таны»
1. Натрий және калийді қалай сақтайды? 2. Натрий және калийдің оттекпен әрекеттесуде қандай ұқсастық бар? 3. Неге олар техникада кең қолданылмайды? 4. Натрий және калийді өндірісте қалай алады?
5. Глаубер тұзындағы натрийдің массалық үлесі?
6.Кальцинирленген сода мен кристалдық соданың ұқсастығы 7. 120г сильвиниттің зат мөлшері.
8. Каустикалық соданың формуласы
9. Кристалдық содадағы судың молекулалар саны
10. Табиғи селитралардың формулалары
Дидактикалық ойын «Кім білгір»
1.20г натриймен 90г су әрекеттескенде түзілген натрий гидроксидінің массалық үлесі қандай?
2.15г кристалдық соданы110г суда еріткенде , сусыз тұздың үлесі қандай?
Үй тапсырмасын беру кезеңдері:
1. Үй тапсырмасын орындауға берілетін нұсқаулар. §5.2-5.3 оқу . № 3-6 - жаттығу, есептер(85бет) 2. Күнделікке жазғанын тексеру
Сабақ қорытындысын шығару:
- жекелеген оқушылар мен сынып жұмысына баға беру. Сабақтың кемшілігі мен қорытындысын шығару. Баға қою
Рефлексия кезеңі
-оқушы мен мұғалім арасындағы дұрыс қарым қатынасты тудыру.-оқушылардыңөзін өзі басқару және басқа адамдармен дұрыс қарым -қатынас принципін үйрету. Өздерің сабақта не істеп лгердіңіздер? Сыныптастарыңызға немен көмектесе алдыңыздар. қызықты болды ма? Білгендеріңнің маңызы қандай? Сабақтың қай кезеңі ұнады?