- Учителю
- Опорный конспект по химии на тему Закономерности протекания химических реакций (11 класс)
Опорный конспект по химии на тему Закономерности протекания химических реакций (11 класс)
Закономерности протекания химических реакций.
Тепловой эффект реакции (Q).
Сущность химической реакции - разрыв одних связей (энергия затрачивается Е реаг) и образование других связей (энергия выделяется Е прод ).

Энергия, которая выделяется или поглощается в химической реакции между определенными количествами исходных веществ, называется тепловым эффектом химической реакции.
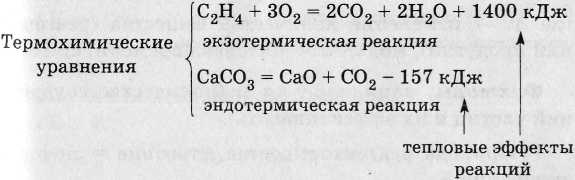
Тепловой эффект реакции образования 1 моль соединения из простых веществ, устойчивых в стандартных условиях (25 °С, 1 атм), - теплота образования соединения (Q o6p).
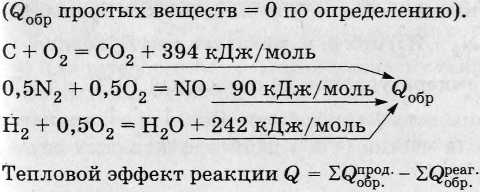
Скорость химической реакции v.
v гомогенной реакции определяется изменением количества вещества в единицу времени в единице объема (V):
![]()
где ∆ v / V = ∆С (изменение концентрации),
![]()
v гетерогенной реакции определяется изменением количества вещества в единицу времени на единице поверхности соприкосновения веществ (S):
![]()
где ∆v - изменение количества вещества (реагента или продукта), моль, ∆ t - интервал времени, с, мин.
Факторы, влияющие на v (количество соударений частиц и их эффективность).
1) Природа реагентов: состав, строение => энергия активации Еа.
Еа - избыток энергии (по сравнению со средней), необходимый для эффективного соударения реагирующих частиц.
• Чем меньше Еа, тем больше v.
• vр ионного обмена большая, так как Eа мала.
• v(N2 + H2) при о. у. мала, так как Еа велика.
2) Температура: при ↑ t на каждый 10 °С, v ↑ в 2 - 4 раза (правило Вант-Гоффа). При ↑ t, ↑ количество активных частиц (с Eа) и их эффективных соударений.
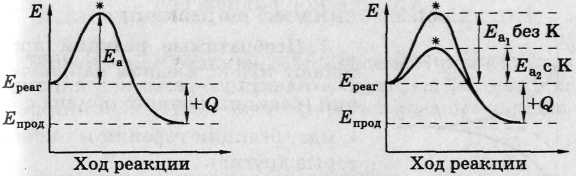
3) Концентрация: чем больше, тем чаще происходят соударения и v ↑. При постоянной t для реакции
тА + пВ = D, происходящей в одну стадию, ![]() (закон действующих масс), k - константа скорости, k = v при
(закон действующих масс), k - константа скорости, k = v при
![]() (C-const твердое вещество и входит в k ).
(C-const твердое вещество и входит в k ).
4) Катализаторы - вещества, которые изменяют
механизм реакции, уменьшают Еа = v ↑.
• Катализаторы остаются неизменными по окончанию реакции.
• Катализ - влияние катализатора на v.
• Реакции в присутствии катализатора каталитические.
Механизм действия катализатора.
• Без К:
![]()
• С участием К:
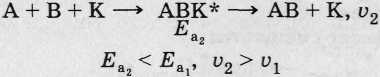
• Ферменты - биологические К, по природе белки.
• Ингибиторы - вещества, которые ↓ v.
5) Для гетерогенных реакций v зависит также:
• от состояния поверхности,
• от характера образующихся продуктов,
• от подвода исходных веществ и отвода продуктов и др.
Химическое равновесие.
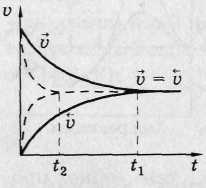
1. Необратимые реакции протекают только в одном направлении (реакции ионного обмена с ↑, ↓, мдс, реакции горения и некоторые другие).
Обратимые реакции при одних и тех же условиях протекают в противоположных направлениях:
![]()
2. Состояние обратимой реакции, при котором vпр =
vобр => химическое равновесие. Химическое равновесие
- динамическое. Концентрации всех веществ неизменные или
равновесные [ ]. При данной t и p ![]()
=> константа равновесия ![]() Чем больше К , тем больше выход продуктов.
Чем больше К , тем больше выход продуктов.
Способы смещения равновесия.
Принцип Ле Шателье: если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить t, p, С), то равновесие сместится в ту сторону, которая ослабит это воздействие.
Равновесие смещается:
1) при ↑ Среаг →, при ↑ Спрод ← ;
2) при ↑ р (для газов) - в сторону меньшего V, при ↓ p - в сторону большего V;
3) при ↑ t - в сторону эндотермической реакции, при ↓ t - в сторону экзотермической реакции.
Катализатор не смещает равновесие, но ускоряет его
достижение![]()
Классификация химических реакций.
Химические реакции - это явления, при которых из одних веществ получаются другие. Химические реакции можно классифицировать по разным признакам.



Возможны и другие классификации - по скорости, механизму (ионные, радикальные) и др. Одну и ту же химическую реакцию можно отнести одновременно к разным типам:
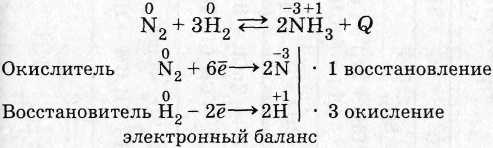
I - соединение
II - ОВР
III - экзотермическая
IV - обратимая
V - гомогенная
VI - каталитическая
Некоторые реакции не удается классифицировать по всем признакам:
СН4 + 2О2 → СО2 + 2Н2О
Сu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2Н2О
Гидролиз.
Гидролиз - это реакция обменного разложения веществ водой.
Гидролиз органических веществ.
1. Галогеналканы.
![]()
(для получения спиртов)
2. Сложные эфиры:
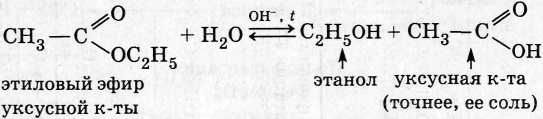
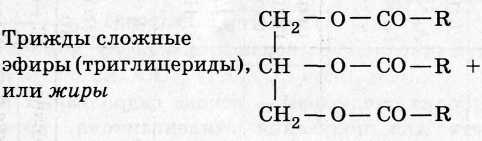
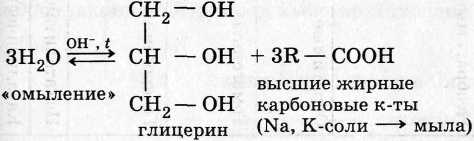
3. Углеводы:
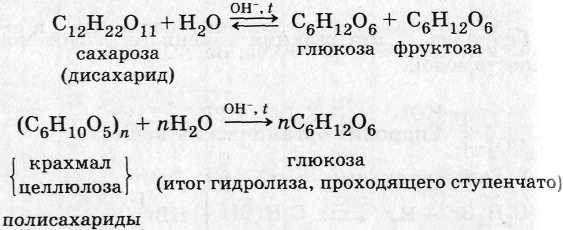
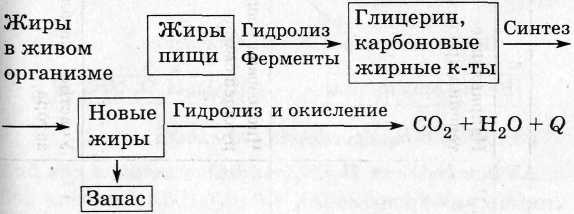
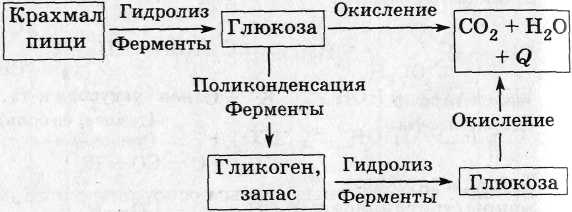
Крахмал в живом организме:
Гидролиз целлюлозы - основа гидролизных производств для получения этиленгликоля, органических кислот, кормовых дрожжей, этанола, сорбита и др.
4. Белки в живом организме:
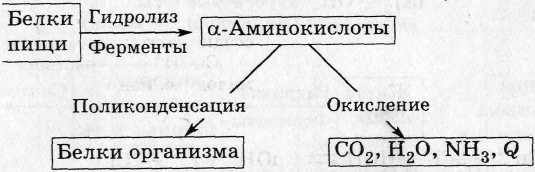
5. Аденозинтрифосфорная кислота: АТФ + Н2О → Н3РО4 + АДФ + энергия для биохимических процессов.
Гидролиз неорганических веществ (солей).
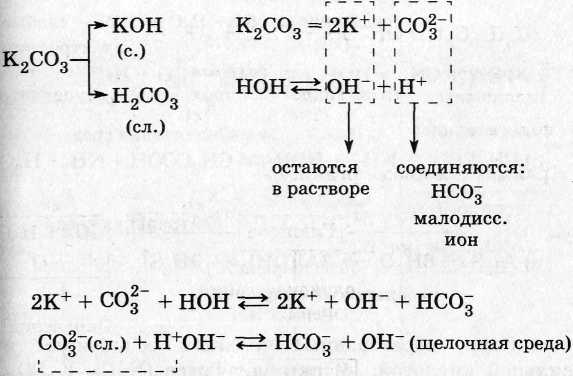
1. Соли, образованные сильным основанием и слабой кислотой (KCN, HCOONa, Ba(NO2)2 и др.):
2. Соли, образованные слабым основанием и сильной кислотой (А1С13, NH4NO3, FeSO4 и др.):
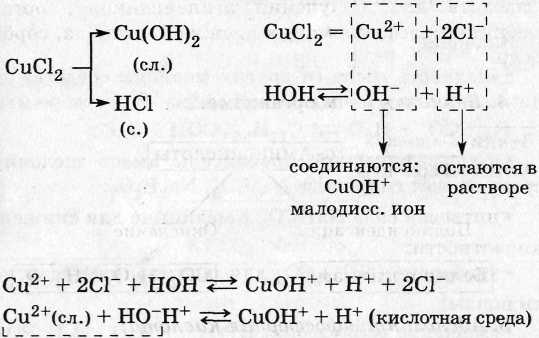
3. Соли, образованные слабым основанием и слабой кислотой ((NH4)2S, (CH3COO)2Cu, Cr2S3 и др.):

4. Соли, образованные сильным основанием и сильной кислотой, не гидролизуются (NaCl, K2SO4,
Ca(NO3)2. BaI2 и др.).
Обратимый гидролиз усиливается при ↑ t и разбавлении (принцип Ле Шателье).
Значение:
• мылкость мыла (и других моющих средств) увеличивается за счет щелочной среды. В растворе мыла
![]()
• фотографический проявитель имеет щелочную среду за счет гидролиза Na2CO3, Na2B2O7;
• питьевая сода NaHCO3 в медицине для снижения кислотности;
• удобрение (NH4)2SO4 для повышения кислотности почвы;
• смещение равновесия:![]()
![]() - в крови и слюне человека поддерживает
- в крови и слюне человека поддерживает
определенную среду.