- Учителю
- Поурочные разработки курса химии 8 класса.
Поурочные разработки курса химии 8 класса.
ПРЕДИСЛОВИЕ
В предлагаемом пособии представлены поурочные разработки курса химии 8 класса, ориентированные на учебник Г. Е. Рудзитиса, Ф. Г. Фельдмана «Химия, 8» (11-е изд., перераб. - М. : Просвещение, 2007, и последующие издания).
Основное назначение пособия - оказать учителю методическую помощь в подготовке к уроку, в организации его проведения, в распределении учебного материала по часам.
Для каждого урока определены: тема, цель, впервые вводимые основные понятия, планируемые результаты обучения, краткое содержание урока, домашнее задание. Разработки уроков, кроме методических рекомендаций и советов, включают дидактический материал: контрольные работы в двух вариантах, тестовые задания, самостоятельные и проверочные работы, алгоритмы составления химических формул, уравнений химических реакций, решения расчетных задач.
При использовании данного пособия следует иметь в виду, что каждый урок является лишь примерным. Учитель вправе использовать различные формы организации учебной деятельности учащихся: лекции, семинарские занятия, обобщающие уроки, конференции, ролевые игры. Поэтому учитель может заимствовать предлагаемые разработки уроков либо полностью, либо частично, встраивая в собственный план урока, корректируя его, исходя из конкретных условий. В любом случае использование различных методов и приемов должно быть направлено на индивидуализацию учебного процесса и повышение доли самостоятельности учащихся при изучении химии. Представленные в данном пособии перечни химических опытов для проведения на уроках носят также рекомендательный характер.
В пособии даются ссылки на таблицы, схемы, задания из учебника Г. Е. Рудзитиса и Ф. Г. Фельдмана «Химия, 8», а также на электронное пособие «Электронная библиотека "Просвещение". Химия. 8 класс».
ТЕМА 1
ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ (18 ч)
УРОК 1
Химия как часть естествознания. Понятие о веществе. Свойства веществ
Цель урока. Сформировать представления о химии как науке, о месте химии среди других наук, о роли химии в жизни и хозяйственной деятельности человека.
Основные понятия. Химия, вещество, тело, свойства веществ.
Планируемые результаты обучения. Знать определение предмета химии. Уметь различать вещества и физические тела.
Демонстрации. Примеры тел и веществ из школьной лаборатории.
Лабораторный опыт. Рассмотрение веществ с различными физическими свойствами.
Краткое содержание урока. На этом уроке учащиеся получают первые представления о науке химии, о месте химии среди других наук. Школьники учатся использовать знания, полученные из курсов естествознания, географии, биологии, физики, на уроках химии. Учитель обращает внимание учащихся на то, что не только химия изучает вещества, их изучают и другие науки о природе. Однако химия изучает не только состав и строение, но и превращения веществ, а также возможности их получения на химических предприятиях.
Затем учитель переходит к понятию «вещество», которое известно учащимся из курса физики. Демонстрируя вещества и тела из школьной лаборатории, он предлагает учащимся объяснить, чем различаются понятия «вещество» и «тело». Далее учитель вводит понятие «свойства веществ» и рассматривает с учащимися схему 1 (с. 5 учебника). Затем учащиеся выполняют лабораторный опыт 1 (с. 49 учебника) и сравнивают свойства веществ, т. е. выявляют черты сходства и различия в свойствах конкретных веществ.
Организуя беседу, учитель подводит учащихся к мировоззренческому выводу: познавая свойства веществ, человек тем самым познает их сущность. В конце урока учитель может зачитать высказывание академика Н. Н. Семенова о значении химии: «Все мы связываем с химической наукой дальнейший прогресс в познании окружающего нас мира, новые методы его преобразования и усовершенствования. И не может быть в наши дни специалиста, который сумел бы обойтись без знания химии».
Домашнее задание. § 1 (с. 5-6), упр. 1-5 (с. 13).
УРОК 2
Практическая работа «Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием»
Цель урока. Изучить приемы обращения с простейшим лабораторным оборудованием: лабораторным штативом, спиртовкой, пробирками, колбами и т. д. Изучить строение пламени. Изучить правила техники безопасности, которые требуется соблюдать при работе в школьном химическом кабинете.
Планируемые результаты обучения. Знать правила работы в химическом кабинете. Уметь обращаться с лабораторным штативом, спиртовкой, мерными сосудами, фарфоровой чашкой, ступкой, пробирками, проводить нагревание в открытом пламени.
Краткое содержание урока. Первую практическую работу лучше всего провести по указаниям учителя. Урок следует разделить на две части. В первой части урока учитель подробно рассматривает с учащимися правила техники безопасности при работе в химическом кабинете (с. 48-49 учебника). Во второй части урока рассматривается устройство лабораторного штатива, спиртовки или электронагревателя (то, что имеется в школьном химическом кабинете). Это оборудование должно быть на каждом ученическом столе. Полезно использовать серию таблиц и слайдов «Лабораторное оборудование и обращение с ним» или электронное пособие «Электронная библиотека "Просвещение". Химия. 8 класс».
Изучение пламени важно для того, чтобы учащиеся впоследствии осознанно использовали приемы нагревания. Учитель обращает внимание учащихся на то, что в разных частях пламени температура разная, нагревание следует проводить, помещая предметы в наиболее горячую, верхнюю часть пламени.
Далее учитель знакомит учащихся с лабораторным оборудованием и способами его использования. Учащиеся учатся отбирать определенные объемы жидкости с помощью мерной посуды или пипетки, правильно присоединять газоотводную трубку к пробирке, укреплять прибор в лапке штатива, определять герметичность прибора. Учащиеся обязательно повторяют за учителем все действия.
Домашнее задание. Так как этот урок очень насыщенный и все операции учащиеся повторяют за учителем, то оформить эту работу в специальных тетрадях для практических занятий можно разрешить дома.
УРОК 3
Чистые вещества и смеси. Способы разделения смесей
Цель урока. Сформировать понятие о смесях веществ как о системах переменного состава. Показать, что индивидуальные свойства компонентов смеси сохраняются (это может быть использовано для ее разделения).
Основные понятия. Чистое вещество, смесь, фильтрование, фильтрат, фильтр, отстаивание, выпаривание, кристаллизация.
Планируемые результаты обучения. Знать отличие чистого вещества от смеси, основные способы разделения смесей.
Демонстрации. Разделение смеси угля и речного песка отстаиванием, разделение сахара и речного песка фильтрованием с последующим упариванием раствора сахара, разделение смеси воды и растительного масла при помощи делительной воронки.
Лабораторный опыт. Разделение смеси, состоящей из порошков железа и серы.
Краткое содержание урока. В начале урока учитель проверяет домашнее задание к урокам 1 и 2. Можно провести небольшую самостоятельную работу на проверку знаний либо по теме «Вещества. Свойства веществ», либо по теме «Лабораторное оборудование, химическая посуда и правила работы с ними» (рекомендуется использовать пособие А. М. Радецкого «Химический тренажер» из серии «Текущий контроль» (М.: Просвещение, 2007).
Самостоятельная работа по теме «Вещества. Свойства веществ»
Вариант I
1. Выпишите из приведенного перечня физических тел (предметов) и веществ названия веществ: кирпич, поваренная соль, мел, железная кнопка, вода, сахар, проволока, свеча, химический стакан, стеклянная воронка.
2. В химической посуде без этикеток находятся медь, алюминий, мрамор, уксусная кислота и поваренная соль. По каким свойствам можно распознать эти вещества? Выпишите названия веществ и наиболее характерный для их распознавания признак.
Вариант II
1. В химическом кабинете используется оборудование, сделанное из разных веществ. Например: а) стеклянные пробирки, колбы, мерные цилиндры, воронки, химические стаканы; б) железные штативы, держалки для пробирок, ложечки и тигли для прокаливания веществ; в) фарфоровые ступки, пестики, шпатели. Приведите примеры предметов, используемых в быту и изготовленных из этих же веществ.
2. Приведите пример предмета, сделанного из разных веществ.
Вариант III
1. Приведите примеры двух тел, состоящих из одного вещества, и одного тела, состоящего из разных веществ.
2. Сравните свойства: а) поваренной соли и сахара; б) меди и алюминия; в) серы и угля. Какие свойства каждой пары веществ позволяют отличить их друг от друга?
Самостоятельная работа по теме «Лабораторное оборудование, химическая посуда и правила работы с ними»
Вариант I
1. Установите соответствие между лабораторным оборудованием и его назначением.
1) фарфоровая чашка
2) шпатель
3) мензурка
4) тигель
А. сосуд для измерения объема жидкости или сыпучих веществ
Б. приспособление для перемешивания смеси
В. сосуд для прокаливания веществ
Г. ложечка для взятия порции вещества
Д. посуда для выпаривания растворов
1
2
3
4
2. Основное назначение ступки с пестиком - это
1) длительное хранение растворов или сыпучих веществ
2) растворение веществ
3) измельчение твердых веществ
4) выпаривание растворов
3. Тонкостенная химическая посуда с круглым дном (пробирки, колбы) служит
1) для нагревания или кипячения растворов веществ
2) для длительного прокаливания веществ
3) для сохранения легко испаряющихся жидкостей
4) для смешивания твердых веществ
Вариант II
1. Установите соответствие между прибором и его назначением.
1) спиртовка
2) ареометр
3) шпатель
4) пипетка
А. прибор для осушения веществ
Б. прибор для взятия сыпучих веществ
В. прибор для получения газа
Г. прибор для нагревания веществ
Д. прибор для взятия определенного объема жидкости
Е. прибор для определения плотности жидкого вещества или раствора
1
2
3
4
2. Фарфоровая чашка служит
1) для длительного хранения растворов или сыпучих веществ
2) для перемешивания и растворения веществ
3) для измельчения твердых веществ
4) для нагревания или выпаривания растворов
3. В химических опытах при нагревании пробирки с исходными веществами ее закрепляют в держателе не посередине, а у горлышка, чтобы
1) удобно было прогреть содержимое пробирки
2) легко вынуть пробирку после окончания опыта
3) легко нагреть пробирку по всей ее поверхности
4) пробирка не растрескалась при нагревании
Можно также использовать серию упражнений к уроку 1 электронного пособия «Электронная библиотека "Просвещение". Химия. 8 класс».
При объяснении нового материала учитель должен довести до учащихся мысль о том, что судить о свойствах вещества можно лишь тогда, когда оно чистое. Учащиеся разбирают примеры чистых веществ и смесей, отмечают признаки, по которым можно судить, является ли вещество чистым (постоянные температуры плавления и кипения). Затем разбирается вопрос: чем отличаются чистые вещества от смесей? Для доказательства того, что вещества при смешивании сохраняют свои свойства, проводят лабораторный опыт 1 (с. 49 учебника). Далее учитель демонстрирует учащимся способы разделения смесей веществ: смеси угля и речного песка отстаиванием, сахара и речного песка фильтрованием с последующим упариванием раствора сахара, смеси воды и растительного масла при помощи делительной воронки. Если в кабинете отсутствует какое-либо оборудование, учитель может воспользоваться видеофрагментами по очистке веществ упомянутого ранее электронного пособия (уроки 1, 7).
Домашнее задание. § 2, упр. 6-9. (с. 13). Подготовиться к практической работе 2 (с. 52 учебника).
УРОК 4
Практическая работа «Очистка загрязненной поваренной соли»
Цель урока. Научить простейшим способам очистки веществ: фильтрованию и выпариванию. Научить выполнять практическую работу по инструкции и оформлять отчет о химическом эксперименте.
Планируемые результаты обучения. Знать правила обращения с необходимым для работы лабораторным оборудованием, способы разделения смесей фильтрованием и выпариванием. Уметь изготавливать фильтр, фильтровать и выпаривать.
Краткое содержание урока. Перед выполнением практической работы следует провести беседу с классом. Учащиеся должны ответить на следующие вопросы:
1. Какими физическими свойствами (агрегатное состояние при обычных условиях, запах, цвет, растворимость в воде) обладают поваренная соль и речной песок?
2. Как разделить компоненты смеси, используя различия в их физических свойствах? Составьте план действий.
3. Какое оборудование вам потребуется для очистки поваренной соли?
Затем учащиеся приступают к выполнению практической работы (с. 52 учебника).
Отчет о работе учащиеся оформляют в тетрадях для практических занятий в виде таблицы.
Что сделали
(названия опытов, рисунки приборов с обозначениями)
Что наблюдали
(признаки химических реакций)
Выводы
Домашнее задание. Провести домашний эксперимент - вырастить кристаллы поваренной соли или медного купороса (соблюдая правила техники безопасности). Учитель должен проконсультировать учащихся о деталях постановки опыта.
УРОК 5
Физические и химические явления
Цель урока. Сформировать понятие о химической реакции и признаках, отличающих химическую реакцию от физического явления.
Основные понятия. Химическая реакция.
Планируемые результаты обучения. Знать определение химической реакции, признаки и условия протекания химических реакций. Уметь отличать физические процессы от химических реакций.
Демонстрации. Демонстрация урока 8 электронного пособия «Электронная библиотека "Просвещение". Химия. 8 класс». Примеры физических и химических явлений: изменения, происходящие при растворении сахара в воде, при нагревании сахара, при плавлении и горении парафина.
Лабораторные опыты. Изучение физических и химических явлений.
Краткое содержание урока. Если в химическом кабинете есть электронное пособие «Электронная библиотека "Просвещение". Химия. 8 класс», то урок можно провести согласно описанию урока 8 этого пособия.
Изучение физических и химических явлений, признаков химических реакций можно осуществить и традиционным путем. Учитель демонстрирует физические явления: испарение воды, разрезание бумаги, растворение сахара в воде - и подводит к выводу, что данные вещества не превращаются в другие, т. е. эти изменения веществ относятся к физическим явлениям. Затем учитель демонстрирует химические явления: сгорание спирта, ржавление железа (поставить опыт заранее), скисание молока, выпадение осадка при взаимодействии сульфата натрия с хлоридом бария - и подводит к выводу, что при таких изменениях исходные вещества превращаются в новые вещества, т. е. эти изменения относятся к химическим явлениям, или химическим реакциям. Учащиеся рассматривают схему 4 (с. 11 учебника) и выполняют лабораторные опыты 3 и 4 (с. 50 учебника).
Далее учащиеся под руководством учителя пытаются ответить на вопрос: по каким признакам химических реакций можно судить, что образовалось новое вещество? После рассмотрения признаков химических реакций следует перейти к условиям их протекания.
В конце урока можно дать небольшую проверочную работу.
Вариант I
1. Из предложенного перечня явлений выпишите только химические реакции: горение лучины, растворение сахара в воде, ржавление железной проволоки, помутнение хранящейся в сосуде без пробки известковой воды, образование инея, таяние льда.
2. Какие признаки подтверждают, что пригорание масла во время приготовления пищи - химическое явление?
Вариант II
1. Из предложенного перечня явлений выпишите химические реакции: почернение медной пластинки при нагревании, плавление металла в пламени ацетиленово-кислородной горелки, образование кристаллов соли при упаривании ее раствора, выделение пузырьков газа из открытой бутылки с минеральной водой, обугливание лучины, скисание молока.
2. Поясните, какие признаки подтверждают, что гниение пищевых остатков - химическая реакция.
Вариант III
1. Приведите по два примера физических и химических явлений, которые можно наблюдать в быту. Назовите признаки химических реакций.
2. Приведите пример какого-либо вещества или тела и поясните, какие могут происходить с ним физические и химические явления.
Домашнее задание: § 3, упр. 10-13 (с. 13).
УРОК 6
Атомы и молекулы. Атомно-молекулярное учение. Вещества молекулярного и немолекулярного строения
Цель урока. Объяснить различие между атомом и молекулой, сформулировать основные положения атомно-молекулярного учения. Обратить внимание на существование веществ немолекулярного строения.
Основные понятия. Атом, молекула, вещества молекулярного и немолекулярного строения.
Планируемые результаты обучения. Знать основные положения атомно-молекулярного учения, представлять, что не все вещества состоят из молекул.
Демонстрации. Примеры веществ молекулярного (сахароза, иод) и немолекулярного (поваренная соль, железо) строения. Разложение воды электрическим током.
Краткое содержание урока. Изучение нового материала начинается с первых представлений об атомах и молекулах. Древнегреческим философом Демокритом (2500 лет назад) был введен термин «атом», что означает «неделимый». Далее учитель рассказывает об учении М. В. Ломоносова, который утверждал, что вещества состоят из корпускул (молекул), в состав которых входят элементы (атомы). В подтверждение этого учитель демонстрирует опыт разложения воды электрическим током. Затем дается определение атома и молекулы. Необходимо обратить внимание учащихся на то, что учение об атомах получило дальнейшее развитие в трудах известного английского ученого Дж. Дальтона.
Затем учитель переходит к рассмотрению веществ молекулярного и немолекулярного строения, демонстрируя их, вводит первые представления о кристаллической решетке вещества и зависимости физических свойств вещества от строения его кристаллической решетки.
Как вывод учащиеся под руководством учителя формулируют основные положения атомно-молекулярного учения.
Домашнее задание. § 4, упр. 1-10 (с. 25), § 13, упр. 8-12 (с. 37).
УРОК 7
Простые и сложные вещества. Химический элемент
Цель урока. Сформировать представления о простом и сложном веществах, химическом элементе как совокупности атомов одного вида. Научить различать понятия «простое вещество» и «химический элемент».
Основные понятия. Атом, молекула, простое вещество, сложное вещество, химический элемент.
Планируемые результаты обучения. Знать определение атома и молекулы, простого и сложного вещества, химического элемента как определенного вида атомов. Уметь различать понятия «простое вещество» и «химический элемент».
Демонстрации. Взаимодействие серы с железом (образование сульфида железа(П)).
Лабораторный опыт. Ознакомление с образцами простых и сложных веществ, минералов и горных пород, металлов и неметаллов.
Краткое содержание урока. После проверки домашнего задания учитель переходит к изучению нового материала. Опираясь на опыт, проведенный на предыдущем уроке (разложение воды электрическим током), учитель подчеркивает, что вода - сложное вещество, так как ее можно разложить на два разных вещества - кислород и водород. Не все сложные вещества в условиях школьной лаборатории можно разложить, но можно провести обратную реакцию - реакцию соединения. Учитель демонстрирует опыт соединения серы с железом (с. 17 учебника). Затем дается определение понятий «сложное вещество» и «простое вещество», разбирается схема 5 (с. 18 учебника) и выполняется лабораторный опыт 5 (с. 50 учебника).
При выполнении задания 1 лабораторного опыта следует обратить внимание на то, что все простые вещества делятся на металлы и неметаллы в зависимости от их свойств.
При объяснении нового материала нужно обратить внимание учащихся на то, что одной из причин многообразия веществ является способность атомов одного вида образовывать простые вещества, а также входить в состав сложных.
Разобрав со школьниками таблицу 1 (с. 9 учебника), учитель переходит к рассмотрению понятия «химический элемент». Учащимся следует сообщить, что химические элементы реально существуют в природе в виде отдельных атомов, а также входят в состав простых и сложных веществ. Простые и сложные вещества являются формами существования химического элемента. Дается определение химического элемента как определенного вида атомов.
Для закрепления материала учащиеся выполняют задания и отвечают на вопросы, например:
1. Допишите приведенные ниже предложения, заменив многоточия подходящими по смыслу понятиями «химический элемент», «атом», «молекула»:
а) ... кислорода состоят из ... одного ... .
б) ... кислорода содержит два ... .
в) В состав ... воды входят ... двух ..., одним из которых является кислород.
г) ... кислорода входят в состав воздуха.
2. Какие неточности допущены в выражении: «В соке антоновских яблок много железа»? В каком виде находится железо в яблочном соке?
3. Из приведенного перечня: сера, железо, сульфид железа, вода дистиллированная, вода минеральная, вода речная - выпишите названия веществ, состоящих из: а) атомов одного химического элемента; б) атомов разных химических элементов; в) смесей.
4. Используя слово «медь», составьте два предложения, в одном из которых говорится о меди как простом веществе, в другом - о меди как химическом элементе.
В конце урока уточняются определения понятий «простое вещество» и «сложное вещество».
Домашнее задание. § 5. упр. 11-13 (с. 25), § 6, упр. 14-15 (с. 25).
УРОК 8
Язык химии. Знаки химических элементов. Относительная атомная масса химических элементов
Цель урока. Познакомить учащихся с символами и названиями некоторых химических элементов. Сформировать понятие об относительной атомной массе. Показать различие между понятиями «масса атома» и «относительная атомная масса». Научить находить значение относительной атомной массы.
Основные понятия. Химический знак, атомная единица массы, относительная атомная масса.
Планируемые результаты обучения. Знать химические знаки некоторых химических элементов. Понимать различия между абсолютной и относительной массами. Уметь находить значение относительной атомной массы.
Краткое содержание урока. После проверки домашнего задания учитель переходит к рассмотрению символов химических элементов. Во время краткого рассказа об истории создания химической символики учитель обращает внимание на то, что каждый элемент имеет свой символ, понятный ученым любой страны. Эти символы одни и те же во всем мире. Не нужно запоминать химические знаки всех существующих элементов, для этого в химическом кабинете есть периодическая таблица химических элементов Д. И. Менделеева. Однако рекомендуется помнить некоторые из них. Учитель знакомит учащихся с химическими знаками 17 наиболее часто упоминаемых элементов (водород, кислород, азот, углерод, натрий, калий, магний, кальций, алюминий, марганец, железо, медь, цинк, серебро, сера, фосфор, хлор).
Методика заучивания химической символики приводится во многих пособиях. Лучше это делать в игровой форме с помощью самодельных карточек.
При изучении относительной атомной массы химического элемента учащимся необходимо объяснить, что атомы, как всякие частицы вещества, имеют массу, но очень маленькую. Учитель приводит примеры: масса самого легкого атома - атома водорода - равна 1,67375 · 10-24 г, масса атома кислорода - 2,656812 · 10-23 г, масса атома углерода - 1,9927 · 10-23 г. Можно привести такой пример: число атомов водорода в 1 см3 при температуре 0 °С и давлении 1 атм так велико, что если мы будем считать их со скоростью два атома в секунду, то, чтобы пересчитать все, понадобится около 900 миллиардов лет.
Далее учитель разъясняет, что массы атомов, выраженные в граммах, настолько малы, что пользоваться ими неудобно. Учитель ставит проблемный вопрос: в каких единицах массы выражают массу атомов химических элементов? Здесь учитель привлекает опорные знания межпредметного характера и подводит учащихся к введению новой единицы измерения массы атома - атомной единицы массы (а. е. м.), которая равна 1/12 массы атома углерода, т. е. 1,66 · 10-24 г. Затем показывает, как вычислить в атомных единицах массы массу нескольких химических элементов. После этого учитель рассказывает о работах Дж. Дальтона, который составил первую таблицу относительных атомных масс элементов, сообщает, что на практике пользуются относительной атомной массой элементов - безразмерной величиной, округленной до целых чисел (исключение - хлор; Ar(Cl) = 35,5). В заключение учитель формирует у учащихся умение находить значение относительных атомных масс элементов в периодической таблице химических элементов.
Домашнее задание. § 7, упр. 16, 17 (с. 25), § 8, упр. 18, 19 (с. 25).
УРОК 9
Закон постоянства состава веществ
Цель урока. Сформировать понятие о постоянстве состава веществ. Показать, что постоянный состав характерен только для веществ, имеющих молекулярное строение.
Основные понятия. Вещества молекулярного и немолекулярного строения, закон постоянства состава веществ.
Планируемые результаты обучения. Знать формулировку закона постоянства состава веществ. Уметь производить расчеты на основе закона постоянства состава веществ.
Демонстрации. Синтез воды в эвдиометре.
Краткое содержание урока. В начале урока проводится диктант с целью проверки знания символов (знаков) химических элементов. Для этого учитель сначала диктует названия семи-восьми химических элементов (учащиеся записывают на листочках символы элементов), затем пишет на доске символы семи-восьми элементов (учащиеся записывают названия элементов). На последующих пяти-шести уроках также полезно проводить диктанты.
Изучение закона постоянства состава веществ следует начать с повторения. Учащиеся должны вспомнить, чем отличаются смеси от химических соединений по составу и свойствам (табл. 1, с. 19 учебника).
Учитель напоминает о проводимом ранее опыте разложения воды электрическим током и выясняет с учащимися, что водород и кислород, образуя воду, вступают в реакцию в соотношении 2 : 1 (по объему) или в соотношении 1 : 8 (по массе).
2Ar(H) : Ar(O) = 2 · 1 : 1 · 16 = 1: 8
Затем можно продемонстрировать взаимодействие водорода и кислорода (синтез воды в эвдиометре) и убедиться, что водород и кислород вступают в реакцию в соотношении 2 : 1 (по объему). Если это соотношение не соблюдается, то одно из веществ остается в избытке.
Если взять 3 г водорода и смешать с 8 г кислорода, то химическая реакция произойдет, образуется вода, но 2 г водорода останется, не вступит в реакцию.
Затем учитель переходит к формулировке закона постоянства состава и уточняет, что этот закон справедлив только по отношению к веществам, имеющим молекулярное строение. Далее учитель показывает, как производить расчеты на основе закона постоянства состава (с. 27 учебника).
Домашнее задание. § 9, упр. 1-3 (с. 31).
УРОК 10
Химические формулы. Относительная молекулярная масса
Цель урока. Сформировать понятия о химической формуле, качественном и количественном составе вещества, индексе, коэффициенте, относительной молекулярной массе.
Основные понятия. Химическая формула, качественный и количественный состав вещества, индекс, коэффициент, относительная молекулярная масса.
Планируемые результаты обучения. Знать определение понятия «химическая формула» и что обозначает индекс в химической формуле. Уметь вычислять относительную молекулярную массу, характеризовать по данной формуле качественный и количественный состав вещества.
Краткое содержание урока. В начале урока либо проводится диктант для проверки знания знаков химических элементов, либо вызываются к доске ученики, которые выполняют задания по карточкам (записывают или знак элемента, или его название).
При изучении нового материала необходимо пояснить учащимся, какое значение имеет закон постоянства состава веществ для выведения химических формул. Рассматриваются конкретные примеры. Учитель подчеркивает, что при составлении химической формулы простого вещества вначале записывают знак химического элемента, входящего в состав данного вещества, затем внизу справа от знака записывают цифру, обозначающую число атомов данного химического элемента в молекуле. Эту цифру называют индексом. Например, молекулы кислорода, водорода, хлора, азота состоят из двух атомов; их формулы выглядят так: O2, Н2, Cl2, N2. Если вещество сложное, т. е. его молекула состоит из нескольких химических элементов, то при составлении формулы следует записать знаки химических элементов, составляющих данное вещество и определяющих качественный состав, а внизу справа от знаков - индексы, показывающие, сколько атомов данного элемента входит в молекулу (количественный состав). Например, СО, CO2, N2O5, NO2.
Учащимся необходимо упражняться в чтении химических формул: СО - цэ-о; СO2 - цэ-о-два; N2O5 - эн-два-о-пять; NO2 - эн-о-два. Если молекул несколько, то перед формулой ставится число (коэффициент). Например, 5N2O5 - это пять молекул оксида азота(V). Читается это так: пять эн-два-о-пять.
Закрепляя представление о веществах молекулярного и немолекулярного строения, нужно отметить особый смысл индекса. В формулах веществ молекулярного строения индекс показывает, сколько атомов химического элемента входит в состав каждой молекулы, а в формулах веществ немолекулярного строения индексы выражают соотношение чисел атомов каждого из элементов в соединении. Например, формула Н2O показывает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Формула АlСl3 показывает, что в хлориде алюминия на каждый атом алюминия приходится три атома хлора. Необходимо добиваться того, чтобы учащиеся усвоили, что индексы характеризуют постоянство состава каждого вещества и поэтому их нельзя изменять произвольно. Учитель должен подвести учащихся к выводу, что химическая формула выражает состав определенного вещества, взятого в чистом виде.
Далее необходимо поупражняться в написании химических формул. К доске вызываются ученики, которым можно предложить следующие задания:
1. Напишите химические формулы веществ:
а) кислорода, если молекула кислорода состоит из двух атомов кислорода;
б) озона, если молекула озона состоит из трех атомов кислорода;
в) сероводорода, если молекула сероводорода состоит из двух атомов водорода и одного атома серы;
г) серной кислоты, если молекула серной кислоты состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода;
д) фторида кальция, если во фториде кальция на каждый атом кальция приходится два атома фтора.
2. Что означает следующая запись?
а) 4Н; 7Fe; Н2; 4Н2
б) NaCl; AlBr3; FeS
Далее учитель переходит к рассмотрению относительной молекулярной массы вещества, на конкретных примерах показывает, как ее рассчитывают. В заключение учащиеся самостоятельно выясняют, какую информацию о веществе можно получить по его химической формуле, используя материал учебника (с. 29).
Домашнее задание. § 10 (примеры задач 1, 2), упр. 4-9, 11, 12 (с. 32).
УРОК 11
Массовая доля химического элемента
Цель урока. Научить вычислять массовую долю элементов по формулам сложных веществ и устанавливать химическую формулу сложного вещества по известным массовым долям химических элементов.
Основные понятия. Относительная атомная и молекулярная массы, массовая доля химического элемента.
Планируемые результаты обучения. Уметь рассчитывать массовую долю элемента в соединении по его формуле и устанавливать химическую формулу сложного вещества по известным массовым долям химических элементов.
Краткое содержание урока. В начале урока можно провести проверочную работу в тестовой форме.
Вариант I
1. Среди перечисленных химических знаков отметьте знак кальция.
1) K
2) Са
3) С
4) Mg
2. Установите соответствие между химическим знаком элемента и его названием.
1) Мn
2) Na
3) О
4) Mg
А. кислород
Б. марганец
В. магний
Г. водород
Д. натрий
1
2
3
4
3. Что обозначает запись 2O2?
1) четыре атома кислорода
2) два атома кислорода
3) две молекулы кислорода
4) четыре молекулы кислорода
4. Из перечисленных формул выберите формулу, обозначающую вещество, молекула которого состоит из четырех атомов.
1) Н2O2
2) С2Н4
3) Na2CO3
4) СН2СlСООН
5. Какое утверждение правильно отражает состав молекулы углекислого газа СO2?
Молекула углекислого газа состоит
1) из молекулы углерода и молекулы кислорода
2) из атома углерода и двухатомной молекулы кислорода
3) из атома углерода и двух атомов кислорода
4) из молекулы углерода и двух атомов кислорода
6. Относительная молекулярная масса оксида железа(III) Fe2O3 равна
1) 320
2) 160
3) 480
4) 62
7. В каком массовом отношении находятся медь и кислород в соединении, формула которого CuO?
1) 2 : 1
2) 4 : 1
3) 1 : 1
4) 1 : 4
8. Водород соединяется с серой в массовом отношении 1 : 16. Используя данные об относительных атомных массах этих элементов, выведите химическую формулу получившегося вещества.
Вариант II
1. Среди перечисленных химических знаков отметьте знак серы.
1) Сl
2) С
3) S
4) Р
2. Установите соответствие между химическим знаком элемента и его названием.
1) Fe
2) Н
3) Сl
4) Cu
А. медь
Б. водород
В. серебро
Г. железо
Д. хлор
1
2
3
4
3. Какая запись обозначает, что молекула азота состоит из двух атомов?
1) 2N
2) N2
3) N2O
4) N2O3
4. Из перечисленных формул выберите формулу, обозначающую вещество, молекула которого состоит из атомов трех химических элементов.
1) K2O
2) C2H4
3) MgOHCl
4) CH3COOH
5. Какое утверждение правильно отражает состав молекулы оксида азота(IV) NO2?
Молекула оксида азота(IV) состоит
1) из атомов азота и молекулы кислорода
2) из молекулы азота и молекулы кислорода
3) из атомов азота и двух атомов кислорода
4) из молекулы азота и двух атомов кислорода
6. Относительная молекулярная масса глюкозы C6H12O6 равна
1) 360
2) 90
3) 180
4) 540
7. В каком массовом отношении находятся сера и кислород в соединении, формула которого SO2?
1) 2 : 1
2) 1 : 1
3) 1 : 2
4) 1 : 4
8. Используя сведения об относительных атомных массах химических элементов, составьте химическую формулу вещества, если известно, что массовое отношение в нем меди, серы и кислорода 2 : 1 : 2.
После проведения проверочной работы учитель переходит к изучению нового материала.
Нахождение массовой доли элемента в сложном веществе можно осуществить двумя путями: либо как это показано в учебнике (с. 30), либо через относительную атомную и молекулярную массы:
![]()
Учителю необходимо объяснить понятие доли как части целого, ввести два способа выражения долей - в долях единицы и процентах.
Вывод химических формул сложного вещества по известным массовым долям химических элементов подробно рассмотрен в учебнике (с. 31).
Домашнее задание: § 10, упр. 10 (с. 32).
УРОКИ 12-13
Валентность химических элементов.
Составление химических формул по валентности
Цель урока. Сформировать понятие о валентности как о свойстве атомов одного элемента присоединять или замещать определенное число атомов другого элемента. Научить определять валентность элементов по формулам соединений и составлять формулы соединений по валентности элементов.
Основные понятия. Валентность.
Планируемые результаты обучения. Уметь определять валентность элементов по формулам соединений из двух элементов и составлять формулы веществ из двух элементов по известной валентности.
Краткое содержание урока. Изучение валентности и составление химических формул по валентности следует рассмотреть на двух уроках. На первом уроке учитель формирует понятие о валентности, учит определять валентность атомов по формулам соединений. На втором уроке учащиеся обучаются составлению химических формул соединений по валентности. Большую помощь в этом учителю и ученикам окажут алгоритмы, представленные в учебнике, а также электронное пособие «Электронная библиотека "Просвещение". Химия. 8 класс», урок 23.
Формирование понятия «валентность» предлагаем осуществить на примерах водородных соединений неметаллов. Учитель обращает внимание учащихся на то, что атомы водорода не могут присоединять более одного атома другого химического элемента, поэтому валентность водорода принята за единицу.
Свойство атомов присоединять определенное число других атомов называют валентностью и выражают ее числом, сравнивая с валентностью водорода. Например, хлор в хлороводороде НСl одновалентен, кислород в воде Н2O двухвалентен, а азот в аммиаке NH3 трехвалентен и т. д.
Если валентность обозначить черточкой (число черточек указывает на валентность атомов в соединении), то мы получим структурную формулу соединения:
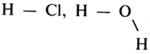
Структурная формула дает наглядное представление о валентности каждого элемента и отражает порядок связи атомов в молекуле вещества.
Используя алгоритм (с. 34 учебника), учитель показывает, как определить валентность элементов по формулам их соединений. После этого необходимо предложить несколько упражнений для закрепления материала.
Домашнее задание. § 11, 12 (с. 33-34), упр. 1-4 (с. 37).
На втором уроке после проверки домашнего задания учитель знакомит учащихся с приемами составления формул веществ по валентности. Имеет смысл уже здесь дать названия некоторым соединениям (оксиды, хлориды, сульфиды). Это обогатит химический язык и даст возможность более свободно пользоваться формулами веществ.
Для закрепления умения составлять формулы веществ по валентности можно дать упражнения с последующим обсуждением:
1. Составьте формулы следующих оксидов: оксида натрия, оксида магния, оксида алюминия, оксида фосфора(V).
2. Составьте формулы хлоридов и сульфидов калия, железа(III), кальция, алюминия.
3. Составьте формулы оксидов азота, если азот проявляет переменную валентность от I до V.
Домашнее задание. § 12, упр. 5-7, задачи 1, 2 (с. 37).
УРОК 14
Закон сохранения массы веществ. Химические уравнения
Цель урока. Экспериментально доказать закон сохранения массы веществ. На основе этого закона сформировать понятие о материальном балансе химической реакции. Сформировать понятие об уравнении химической реакции как об условной записи, отображающей превращения веществ. Научить расставлять коэффициенты в уравнениях реакций.
Основные понятия. Закон сохранения массы веществ, химическое уравнение, коэффициенты.
Планируемые результаты обучения. Знать формулировку закона сохранения массы веществ, понимать смысл уравнений химических реакций, уметь расставлять коэффициенты в уравнениях реакций.
Демонстрации. Опыты, подтверждающие закон сохранения массы веществ: горение красного фосфора в закрытом сосуде, взаимодействие сульфата натрия и хлорида бария в закрытом сосуде. Технические весы с разновесами.
Краткое содержание урока. После проверки умения составлять химические формулы веществ по валентности элементов учитель переходит к рассказу об опытах, проводимых М. В. Ломоносовым и А. Лавуазье, которые независимо друг от друга открыли закон сохранения массы веществ при химических реакциях. Затем учитель переходит к формулировке закона.
Внимание учащихся следует обратить на то, что сохранение массы веществ наблюдается только при таких явлениях, когда атомы не разрушаются - происходит их перегруппировка. Так как число атомов до реакции и после реакции остается неизменным, то их общая масса также не изменяется.
Далее учитель переходит к демонстрации опытов, иллюстрирующих закон сохранения массы веществ (горение красного фосфора и взаимодействие сульфата натрия с хлоридом бария в закрытых сосудах).
Рассматривается значение закона сохранения массы веществ. Затем учитель сообщает, что этот закон является основой для составления уравнений химических реакций, и переходит к условной записи химических реакций. При этом используются ранее приобретенные знания: понятие «валентность», правила составления формул веществ по валентности; формируется понятие «коэффициент» и умение расставлять коэффициенты в уравнении химической реакции. Учитель дает учащимся алгоритм расстановки коэффициентов в уравнениях химических реакций на примере реакции горения красного фосфора.
Порядок выполнения операций
Пример
1. В левой части уравнения записать исходные вещества, в правой - продукты реакции (молекулы газов водорода, хлора, кислорода, азота состоят из двух атомов)
![]()
2. Определить число атомов каждого элемента в левой и правой частях схемы реакции
![]()
3. Среди элементов с разным числом атомов до и после реакции выбрать тот, число атомов которого больше
O - 2 атома слева
O - 5 атомов справа
4. Найти наименьшее общее кратное (НОК) числа атомов этого элемента в левой части уравнения и числа атомов этого элемента в правой части уравнения
НОК - 10
5. Разделить НОК на число атомов этого элемента в левой части уравнения, получив коэффициент для левой части уравнения
10 : 2 = 5
P + 5O2 ![]() P2O5
P2O5
6. Разделить НОК на число атомов этого элемента в правой части уравнения, получив коэффициент для правой части уравнения
10 : 2 = 5
P + 5O2 ![]() 2P2O5
2P2O5
7. Необходимо подсчитать число атомов других элементов в левой и правой частях уравнения и с помощью коэффициентов уравнять их, т. е. число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым
![]()
В левую часть уравнения перед фосфором необходимо поставить коэффициент 4.
4P + 5O2 ![]() 2P2O5
2P2O5
Для закрепления умения записывать химические уравнения можно вызывать учащихся к доске и упражняться в расстановке коэффициентов в уравнениях химических реакций.
Этот урок можно провести, руководствуясь уроком 25 в электронном пособии «Электронная библиотека "Просвещение". Химия. 8 класс».
Домашнее задание. § 14, 15, упр. 1-4 (с. 47).
УРОК 15
Классификация химических реакций по числу и составу исходных и полученных веществ
Цель урока. Сформировать умение классифицировать химические реакции по числу и составу исходных и полученных веществ. Научить определять тип реакции по данному химическому уравнению.
Основные понятия. Реакции разложения, соединения, замещения.
Планируемые результаты обучения. Знать определения реакций разложения, соединения и замещения. Уметь определять тип реакции по данному химическому уравнению.
Демонстрации. Прокаливание медной пластинки, горение магния.
Лабораторные опыты. Разложение основного карбоната меди(II). Реакция замещения меди железом.
Краткое содержание урока. Урок можно начать с объяснения нового материала, где учитель продолжает формировать умение записывать уравнения химических реакций и расставлять в них коэффициенты.
При изучении типов химических реакций учащиеся знакомятся с классификацией химических реакций по такому признаку, как число и состав исходных и образующихся в результате реакций веществ; рассматривают особенности реакций разложения, соединения, замещения.
Учитель рассказывает о реакции разложения на примере разложения воды электрическим током (рис. 9, с. 15 учебника), проводит беседу по следующим вопросам:
1. Сколько веществ было взято для реакции разложения воды и сколько веществ образовалось в результате реакции? Какие вещества образовались?
2. При каких условиях протекает эта реакция?
3. Какими признаками она сопровождается?
Затем учитель вызывает к доске ученика, который записывает уравнение реакции разложения воды и расставляет коэффициенты.
Далее учащиеся выполняют лабораторный опыт 6 (с. 50 учебника) - разложение основного карбоната меди(II). Учитель проводит беседу по тем же вопросам, что и при обсуждении реакции разложения воды. Один из учащихся на доске записывает уравнение химической реакции. Учащиеся должны самостоятельно дать определение реакции разложения. После этого они проверяют себя, рассматривая схему 6 (с. 41 учебника).
В качестве примеров реакций соединения учитель демонстрирует горение магния и прокаливание медной пластинки. Реакцию замещения учащиеся изучают, проводя лабораторный опыт 7 (с. 51 учебника) - взаимодействие хлорида меди(II) с железным гвоздем.
Методика рассмотрения этих типов реакций такая же, что и при рассмотрении реакции разложения.
Если в химическом кабинете имеется электронное пособие «Электронная библиотека "Просвещение". Химия. 8 класс», то можно разобрать с учащимися урок 24 этого пособия.
Для закрепления полученных знаний учащиеся в конце урока выполняют несколько заданий, например:
1. Допишите схему химической реакции. Расставьте коэффициенты. Укажите тип каждой реакции.
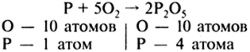
2. Сравните реакции соединения и разложения (разложения и замещения, замещения и соединения): а) по числу взятых и полученных веществ; б) по тому, являются ли исходные и полученные вещества простыми или сложными.
Домашнее задание. § 16, упр. 5, 6 (с. 47).
УРОК 16
Моль - единица количества вещества. Молярная масса
Цель урока. Сформировать понятие о количестве вещества как об одной из основных физических величин. Показать численное равенство молярной и относительной молекулярной масс вещества. Научить вычислять количество вещества по известной массе вещества и массу вещества по известному количеству вещества.
Основные понятия. Количество вещества, моль, число Авогадро, постоянная Авогадро, молярная масса.
Планируемые результаты обучения. Знать число Авогадро, определения количества вещества и моля. Уметь определять число структурных единиц по данному количеству вещества и наоборот. Знать о равенстве числовых значений молярной и относительной молекулярной масс. Уметь вычислять массу данного количества вещества.
Демонстрации. Показ некоторых металлов и неметаллов количеством вещества 1 моль.
Краткое содержание урока. Рекомендуем в начале урока провести проверочную работу на составление уравнений химических реакций, расстановку коэффициентов и определение типа реакции.
При изучении нового материала учитель обращает внимание учащихся на то, что в химии, кроме использования таких величин, как масса и объем, используется еще одна физическая величина - количество вещества. Количество вещества определяется числом структурных единиц (атомов, молекул или наименьшим повторяющимся фрагментом для веществ немолекулярного строения, ионов, электронов и других частиц). Единицей количества вещества является моль. Обозначается данная величина буквой ν (ню). Число частиц в одном моле вещества (6,02 · 1023) называют числом Авогадро. Постоянная Авогадро численно совпадает с числом Авогадро, но в отличие от него имеет единицу измерения - моль-1. Учитель обращает внимание учащихся на то, что химическая формула может обозначать как одну молекулу вещества (или наименьший повторяющийся фрагмент для веществ немолекулярного строения), так и один моль вещества, т. е. 6 · 1023 таких частиц. Затем учитель переходит к понятию «молярная масса», дает определение молярной массы, показывает, что молярная масса вещества численно равна массе 1 моль, т. е. массе 6,02 · 1023 частиц данного вещества. Важно объяснить, что числовое значение молярной массы совпадает с числовым значением относительной молекулярной массы, а также массы порции вещества, взятого в количестве 1 моль. Можно привести следующую таблицу.

Следовательно, молярная масса - это постоянная характеристика вещества. Она численно равна относительной молекулярной (или атомной) массе данного вещества (см. табл. 5 учебника). Используя формулу ![]() , можно определить одну величину по известной другой (массу вещества по известному количеству вещества и, наоборот, количество вещества по известной массе вещества). Методика решения таких задач подробно рассмотрена в учебнике (с. 44).
, можно определить одну величину по известной другой (массу вещества по известному количеству вещества и, наоборот, количество вещества по известной массе вещества). Методика решения таких задач подробно рассмотрена в учебнике (с. 44).
Домашнее задание. § 17, упр. 7-10 (с. 47).
УРОК 17
Вычисления по химическим уравнениям
Цель урока. Научить вычислять по заданным химическим уравнениям массу или количество вещества по известной массе или известному количеству одного из вступающих в реакцию или получающихся в результате реакции веществ.
Основные понятия. Относительная атомная и молекулярная массы, моль, количество вещества, молярная масса.
Планируемые результаты обучения. Уметь вычислять по заданным химическим уравнениям массу или количество вещества по известному количеству вещества или по известной массе одного из вступающих в реакцию или получающихся в результате реакции веществ.
Краткое содержание урока. Урок можно начать с изучения нового материала, так как проверку умений вычислять молярную массу можно осуществить при решении задач по химическим уравнениям.
При формировании умения решать задачи по химическим уравнениям следует использовать такие задачи, решение которых не будет вызывать у учащихся затруднения в составлении уравнений реакций. На первом этапе уравнения можно давать в готовом виде.
Расчетные химические задачи являются арифметическими. Решение таких задач строится на использовании прямо пропорциональной зависимости между четырьмя величинами: две из них даются в условии задачи, две другие определяются по уравнению химической реакции. Учащиеся умеют составлять и решать пропорцию. Однако необходимо обратить их внимание на то, что коэффициенты в уравнении реакции показывают количество взятых и полученных веществ. Следует также обратить внимание на то, что при выборе величин, по которым будет производиться расчет, необходимо использовать для каждого вещества одинаковые единицы измерения (как по условию задачи, так и по уравнению реакции).
На первом этапе обучения решению задач по химическим уравнениям надо показать подробный образец записи условия задачи и ее решения. Затем можно постепенно переходить от подробной записи решения задачи к более краткой («Электронная библиотека "Просвещение". Химия. 8 класс», урок 27).
Домашнее задание. § 17 (с. 45-47), задачи 1, 2 (с. 48).
УРОК 18
Контрольная работа по теме «Первоначальные химические понятия»
Цель урока. Проконтролировать знания по теме.
Методические рекомендации. Для проведения контрольной работы необходимо подготовить задания, отличающиеся по уровню сложности.
Значительную помощь в составлении вариантов контрольной работы окажут пособия:
1. Гара Н. Н., Зуева М. В. Химия. Сборник заданий для проведения промежуточной аттестации (Серия «Текущий контроль»). - М.: Просвещение, 2006.
2. Иванова Р. Г., Каверина А. А., Корощенко А. С. Химия. Сборник заданий для проведения экзамена в 9 классе (Серия «Итоговая аттестация»). - М.: Просвещение, 2006.
3. Радецкий А. М. Химический тренажер (Серия «Текущий контроль»). - М.: Просвещение, 2007.
4. Радецкий А. М. Проверочные работы по химии в 8-11 классах. - М.: Просвещение, 2001.
Предлагаем варианты контрольной работы в тестовой форме.
Вариант I
1. В левом столбце под номерами 1-4 записаны известные вам понятия, в правом столбце буквами А-Г обозначены их характеристики. Выпишите номер, которым обозначено понятие, и букву, соответствующую его характеристике.
1) химический элемент
2) простое вещество
3) сложное вещество
4) смесь
А. состоит из атомов одного вида, обладает постоянными физическими свойствами
Б. состоит из атомов разных видов, имеет постоянные свойства
В. состоит из разных веществ, которые отличаются свойствами
Г. один вид атомов, физические свойства которого обычно не характеризуют
1
2
3
4
2. Очистить железные опилки от порошка серы можно
1) фильтрованием
2) с помощью магнита
3) нагреванием
4) растиранием смеси в ступке
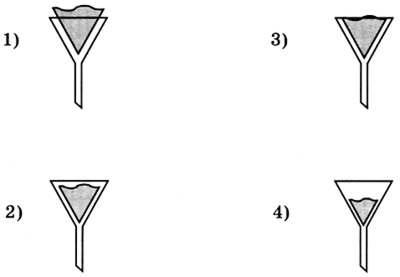
3. Правильно вложен фильтр в воронку для проведения опыта по разделению смеси на рисунке
4. На приведенных ниже рисунках показан состав веществ, в которые могут входить химические элементы кислород, сера, углерод и железо. Один из рисунков не изображает состав сложного вещества - это
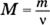
5. Только сложные вещества перечислены в ряду
1) воздух, вода, кислород
2) серная кислота, водород, озон
3) кислород, азот, хлор
4) поваренная соль, вода, сероводород
6. Какая запись обозначает, что молекула азота состоит из двух атомов?
1) 2N
2) N2
3) N2O
4) N2O3
7. В соединении с водородом валентность II всегда имеют химические элементы
1) S, N
2) О, S
3) О, С
4) S, Cl
8. Среди приведенных схем химических реакций к реакциям соединения относится
9. Массовая доля химического элемента фосфора в оксиде фосфора(V) равна
1) 19,2%
2) 36,4%
3) 43,7%
4) 100%
10. В результате окисления 3,2 г меди кислородом получен оксид меди(П) количеством вещества
1) 0,01 моль
2) 0,05 моль
3) 0,4 моль
4) 1,5 моль
Вариант II
1. Покажите стрелкой вертикальной (![]() ), горизонтальной (
), горизонтальной (![]() ) или диагональной (
) или диагональной (![]() ) расположение в каждом из трех квадратов названий: в первом квадрате металлов, во втором - сложных веществ, в третьем - смесей.
) расположение в каждом из трех квадратов названий: в первом квадрате металлов, во втором - сложных веществ, в третьем - смесей.
I
Серебро
Сера
Кислород
Железо
Хлор
Кремний
Медь
Водород
Азот
II
Вода
Сера
Кислород
Воздух
Углекислый газ
Азот
Железо
Медь
Сульфид алюминия
III
Медь
Сера
Оксид магния
Азот
Вода дистиллированная
Углекислый газ
Воздух
Сахар, загрязненный углем
Вода, загрязненная нефтью
2. Фильтрованием можно разделить смесь
1) воды и сахара
2) воды и поваренной соли
3) воды и угольной пыли
4) воды и уксусной эссенции
3. Чтобы правильно погасить пламя спиртовки, нужно
1) подуть на пламя
2) надеть на пламя колпачок
3) накрыть пламя руками
4. На приведенных ниже рисунках показан состав веществ, в которые могут входить химические элементы железо, кислород, сера и медь. Состав простого вещества изображает рисунок
5. Только простые вещества перечислены в ряду
1) воздух, вода, кислород
2) серная кислота, водород, озон
3) кислород, азот, хлор
4) поваренная соль, вода, сероводород
6. Запись 2O2 обозначает
1) четыре атома кислорода
2) два атома кислорода
3) две молекулы кислорода
4) четыре молекулы кислорода
7. Валентность V азот имеет в каждом из веществ, указанных в ряду
1) N2O5, HNO3, HNO2
2) NH3, NO2, N2O5
3) KNO3, N2O5, HNO3
4) NH3, HNO3, NO
8. Среди приведенных схем химических реакций к реакциям разложения относится
1) Cu + Н2SO4 (конц.) ![]() CuSO4 + Н2O + SO2
CuSO4 + Н2O + SO2
2) HgO ![]() Нg + O2
Нg + O2
3) Н2 + O2 ![]() Н2O
Н2O
4) FеО + НСl ![]() FеСl2 + Н2O
FеСl2 + Н2O
9. Массовая доля химического элемента натрия в сульфиде натрия равна
1) 0,28
2) 0,46
3) 0,59
4) 0,78
10. При полном сжигании алюминиевой фольги в 0,6 моль кислорода можно получить оксид алюминия количеством вещества
1) 0,4 моль
2) 1,2 моль
3) 3,5 моль
4) 4 моль
ТЕМА 2
КИСЛОРОД (5 ч)
УРОК 19
Кислород, его общая характеристика и нахождение в природе. Получение. Физические свойства кислорода
Цель урока. Конкретизировать знания о химическом элементе и простом веществе. Повторить, какие свойства относятся к физическим, какие - к химическим. Сформировать представления о способах получения и собирания кислорода в лаборатории.
Основные понятия. Химический элемент, простое вещество, физические свойства, катализаторы.
Планируемые результаты обучения. Уметь различать понятия «химический элемент» и «простое вещество» на примере кислорода. Уметь характеризовать физические свойства кислорода и способы собирания кислорода.
Демонстрации. Получение кислорода из перманганата калия, пероксида водорода. Собирание кислорода методом вытеснения воздуха и методом вытеснения воды.
Краткое содержание урока. В начале урока необходимо провести анализ контрольной работы.
Приступая к изучению новой темы, важно охарактеризовать кислород как один из важнейших для большинства живых организмов химических элементов. Этим и обусловлено то, что изучение простых веществ начинается с кислорода. Следует учесть, что многие вопросы уже изучены учащимися в курсах природоведения и биологии. Необходимо выяснить у учащихся, что им известно о кислороде.
Изучение кислорода начинают с рассмотрения его как химического элемента и как простого вещества. Учитель дает план, в котором четко проявляется различие вышеупомянутых понятий. Этим планом необходимо пользоваться и в дальнейшем при изучении других химических элементов.
План характеристики химического элемента
1. Химический знак.
2. Относительная атомная масса.
3. Валентность.
4. Распространенность элемента в природе.
План характеристики простого вещества
1. Химическая формула.
2. Относительная молекулярная масса.
3. Физические свойства.
4. Химические свойства.
5. Применение.
6. Способы получения в лаборатории и в промышленности.
7. Нахождение в природе.
Используя этот план, учащиеся самостоятельно характеризуют кислород как химический элемент.
При характеристике кислорода как простого вещества надо знать его физические свойства. Для этого надо получить это вещество и наблюдать его физические свойства. Вначале необходимо дать историческую справку об открытии кислорода английским ученым Дж. Пристли, а затем получить кислород из перманганата калия и показать учащимся способы собирания кислорода, при этом обязательно надо обратить внимание на технику безопасности выполнения опытов и выяснить, на каких физических свойствах основаны способы собирания кислорода.
Изучение понятия «катализатор» можно осуществить при обсуждении демонстрационного опыта - получения кислорода из пероксида водорода.
Домашнее задание. § 18, 19, 20 (физические свойства кислорода), упр. 1-3, задача 1 (с. 59-60).
УРОК 20
Химические свойства кислорода. Применение. Круговорот кислорода в природе
Цель урока. Изучить химические свойства кислорода. Закрепить знания учащихся о реакциях соединения и отработать умения составлять соответствующие химические уравнения. Сформировать первые представления о реакциях окисления.
Основные понятия. Химические свойства, реакция соединения, горение, окисление, оксиды.
Планируемые результаты обучения. Знать химические свойства кислорода. Уметь различать физические и химические свойства, составлять уравнения реакций кислорода с фосфором, серой, углем и железом. Уметь объяснять круговорот кислорода в природе.
Лабораторный опыт. Ознакомление с образцами оксидов.
Демонстрации. Горение углерода, серы, фосфора, железа в кислороде.
Краткое содержание урока. На этом уроке учащиеся впервые начинают знакомиться с химическими свойствами простого вещества - кислорода. Учитель должен показать отличие физических и химических свойств и что понимается под химическими свойствами (способность веществ превращаться в другие под воздействием определенных условий: при изменении температуры, давления и т. д.).
Изучение химических свойств кислорода учитель проводит на основе демонстрационных опытов. Так как для опытов потребуется большое количество кислорода, то на демонстрационном столе должен находиться газометр, наполненный кислородом. Учитель обращает внимание учащихся на этот прибор, при этом необходимо задать вопрос: на каком свойстве кислорода основан способ его хранения?
Далее учитель демонстрирует опыты горения угля, серы, фосфора, железа в кислороде, обращает внимание учащихся на условия и признаки химических реакций, отмечает, как эти вещества горят на воздухе и в чистом кислороде. На доске после каждого опыта один из учащихся записывает уравнения проделанных химических реакций. В конце демонстраций учащиеся приходят к выводу, что горение простых веществ в кислороде относится к реакциям соединения. В результате этих реакций образуются сложные вещества, которые состоят из двух элементов, одним из которых является кислород, т. е. образуются оксиды. Учащиеся получают первоначальные сведения об оксидах, выполняют лабораторный опыт 8 (с. 69 учебника). Затем дается понятие реакции окисления.
Для закрепления нового материала можно предложить учащимся самостоятельно записать несколько уравнений реакций окисления простых веществ кислородом. Если позволяет время, то следует обратить внимание на горение сложных веществ в кислороде. В результате реакции образуются также оксиды, но тип реакции будет уже другой, его рассматривают позже. Если нет времени, то взаимодействие кислорода со сложными веществами можно рассмотреть на уроке «Горение и медленное окисление». Изучая применение кислорода, учитель прослеживает зависимость между свойствами кислорода и областями его применения.
Домашнее задание. § 20, 21, упр. 4-12, задачи 2, 3 (с. 60).
УРОК 21
Практическая работа 3
«Получение и свойства кислорода»
Цель урока. Ознакомить с одним из способов получения кислорода в лаборатории и его химическим свойством - способностью поддерживать горение простых веществ. Научить собирать газ в сосуд вытеснением воздуха и воды. Совершенствовать умение работать с простейшими приборами при нагревании.
Планируемые результаты обучения. Уметь собирать простейший прибор для получения газа, проверять его на герметичность, укреплять прибор в штативе, обращаться с нагревательными приборами. Уметь собирать газ вытеснением воды и воздуха.
Краткое содержание урока. Этот урок очень важен для формирования практических умений. Учащиеся впервые самостоятельно проводят практическую работу. Учителю следует напоминать им, что после выполнения каждого опыта необходимо записывать в тетрадь наблюдения и выводы. Учащиеся оформляют отчет о работе в виде таблицы.
Инструкция по выполнению данной работы дана в учебнике (с. 70).
Домашнее задание. Повторить § 18-21.
УРОК 22
Воздух и его состав. Защита атмосферного воздуха от загрязнений
Цель урока. Сформировать понятие о воздухе как смеси, состоящей из простых и сложных веществ. Познакомить учащихся с экологическими проблемами, связанными с загрязнением воздуха, и показать необходимость охраны атмосферного воздуха.
Основные понятия. Простые и сложные вещества, смеси.
Планируемые результаты обучения. Знать состав воздуха как смеси, состоящей из простых и сложных веществ. Понимать проблемы, связанные с охраной атмосферного воздуха.
Демонстрации. Определение состава воздуха (сжигание фосфора под колоколом).
Краткое содержание урока. В начале урока следует актуализировать знания учащихся о физических и химических свойствах кислорода, о лабораторных способах его получения, о применении кислорода. Для этого учитель проводит фронтальную беседу, а отдельным учащимся дает индивидуальные задания.
Объяснение нового материала следует начать с вопроса о составе воздуха. Этот вопрос был объектом исследований в течение многих веков. Лишь в конце XVIII века ученые-естествоиспытатели Дж. Пристли, А. Лавуазье и К. Шееле установили, что воздух - это смесь газов, из которых наиболее важными являются кислород и азот. Учитель рассматривает исторический опыт А. Лавуазье по определению состава воздуха (рис. 35, с. 61 учебника). Опыт А. Лавуазье позволил судить о составе воздуха как с качественной, так и с количественной стороны: в воздухе содержится примерно 4/5 азота и 1/5 кислорода (по объему). Затем учитель демонстрирует горение фосфора под колоколом. При этом вода в колоколе поднимается примерно на 1/5, так как при горении фосфора расходуется только кислород. Далее учитель рассказывает, что в конце XIX века ученым удалось уточнить состав воздуха. Кроме азота и кислорода, в состав воздуха входят благородные (инертные) газы, оксид углерода(IV) и водяные пары. Учащиеся рассматривают таблицу 6 (с. 61 учебника). Один из учащихся может выступить с заранее подготовленным сообщением о применении благородных газов (возможно использование видеофрагментов урока 9 электронного пособия «Электронная библиотека "Просвещение". Химия. 8 класс»). Далее учитель отмечает, что процентное содержание углекислого газа в воздухе непостоянно. Оно может меняться в зависимости от конкретной местности. Учащиеся могут пояснить это высказывание. Здесь уместно рассказать о парниковом эффекте, используя фрагменты урока 12 вышеупомянутого пособия.
Материал урока позволяет перейти к экологическим проблемам - охране атмосферного воздуха от загрязнений.
Домашнее задание. § 22 (с. 60-62), § 24 (с. 68), упр. 1-4 (с. 69). Подготовить сообщение «Воздушная среда нашей местности».
УРОК 23
Горение и медленное окисление. Тепловой эффект химических реакций
Цель урока. Развивать знания учащихся о химических свойствах кислорода при рассмотрении процессов горения и медленного окисления, о значении этих процессов для природы и человека. Сформировать понятия о тепловом эффекте химических реакций, экзо- и эндотермических реакциях.
Основные понятия. Горение, медленное окисление, тепловой эффект химических реакций, экзо- и эндотермические реакции.
Планируемые результаты обучения. Уметь объяснять различие между горением и медленным окислением. Уметь записывать термохимическое уравнение реакции и вычислять количество теплоты по термохимическому уравнению реакции.
Демонстрации. Горение спирта в фарфоровой чашке. Тушение пламени.
Краткое содержание урока. В начале урока после проверки домашнего задания учитель рассматривает горение сложных веществ в кислороде (если этот вопрос еще не рассматривался). Изучение горения и медленного окисления можно организовать в форме самостоятельной работы по учебнику (с. 63-64). После прочтения этого материала учитель проводит обсуждение следующих вопросов: чем различается горение в кислороде и на воздухе? Каковы условия возникновения и прекращения горения, способы тушения горящих веществ (демонстрирует горение спирта и его тушение)? В чем сущность медленного окисления? Кроме этого, можно обсудить вопросы экологического характера, как вести себя в лесу, как разводить костры во время походов.
В конце беседы учащимся предлагается составить таблицу «Сравнение горения и медленного окисления»
Процесс
Сходство
Различие
Горение
Медленное окисление
После этого учитель переходит к рассмотрению теплового эффекта химических реакций, экзо- и эндотермических реакций, обращает внимание на запись уравнений реакций. В термохимических уравнениях в отличие от обычных химических уравнений обязательно указывают агрегатное состояние вещества (твердое, жидкое, газообразное).
Алгоритм решения расчетных задач по термохимическим уравнениям приведен в § 23 учебника.
Домашнее задание. § 22 (с. 62-64), § 23, упр. 5-13, задачи 1, 2 (с. 69).
ТЕМА 3
ВОДОРОД (3 ч)
УРОК 24
Водород, его общая характеристика и нахождение в природе. Получение водорода в лаборатории и его физические свойства
Цель урока. Конкретизировать знания о химическом элементе и простом веществе на примере изучения водорода. Сформировать представления о способах получения и собирания водорода в лаборатории.
Основные понятия. Химический элемент, простое вещество, физические свойства, валентность кислотного остатка.
Планируемые результаты обучения. Знать состав молекул водорода и способ его получения реакцией замещения. Уметь характеризовать физические свойства водорода, собирать водород методом вытеснения воздуха, доказывать его наличие, проверять водород на чистоту. Соблюдать меры предосторожности при работе с химическими реактивами.
Демонстрации. Получение водорода в аппарате Киппа. Ознакомление с физическими свойствами водорода. Проверка водорода на чистоту. Наполнение водородом мыльных пузырей.
Лабораторный опыт. Получение и свойства водорода.
Краткое содержание урока. В начале урока учитель продолжает формировать умение решать расчетные задачи с использованием термохимических уравнений. К доске вызываются несколько человек, которые получают индивидуальные задания. Класс в это время обсуждает выполнение домашнего задания.
При изучении нового материала продолжается конкретизация знаний о химическом элементе и простом веществе. Используя план характеристики химического элемента (см. урок 19), учащиеся самостоятельно характеризуют водород как химический элемент.
Далее учитель демонстрирует получение водорода в аппарате Киппа: объясняет устройство аппарата и показывает, как проверить водород на чистоту, разъясняет, почему работать с водородом опасно. Затем учитель демонстрирует способы собирания водорода. Учащиеся, наблюдая за демонстрационным экспериментом, отмечают физические свойства водорода. Обсуждение физических свойств водорода необходимо проводить в сравнении с физическими свойствами кислорода.
Говоря о том, что водород самый легкий из газов, можно продемонстрировать наполнение водородом мыльных пузырей. Готовят из туалетного мыла пену, в которую для прочности мыльных пузырей добавляют несколько капель глицерина.
Затем учитель подробно разбирает запись уравнения реакции получения водорода в лаборатории, отмечает, что эта реакция относится к реакциям замещения. Обращает внимание на формулы сложных веществ - соляной кислоты НСl и серной кислоты Н2SO4. Вводит понятие о валентности кислотного остатка. Затем учащиеся выполняют лабораторный опыт 9 (с. 77 учебника), закрепляя практические умения получать водород, собирать его вытеснением воздуха, проверять на чистоту, доказывать наличие образовавшейся соли.
Материал § 26 (с. 73 учебника) лучше рассмотреть при изучении химических свойств воды.
Домашнее задание. § 25, 26, 27 (физические свойства водорода), упр. 1-7 (с. 76-77).
УРОК 25
Химические свойства водорода. Применение водорода
Цель урока. Изучить химические свойства водорода. Сформировать представления о водороде как о восстановителе и экологически чистом топливе.
Основные понятия. Гремучий газ, восстановитель, восстановление, экологически чистое топливо.
Планируемые результаты обучения. Уметь составлять уравнения реакций водорода с кислородом и с оксидами металлов.
Демонстрация. Взрыв смеси водорода с воздухом.
Лабораторный опыт. Взаимодействие водорода с оксидом меди(II).
Краткое содержание урока. После краткого опроса учащихся по теме «Получение водорода в лаборатории, его физические свойства» учитель обсуждает с ними химические свойства водорода: вначале взаимодействие водорода с простыми веществами, затем со сложными. Подробно разбирается реакция горения водорода. При этом еще раз обращается внимание на то, что все эксперименты с водородом проводятся с большой осторожностью. Перед проведением какой-либо реакции с этим газом обязательно надо проверить его на чистоту. Отмечается, что чистый водород горит спокойно. При смешивании с воздухом или кислородом он горит быстро и со взрывом. Смесь одного объема кислорода с двумя объемами водорода называют гремучим газом. Затем записывается уравнение реакции взаимодействия водорода с кислородом и расставляются коэффициенты. Далее учитель демонстрирует взрыв смеси водорода с воздухом. О взрыве учитель должен предупредить учащихся заранее. Этот демонстрационный опыт описан почти во всей существующей методической литературе по химии. После рассмотрения реакции горения водорода в кислороде и на воздухе учитель рассказывает о реакциях водорода с хлором и серой. Учащиеся отмечают, что эти реакции относятся к реакциям соединения.
Изучение взаимодействия водорода со сложным веществом - оксидом меди(II) осуществляется лабораторно (лабораторный опыт 10, с. 77 учебника). Учитывая, что водород - взрывоопасное вещество, перед лабораторным опытом следует обобщить правила техники безопасности при работе с этим газом. Затем надо подробно обсудить уравнение реакции водорода с оксидом меди(II). На доске записывается левая часть уравнения, определяется, к какому типу реакций это уравнение относится, и учащиеся самостоятельно определяют продукты реакции, т. е. дописывают правую часть уравнения. После обсуждения всех вопросов учащиеся приступают к выполнению лабораторного опыта. Затем учитель вводит понятия «восстановитель», «процесс восстановления» (как противоположный процессу окисления), отмечает окислитель и восстановитель как противоположные по своей роли вещества.
Применение водорода следует рассматривать в зависимости от его свойств. Можно предложить учащимся составить следующую таблицу:
Свойства водорода
Некоторые области применения водорода
Домашнее задание. § 27, упр. 8-11 (с. 77).
УРОК 26
Повторение и обобщение по темам «Кислород» и «Водород»
Цель урока. Обобщить и систематизировать знания и умения учащихся, скорректировать знания по темам «Кислород» и «Водород».
Основные понятия. Химический элемент, простое и сложное вещества, валентность, индекс, коэффициент, физические и химические свойства, катализатор, оксиды, окислитель и восстановитель, реакции соединения, разложения, замещения.
Планируемые результаты обучения. Различать понятия «химический элемент» и «простое вещество», «физические свойства» и «химические свойства» на примере водорода и кислорода. Уметь собирать кислород и водород вытеснением воды и воздуха, рассматривать применение веществ в зависимости от их свойств. Соблюдать меры предосторожности при работе с химическими реактивами.
Демонстрации. Газометр, аппарат Киппа, детали для сборки простейшего прибора для получения газов.
Краткое содержание урока. Обобщение и систематизацию знаний и умений по темам «Кислород» и «Водород» следует провести в форме семинарского занятия. Материал двух тем лучше рассматривать в сравнении. Задания даются всем учащимся индивидуально на карточках. Время выполнения работы и обсуждения ее в парах - 15 мин. У доски обсуждаются следующие вопросы:
1. Характеристика химических элементов кислорода и водорода.
2. Характеристика простых веществ кислорода и водорода (по плану до химических свойств). Устройство газометра.
3. Взаимодействие кислорода и водорода с простыми веществами (записать соответствующие уравнения химических реакций, указать тип реакций).
4. Взаимодействие кислорода и водорода со сложными веществами (записать соответствующие уравнения химических реакций).
5. Получение кислорода и водорода в лаборатории (записать уравнения соответствующих реакций, указать тип реакций).
6. Окислитель, процесс окисления (записать уравнения химических реакций, доказывающих окислительные свойства кислорода).
7. Восстановитель, процесс восстановления (записать уравнения химических реакций, доказывающих восстановительные свойства водорода).
8. Устройство аппарата Киппа.
9. Сборка простейшего прибора для получения газов. Как проверить прибор на герметичность? (Укрепить прибор в штативе и показать способы собирания кислорода и водорода вытеснением воздуха и воды.)
10. С какой целью перед каждым опытом водород проверяется на чистоту? (Получить в простейшем приборе водород и проверить его на чистоту.)
11. На каких свойствах основано применение кислорода?
12. На каких свойствах основано применение водорода?
13. Состав воздуха. Охрана воздуха от загрязнений.
14. Решение задач по термохимическим уравнениям.
Домашнее задание. Повторить темы «Кислород» и «Водород».
ТЕМА 4
РАСТВОРЫ. ВОДА (6 ч)
УРОК 27
Растворы. Вода - растворитель. Растворимость веществ в воде
Цель урока. Сформировать понятия о растворе, растворителе, растворимости, насыщенных и ненасыщенных растворах. Научить объяснять процесс растворения веществ в воде на основе атомно-молекулярного учения. Дать первоначальные представления о гидратах.
Основные понятия. Раствор, растворитель, растворимость, насыщенный и ненасыщенный растворы, гидраты.
Планируемые результаты обучения. Знать определения понятий «раствор», «растворимость», «насыщенный и ненасыщенный растворы».
Демонстрации. Растворение в воде сахара (соли), глины, керосина. Растворение серной кислоты в воде. Приготовление ненасыщенных и насыщенных растворов.
Краткое содержание урока. Данный урок можно рассматривать как вводный урок в тему «Растворы». На этом уроке следует начать формировать представления о классификации растворов. Учитель демонстрирует учащимся различные виды растворов: истинные растворы и взвеси (суспензии и эмульсии). Объясняет, что любой раствор состоит из растворителя и растворенного вещества. В качестве растворителя рассматривается вода. Учащиеся самостоятельно могут объяснить растворение как физический процесс. Однако учитель расширяет их знания, рассказывая, что процесс растворения связан и с химическим превращением, т. е. с образованием гидратов. Например, демонстрируя растворение серной кислоты в воде, обращает внимание на сильное разогревание и образование гидратов серной кислоты (соединений серной кислоты с водой).
Далее рассматривается классификация растворов на основании растворимости веществ в воде. Вводится понятие «растворимость»; учитель демонстрирует, как влияет изменение температуры на растворимость твердых веществ и изменение температуры и давления на растворимость газов.
Вводятся понятия «насыщенный раствор» и «ненасыщенный раствор». Учитель показывает, как из ненасыщенного раствора приготовить насыщенный и наоборот.
Домашнее задание. § 28 (с. 78-79), упр. 1-4, задача 1 (с. 81). Можно предложить учащимся подготовить следующие сообщения:
1. Вода - это жизнь.
2. Природная вода.
3. Три агрегатных состояния воды.
4. Использование воды в промышленности и быту.
5. Круговорот воды в природе.
6. Охрана природных водоемов.
Для подготовки этих сообщений можно использовать фрагменты электронного пособия «Электронная библиотека "Просвещение". Химия. 8 класс», уроки 29-32.
УРОК 28
Массовая доля растворенного вещества
Цель урока. Сформировать умение выражать состав раствора через массовую долю растворенного вещества и определять состав раствора по массовой доле растворенного вещества.
Основные понятия. Концентрированный и разбавленный растворы, массовая доля растворенного вещества.
Планируемые результаты обучения. Знать определение массовой доли растворенного вещества. Уметь вычислять массовую долю и массу вещества в растворе.
Демонстрации. Приготовление раствора с определенной массовой долей растворенного вещества.
Краткое содержание урока. На этом уроке следует начать слушание сообщений учащихся (первый доклад «Вода - это жизнь»). Затем к доске вызываются учащиеся, которым даются задания: 1) из насыщенного раствора нитрата калия получить ненасыщенный раствор; 2) из ненасыщенного раствора нитрата калия получить насыщенный раствор. Учащиеся демонстрируют опыты и комментируют эти задания. Далее учитель переходит к составу раствора, вводит понятия «концентрированный раствор», «разбавленный раствор», «массовая доля растворенного вещества». Обязательно надо провести аналогию с уже известным учащимся понятием массовой доли химического элемента в соединении. Учитель приводит формулу
![]()
и учит учащихся вычислять массовую долю и массу растворенного вещества в растворе.
Затем учитель показывает, как готовить раствор с заданной массовой долей растворенного вещества, т. е. осуществляет подготовку к практической работе.
Домашнее задание. § 28 (с. 80-81), упр. 5-6, задачи 2-4 (с. 81).
УРОК 29
Практическая работа «Приготовление растворов солей с определенной массовой долей растворенного вещества»
Цель урока. Сформировать практическое умение готовить растворы с указанной массовой долей растворенного вещества. Практиковаться в работе с химической посудой, в использовании весов с разновесами, в приготовлении растворов веществ.
Планируемые результаты обучения. Уметь приготавливать раствор с определенной массовой долей растворенного вещества.
Краткое содержание урока. В первой половине урока проводится опрос, учащиеся решают задачи на вычисление массовой доли и массы растворенного вещества, продолжают прослушивать сообщения учащихся («Применение воды в промышленности и быту», «Круговорот воды в природе»). Во второй половине урока учащиеся выполняют практическую работу (с. 88 учебника).
Домашнее задание. Повторить темы «Кислород» и «Водород».
УРОК 30
Вода. Анализ и синтез воды. Вода в природе и способы ее очистки
Цель урока. Сформировать понятия об анализе и синтезе на примере изучения состава воды. Сформировать представления о способах очистки природной воды.
Основные понятия. Анализ и синтез, перегонка (дистилляция), дистиллированная вода.
Планируемые результаты обучения. Знать качественный и количественный состав воды. Уметь объяснять закон постоянства состава на примере воды. Знать способы очистки воды.
Демонстрации. Перегонка воды.
Краткое содержание урока. Данный урок можно провести в форме семинара. Достаточные сведения о воде учащиеся уже получили в рамках предмета «Окружающий мир» в младших классах и на уроках естественно-научных дисциплин в основной школе.
Примерный план проведения семинара
1. Состав воды. Анализ и синтез воды. (Учащиеся должны уметь объяснять закон постоянства состава на примере воды. Анализ и синтез как методы познания состава вещества следует рассматривать во взаимосвязи.)
2. Выслушать и обсудить сообщение учащегося «Природная вода».
3. Очистка природной воды. (Учащиеся рассматривают схему водоочистительной станции (рис. 50 учебника), при этом необходимо вспомнить различные способы разделения смесей. Далее учитель разбирает получение дистиллированной воды и демонстрирует перегонку воды.)
4. Выслушать и обсудить сообщение учащегося «Охрана природных водоемов», используя урок 30 электронного пособия «Электронная библиотека "Просвещение". Химия. 8 класс».
5. В качестве повторения проверить знание химических свойств кислорода и водорода.
Домашнее задание. § 29 (с. 82-84), упр. 1-4 (с. 87), задача (с. 88).
УРОК 31
Физические и химические свойства воды
Цель урока. Изучить химические свойства воды. Начать формировать представления о важнейших классах неорганических соединений: кислотах и основаниях. Научить записывать уравнения реакций воды с активными металлами, оксидами металлов и неметаллов.
Основные понятия. Гидроксиды металлов, основания, гидроксильная группа, кислоты, кислотный остаток.
Планируемые результаты обучения. Уметь составлять уравнения реакций воды с некоторыми металлами и оксидами металлов и неметаллов.
Демонстрации. Взаимодействие воды с натрием, магнием, оксидом кальция, оксидом фосфора(V).
Краткое содержание урока. При изучении нового материала следует уделить особое внимание химическим свойствам воды. С физическими свойствами воды учащиеся уже знакомы. Можно выслушать сообщение «Три агрегатных состояния воды».
Изучение химических свойств воды следует проводить экспериментально. Учитель демонстрирует опыты:
1) Взаимодействие воды с активными металлами (натрием). Учитель определяет продукты реакции, показывает, как записывать уравнения этой реакции (рекомендуем формулу воды записывать как Н-ОН, выделяя гидроксильную группу), вводит понятия «гидроксид металла», «основание».
2) Взаимодействие воды с менее активными металлами (магнием).
3) Взаимодействие воды с оксидами активных металлов (оксидом кальция).
4) Взаимодействие воды с оксидами неметаллов (оксидом фосфора(V)). В этом случае учитель вводит понятия «кислота», «кислотный остаток».
Записывая уравнения химических реакций, учащиеся определяют типы реакций. Можно предложить учащимся оформить запись химических свойств воды в виде обобщающей таблицы.
Химические свойства воды
Уравнение химической реакции
Тип реакции
1. Взаимодействие воды с ...
Последним свойством можно записать уже известное уравнение реакции разложения воды электрическим током.
Для закрепления знаний химических свойств воды в конце урока следует предложить учащимся следующие задания:
Вариант I
1. Напишите три уравнения химических реакций, в которых вода была бы исходным веществом.
2. В эвдиометре взорвали смесь, состоящую из 6 мл водорода и 2 мл кислорода. Составьте уравнение проведенной реакции. Останется ли какой-либо газ в избытке и как это проверить?
Вариант II
1. Напишите три уравнения химических реакций, в которых вода была бы продуктом реакции.
2. В эвдиометре взорвали смесь, состоящую из 2 мл водорода и 6 мл кислорода. Составьте уравнение этой химической реакции. Какой газ и в каком объеме останется в избытке? Как это проверить практически?
Домашнее задание. § 29 (с. 84-87), упр. 5-7 (с. 87-88).
УРОК 32
Контрольная работа по темам «Кислород», «Водород», «Растворы. Вода»
Цель урока. Контроль знаний и умений по темам «Кислород», «Водород», «Растворы. Вода».
Методические рекомендации. См. урок 18.
Вариант I
1. Нарисуйте схему прибора, с помощью которого можно получить и собрать кислород в лаборатории методом вытеснения воды.
2. Перечислите области применения водорода. На каких физических или химических свойствах основано это применение?
3. Допишите уравнения химических реакций, укажите, какими из них можно воспользоваться для получения водорода. Назовите тип каждой реакции.
а) СuО + Н2 ![]() Cu + ...
Cu + ...
б) Al + НСl ![]() АlСl3 + ...
АlСl3 + ...
в) Zn + ... ![]() ZnSO4 + ...
ZnSO4 + ...
4. Допишите уравнения реакций, характеризующих химические свойства водорода:

Укажите, окисляется или восстанавливается водород в этих реакциях.
5. Для засолки огурцов приготовили 5 кг 6%-ного раствора поваренной соли. Вычислите, какие массы соли и воды потребовались для приготовления этого раствора.
Вариант II
1. Нарисуйте схему прибора, с помощью которого можно получить и собрать водород в лаборатории методом вытеснения воздуха.
2. В одном столбце приведенной ниже таблицы перечислены (под номерами 1-5) важнейшие области применения кислорода. Во втором столбце таблицы буквами А-Е обозначены свойства кислорода, лежащие в основе его применения. Приведите в соответствие записи таблицы.
Применение кислорода
Свойства кислорода
1. В технике для резки и сварки металлов.
2. В медицине для облегчения дыхания больных.
3. В металлургии (кислородное дутье).
4. В химической промышленности для получения новых веществ.
5. В химических лабораториях для проведения реакций
А. Поддерживает дыхание.
Б. Реагирует со многими простыми и сложными веществами, образуя оксиды.
В. В реакциях с кислородом создаются высокие температуры. Реакции экзотермичны.
Г. Ускоряет процесс горения и окисления веществ.
Д. Бесцветный газ, тяжелее воздуха.
Е. Газ, плохо растворимый в воде, сжижается под давлением
3. Допишите уравнения химических реакций:
а) ... + O2 ![]() CuO
CuO
б) Fе + O2 ![]() ...
...
в) S + ... ![]() SO2
SO2
г) CuS + ... ![]() SO2 + ...
SO2 + ...
Назовите полученные вещества.
4. Допишите уравнения химических реакций, характеризующих химические свойства водорода:
![]()
Укажите, окисляется или восстанавливается водород в этих реакциях.
5. 200 г 15%-ного раствора сахара упарили наполовину. Какой стала после этого массовая доля сахара в растворе?
ТЕМА 5
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ (9 ч)
УРОК 33
Оксиды: классификация, номенклатура, свойства, получение, применение
Цель урока. Систематизировать сведения об оксидах, углубить знания учащихся о составе, классификации и химических свойствах оксидов. Научить доказывать основный и кислотный характер оксидов.
Основные понятия. Оксиды, оснóвные оксиды, кислотные оксиды, амфотерные оксиды.
Планируемые результаты обучения. Знать определения оснóвных и кислотных оксидов. Уметь по составу и свойствам классифицировать оксиды, сравнивать основные и кислотные оксиды. Уметь доказывать основный и кислотный характер оксидов.
Демонстрации. Образцы оксидов. Взаимодействие кислотных и основных оксидов с водой; взаимодействие основных оксидов с кислотами; взаимодействие кислотных оксидов с основаниями (щелочами).
Краткое содержание урока. Учащимся уже знакомы определение оксидов и некоторые способы их получения. Поэтому урок следует начать с определения оксидов, подчеркнув, что в состав этих веществ входят два химических элемента, один из которых кислород. Необходимо обратить внимание на то, что кислород в этих соединениях всегда двухвалентен.
Переходя к получению оксидов, учитель предлагает учащимся записать по два уравнения реакции окисления кислородом простых и сложных веществ. Затем переходят к рассмотрению схемы 12 (с. 91 учебника). Реакции разложения сложных веществ (кислот, оснований, солей) будут рассматриваться постепенно по мере изучения основных классов неорганических соединений.
Далее учитель переходит к классификации оксидов (схема 11 на с. 89 учебника). Следует обсудить основные и кислотные оксиды; амфотерные оксиды будут изучаться позже. Рассматривая состав основных и кислотных оксидов, следует обратить внимание учащихся на то, что металлы в зависимости от валентности могут образовывать и основные, и кислотные оксиды.
Далее изучаются свойства оксидов. Учитель демонстрирует химические свойства основных и кислотных оксидов, подчеркивает их сходство и различие. Показывает, как доказывать основный и кислотный характер оксидов. Учащиеся упражняются в составлении уравнений химических реакций, характерных для оксидов. В конце урока целесообразно выслушать сообщение о применении оксидов.
Этот урок можно провести, используя электронное пособие «Электронная библиотека "Просвещение". Химия. 8 класс», урок 38.
Домашнее задание. § 30, упр. 1-7 (с. 92-93), задачи 1, 2 (с. 93).
УРОК 34
Основания: классификация, номенклатура, получение
Цель урока. Обобщить и систематизировать знания об основаниях, их составе и способах получения. Начать формировать представления о реакции обмена.
Основные понятия. Основания, гидроксиды металлов, гидроксильная группа, щелочи, индикаторы, реакция обмена.
Планируемые результаты обучения. Знать состав оснований, их классификацию. Уметь составлять формулы оснований, распознавать раствор щелочи с помощью индикатора. Уметь определять реакции обмена. Знать правила техники безопасности при работе со щелочами.
Демонстрации. Получение нерастворимых оснований.
Лабораторный опыт. Свойства растворимых и нерастворимых оснований.
Краткое содержание урока. При проверке домашнего задания можно использовать следующие задания:
1. Выберите правильный ответ.
а) Формулы только оксидов приведены в ряду
1) H2SO4, СаО, CuCl2
2) Na2CO3, Na2O, N2O5
3) Р2О5, BaO, SO3
4) NaOH, Na2O, Cu(OH)2
б) Формулы только основных оксидов приведены в ряду
1) СО2, СаО, СuО
2) СО2, Na2O, N2O5
3) Р2О5, BaO, SO3
4) СаО, Na2O, CuO
в) Формулы только кислотных оксидов приведены в ряду
1) СО2, SO2, SO3
2) СО2, Na2O, N2O5
3) Р2О5, BaO, SO3
4) CaO, Na2O, CuO
2. Из приведенных формул веществ выпишите только те, которыми обозначены оксиды.
NaCl, Na2O, НСl, Сl2О7, Са3(РО4)2, CaO, Р2О5, Н2О, Н3РО4
3. Установите соответствие между формулой оксида и формулой соответствующего ему гидроксида.
1) Na2O
2) Fe2O3
3) ВаО
4) СО2
A. Fe(OH)3
Б. Н2СО3
В. NaOH
Г. Ва(ОН)2
Д. H2SO4
1
2
3
4
4. Установите соответствие между названием оксида и его формулой.
1) оксид натрия
2) оксид серы(IV)
3) оксид железа(Ш)
4) оксид фосфора(V)
A. SO2
Б. SO3
B. Na2O
Г. Р2О5
Д. Fe2O3
1
2
3
4
5. Вставьте в схемы химических реакций недостающие формулы веществ.
1) ... + Н2О ![]() Са(ОН)2
Са(ОН)2
2) SO3 + ... ![]() H2SO4
H2SO4
3) MgO + ... ![]() Mg(NO3)2 + ...
Mg(NO3)2 + ...
4) СО2 + ... ![]() Na2CO3 + ...
Na2CO3 + ...
6. Вставьте в схемы химических реакций недостающие формулы веществ.
1) ... + ... ![]() MgO
MgO
2) ... + ... ![]() ZnO
ZnO
3) ... + ... ![]() NO
NO
4) ... + ... ![]() P2O5
P2O5
7. Оксид натрия не взаимодействует
1) с водой
2) с кислотами
3) с основаниями
4) с кислотными оксидами
8. Оксид серы(IV) не взаимодействует
1) с водой
2) со щелочами
3) с кислотами
4) с основными оксидами
9. Установите соответствие между исходными веществами и продуктами (продуктом) химических реакций.
1) K2O + H2SO4
2) N2O5 + H2O
3) Li2O + H2O
4) SO3 + NaOH
A. LiOH
Б. Na2SO4 + H2O
B. K2SO4 + H2O
Г. HNO3
1
2
3
4
10. Как различить по внешнему виду оксид меди(II) и оксид кальция, если они находятся в склянках без этикеток? Как доказать это химическими опытами?
11. В склянках без этикеток находятся два белых порошка: оксид кальция и оксид фосфора(V). Как доказать, что в одной из склянок оксид фосфора(V)?
При изучении химических свойств воды учащиеся уже познакомились с составом оснований. К доске можно вызвать учащихся, которым дается задание записать уравнения реакций воды с активными металлами и их оксидами, т. е. рассмотреть способы получения оснований. В записанных уравнениях необходимо выделить формулы оснований и на этих примерах разобрать состав оснований и номенклатуру.
Затем учащиеся получают задание составить формулы оснований, которым соответствуют следующие оксиды:
Li2O, K2O, CaO, BaO, CuO, Fe2O3.
На этом примере рассматривается классификация оснований (щелочи и нерастворимые основания). Затем выполняется лабораторный опыт 14 (с. 113 учебника). Учащиеся должны сделать вывод, как отличить растворы щелочей от растворов других веществ.
Далее можно рассмотреть получение нерастворимых оснований. Учитель демонстрирует реакцию хлорида меди(II) с гидроксидом натрия. Учащиеся отмечают признаки реакции. Учитель вводит понятие «реакция обмена».
На этом уроке можно использовать электронное пособие «Электронная библиотека "Просвещение". Химия. 8 класс», урок 43.
Домашнее задание. § 31 (с. 93-95), упр. 2, 3 (с. 99), задачи 3, 4 (с. 99).
УРОК 35
Физические и химические свойства оснований. Реакция нейтрализации
Цель урока. Обобщить и развить знания учащихся об основаниях, их химических свойствах. Сформировать понятия о реакции нейтрализации как частном случае реакции обмена.
Основные понятия. Реакция нейтрализации, индикаторы.
Планируемые результаты обучения. Знать химические свойства оснований. Уметь составлять уравнения реакции нейтрализации.
Демонстрация. Реакция нейтрализации.
Лабораторные опыты. Взаимодействие щелочей с кислотами, нерастворимых оснований с кислотами. Разложение гидроксида меди(II) при нагревании.
Краткое содержание урока. Урок начинается с фронтального опроса. Задания, по которым проводится опрос, могут быть следующими.
1. Из приведенных формул веществ выпишите только те, которыми обозначены основания.
H2SO4, Ca(OH)2, CaO, NaOH, Na3PO4, P2O5, Fe(OH)3, Fe2O3, Cu(OH)2, LiOH
2. Напишите формулу каждого из перечисленных оснований:
1) гидроксид железа(II)
2) гидроксид бария
3) гидроксид меди(II)
4) гидроксид меди(I)
3. Формулы только оснований приведены в ряду
1) Na2CO3, NaOH, NaCl
2) KNO3, HNO3, KОН
3) KОН, Mg(OH)2, Cu(OH)2
4) HCl, BaCl2, Ba(OH)2
4. Формулы только щелочей приведены в ряду
1) Fe(OH)3, NaOH, Ca(OH)2
2) KOH, LiOH, NaOH
3) KOH, Mg(OH)2, Cu(OH)2
4) Al(OH)3, Fe(OH)2, Ba(OH)2
5. Из указанных соединений нерастворимым в воде основанием является
1) NaOH
2) Ва(ОН)2
3) Fe(OH)2
4) KOH
6. Из указанных соединений щелочью является
1) Fe(OH)2
2) LiOH
3) Mg(OH)2
4) Cu(OH)2
7. Металл, который, реагируя с водой, образует щелочь, - это
1) железо
2) медь
3) калий
4) алюминий
8. Оксид, который при взаимодействии с водой образует щелочь, - это
1) оксид алюминия
2) оксид лития
3) оксид свинца(II)
4) оксид марганца(II)
9. При взаимодействии основного оксида с водой образуется основание
1) Аl(ОН)3
2) Ва(ОН)2
3) Cu(ОН)2
4) Fe(OH)3
10. Из перечисленных уравнений химических реакций выберите уравнение реакции обмена.
1) 2H2O = 2H2 + O2
2) HgCl2 + Fe = FeCl2 + Hg
3) ZnCl2 + 2KOH = Zn(OH)2![]() + 2KCl
+ 2KCl
4) CaO + CO2 = CaCO3
Изучение химических свойств оснований следует проводить экспериментально. Учащиеся под руководством учителя выполняют лабораторные опыты 15, 16, 17 (с. 113-114 учебника), подробно разбирают реакцию нейтрализации, делают вывод, что реакция нейтрализации - это частный случай реакции обмена. На основании выполненного эксперимента учащиеся заполняют таблицу «Сравнение химических свойств щелочей и нерастворимых оснований».
В конце урока целесообразно рассмотреть генетический ряд металла: металл ![]() оксид металла
оксид металла ![]() основание.
основание.
Возможно использование содержания урока 44 электронного пособия «Электронная библиотека "Просвещение". Химия. 8 класс».
Домашнее задание. § 31 (с. 95-99), упр. 1, 5-9, задачи 1, 2 (с. 99).
УРОК 36
Кислоты: классификация, номенклатура, физические и химические свойства
Цель урока. Обобщить и систематизировать знания о кислотах, их составе, классификации и химических свойствах. Сформировать понятие о вытеснительном ряде металлов (ряде стандартных электродных потенциалов металлов).
Основные понятия. Кислоты, вытеснительный ряд металлов Н. Н. Бекетова, индикаторы.
Планируемые результаты обучения. Знать состав кислот и их классификацию. Уметь определять валентность кислотного остатка и составлять формулы кислот. Знать химические свойства кислот, уметь составлять уравнения химических реакций, уметь пользоваться рядом активности металлов, распознавать кислоты с помощью индикаторов. Знать правила техники безопасности при работе с кислотами.
Демонстрации. Действие растворов кислот на индикаторы (фенолфталеин, лакмус, метиловый оранжевый), взаимодействие кислот с металлами.
Краткое содержание урока. После контроля знаний по теме «Основания» можно провести самостоятельную работу с книгой. Учащиеся уже знакомы с кислотами, с их составом и некоторыми свойствами. Поэтому вопросы, касающиеся изучения состава кислот, структурных формул, классификации, получения кислот, можно дать учащимся для самостоятельной проработки. Параллельно они выполняют упражнения 1-4 (с. 104 учебника).
Изучение химических свойств кислот осуществляется экспериментально (проводится либо демонстрационный эксперимент, либо лабораторный). Особое внимание учащихся следует обратить на правила техники безопасности при работе с кислотами. Подробно рассматривается взаимодействие кислот с металлами. Учитель рассказывает о вытеснительном ряде металлов, предложенном Н. Н. Бекетовым, и объясняет, как пользоваться этим рядом при составлении уравнений химических реакций.
В заключение целесообразно рассмотреть генетический ряд неметалла: неметалл ![]() оксид неметалла
оксид неметалла ![]() кислота
кислота ![]() соль.
соль.
Домашнее задание. § 32, упр. 5-9 (с. 104-105), задачи 1-4 (с. 105).
УРОК 37
Соли: классификация, номенклатура, способы получения
Цель урока. Обобщить и систематизировать знания о солях, их составе, классификации и способах получения.
Основные понятия. Соли, номенклатура солей, классификация солей.
Планируемые результаты обучения. Знать состав солей и их классификацию. Уметь составлять формулы солей по валентностям металла и кислотного остатка. Знать номенклатуру солей. Знать способы получения солей и записывать уравнения соответствующих реакций.
Краткое содержание урока. Данный урок, как и предыдущий, можно провести в форме самостоятельной работы с учебником, так как на протяжении нескольких уроков учащиеся, знакомясь с химическими свойствами оксидов, кислот и оснований, постоянно встречались с солями. Учащиеся, читая § 33 (с. 105-107 учебника), выполняют упражнения 1-4 (с. 112 учебника) и самостоятельно дают определение солей. После работы с книгой учитель может дать проверочную работу.
Вариант I
1. Состав нитратов лития, бария и железа отражают формулы LiNO3, Ba(NO3)2, Fe(NO3)3. Используя эти формулы, определите значение валентностей атомов металлов. Составьте формулы солей, образованных этими металлами и кислотными остатками: а) соляной кислоты; б) сероводородной кислоты; в) фосфорной кислоты.
2. Назовите соли: CuS, CaSO4, Cu2S, K3PO4, BaCO3.
3. Установите соответствие между химической формулой соли и классом, к которому она относится.
1) NaHCO3
2) Сu(ОН)Сl
3) Na2CO3
4) Na2KPO4
А. средние соли
Б. кислые соли
В. основные соли
Г. двойные соли
1
2
3
4
Вариант II
1. Укажите значения валентностей металла и кислотного остатка в формуле каждой соли.
Валентность металла
1) K2SO4 _________________
2) FeS ___________________
3) Са3(РО4)2 ______________
4) Na2CO3 ________________
Валентность кислотного остатка
______________________________
______________________________
______________________________
______________________________
2. Установите соответствие между химической формулой вещества и его названием.
1) FeCl3
2) Cu(NO3)2
3) Al2(SO4)3
4) К2СО3
A. нитрат меди(II)
Б. карбонат калия
B. хлорид железа(III)
Г. нитрит меди(П)
Д. сульфат алюминия
1
2
3
4
3. Установите соответствие между химической формулой соли и классом, к которому она относится.
1) Na3PO4
2) Na2HPO4
3) K2NaPO4
4) Аl(ОН)2Сl
A. кислые соли
Б. двойные соли
B. средние соли
Г. основные соли
1
2
3
4
Вместо проверочной работы учитель может провести фронтальную беседу, обобщающую и систематизирующую знания о составе, номенклатуре и классификации солей.
Далее рассматриваются способы получения солей. Можно осуществить это двумя путями: либо как самостоятельную работу с учебником (с. 107-108 учебника), либо как аукцион: кто больше назовет способов получения солей. При подведении итогов по этому вопросу следует проанализировать таблицу 15 (с. 110-111 учебника).
Домашнее задание. § 33 (с. 105-108), упр. 1-6, 8 (с. 112).
УРОК 38
Физические и химические свойства солей
Цель урока. Обобщить и систематизировать знания о химических свойствах солей.
Основные понятия. Оксиды, кислоты, основания, соли.
Планируемые результаты обучения. Знать химические свойства солей. Уметь записывать соответствующие уравнения реакций.
Краткое содержание урока. Данный урок следует построить таким образом, чтобы учащиеся поняли, что соли - это класс веществ, который связывает другие классы неорганических соединений. Это создает условия для осознанного восприятия материала о генетической связи оксидов, оснований, кислот и солей. Урок можно провести в форме фронтальной беседы, работы в группах, самостоятельной работы с учебником. Задания следует подбирать не только теоретического, но и экспериментального характера.
Домашнее задание. § 33 (с. 108-110), упр. 7, 9, 10 (а, б, в), задачи 1, 2 (с. 112).
УРОК 39
Генетическая связь между основными классами неорганических соединений
Цель урока. Обобщить, систематизировать и скорректировать знания учащихся о классификации и химических свойствах веществ важнейших классов неорганических соединений. Сформировать представления о генетической связи этих классов.
Основные понятия. Генетический ряд, генетическая связь, оксиды, основания, кислоты, соли.
Планируемые результаты обучения. Знать определения и классификацию неорганических веществ. Уметь по составу и свойствам классифицировать неорганические вещества; составлять генетические ряды металла и неметалла; иллюстрировать уравнениями химических реакций генетическую связь между основными классами неорганических соединений.
Краткое содержание урока. На данном уроке следует показать учащимся, что знание взаимосвязи веществ необходимо человеку для управления их превращениями и получения новых соединений. Однако выявление генетических связей (от греч. «генезис» - происхождение) невозможно без предварительной классификации веществ. Поэтому первое задание, которое дается учащимся, касается классификации неорганических соединений. Например:
Вариант I
Заполните таблицу. Приведите примеры неорганических соединений.

Вариант II
Зная классификацию неорганических соединений, распределите вещества по основным классам.
NaCl, NaOH, CO2, Ba(OH)2, H2SO4, Cu(OH)2, HF, SO3, MgO, Li2O, Mg(OH)Cl, Mg(OH)2, HNO3, Na2CO3, K2HPO4, H2S.
Затем учитель переходит к генетическим рядам металла и неметалла, т. е. учащиеся на конкретных примерах обсуждают возможность взаимного превращения веществ. Задание дается в двух вариантах:
Вариант I
Металл ![]() Основный оксид
Основный оксид ![]() Основание
Основание ![]() Соль
Соль
Вариант II
Неметалл ![]() Кислотный оксид
Кислотный оксид ![]() Кислота
Кислота ![]() Соль
Соль
Во время выполнения этих заданий учащиеся могут пользоваться учебником. Химия - наука экспериментальная, поэтому желательно, чтобы эти превращения веществ выполнялись и практически.
Для закрепления изученного материала можно дать учащимся небольшую самостоятельную работу.
Задание. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения.

Домашнее задание. § 33 (с. 110-111), упр. 10 (г-к).
УРОК 40
Практическая работа «Решение экспериментальных задач по теме «Важнейшие классы неорганических соединений»
Цель урока. Применить знания о свойствах основных классов неорганических соединений при экспериментальном решении задач. Сформировать практические умения по превращению веществ разных классов друг в друга.
Планируемые результаты обучения. Уметь подбирать вещества и проводить химические реакции, необходимые для решения определенной задачи, соблюдая правила работы в кабинете химии.
Краткое содержание урока. Учащимся впервые предоставляется возможность решать химические задачи экспериментально. На этом уроке они должны проявить свою самостоятельность: составить план решения задачи, определить перечень необходимых для этого реактивов и оборудования, реализовать свой план и составить отчет о проделанной работе.
При решении экспериментальных задач необходимо использовать тот же порядок действий, что и при выполнении предыдущих практических работ, и при оформлении отчетов к ним.
Особенностью экспериментального решения задач является то, что для опыта берут не все вещество, а часть, т. е. отливают или отсыпают порцию - пробу - примерно 1 см3.
При распознавании веществ, при проведении нескольких разных опытов с одним веществом или при решении задачи разными способами берут несколько проб. Чтобы их не перепутать, необходимо ставить пробирки с растворами одну за другой в штатив для пробирок.
Задачи для экспериментального решения следует давать учащимся в двух вариантах. Каждый ученик должен выполнить не менее пяти задач. Можно использовать задания практической работы (с. 114 учебника).
Задача 1
Вариант I. В двух склянках без этикеток находятся порошки: в одной - оксид кальция, в другой - оксид меди(II).
Как различить эти вещества, не проводя химических опытов?
Как химическими опытами подтвердить наличие в склянках именно этих веществ?
Вариант II. В двух склянках без этикеток находятся растворы: в одной - соляной кислоты, в другой - гидроксида калия.
Как опытным путем определить, в какой склянке находится каждое из веществ?
Задача 2
Вариант I. Очистите химическим способом железный гвоздь от ржавчины, считая, что в состав ржавчины входят оксид железа(III) и гидроксид железа(III).
Вариант II. Химическим способом отмойте пробирку, загрязненную на практическом занятии гидроксидом меди(II).
Задача 3
Вариант I. Разделите любым способом выданную вам смесь медных и железных опилок. В качестве ответа представьте рисунок с обозначениями.
Вариант II. Разделите выданную вам смесь железных и древесных опилок, на основе их физических свойств. В качестве ответа представьте рисунок с обозначениями.
Задача 4
Вариант I. После практической работы остался розовый раствор. Лаборант предполагает, что это раствор лакмуса в кислой среде. Проведите несколько опытов для проверки этого предположения.
Вариант II. В склянке без этикетки находится бесцветный раствор. Предполагают, что это раствор фенолфталеина. Проведите опыт, подтверждающий или опровергающий это предположение.
Мотивированный ответ и результаты опытов запишите в произвольной форме.
Задача 5
Вариант I. Из имеющихся на столе реактивов получите несколькими способами сульфат меди(II).
Вариант II. В вашем распоряжении есть магний, оксид магния, гидроксид магния, соляная кислота. Сколькими способами вы сможете получить хлорид магния, используя эти реактивы? Подберите необходимое для эксперимента оборудование и получите хлорид магния.
Задача 6
Вариант I. Получите опытным путем из хлорида железа(III) оксид железа(III).
Вариант II. Проведя два опыта, получите из хлорида меди(II) оксид меди(II).
Домашнее задание. Подготовиться к контрольной работе.
УРОК 41
Контрольная работа по теме «Важнейшие классы неорганических соединений»
Цель урока. Контроль знаний по теме.
Методические рекомендации. См. урок 18. Контрольная работа предлагается в виде тестовых заданий: семь заданий уровня А; пять заданий уровня В; три задания уровня С (повышенный уровень).
Вариант I
А-1. Формулы только кислот приведены в ряду
1) НСl, NaCl, HNO3
2) H2SO3, H2SO4, H2S
3) Ca(OH)2, H3PO4, Ca3(PO4)2
4) Na2O, NaNO3, HNO3
А-2. Формулы только щелочей приведены в ряду
1) Fe(OH)2, KOH, Ва(ОН)2
2) NaOH, Ca(OH)2, Cu(OH)2
3) KOH, NaOH, LiOH
4) Fe(OH)3, Cu(OH)2, NaOH
A-3. Оксид, который реагирует с гидроксидом натрия, образуя соль,- это
1) Fe2O3
2) К2О
3) SO3
4) BaO
A-4. Взаимодействие оксида с водой относится к реакциям
1) соединения
2) обмена
3) разложения
4) замещения
А-5. Взаимодействие гидроксида меди(II) с азотной кислотой относится к реакциям
1) соединения
2) разложения
3) замещения
4) обмена
А-6. Индикатор фенолфталеин в щелочной среде становится
1) бесцветным
2) малиновым
3) красным
4) желтым
А-7. Свойство, которое является общим для нерастворимых оснований и щелочей,- это
1) взаимодействие с кислотными оксидами
2) взаимодействие с кислотами
3) взаимодействие с солями
4) разложение
В-8. Даны формулы веществ:
FeO, K2O, CO2, MgO, CrO, CrO3, SO2, Р2О5
Выпишите формулы только основных оксидов.
Ответ:_______________________________
В-9. Установите соответствие между химической формулой вещества и классом неорганических соединений, к которому оно принадлежит.
1) MgO
2) Н3РО4
3) Аl(ОН)3
4) NaOH
А. кислоты
Б. щелочи
В. оксиды
Г. нерастворимые основания
1
2
3
4
В-10. Установите соответствие между исходными веществами и продуктами химических реакций.
1) HgO + HNO3
2) Al + H2SO4
3) Na2O + CO2 + H2O
4) K2O + H3PO4
A. Al2(SO4)3 + Н2
Б. K3РО4 + Н2О
B. Hg(NO3)2+ Н2О
Г. Na2CO3 + Н2О
1
2
3
4
В-11. Вставьте в схемы химических реакций недостающие формулы веществ.
1) ... + ... ![]() Mg(NO3)2 + Н2О
Mg(NO3)2 + Н2О
2) ... + ... ![]() MgCl2 + Н2
MgCl2 + Н2
3) ... + ... ![]() K3РО4 + Н2О
K3РО4 + Н2О
4) ... + ... ![]() Na2S + Н2О
Na2S + Н2О
В-12. Допишите уравнения химических реакций.
1) LiОН + SO3 ![]()
2) NaOH + Р2О5 ![]()
3) Са(ОН)2 + СО2 ![]()
4) Ва(ОН)2 + SO2 ![]()
С-13. Даны вещества: соляная кислота, гидроксид кальция, вода, оксид фосфора(V), оксид магния. С какими из перечисленных веществ может взаимодействовать: а) гидроксид натрия; б) гидроксид железа(III)? Напишите уравнения соответствующих реакций. Укажите тип каждой реакции.
С-14. Как отмыть пробирку от остатков нерастворимого в воде основания?
С-15. Составьте уравнения химических реакций, соответствующих схеме

Вариант II
А-1. Формулы только солей приведены в ряду
1) K2СО3, Н2СО3, KOH
2) АlСl3, Al(NO3)3, Al2S3
3) H2S, Ba(NO3)2, BaCl2
4) Cu(OH)2, CuSO4, CuS
A-2. Формулы только бескислородных кислот приведены в ряду
1) НСl, HNO3, H2S
2) H2SO3, H2S, HNO2
3) Н3РО4, Н2СО3, H2S
4) H2S, HF, HCl
A-3. Оксид, который реагирует с кислотой, образуя соль, - это
1) Р2О5
2) СuО
3) SO2
4) СО2
А-4. Получение оксида металла при нагревании гидроксида металла относится к реакциям
1) соединения
2) обмена
3) разложения
4) замещения
А-5. Химическая реакция, уравнение которой
K2О + 2HNO3 = 2KNO3 + Н2О,
относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
А-6. Индикатор лакмус в щелочной среде становится
1) фиолетовым
2) красным
3) синим
4) бесцветным
А-7. В каком ряду все основания, формулы которых приведены, разлагаются при нагревании?
1) NaOH, Сr(ОН)2, Са(ОН)2
2) Fe(OH)3, Cu(OH)2, Fe(OH)2
3) Ва(ОН)2, Mg(OH)2, KOH
4) KOH, LiOH, Al(OH)3
В-8. Даны формулы веществ:
СО2, Na2O, СаО, МnО, Мn2О7, Сl2О7, Li2O, P2O5
Выпишите формулы только кислотных оксидов.
Ответ: _____________________________________
В-9. Установите соответствие между химической формулой вещества и его названием.
1) FeCl3
2) Cu(NO3)2
3) Al2(SO4)3
4) K2СО3
А. нитрат меди(П)
Б. карбонат калия
В. хлорид железа(III)
Г. нитрит меди(II)
Д. сульфат алюминия
1
2
3
4
В-10. Установите соответствие между исходными веществами (веществом) и продуктами химических реакций.
1) NaOH + СО2
2) NaOH + H2SO4
3) Fe(OH)2 + НСl
4) Fe(OH)2
A. FeO + Н2О
Б. Na2CO3 + Н2О
В. Na2SO4 + Н2О
Г. FeCl2 + Н2О
1
2
3
4
В-11. Вставьте в схемы уравнений химических реакций недостающие формулы веществ.
1) ... + KOH ![]() Fe(OH)3 + ...
Fe(OH)3 + ...
2) ... + НСl ![]() MgCl2 + ... + …
MgCl2 + ... + …
3) HNO3 + KOH ![]() ... + Н2О
... + Н2О
4) ... + ... ![]() BaSO4 + NaCl
BaSO4 + NaCl
В-12. Допишите уравнения химических реакций, протекающих при нагревании.
1) Mg(OH)2 ![]()
2) Аl(ОН)3 ![]()
3) Fe(OH)3 ![]()
4) Cu(OH)2 ![]()
С-13. С какими из перечисленных веществ: вода, оксид углерода(IV), азотная кислота, гидроксид кальция, поваренная соль - может вступать в реакцию: а) оксид кальция: б) оксид фосфора(V); в) оксид кремния(IV)? Запишите уравнения возможных химических реакций.
С-14. В трех склянках без этикеток находятся оксиды: в одной - оксид кальция, в другой - оксид меди(II), в третьей - оксид фосфора(V). Как их можно распознать?
С-15. Составьте уравнения химических реакций, соответствующих схеме
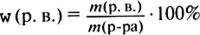
ТЕМА 6
ПЕРИОДИЧЕСКИЙ ЗАKOH И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА. СТРОЕНИЕ АТОМА (8 ч)
УРОК 42
Классификация химических элементов. Амфотерные соединения
Цель урока. Сформировать понятие о классификации химических элементов на примерах естественных семейств щелочных металлов, галогенов, благородных газов. Научить доказывать амфотерный характер оксидов и гидроксидов.
Основные понятия. Классификация, группы сходных элементов, амфотерность.
Планируемые результаты обучения. Знать общие признаки классификации химических элементов на примере групп сходных элементов. Уметь характеризовать зависимость свойств щелочных металлов, галогенов и их соединений от относительной атомной массы. Знать определение амфотерности, уметь экспериментально доказывать амфотерность предложенного оксида и гидроксида.
Демонстрации. Образцы щелочных металлов и галогенов.
Лабораторный опыт. Взаимодействие гидроксида цинка с растворами кислот и щелочей.
Краткое содержание урока. Рассматривая классификацию химических элементов, необходимо пояснить учащимся, что развитие любой науки проходит ряд этапов: изучение и накопление фактов, их классификацию, выявление связи между установленными фактами и на основании этого более полное их познание. В химии накопление знаний об элементах и их соединениях привело к необходимости их группировки по сходным признакам. В доступной для учащихся форме можно рассказать о классификациях химических элементов, предложенных разными учеными (И. Деберейнер, Дж. Ньюлендс, Л. Майер). Необходимо подробно остановиться на разделении всех элементов на металлы и неметаллы, ввести понятие амфотерности. Учащиеся должны выполнить лабораторный опыт 18 (с. 138 учебника), сделать вывод, что гидроксид цинка имеет двойственный характер, сформулировать определения амфотерных оксидов и гидроксидов.
Можно продемонстрировать учащимся условную запись:
Zn(OH)2 = H2ZnO2
Далее учителю необходимо сформировать понятие о группах сходных элементов (щелочные металлы, галогены, благородные металлы), рассмотреть их общие свойства по таблице 16 (с. 118 учебника). Учащиеся должны уметь описывать свойства трех семейств элементов. Уже на этом этапе можно начать формировать умение характеризовать зависимость свойств щелочных металлов, галогенов и их соединений от относительной атомной массы. Это очень важно для понимания периодического закона Д. И. Менделеева.
Домашнее задание. § 34, упр. 1-3 (с. 122), подготовить 20 карточек к уроку 43.
УРОК 43
Периодический закон Д. И. Менделеева
Цель урока. Сформировать понятие о периодичности в изменении свойств химических элементов. Показать, что открытый Д. И. Менделеевым периодический закон является фундаментальным законом природы.
Основные понятия. Порядковый номер элемента, периодичность.
Планируемые результаты обучения. Знать формулировку периодического закона. Уметь приводить примеры периодического изменения свойств химических элементов и их соединений.
Демонстрации. Взаимодействие оксидов Na, Mg, P, S с водой, исследования свойств полученных продуктов.
Краткое содержание урока. Во время фронтальной беседы необходимо сконцентрировать внимание примерно на таких вопросах и заданиях:
1. Охарактеризуйте физические свойства натрия. К какому классу простых веществ его можно отнести?
2. Составьте формулы важнейших соединений натрия (оксид, гидроксид). Как можно опытным путем доказать их характер?
3. Охарактеризуйте физические свойства фосфора. К какому классу простых веществ его можно отнести?
4. Составьте формулы важнейших соединений фосфора (оксид, гидроксид). Как можно опытным путем доказать их характер?
5. Получите опытным путем гидроксид цинка и докажите его характер.
6. Первые попытки классификации химических элементов.
После проверки домашнего задания учащихся следует подвести к открытию периодического закона Д. И. Менделеевым. Для этого необходимо подчеркнуть, что в основу классификации Д. И. Менделеев положил главную в то время известную величину - атомный вес (в настоящее время мы рассматриваем изменение свойств в зависимости от относительной атомной массы химического элемента).
Учитель вводит понятие «порядковый (атомный) номер» химического элемента и вместе с учащимися анализирует таблицы 16 и 17 учебника, пользуясь текстом на с. 120-121. Возможен и другой вариант. Предварительно можно дать задание на дом: используя данные таблицы 16 (с. 118 учебника), подготовить набор карточек для 20 элементов по образцу:

Если элемент имеет оксид и гидроксид основного характера, то нижняя полоска закрашивается синим цветом, если кислотного характера, то полоска закрашивается красным цветом. Амфотерный гидроксид - полоска закрашивается синим и красным. Используя эти карточки, можно проанализировать изменение свойств простых веществ и их соединений с увеличением относительной атомной массы химического элемента и подойти к понятию «периодичность».
Важно обратить внимание учащихся на то, что Д. И. Менделеев в отличие от других ученых сравнивал несходные семейства элементов. Учитель приводит формулировку периодического закона и отмечает, что Д. И. Менделеев пришел к выводу: периодическое изменение свойств простых веществ, а также формы и свойства соединений элементов зависят не столько от относительной атомной массы, сколько от другой величины, которая в то время была неизвестна (с. 122 учебника).
Домашнее задание. § 35, упр. 4, 5, задача (с. 122).
УРОК 44
Периодическая таблица химических элементов
Цель урока. Обобщить знания о структуре периодической системы химических элементов. Начать формирование умения характеризовать химический элемент по его положению в периодической таблице.
Основные понятия. Малые и большие периоды, группа, подгруппы: главная (А-группа) и побочная (Б-группа).
Планируемые результаты обучения. Знать определения периода, группы, главной и побочной подгрупп, тенденций изменения свойств простых веществ и соединений химических элементов в периодах, главных и побочных подгруппах периодической системы. Уметь характеризовать химический элемент по положению в периодической таблице.
Краткое содержание урока. Урок рекомендуется начать с изучения нового материала. Учитель рассматривает структуру периодической таблицы химических элементов, учащиеся анализируют, как изменяются металлические и неметаллические свойства простых веществ и основные и кислотные свойства их соединений в периодах, главных подгруппах (А-группах). Затем учитель дает информацию о длинном варианте периодической таблицы. Подводя итог, учитель сообщает учащимся план характеристики химического элемента по его положению в периодической таблице элементов, который в дальнейшем будет расширяться и уточняться.
План характеристики химического элемента по положению его в периодической таблице элементов
1. Название химического элемента. Химический знак этого элемента.
2. Положение в периодической таблице (порядковый номер, номер периода (малый, большой), номер группы, подгруппа (главная, побочная).
3. Металл или неметалл.
4. Высшая валентность в кислородных соединениях, формула высшего оксида, гидроксида и характер их свойств.
5. Валентность в водородном соединении, формула летучего водородного соединения (для неметаллов).
Учащиеся на нескольких примерах закрепляют умение характеризовать химический элемент по положению в периодической таблице.
Домашнее задание. § 36, упр. 1-4.
УРОК 45
Строение атома. Изотопы. Химический элемент
Цель урока. Обобщить знания учащихся о составе атома и атомного ядра. Раскрыть физический смысл порядкового номера химического элемента в периодической таблице. Сформировать понятия о химическом элементе и изотопах.
Основные понятия. Порядковый номер, заряд ядра атома, электрон, протон, нейтрон, химический элемент, изотопы.
Планируемые результаты обучения. Знать состав атомного ядра, определения изотопов, химического элемента как вида атомов с одинаковым зарядом ядра. Уметь находить число протонов, нейтронов, электронов указанного атома.
Краткое содержание урока. В начале урока рекомендуется дать учащимся самостоятельную работу для проверки усвоения изученного материала.
Вариант I
1. Даны химические элементы с порядковыми номерами 11, 14, 17. Какой из них образует простое вещество - металл?
2. Выпишите в строчку знаки химических элементов с порядковыми номерами 2-7. Подчеркните наиболее ярко выраженный неметалл. Составьте формулы типичных соединений для химических элементов с порядковыми номерами 3, 4 и 7. Отметьте характер их оксидов (основный, амфотерный или кислотный).
3. Назовите химический элемент, который образует водородное соединение типа H2R и находится в 3-м периоде периодической системы химических элементов Д. И. Менделеева. Укажите его порядковый номер. Составьте формулу его высшего оксида, отметьте характер его водного раствора.
Вариант II
1. Даны химические элементы с порядковыми номерами 16, 17, 19. Какой из них образует простое вещество с наиболее выраженными неметаллическими свойствами?
2. Выпишите в строчку знаки химических элементов с порядковыми номерами 10-17. Назовите среди них наиболее типичный металл. Составьте формулы типичных соединений для химических элементов с порядковыми номерами 11, 13 и 16. Укажите характер их оксидов (основный, амфотерный или кислотный).
3. Химический элемент образует высший оксид R2O7 и находится в 3-м периоде периодической системы Д. И. Менделеева. Назовите этот химический элемент и его порядковый номер. Отметьте характер (основный или кислотный) его оксида, составьте формулу его летучего водородного соединения.
При изучении нового материала следует использовать знания учащихся о строении атома, полученные на уроках физики. Учитель вводит понятия об элементарных частицах (электрон, протон, нейтрон), ядре атома, изотопах, раскрывает физический смысл порядкового номера. Необходимо обратить внимание учащихся на правильную форму обозначения изотопа (массовое число ставится слева от химического знака вверху, заряд ядра - слева внизу). Уточняется понятие «химический элемент». Следует дать учащимся несколько упражнений на нахождение числа протонов, нейтронов и электронов в атоме.
Можно составить с учащимися обобщающую таблицу:
Название частицы
Обозначение частицы
Электрический заряд
Приблизительная масса (в атомных единицах массы)
протон
p
+1
1
нейтрон
n
0
1
электрон
![]()
-1
1/1840
Знакомство с понятием «изотопы» дает возможность ответить на вопрос, почему в некоторых случаях (Ar и K, Со и Ni, Fe и I) надо было отступить от общего принципа и расположить эти элементы в периодической таблице не в порядке возрастания их относительных масс. Все перестановки элементов в периодической таблице объясняются разным соотношением легких и тяжелых изотопов.
Затем учитель объясняет, почему относительная атомная масса большинства химических элементов выражается дробным числом.
В конце урока можно кратко рассказать о ядерных реакциях.
В проведении этого урока методическую помощь может оказать электронное пособие «Электронная библиотека "Просвещение". Химия. 8 класс», уроки 18-20.
Домашнее задание. § 37 (с. 125-129), упр. 1-3 (с. 138).
Подготовить сообщения на темы:
1. Тяжелая вода.
2. Искусственная радиоактивность.
3. Использование радиоактивных элементов.
УРОК 46
Строение электронных оболочек атомов
Цель урока. Сформировать представления об электронном строении атомов на примере 20 химических элементов периодической таблицы. Основываясь на теории электронного строения атома, рассмотреть современную формулировку периодического закона.
Основные понятия. Электронная оболочка, энергетический уровень (электронный слой), главное квантовое число, валентные электроны, завершенный электронный слой.
Планируемые результаты обучения. Знать современную формулировку периодического закона, физический смысл номеров периода и группы, причину периодического изменения химических свойств первых 20 элементов. Уметь объяснять периодическое изменение свойств химических элементов в свете теории строения атомов, составлять схемы строения атомов первых 20 элементов.
Краткое содержание урока. Содержание этого урока отличается высоким уровнем абстракции. При объяснении нового материала все время надо вовлекать учащихся в беседу, используя межпредметные связи. Можно воспользоваться содержанием урока 18 электронного пособия «Электронная библиотека "Просвещение". Химия. 8 класс». Особое внимание надо уделить формированию умений составлять схемы строения атомов первых 20 химических элементов.
Надо пояснить учащимся, что электроны в совокупности образуют электронную оболочку атома. Электронная оболочка атома состоит из электронных слоев. В каждом электронном слое находятся электроны с близкими значениями энергии, поэтому электронные слои называют энергетическими уровнями. Максимальное число электронов, находящихся на определенном энергетическом уровне, можно вычислить по формуле 2n2, где п - номер энергетического уровня.
На основании электронной теории строения атома необходимо развить у учащихся представления о причинах и закономерностях изменения свойств химических элементов и их соединений.
Объясняя учащимся закономерности заполнения электронами энергетических уровней (электронных слоев) атомов элементов, важно подчеркнуть, что количественные изменения переходят в качественные скачкообразно. Учащиеся должны проследить, как изменяются свойства простых веществ и их соединений (металличность и неметалличность, основные и кислотные свойства) по периоду и в главных подгруппах, а также должны объяснить причины этих изменений.
В конце объяснения нового материала учитель подводит учащихся к мысли, что заряд ядра атома является главной характеристикой химического элемента, и дает современную формулировку периодического закона Д. И. Менделеева.
Далее учитель дополняет план характеристики химического элемента по его положению в периодической таблице пунктами:
1. Состав ядра атома.
2. Электронное строение атома.
Домашнее задание. § 37 (с. 129-132), упр. 4-6 (с. 138).
УРОК 47
Состояние электронов в атомах
Цель урока. Сформировать представления о состоянии электрона в атоме - электронной плотности, атомной орбитали. Научить составлять электронные формулы атомов.
Основные понятия. Электронное облако, орбиталь, форма орбиталей, электронная формула атома.
Планируемые результаты обучения. Иметь представления о двойственной природе электрона и состоянии электронов в атоме. Уметь составлять электронные формулы атомов.
Демонстрации. Плакат «Формы электронных орбиталей».
Краткое содержание урока. Данный урок является логическим продолжением предыдущего урока. Подробно этот материал будет изучаться в 10-11 классах. Поэтому можно дать краткую информацию о состоянии электронов в атоме: рассказать о двойственной природе электрона, ввести понятие «атомная орбиталь», рассмотреть формы орбиталей (s- и p-орбитали).
Далее учитель учит учащихся составлять электронные формулы первых 20 элементов. Учащиеся делают выводы, что к главным подгруппам (А-группам) относят те элементы, у которых очередные электроны помещаются на s- и p-орбиталях. Такие элементы называют s- и p-элементами. К побочным подгруппам (Б-группам) относят элементы, очередные электроны которых помещаются на d-орбиталях. Это d-элементы.
С изображением электронных формул атомов химических элементов с помощью квантовых ячеек в 8 классе знакомить учащихся необязательно.
Домашнее задание. § 37 (с. 132-135). Нескольким учащимся подготовить сообщения о жизни и деятельности Д. И. Менделеева.
УРОК 48
Значение периодического закона. Жизнь и деятельность Д. И. Менделеева
Цель урока. Сформировать представления о научно-практическом значении периодического закона.
Планируемые результаты обучения. Знать о роли периодического закона для обобщения и объяснения уже известных и предсказания новых фактов. Уметь показать его значение для развития науки и техники.
Краткое содержание урока. После фронтальной проверки домашнего задания учитель переходит к новой теме. Учитель рассказывает, что периодический закон химических элементов Д. И. Менделеева - это один из наиболее общих законов природы, которому подчиняются все химические элементы. Важно подчеркнуть, что закон - объективная реальность, существующая в природе независимо от сознания человека. Для того чтобы учащиеся лучше осознали значение закона и поняли, почему периодический закон стал инструментом научного предвидения и целенаправленного поиска новых химических элементов и их соединений, следует рассказать им об истории открытия скандия, галлия и германия.
Далее учитель рассказывает, что периодический закон сыграл большую роль в создании современной теории строения атомов, которая, в свою очередь, явилась его подтверждением. Здесь можно попросить учащихся, чтобы они прокомментировали это положение.
В заключение урока учащиеся выслушивают сообщения своих одноклассников о жизни и деятельности Д. И. Менделеева. Если в кабинете есть кинофильм «Периодический закон Д. И. Менделеева», то желательно урок закончить просмотром этого фильма.
Домашнее задание. § 38, 39, упр. 7 (с. 158). Повторить § 34-39, подготовиться к семинарскому занятию.
УРОК 49
Повторение и обобщение по теме «Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома»
Цель урока. Обобщить, систематизировать и скорректировать знания учащихся по теме. Контроль знаний и умений по теме.
Планируемые результаты обучения. Знать зависимость свойств атомов химических элементов и их соединений от строения атома. Уметь характеризовать химический элемент по положению его в периодической таблице. Уметь объяснять физический смысл порядкового номера химического элемента, номера периода, номера группы в периодической таблице.
Краткое содержание урока. Данный урок рекомендуется провести в форме семинарского занятия, используя работу в группах или парах, фронтальную беседу, самостоятельную работу.
Вопросы для обсуждения могут быть следующими:
1. Характеристика элементарных частиц, входящих в состав атома.
2. Понятие об изотопах. Химический элемент.
3. Расположение электронов в атоме. Понятие об энергетическом уровне. Правила заполнения энергетических уровней атома электронами.
4. Составление схем строения атома и электронных формул элементов 1-3-го периодов периодической таблицы.
5. Периодический закон Д. И. Менделеева (современная формулировка). Периодическая таблица химических элементов.
6. Изменение в периодах и главных подгруппах (А-группах) свойств химических элементов, а также их соединений: заряда ядра, радиуса атома, числа электронов на внешнем уровне, металлических и неметаллических свойств, основных и кислотных свойств. Причины периодического изменения свойств.
7. Характеристика химических элементов по их положению в периодической таблице.
8. Научно-практическое значение периодического закона.
При проведении самостоятельной работы можно предложить учащимся задания в виде текста или в тестовой форме.
Самостоятельная работа
Тестовые задания
Вариант I
1. В ряду Si ![]() Р
Р ![]() S
S ![]() Сl неметаллические свойства
Сl неметаллические свойства
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
2. В ряду Mg ![]() Са
Са ![]() Sr
Sr ![]() Ba металлические свойства
Ba металлические свойства
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
3. В ряду оксидов MgO ![]() СаО
СаО ![]() SrO
SrO ![]() BaO основные свойства
BaO основные свойства
1) усиливаются
2) ослабевают
3) не изменяются
4) сначала усиливаются, затем ослабевают
4. В ряду H2SiO3 ![]() Н3РО4
Н3РО4 ![]() H2SO4
H2SO4 ![]() НСlО4 кислотные свойства __________________
НСlО4 кислотные свойства __________________
5. Наиболее ярко выражены неметаллические свойства у простого вещества, образованного атомами, которые имеют строение электронной оболочки
1) 2, 8, 4
2) 2, 8, 5
3) 2, 8, 6
4) 2, 8, 7
6. Наиболее ярко выражены неметаллические свойства у простого вещества, образованного атомами, которые имеют строение электронной оболочки
1) 2, 7
2) 2, 8, 7
3) 2, 8, 8, 7
4) 2, 8, 6
7. Усиление металлических свойств элементов, расположенных в А-группах периодической системы, с увеличением порядкового номера обусловлено
1) увеличением атомной массы элемента
2) увеличением общего числа электронов
3) увеличением атомного радиуса элемента
4) увеличением номера периода
8. Формула летучего водородного соединения химического элемента H3R. Группа химических элементов периодической системы Д. И. Менделеева, к которой принадлежит этот элемент
1) III
2) V
3) VII
4) IV
9. Установите соответствие между массовым числом химического элемента и числом нейтронов в ядре атома этого элемента.
1) 56
2) 19
3) 31
4) 24
А. 10
Б. 16
В. 30
Г. 14
Д. 12
1
2
3
4
10. Назовите химические элементы, имеющие сходные свойства, на основании приведенных ниже схем распределения электронов по энергетическим уровням в атомах этих элементов.
1) 2, 2
2) 2, 1
3) 2, 8, 7
4) 2, 8, 8, 1
Ответ: ________________________
11. Установите соответствие между ионом и его электронным строением.

1
2
3
4
Вариант II
1. В ряду Na ![]() Mg
Mg ![]() Al
Al ![]() Si металлические свойства
Si металлические свойства
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
2. В ряду F ![]() Сl
Сl ![]() Br
Br ![]() I неметаллические свойства
I неметаллические свойства
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
3. В ряду оксидов SiO2 ![]() P2O5
P2O5 ![]() SO3
SO3 ![]() Cl2O7 кислотные свойства
Cl2O7 кислотные свойства
1) усиливаются
2) ослабевают
3) не изменяются
4) сначала усиливаются, затем ослабевают
4. В ряду LiOH ![]() NaOH
NaOH ![]() KOH
KOH ![]() RbOH основные свойства ____________________
RbOH основные свойства ____________________
5. Наиболее ярко выражены металлические свойства у простого вещества, образованного атомами, которые имеют строение электронной оболочки
1) 2, 1
2) 2, 8, 1
3) 2, 8, 8, 1
4) 2, 8, 2
6. Наиболее ярко выражены металлические свойства у простого вещества, образованного атомами, которые имеют строение электронной оболочки
1) 2, 8, 1
2) 2, 8, 2
3) 2,8, 3
4) 2, 8, 4
7. С увеличением относительной атомной массы химических элементов в периоде периодически изменяется
1) заряд числа
2) число валентных электронов
3) число нейтронов в ядре атома
4) атомный радиус
8. Формула высшего оксида химического элемента R2O7. Группа химических элементов периодической системы Д. И. Менделеева, к которой принадлежит этот элемент
1) III
2) V
3) VI
4) VII
9. Установите соответствие между химическим элементом и числом протонов в ядре атома этого элемента.
1) Be
2) Сl
3) Fe
4) Аl
A. 26
Б. 4
В. 13
Г. 17
Д. 24
1
2
3
4
10. Назовите химические элементы, имеющие сходные свойства, на основании приведенных ниже схем распределения электронов по энергетическим уровням в атомах этих элементов.
1) 2, 4
2) 2, 5
3) 2, 8, 5
4) 2, 8, 6
Ответ: ____________________________
11. Установите соответствие между частицей (атомом, ионом) и ее электронным строением.
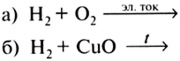
1
2
3
4
ТЕМА 7
СТРОЕНИЕ ВЕЩЕСТВА. ХИМИЧЕСКАЯ СВЯЗЬ (9 ч)
УРОК 50
Электроотрицательность химических элементов
Цель урока. Сформировать понятие об электроотрицательности. Показать учащимся, как изменяется электроотрицательность химических элементов в периодах и главных подгруппах периодической таблицы.
Основные понятия. Электроотрицательность, атомный радиус, металлические и неметаллические свойства.
Планируемые результаты обучения. Знать определение электроотрицательности, характер изменения атомных радиусов, электроотрицательности, металлических и неметаллических свойств в периодах и главных подгруппах (А-группах). Уметь сравнивать электроотрицательность элементов, расположенных в одной подгруппе и в одном периоде периодической таблицы.
Краткое содержание урока. На данном уроке учащиеся должны усвоить, что принадлежность элементов к металлам и неметаллам с точки зрения теории строения атомов определяется способностью их атомов отдавать или присоединять электроны при химических реакциях.
Затем вводится понятие «электроотрицательность». Рассматривается таблица 19 (с. 140 учебника). За единицу электроотрицательности принимается электроотрицательность лития (1,0). Наибольшее значение электроотрицательности имеет элемент фтор (4,0).
Уменьшение электроотрицательности и усиление металлических (ослабление неметаллических) свойств в подгруппах связаны с уменьшением притяжения валентных электронов к ядру; увеличение электроотрицательности и ослабление металлических (усиление неметаллических) свойств в периодах объясняются увеличением числа валентных электронов и стремлением атома дополнить свою электронную конфигурацию до конфигурации инертного газа.
На основании положения элемента в периодической таблице можно судить о его электроотрицательности. С возрастанием атомного радиуса в главной подгруппе (А-группе) усиливается металличность и ослабевает неметалличность, так как увеличивается расстояние между ядром атома и валентными электронами. В периоде происходит некоторое уменьшение атомного радиуса. Это связано со сжатием электронных оболочек при увеличении заряда ядра. Поэтому в периоде ослабевает металлическая активность и усиливается неметаллическая активность.
Для закрепления знаний можно предложить следующие задания:
1. В приведенных ниже формулах подчеркните атомы наиболее электроотрицательного химического элемента.
Вариант I
KСl, Na2O, N2, HI, H2S, AlBr3.
Вариант II
NH3, ZnO, CS2, PCl5, I2, Al2S3.
Вариант III
AlF3, H2, Mg3N2, CO2, CuS, CCl4.
2. Составьте формулы веществ, образованных атомами различных элементов, знаки которых предложены ниже.
Вариант I
а) Сu и S
б) Н и F
в) Са и N
Вариант II
а) N и Mg
б) S и Н
в) Сl и В
Вариант III
a) Si и Н
б) Сl и Si
в) Sb и О
Можно предложить задания в тестовой форме:
1. В ряду элементов F ![]() Cl
Cl ![]() Br
Br ![]() I с увеличением порядкового номера химического элемента электроотрицательность
I с увеличением порядкового номера химического элемента электроотрицательность
1) увеличивается
2) уменьшается
3) не изменяется
4) изменяется периодически
2. В ряду элементов С ![]() N
N ![]() О
О ![]() F с увеличением порядкового номера химического элемента электроотрицательность
F с увеличением порядкового номера химического элемента электроотрицательность
1) увеличивается
2) уменьшается
3) не изменяется
4) изменяется периодически
3. Как изменяется электроотрицательность (ОЭ) в группе галогенов?
1) ОЭ(F) > ОЭ(Cl) > ОЭ(Br) > ОЭ(I)
2) ОЭ(F) = ОЭ(Cl) = ОЭ(Br) = ОЭ(I)
3) ОЭ(I) > ОЭ(Br) > ОЭ(Cl) > ОЭ(F)
4) ОЭ(F) <����������������
������������������������
��КИ 51-52
Ковалентная связь. Полярная и неполярная ковалентная связь
Цель урока. Сформировать представления о химической связи между атомами элементов, показать механизм ее образования. Научить составлять электронные схемы образования ковалентных соединений, записывать электронные формулы молекул данного вещества.
Основные понятия. Ковалентная связь, полярная и неполярная ковалентная связь, электронная формула, σ-связь, π-связь.
Планируемые результаты обучения. Знать определение ковалентной связи, механизм ее образования. Уметь составлять электронные схемы образования ковалентных соединений, записывать электронные формулы молекул данного вещества. Уметь различать соединения с полярной и неполярной ковалентной связью.
Краткое содержание урока. На данную тему отводятся два урока. Материал отличается высоким уровнем абстрактности и сложен для восприятия. Для наглядности можно использовать кинофрагмент «Химическая связь» или урок 22 электронного пособия «Электронная библиотека "Просвещение". Химия. 8 класс».
Прежде чем рассматривать механизм ковалентной связи, необходимо повторить с учащимися строение атома и распределение электронов по энергетическим уровням; объяснить на основании строения атома причину химической инертности атомов благородных газов; рассмотреть, что такое завершенный электронный слой. Учащиеся должны понять, что причина способности атомов всех элементов соединяться друг с другом состоит в незавершенности наружного слоя их атомов. При взаимодействии атомы приобретают устойчивую электронную структуру с завершенным внешним электронным слоем за счет спаривания электронов, принадлежащих атомам одного или разных элементов.
Далее учитель переходит к рассмотрению механизма образования ковалентной связи. Этот вопрос подробно разобран в учебнике.
Изучение полярной и неполярной ковалентной связи строится на основе понятия электроотрицательности.
Для закрепления изученного материала учащиеся упражняются в умении составлять электронные формулы соединений и электронные схемы образования ковалентных (полярных и неполярных) соединений.
Домашнее задание. § 41 (с. 141-144), упр. 3 (б, в) (с. 145).
УРОК 53
Ионная связь
Цель урока. Сформировать представления о ионах, о ионной химической связи как предельном случае полярной ковалентной связи, показать механизм ее образования. Научить составлять схемы образования ионных соединений и их электронные формулы.
Основные понятия. Ионы, ионная связь, ионные соединения.
Планируемые результаты обучения. Знать определение ионов и ионной связи, механизм образования ионной связи. Уметь составлять схемы образования ионных соединений и их электронные формулы. Понимать отличия ионной связи от ковалентной.
Краткое содержание урока. После проверки домашнего задания учитель переходит к изучению нового материала и рассматривает ионную связь как предельный случай полярной ковалентной связи. Дает понятие о ионах и ионной связи, разбирает механизм образования ионных соединений. Обращает внимание учащихся на то, что формула ионного соединения выражает не состав молекулы, а соотношение положительных и отрицательных ионов. Для закрепления полученных знаний можно дать ученикам следующие тестовые задания:
1. Ионная химическая связь образуется
1) между элементами с одинаковой электроотрицательностью
2) между элементами, электроотрицательность которых резко различается
3) между элементами, электроотрицательность которых различается незначительно
4) между элементами, электроотрицательность которых не имеет значения
2. Ионная химическая связь характерна для соединения
1) СН4
2) NaF
3) N2
4) SiO2
3. Наиболее выражена ионная химическая связь между атомами
1) Li и Сl
2) Mg и Сl
3) Аl и Сl
4) С и Сl
4. Между атомами элементов с порядковыми номерами 9 и 19 образуется химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) металлическая
В качестве заданий можно также предложить сравнить ионную химическую связь с ковалентной полярной химической связью (подтвердив ответ конкретными примерами) и изобразить электронные схемы строения атома и иона лития (указав различия в их строении).
Домашнее задание. § 41, упр. 3 (а), 4, 6, 7 (с. 145).
УРОК 54
Кристаллические решетки
Цель урока. Сформировать представления о типах кристаллических решеток. Научить характеризовать свойства соединений по определенному типу кристаллической решетки.
Основные понятия. Кристаллические и аморфные вещества, кристаллические решетки: ионные, атомные, молекулярные.
Планируемые результаты обучения. Знать типы кристаллических решеток. Уметь характеризовать физические свойства вещества по типу кристаллической решетки.
Демонстрации. Модели кристаллических решеток поваренной соли, алмаза, оксида углерода(IV) или иода.
Лабораторные опыты. Составление моделей молекул и кристаллов веществ с различными видами химической связи.
Краткое содержание урока. Перед изучением нового материала учитель актуализирует знания учащихся по видам химической связи следующими вопросами:
1. В чем особенности строения атомов металлов, неметаллов, благородных газов?
2. Что такое завершенный и незавершенный электронный слой?
3. В чем причина соединения атомов друг с другом?
4. Какие виды химической связи вам известны? Каковы механизмы их образования?
5. Как изображают электронные формулы веществ с различным видом связи?
Одновременно можно предложить учащимся составить и заполнить таблицу, обобщающую сведения о видах химической связи.
После этого учитель переходит к изучению нового материала, вводит понятия «кристаллические вещества» и «аморфные вещества». Большинство веществ, свойства которых изучают учащиеся, имеет кристаллическое строение. Учитель дает определение кристаллической решетки, рассматривает особенности ионной, атомной и молекулярной кристаллических решеток. Демонстрирует модели этих решеток, сравнивая их между собой. Учащиеся выполняют лабораторный опыт 19 (с. 152 учебника). Учитель обращает внимание на то, что понятие «молекула» неприменимо к веществам ионного и атомного строения. Формула ионного соединения отражает соотношение положительных и отрицательных ионов. В конце данной темы разбирается вопрос о влиянии типа кристаллической решетки на свойства вещества. Приводятся конкретные примеры.
В заключение можно предложить учащимся следующие вопросы и задания:
1. Приведите примеры веществ, имеющих кристаллическую решетку: а) ионную; б) молекулярную; в) атомную. Поясните, как строение этих веществ отражается на их свойствах.
2. Используя знания о строении вещества и данные, приведенные ниже, объясните, почему у хлора, натрия и полученного из них хлорида натрия разные температуры кипения и плавления.
Формула вещества
t кип, °С
t пл, °C
Сl2
-19
-34
Na
883
98
NaCl
1465
801
3. Даны вещества: иод, иодид калия, алмаз, графит, «сухой лед» (оксид углерода(IV)), фторид натрия, речной песок (оксид кремния(IV)), сахар С12Н22О11. Выпишите названия веществ с молекулярной кристаллической решеткой и ионной кристаллической решеткой, пояснив, какие свойства этих веществ определяются их строением.
4. Какую кристаллическую решетку должен иметь карбид кремния, из которого делают абразивные материалы?
5. Установите соответствие между типом кристаллической решетки и свойствами веществ.
1) молекулярная
2) металлическая
3) ионная
4) атомная
A. твердые, тугоплавкие, не растворяются в воде
Б. хрупкие, легкоплавкие, не проводят электрический ток
B. пластичные, имеют различные температуры плавления, проводят электрический ток
Г. твердые, тугоплавкие, хорошо растворяются в воде
1
2
3
4
6. Изобразите схемы строения ионов Mg2+ и Сl-. Какой тип кристаллической решетки характерен для соединения, образованного этими частицами?
Домашнее задание. § 42 (с. 146-148), упр. 1-4, задачи 1, 2 (с. 152).
УРОК 55
Валентность и степень окисления. Правила вычисления степени окисления элементов
Цель урока. Сформировать представления о степени окисления, показать различие понятий «валентность» и «степень окисления».
Основные понятия. Валентность, степень окисления, электронные и структурные формулы.
Планируемые результаты обучения. Знать определения понятий «валентность» и «степень окисления». Понимать отличия степени окисления от валентности. Уметь определять степень окисления элемента по формуле вещества и составлять формулы по известной степени окисления элементов.
Краткое содержание урока. После проверки домашнего задания учитель уточняет определение валентности элементов с точки зрения строения атома, т. е. формирует представления о валентности как свойстве атома, характеризующем его способность образовывать химические связи с другими атомами. Обращает внимание на запись электронных и структурных формул веществ. Затем переходит к рассмотрению степени окисления - условного заряда элемента, рассчитанного исходя из условия, что все связи в соединении являются ионными. Учитель обязательно обращает внимание учащихся на различие валентности и степени окисления.
Далее учащиеся, используя алгоритм (с. 151 учебника), учатся определять степень окисления элемента по формуле вещества и составлять формулы по известной степени окисления элементов.
Домашнее задание. § 42 (с. 148-149), § 43 (с. 150-152), упр. 5, 6, 8 (с. 152).
УРОК 56
Окислительно-восстановительные реакции
Цель урока. Сформировать первоначальные представления об окислительно-восстановительных реакциях. Научить определять окислитель и восстановитель.
Основные понятия. Окислительно-восстановительные реакции, окислитель, восстановитель.
Планируемые результаты обучения. Знать определения понятий «окислитель», «восстановитель», «окислительно-восстановительные реакции». Уметь определять окислительно-восстановительные реакции, различать процессы окисления и восстановления с электронной точки зрения.
Краткое содержание урока. Учащимся уже известны процессы окисления и восстановления с позиций атомно-молекулярного учения. Теперь надо дать обобщенные представления об этих процессах с точки зрения строения атома.
Формирование понятия «окислительно-восстановительная реакция» происходит на основе знаний о степени окисления.
Учитель предлагает учащимся записать уравнение реакции окисления, например кальция, и проставить степень окисления атомов в каждом соединении:
![]()
При обсуждении этого уравнения выясняется, что данная реакция сопровождается изменением степени окисления элементов. Происходит процесс отдачи электронов: ![]() (окисление) и процесс принятия электронов:
(окисление) и процесс принятия электронов: ![]() (восстановление). Потом даются определения понятий «окислитель», «восстановитель», «окислительно-восстановительная реакция». Учащиеся внимательно изучают таблицу 20 (с. 150 учебника). Затем учитель дает несколько уравнений реакций и просит определить, какие из этих реакций окислительно-восстановительные. После этого учитель предлагает учащимся самостоятельно заполнить таблицу.
(восстановление). Потом даются определения понятий «окислитель», «восстановитель», «окислительно-восстановительная реакция». Учащиеся внимательно изучают таблицу 20 (с. 150 учебника). Затем учитель дает несколько уравнений реакций и просит определить, какие из этих реакций окислительно-восстановительные. После этого учитель предлагает учащимся самостоятельно заполнить таблицу.
Тип реакции
Примеры реакций
с изменением степени окисления
без изменения степени окисления
1. Реакция соединения
2. Реакция разложения
3. Реакция замещения
4. Реакция обмена
После заполнения таблицы и ее обсуждения учащиеся приходят к выводу, что химические реакции можно группировать по разным классификационным признакам.
Для упражнений в составлении окислительно-восстановительных реакций следует давать учащимся известные примеры, простые в исполнении. На этом уроке даются первые представления об окислительно-восстановительных реакциях. Можно дать алгоритм составления уравнения окислительно-восстановительной реакции, например взаимодействия кальция с кислородом, методом электронного баланса.
1) Определите степень окисления атомов в каждом соединении.
![]()
2) Выпишите те элементы, у которых степень окисления изменяется, и составьте схему перемещения электронов:
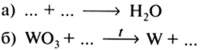
3) Запишите число отданных и принятых электронов и уравняйте их. Расставьте коэффициенты в схеме реакции:

4) Определите процессы окисления и восстановления, окислитель и восстановитель и запишите их в электронной схеме:

Можно записывать уравнения окислительно-восстановительных реакций так, как это показано на с. 149 учебника.
Домашнее задание. § 43 (с. 149-150), упр. 7, 9 (с. 152). Повторить § 40-43, подготовиться к семинарскому занятию.
УРОК 57
Повторение и обобщение по теме «Строение вещества. Химическая связь»
Цель урока. Обобщить, систематизировать и скорректировать знания и умения учащихся по теме «Строение вещества. Химическая связь».
Основные понятия. Электроотрицательность, степень окисления, валентность, ковалентная (полярная, неполярная) химическая связь, ионы, ионная химическая связь, кристаллические решетки.
Планируемые результаты обучения. Знать определения основных понятий по теме, типы кристаллических решеток и свойства соединений с каждым типом кристаллической решетки. Уметь определять степень окисления в бинарных соединениях и вид химической связи в соединении по разности электроотрицательности двух атомов. Понимать отличие степени окисления от валентности, ионных соединений от ковалентных.
Краткое содержание урока. Урок рекомендуется провести в форме семинара, используя фронтальную беседу, работу в парах, индивидуальные задания, самостоятельную работу. На данном уроке следует подготовить учащихся к контрольной работе, обсуждая и разбирая следующие вопросы:
1. Что означает понятие «электроотрицательность»? Может ли быть электроотрицательность равна нулю? Поясните примерами. Как изменяется электроотрицательность в ряду химических элементов: F, I, Br, Cl?
2. Назовите наиболее электроотрицательный химический элемент. Электроотрицательность какого химического элемента принята за единицу?
3. Какие химические элементы - металлы или неметаллы - имеют наибольшее численное значение электроотрицательности? Почему?
4. Как изменяется электроотрицательность химических элементов: а) в главной подгруппе одной группы; б) в периодах периодической системы химических элементов Д. И. Менделеева?
5. Что такое степень окисления? Составьте формулы бинарных соединений, в которых степени окисления атомов химических элементов равны: а) +4 и -2; б) +7 и -2; в) +1 и -4; г) +1 и -1. Назовите эти вещества.
6. Установите соответствие между названием химического элемента и его высшей положительной степенью окисления.
1) железо
2) хлор
3) кальций
4) азот
А. +2
Б. +3
В. +5
Г. +7
1
2
3
4
7. Установите соответствие между названием химического элемента и его отрицательной степенью окисления.
1) сера
2) хлор
3) азот
4) кремний
А. -3
Б. -2
В. -4
Г. -1
1
2
3
4
8. Установите соответствие между химическим элементом и возможными значениями его степеней окисления.
1) Сl
2) F
3) Р
4) S
А. -2, -1, 0, +2
Б. -2, 0, +4, +6
В. -3, 0, +3, +5
Г. -1, 0
Д. -4, -2, 0, +2, +4
Е. -1, 0, +1, +3, +5, +7
1
2
3
4
9. Дайте определение понятий «ковалентная химическая связь», «ионная химическая связь». Сравните ковалентную полярную связь с ионной связью.
10. Пользуясь знаниями о химической связи, решите, какие из веществ, формулы которых СО2, N2, NH3, H2O, AlI3, Аl2О3, являются: а) газами; б) жидкостями; в) твердыми веществами.
11. Что называют кристаллической решеткой вещества? Какие кристаллические решетки имеют: а) графит; б) поваренная соль; в) медь? Какие частицы находятся в узлах каждой кристаллической решетки? Как это отражается на свойствах названных веществ?
12. Почему вещества F2, HF, NaCl имеют разные температуры плавления, соответственно равные -220 °С, -83 °С, +800 °С?
13. Приведите по два примера уравнений химических реакций: а) соединения; б) разложения, одна из которых является окислительно-восстановительной реакцией, другая происходит без изменения степени окисления атомов химических элементов.
14. Какие химические реакции из тех, схемы которых приведены ниже, следует отнести к окислительно-восстановительным?
1) Сl2 + KI ![]() KСl + I2
KСl + I2
2) Н2О + SO3 ![]() H2SO4
H2SO4
3) H2S ![]() H2 + S
H2 + S
4) СаО + НСl ![]() CаСl2 + Н2О
CаСl2 + Н2О
5) CuS + О2 ![]() CuO + SO2
CuO + SO2
6) WO3 + H2 ![]() W + H2O
W + H2O
Ответ объясните.
15. Какой процесс (окисление или восстановление) изображен на следующих схемах?

16. Какие опыты можно провести, чтобы прошла окислительно-восстановительная реакция, соответствующая схеме ![]() ? Назовите в этой реакции восстановитель.
? Назовите в этой реакции восстановитель.
17. Какие опыты можно провести, чтобы прошла окислительно-восстановительная реакция, соответствующая схеме ![]() ? Назовите в этой реакции окислитель.
? Назовите в этой реакции окислитель.
18. Расставьте коэффициенты в схеме химической реакции
I2 + Н2 ![]() HI
HI
Подчеркните восстановитель. Укажите вид химической связи и тип кристаллической решетки в иодоводороде. Перечислите свойства иодоводорода, определяемые его строением.
Домашнее задание. Подготовиться к контрольной работе.
УРОК 58
Контрольная работа по темам «Периодический закон и периодическая таблица химических элементов Д. И. Менделеева. Строение атома» и «Строение вещества. Химическая связь»
Цель урока. Контроль знаний и умений по темам.
Методические рекомендации. См. урок 18.
Вариант I
1. Назовите химический элемент, определите заряд ядра атомов этого элемента, зная распределение электронов в его атомах: а) 2, 5; б) 2, 8, 6; в) 2, 8, 8; г) 2, 8, 5.
Какие из этих химических элементов имеют сходные свойства? Составьте формулы их оксидов, гидроксидов, летучих водородных соединений, если они их образуют.
2. Расположите: а) в порядке ослабления металлических свойств химические элементы Na, Li, Cu, Rb, K; б) в порядке усиления неметаллических свойств химические элементы Si, Al, Cl, P, S.
3. Определите по формулам степени окисления атомов в бинарных соединениях. Назовите вещества. Подчеркните наиболее электроотрицательный химический элемент.
АlСl3, HF, NH3, CaBr2, NO2, IF7.
4. Запишите формулу сероводорода. Определите вид химической связи. Составьте схему ее образования.
5. Поясните, какую кристаллическую решетку имеет карбид кремния (SiC), если известно, что это вещество используют как абразивный материал.
6. Какие химические реакции, уравнения которых приведены ниже, относятся к окислительно-восстановительным?
а) 2Na + 2Н2О = 2NaOH + Н2![]()
б) K2О + Н2О = 2KOH
в) СаО + 2НСl = СаСl2 + Н2О
г) Fe + H2SO4 = FeSO4 + H2![]()
Вариант II
1. Назовите химический элемент, определите заряд ядра атомов этого элемента, зная распределение электронов в его атомах: а) 2, 8, 2; б) 2, 8, 7; в) 2, 8, 8; г) 2, 8, 8, 2.
Какие из этих химических элементов имеют сходные свойства? Составьте формулы их оксидов, гидроксидов, летучих водородных соединений, если они их образуют.
2. Расположите: а) в порядке усиления металлических свойств химические элементы Ва, Sr, Mg, Ca, Be; б) в порядке ослабления неметаллических свойств химические элементы F, В, N, О, С.
3. Составьте формулы веществ. Проставьте степени окисления над знаками химических элементов в каждой формуле. Подчеркните наиболее электроотрицательный химический элемент.
а) нитрид кальция
б) оксид марганца(VII)
в) карбид кремния
4. Какая из схем соответствует изображению химической связи, удерживающей атомы в оксиде лития
![]()
Назовите вид этой химической связи.
5. Поясните, какую кристаллическую решетку имеет иод, если известно, что это вещество легко возгоняется.
6. Какие химические реакции, уравнения которых приведены ниже, относятся к окислительно-восстановительным?
а) Na2O + Н2О = 2NaOH
б) СаСО3 = СаО + СО2![]()
в) Zn + 2HCl = ZnCl2 + H2![]()
г) 2Mg + О2 = 2MgO
ТЕМА 8
ЗАKOH АВОГАДРО. МОЛЯРНЫЙ ОБЪЕМ ГАЗОВ (3 ч)
УРОК 59
Закон Авогадро. Молярный объем газов
Цель урока. Сформировать понятие о молярном объеме газов. Научить производить расчеты, используя закон Авогадро и следствие из него.
Основные понятия. Закон Авогадро, молярный объем газов, нормальные условия.
Планируемые результаты обучения. Знать закон Авогадро и следствие из него. Уметь определять объем определенного количества вещества газа, а также количество вещества газа, массу газа и число молекул, исходя из объема газа при нормальных условиях.
Краткое содержание урока. Учитель начинает изучение данной темы с формулировки закона Авогадро, затем объясняет закон Авогадро, привлекая знания учащихся. Проводит фронтальную беседу по следующим вопросам:
1. Чем газообразное состояние вещества отличается от жидкого и твердого?
2. Каково расстояние между молекулами в газе по сравнению с размерами самих молекул?
3. Как изменяется расстояние между молекулами в газообразном веществе при изменении температуры и давления? Почему?
В итоге учащиеся должны прийти к выводу, что для газообразных веществ важно знать объем, который занимают 6,02 · 1023 молекул газа, т. е. 1 моль газа. Этот объем можно вычислить, если известна масса 1 л газа. Например, при нормальных условиях масса 1 л водорода равна 0,09 г (а плотность 0,09 г/л); молярная масса водорода равна 2,016 г/моль. Тогда объем, занимаемый 1 моль водорода, равен:
![]()
При нормальных условиях масса 1 л кислорода равна 1,429 г, М(О2) = 32 г/моль, тогда
![]()
Учащиеся делают вывод, что 1 моль любого газа при нормальных условиях занимает объем, равный 22,4 л. Этот объем называют молярным объемом газа. Необходимо различать нормальные условия (0 °С, 1 атм) и стандартные условия (25 °С, 1 атм).
На основании закона Авогадро и следствия из него школьники учатся производить расчеты.
Задача 1. Рассчитайте, какой объем занимают 5 моль аммиака (н. у.).
Задача 2. Рассчитайте, какой объем при нормальных условиях займет оксид углерода(IV) массой 5,6 г.
Задача 3. Определите массу 5 л аммиака (н. у.). Какое количество вещества аммиака заключено в этом объеме?
Задача 4. Определите, какой объем занимают 1,204 · 1023 молекул кислорода (н. у.).
В конце урока следует дать самостоятельную работу на вычисление объема определенного количества вещества газа, определенной массы газа, определенного числа молекул, исходя из объема газа при нормальных условиях. Можно предложить учащимся самим составить и решить несколько задач.
Домашнее задание. § 44 (с. 153-154), упр. 1, 2 (с. 156).
УРОК 60
Относительная плотность газов
Цель урока. Научить вычислять по химическим уравнениям объем газа (по известной массе или количеству вещества), массу или количество вещества (по известному объему газа) одного из вступивших в реакцию или получившихся в результате реакции веществ. Сформировать понятие об относительной плотности газов. Научить производить расчеты, используя понятие «относительная плотность газов».
Основные понятия. Молярный объем, молярная масса, относительная плотность газов, плотность газов.
Планируемые результаты обучения. Знать определение относительной плотности газов и уметь производить расчеты, используя эту величину. Уметь рассчитывать по химическому уравнению массу, количество и объем вещества.
Краткое содержание урока. Фронтальная проверка домашнего задания: решение задач с использованием понятий «молярный объем», «количество вещества», «масса».
К доске можно вызвать несколько учеников для выполнения индивидуальных заданий, остальные учащиеся работают в парах. Учитель должен подготовить задания для каждой пары.
После проверки домашнего задания учитель переходит к понятию «относительная плотность газов». Сначала дается пояснение, что такое плотность газов, и выполняется ряд упражнений - нахождение молярной массы вещества с использованием понятия «плотность газа». Затем следует перейти к относительной плотности газов. Учитель обращает внимание учащихся на то, что при расчетах более удобно использовать относительную величину, называющую, во сколько раз один газ тяжелее или легче другого. Это понятие закрепляется расчетами на нахождение относительной плотности газа и молярной массы вещества.
После этого учитель переходит к решению задач по химическим уравнениям, используя понятия «молярная масса», «масса», «молярный объем», «количество вещества».
Домашнее задание. § 44, упр. 3, задача 3 (с. 156).
Составить две-три задачи, используя понятия «молярный объем», «количество вещества», «масса», «относительная плотность газов».
УРОК 61
Объемные отношения газов при химических реакциях
Цель урока. Сформировать умение вычислять объемы газов, участвующих в химических реакциях.
Основные понятия. Закон Авогадро, молярный объем.
Планируемые результаты обучения. Уметь вычислять объемы газов, участвующих в химических реакциях.
Краткое содержание урока. В начале урока можно провести самостоятельную работу.
Вариант I
1. Рассчитайте: а) плотность (н. у.) оксида углерода(IV) (г/л); б) относительную плотность оксида азота(IV) по кислороду.
2. Рассчитайте, какой объем (н. у.) займут: а) 0,6 моль азота; б) 10 г водорода; в) 4,5 моль кислорода.
3. Сгорело 6 г углерода. Вычислите: а) объем вступившего в реакцию кислорода; б) объем образовавшегося оксида углерода(IV) (н. у.).
Вариант II
1. Рассчитайте: а) плотность (н. у.) оксида серы(IV) (г/л); б) относительную плотность сероводорода H2S по водороду.
2. Рассчитайте, какой объем (н. у.) займут: а) 38 г фтора; б) 0,4 моль хлора; в) 1,5 моль кислорода.
3. Сгорело 8 г серы. Вычислите: а) объем вступившего в реакцию кислорода; б) объем образовавшегося оксида серы(IV) (н. у.).
Переходя к вопросу об объемных отношениях газов при химических реакциях, учитель напоминает учащимся, что коэффициенты, стоящие перед химическими знаками и формулами, показывают не только число молекул или формульных единиц, но и число молей, участвующих в реакции. Поэтому уравнения реакций между газами можно записать и так:
Если разделить указанные численные значения объемов реагирующих и образующихся газов на 22,4, то получатся простые целые числа, показывающие объемные отношения газов: 3 : 1 : 2. Следовательно, реакции между газообразными веществами подчиняются определенным закономерностям: при неизменном давлении объемы реагирующих и образующихся газов относятся между собой как небольшие целые числа.
Коэффициенты в уравнениях реакций показывают число объемов реагирующих и образующихся веществ:
![]()
Далее на конкретном примере дается алгоритм решения типовой задачи.
Задача. Вычислите объем углекислого газа (оксида углерода(IV)), который выделится при сгорании 2 л метана (н. у.).

Чтобы закрепить умение решать такие задачи, учащимся можно дать несколько задач для самостоятельного выполнения. Учащиеся могут также придумать свои варианты задач и решить их.
Домашнее задание. § 45, упр. 4, задачи 2, 4 (с. 156).
ТЕМА 9
ГАЛОГЕНЫ (6 ч)
УРОК 62
Положение галогенов в периодической таблице и строение их атомов. Хлор: физические и химические свойства, получение и применение
Цель урока. Обобщить и развить знания учащихся о строении атомов, свойствах химических элементов и их соединений в зависимости от положения в периодической таблице, строении молекул на примере галогенов. Изучить свойства хлора и его применение.
Основные понятия. Цепная реакция.
Планируемые результаты обучения. Уметь давать характеристику элементов-галогенов по их положению в периодической таблице и строению атомов. Знать свойства хлора как простого вещества. Уметь составлять уравнения реакций, характеризующих химические свойства хлора.
Демонстрации. Получение хлора в лаборатории. Горение натрия, меди, железа, сурьмы в хлоре. Отбеливание ткани и бумаги хлором (все опыты проводить в вытяжном шкафу).
Краткое содержание урока. Общую характеристику семейству галогенов учащиеся могут дать самостоятельно, для этого они должны прочитать § 46 учебника и ответить на следующие вопросы:
1. Какие элементы входят в подгруппу галогенов?
2. Что общего в строении атомов галогенов?
3. Какими свойствами (металлов или неметаллов) должны обладать галогены на основании строения атомов и положения в периодической таблице?
4. Чему равна степень окисления галогенов в соединениях с металлами и водородом?
5. Чему равна степень окисления атомов галогена в следующих соединениях: HI, Сl2О7, НClO4, KClO3, НClO, OF2?
6. Какой вид химической связи и тип кристаллической решетки характерны для простых веществ - галогенов?
Можно использовать и тест обучающего характера, который тут же проверяется во фронтальной беседе:
1. Что общего в строении атомов галогенов?
1) заряд ядра атома
2) радиус атома
3) одинаковое число электронов на наружном электронном слое
4) до октета (восьми электронов) на наружном электронном слое недостает по одному электрону
2. В чем различие в строении атомов галогенов?
1) заряд ядра атома
2) радиус атома
3) наружный электронный слой близок к завершенному
4) относительная атомная масса
3. Особенности в строении атомов галогенов, обусловливающие их принадлежность к типичным неметаллам
1) заряд ядра атома
2) радиус атома
3) общее число электронов, вращающихся вокруг ядра атома
4) близкое к завершению общее число электронов, находящихся на наружном электронном слое атома, и способность атома легко принимать недостающие для этого электроны
4. Неметаллические свойства галогенов в группе с увеличением порядкового номера химического элемента
1) усиливаются
2) не изменяются
3) возрастают
4) усиливаются только от химического элемента с порядковым номером 17 к элементу с порядковым номером 9, остальные - без изменения
5. Как изменяется электроотрицательность в группе галогенов?
1) ЭO(F) > ЭО(Cl) > ЭО(Br) > ЭО(I)
2) ЭO(F) = ЭО(Сl) = ЭО(Br) = ЭО(I)
3) ЭО(I) > ЭО(Br) > ЭО(Cl) > ЭО(F)
4) ЭО(F) <����������������
���������������������������
����1) сильными восстановителями
2) сильными окислителями
3) переходными элементами
4) как восстановителями, так и окислителями
7. Галогены в своих соединениях могут проявлять переменную степень окисления. Выберите правильные ответы.
Вещества
Степени окисления галогенов
1. F2, HF, O2F, CaF2
2. Cl2, HCl, Cl2O7, HClO4
3. Br2, HBr, Br2O5, Br2O3
4. I2, HI, I2O7, KI
A. 0, -1, +5, +3
Б. 0, -1, +7, -1
В. 0, -1, -1, -1
Г. 0, -1, +7, +7
8. Вид химической связи в соединениях, образованных галогенами, неодинаков. Выберите правильные ответы.
Соединения галогенов
Вид химической связи
1. Молекулы простых веществ (F2, Сl2, Br2, I2)
2. Летучие водородные соединения
3. Соли (NaCl, KBr, CuI2, CaF2)
А. Ковалентная полярная
Б. Металлическая
В. Ковалентная неполярная
Г. Ионная
9. Галогены и их соединения в твердом состоянии имеют кристаллическое строение. Какой тип кристаллической решетки можно предположить у галогенов и образованных ими веществ, находящихся в твердом состоянии? Выберите правильный ответ.
Соединения
Тип кристаллической решетки
1. Галогены - простые вещества
2. Галогеноводороды
3. Соли бескислородных кислот (растворов галогеноводородов)
А. Ионная
Б. Атомная
В. Молекулярная
Г. Металлическая
10. Установите соответствие между названием галогена и его физическими свойствами.
Вещество
Агрегатное состояние и цвет простого вещества
1. Фтор
2. Хлор
3. Бром
4. Иод
А. Жидкость, красно-бурая
Б. Газ, зелено-желтый
В. Твердое кристаллическое вещество, черное с серым отливом
Г. Газ, желто-зеленый
1
2
3
4
11. Галогены - простые вещества - имеют одинаковый вид химической связи, удерживающей атомы в молекулах, и одинаковый тип кристаллической решетки, но разное агрегатное состояние. Это объясняется тем, что
1) в узлах кристаллической решетки находятся одинаковые по массе частицы, но расположенные друг от друга на разном расстоянии
2) в узлах кристаллической решетки находятся двухатомные молекулы с разной массой и разной силой притяжения
3) в узлах кристаллической решетки находятся нейтральные атомы, на которые не действуют силы межатомного (межмолекулярного) притяжения в кристалле
4) галогены образуют кристаллы разной формы
После выполнения этих заданий следует остановиться на элементе хлоре, так как он имеет наибольшее практическое значение из всех галогенов. Изучение свойств хлора как химического элемента и как простого вещества позволяет показать, что возможные формы существования химического элемента определяются строением его атома. Учащиеся дают характеристику хлору по положению в периодической таблице, используя общий план, и предсказывают его свойства.
Учитель демонстрирует получение хлора в лаборатории:
4НСl + MnО2 ![]() MnСl2 + Сl2
MnСl2 + Сl2![]() + 2Н2О
+ 2Н2О
Вместе с учащимися разбирает эту реакцию с точки зрения процессов окисления и восстановления, затем рассматривает физические и химические свойства хлора. После каждой демонстрации учитель вызывает к доске ученика, который записывает соответствующее уравнение реакции, рассматривая его с электронной точки зрения, подчеркивая окислительные свойства хлора. При изучении реакции взаимодействия хлора с водородом вводится понятие «цепная реакция». При рассмотрении химических свойств хлора уделяется внимание использованию хлора в быту и промышленности.
При наличии электронного пособия «Электронная библиотека "Просвещение". Химия. 8 класс» можно использовать урок 19.
Домашнее задание. § 46, 47, упр. 1-9, задачи 1, 2 (c. 164)
УРОК 63
Хлороводород: получение и физические свойства
Цель урока. Систематизировать знания учащихся о строении атома, видах химической связи на примере молекул хлора и хлороводорода. Изучить способ получения и собирания хлороводорода в лаборатории.
Основные понятия. Синтез хлороводорода.
Планируемые результаты обучения. Знать способ получения хлороводорода в лаборатории и собирания его в пробирку, колбу. Уметь характеризовать свойства хлороводорода.
Демонстрации. Получение хлороводорода и растворение его в воде.
Краткое содержание урока. При проверке домашнего задания следует рассмотреть следующие вопросы:
1. Что общего в строении атомов галогенов?
2. Почему вещества, образованные галогенами, проявляют сходные свойства?
3. Чем различается строение атомов галогенов?
4. У атомов каких элементов внешние электроны прочнее связаны с ядром:
а) у хлора или у брома; б) у фтора или у иода; в) у хлора или у иода?
5. Как изменяются свойства галогенов в подгруппе? Почему?
6. Почему галогены образуют двухатомные молекулы?
7. Каким способом можно собрать хлор? Запишите уравнение реакции получения хлора в лаборатории.
8. Назовите опыты, которые подтверждают основные химические свойства хлора. Сделайте к ним поясняющие надписи. Запишите, где требуется, уравнения химических реакций (рисунки заранее нарисовать на доске).
9. Решение задач 1, 2 (с. 164 учебника) у доски.
Рассматривая новый материал, учащиеся должны самостоятельно ответить на вопросы:
1. В чем сходство и различие видов химической связи в молекуле хлора и в молекуле хлороводорода?
2. Какой тип кристаллической решетки будет иметь хлороводород в твердом состоянии?
3. Какие свойства можно предположить у хлороводорода, исходя из вида химической связи в его молекуле и типа кристаллической решетки?
Учитель более подробно останавливается на получении хлороводорода.
Рассматривая получение хлороводорода в промышленности, учитель закрепляет понятие «синтез». Демонстрируя получение хлороводорода в лаборатории, учитель подробно разбирает прибор, с помощью которого проводится опыт, обращает внимание учащихся на технику безопасности, так как опыт проводится в присутствии концентрированной кислоты, и показывает растворение хлороводорода в воде.
После проведения опытов можно вызвать одного-двух учеников, которые повторили бы эти опыты. Учитель еще раз должен обратить внимание учащихся на правила безопасного выполнения эксперимента, так как хлороводород вреден для здоровья. Это необходимо, так как учащимся предстоит выполнить практическую работу по получению соляной кислоты и изучению ее свойств.
Домашнее задание. § 48, упр. 1-3, задачи 1-3 (с. 169).
УРОК 64
Соляная кислота и ее соли
Цель урока. Систематизировать знания учащихся о свойствах кислот на примере соляной кислоты. Изучить индивидуальные свойства соляной кислоты, качественную реакцию на соляную кислоту и ее соли.
Основные понятия. Качественная реакция.
Планируемые результаты обучения. Знать общие и индивидуальные свойства соляной кислоты. Уметь отличать соляную кислоту и ее соли от других кислот и солей. Соблюдать меры предосторожности при работе с химическими реактивами.
Демонстрации. Качественная реакция на соляную кислоту и ее соли.
Краткое содержание урока. Проверку знаний можно осуществить фронтально. К доске вызываются учащиеся, получившие индивидуальные задания, класс готовит ответы на следующие задания:
Вариант I
Какими из попарно взятых веществ можно воспользоваться для получения хлороводорода?
1) NaCl(тв.), H2SO4(p-p)
2) NaCl(тв.), H2SO4(конц.)
3) NaCl(p-p), H2SO4(p-p)
4) NaCl(p-p), H2SO4(конц.)
Ответ поясните. Запишите уравнения химических реакций.
Вариант II
Рассмотрите рисунки, изображающие опыты по изучению свойств хлороводорода. Приготовьте рассказ о том, какие свойства хлороводорода можно обнаружить при проведении каждого опыта.
Вариант III
Рассмотрите рисунки, изображающие опыты по получению хлороводорода в лаборатории. Какими приборами следует воспользоваться для получения хлороводорода? Какими нельзя пользоваться? Почему?
После обсуждения этих заданий учитель переходит к изучению свойств хлороводородной (соляной) кислоты. Учащимся многое известно о составе, свойствах и применении соляной кислоты, поэтому учитель может предложить учащимся изучить этот материал самостоятельно или при рассказе должен опираться на знания учащихся. Особое внимание следует уделить качественной реакции на соляную кислоту и ее соли.
Для закрепления изученного материала учащиеся выполняют следующие задания:
1. С какими из веществ, формулы которых приведены ниже, будет реагировать соляная кислота?
Вариант I
CuО, СО2, Cu, Mg, H2SO4, Cu(OH)2, AgNO3.
Вариант II
SiO2, AgNO3, Zn(OH)2, Ag, Al, BaO, LiOH, Na2CO3.
Ответ подтвердите записью уравнений химических реакций.
2. Какие признаки реакций можно предположить у процессов, описываемых приведенными ниже схемами?
Вариант I
НСl + AgNO3 ![]()
Вариант II
KСl + AgNO3 ![]()
Допишите уравнения химических реакций. Сделайте вывод, какое вещество является реактивом на соляную кислоту и ее соли.
Домашнее задание. § 49, упр. 4, 5, задачи 4, 5 (с. 169).
УРОК 65
Сравнительная характеристика галогенов
Цель урока. Систематизировать знания учащихся о свойствах галогенов и их применении. Научить учащихся распознавать хлориды, бромиды, иодиды.
Основные понятия. Хлорная вода, бромная вода, иодная вода, возгонка, конденсация.
Планируемые результаты обучения. Знать физические и химические свойства галогенов. Уметь объяснять активность галогенов с точки зрения строения атома.
Демонстрации. Возгонка и конденсация иода. Качественные реакции на иод, бромиды, иодиды.
Лабораторные опыты. Распознавание соляной кислоты, хлоридов, бромидов, иодидов и иода. Вытеснение галогенами друг друга из растворов их соединений.
Краткое содержание урока. Данный материал учащиеся могут изучить самостоятельно, с выполнением лабораторных опытов. Для этого им дается задание - прочитать § 50 учебника, выполнить лабораторные опыты 20, 21 (с. 172-173 учебника) и заполнить таблицы 1 и 2.
Таблица 1
Название галогена, химический знак
Электронная формула валентного слоя
Химическая формула простого вещества
Структурная формула
Электронная формула
Вид химической связи
Тип кристаллической решетки
Физические свойства
Агрегатное состояние
Цвет
Растворимость в воде
Нахождение в природе
фтор F
хлор Сl
бром Br
иод I
Таблица 2
Химическая формула простого вещества
Химические свойства галогенов
Взаимодействие с водородом
Взаимодействие с металлами
Взаимодействие с водой
Взаимодействие с
KF
KCl
KBr
KI
F2
Сl2
Вr2
I2
В таблице ставятся знаки «+» или «-», а вне таблицы записываются уравнения химических реакций.
Домашнее задание. § 50, упр. 1-6, задача (с. 172). Подготовиться к практической работе «Получение соляной кислоты и изучение ее свойств».
УРОК 66
Практическая работа «Получение соляной кислоты и изучение ее свойств»
Цель урока. Практически изучить условия получения хлороводорода, его свойства и способы собирания. Научить распознавать соляную кислоту и ее соли. Повторить правила техники безопасности при работе с кислотами.
Планируемые результаты обучения. Знать условия получения хлороводорода, его свойства и способы собирания. Уметь собирать простейший прибор для получения газов, растворять хлороводород в воде. Уметь распознавать соляную кислоту и ее соли. Соблюдать правила техники безопасности при работе с кислотами.
Методические рекомендации. При проведении практической работы необходимо обратить внимание учащихся на строгое соблюдение правил техники безопасности, так как хлороводород опасен, он сильно раздражает слизистую оболочку дыхательных путей. Для того чтобы хлороводород не попадал в воздух помещения, необходимо после растворения хлороводорода в воде свободный конец газоотводной трубки закрыть ватным тампоном, смоченным раствором соды.
Для получения хлороводорода следует заранее приготовить раствор серной кислоты 1 : 1 и охладить его. Кислота такой концентрации не вспенивает реакционную смесь, и хлороводород не попадает в воздух в момент сборки прибора. Для опыта надо взять 0,1 г хлорида натрия и 5 капель раствора серной кислоты.
Необходимо напомнить учащимся, чтобы они следили за газоотводной трубкой, направленной в пробирку с водой. Она не должна касаться воды! Как только газоотводная трубка коснется поверхности воды, воду перебросит в горячую пробирку-реактор и стекло лопнет.
Составление отчета о выполненной работе следует осуществить в виде таблицы.
Домашнее задание. Подготовиться к контрольной работе. Повторить темы «Закон Авогадро. Молярный объем газов» и «Галогены».
УРОК 67
Контрольная работа по темам «Закон Авогадро. Молярный объем газов» и «Галогены»
Цель урока. Контроль знаний и умений по темам 8 и 9.
Методические рекомендации. См. урок 18.
Вариант I
1. Жидким галогеном является
1) хлор
2) фтор
3) бром
4) иод
2. Составьте схему строения атома хлора. Укажите общее число и число неспаренных электронов. Запишите формулы типичных соединений.
3. Наиболее сильный окислитель - это
1) хлор
2) бром
3) фтор
4) иод
4. Составьте уравнение реакции, расставьте коэффициенты с помощью электронного баланса. Укажите окислитель и восстановитель.
KВr + Сl2 ![]() KСl + Вr2
KСl + Вr2
5. Степень окисления хлора в хлорной кислоте
1) +5
2) +1
3) -1
4) +7
5) 0
6. Составьте два уравнения реакций: а) соединения; б) замещения, в которых участвуют галогены.
7. Наиболее прочная галогеноводородная кислота - это
1) НСl
2) НВr
3) HI
4) HF
8. Составьте уравнения реакций, позволяющих характеризовать химические свойства соляной кислоты или других галогеноводородных кислот.
9. Вычислите объемы хлора и водорода (н. у.), необходимых для получения 20 м3 хлороводорода.
Вариант II
1. Галоген, представляющий собой твердое вещество, - это
1) фтор
2) хлор
3) бром
4) иод
2. Составьте схему строения атома фтора. Укажите общее число электронов, вращающихся вокруг ядра атома, и число электронов, находящихся на наружном электронном слое.
3. Галоген, который способен возгоняться, - это
1) фтор
2) хлор
3) бром
4) иод
4. Расставьте коэффициенты в схеме реакции с помощью электронного баланса. Укажите, какое вещество окисляется, какое восстанавливается.
MnO2 + HCl ![]() Сl2 + МnCl2 + Н2О
Сl2 + МnCl2 + Н2О
5. Степень окисления хлора в бертолетовой соли KСlO3
1) -1
2) +1
3) +5
4) +7
5) 0
6. Составьте два уравнения реакций, в которых один галоген вытесняет другой из соли.
7. Различить галогеноводородные кислоты и их соли можно с помощью одного реактива
1) хлорной воды
2) AgNO3
3) крахмального клейстера
4) Cu
8. С какими из перечисленных веществ будет реагировать соляная кислота: ртуть, оксид меди(II), алюминий, гидроксид калия, карбонат калия? Напишите уравнения возможных реакций.
9. Для реакции взяли 5 л хлора и 2 л водорода (н. у.). Смесь взорвали. Каков объем полученного хлороводорода? Какой газ остался в избытке?