- Учителю
- Урок химии на тему «Факторы, влияющие на скорость химической реакции» (11 класс)
Урок химии на тему «Факторы, влияющие на скорость химической реакции» (11 класс)
Предмет: химия
Учитель: Сазанова Ольга Леонидовна
Тема: «Факторы, влияющие на скорость химической реакции»
Технология проблемного изучения и развития критического мышления с элементами интегрированного урока.
Класс: 11
Тип урока: изучение нового материала
Цель урока:
-
Выявить факторы, влияющие на скорость химической реакции.
-
Обеспечить понимание материала учащимися.
-
Развивать критическое мышление посредством интерактивного включения учащихся в процесс обучения.
Основные понятия темы:
-
Закон Вант-Гоффа;
-
Концентрация;
-
Катализатор;
-
Катализ;
-
Фермент;
-
Ингибитор;
Демонстрация:
-
Взаимодействие разных металлов с раствором соляной кислоты.
-
Взаимодействие цинка с серной кислотой различной концентрации.
-
Разложение пероксида водорода под действием каталазы.
-
Разложение пероксида водорода под действием сульфата тетрамминамеди (II).
Ход урока:
Слайд 1. Факторы, влияющие на скорость химической реакции.
Итак, мы на прошлом уроке приступили к изучению темы, связанной с кинетикой химических реакций.
Слайд 2. Ответь на вопрос.
? Вспомните, а что скрывается за понятием скорость химической реакции?
Скорость химической реакции - это изменение количества вещества реагирующих и полученных веществ за единицу времени.
Слайд 3. Подумайте.
Проверка домашнего индивидуального задания.
В разных науках часто используются одни и те же термины, но вкладывается в них разный смысл. Например: термин «скорость» в ходу и у химиков и у физиков. Сравните:
«скорость»
В физике
В химии
Определение
Формула для расчета
Единица измерения
Примеры
? Посмотрите и скажите, чем отличаются две реакции друг от друга:
N2+ 3H2 = 2NH3 гомогенная
2NaCl + MgSO4 = Na2SO4 + MgCl2 гомогенная
В первом случае - газовая система, во втором - растворы сложных веществ в одном растворителе.
Zn + 2HCl = ZnCl2 + H2 гетерогенная
С + О2 = СО2 гетерогенная
Вещества реагирующие и продукты реакции - в разных агрегатных состояниях.
Слайд 4. Формулы для определения скорости гомогенной и гетерогенной химической реакции.
Заранее на доске - примеры и формулы, выражающие скорость химических реакций.
Соотнесите тип реакции с формулой, по которой можно рассчитать скорость химической реакции:
Раствор хлорида натрия в воде (гомогенная)
Раствор кислорода в воде (гомогенная)
Вода со льдом (гетерогенная)
Насыщенный раствор с осадком (гетерогенная)
Уголь и сера в атмосфере воздуха (гетерогенная)
Молодцы, вы хорошо усвоили материал.
Посмотрите в план работы. Каков следующий пункт?
Итак, факторы, влияющие на скорость химической реакции. Запись темы урока.
Слайд 5. Проблема урока.
Попробуйте сформулировать проблему, над которой мы будем с вами работать.
А все ли реакции идут с одинаковыми скоростями? И можно ли изменить при необходимости скорость? Поиск ответов на эти вопросы и будет целью нашего урока.
? подумайте, а зачем человек ищет способы управления реакциями? Заслушиваются ответы учащихся.
-
Природа реагирующих веществ.
Слайд 6. Природа реагирующих веществ.
Все внимание сюда. Проведем опыт между различными металлами и раствором соляной или серной кислотой.
? почему разные металлы по разному реагируют с одинаковым раствором кислоты?
Взяты металлы разной активности
? А что же необходимо для начала реакции?
Взаимодействие, а для этого требуется сближение частиц и их столкновение. Чтобы молекулы столкнулись необходима энергия. Избыточная энергия молекулы называется энергией активации Е акт , и если молекула обладает энергией меньше Е акт , то она даже при столкновении в реакцию не вступает. Молекула же с такой энергией - активная.
Как получить больше активных молекул? Повысить температуру.
2. Температура.
В середине XIX века физиком Вант-Гоффом было сформулировано правило: скорость химической реакции увеличивается в 2-4 раза при повышении температуры на каждые 100 С.
? чем это можно объяснить? Частицы начинают более активно двигаться, а значит и вероятность соударений возрастает.
Слайд 7. Влияние температуры.
3. Третья причины, влияющая на скорость реакции.
Рисуем на доске.
Какова вероятность соударения? А здесь число соударений?
Почему, что изменилось? Возросла концентрация реагирующих веществ.
-
Изменение концентрации веществ.
Слайд 8. Концентрация реагирующих веществ.
Допустим, что в результате реакции получено новое третье вещество. Пусть концентрация вещества А - [ А], вещества В - [В].
Как выразить формулу для расчета скорости реакции:
V = k · [ А] · [В], где k - константа Vх.р.
При увеличении концентрации веществ, изменяется и значение Vх.р. 2А + В = С
V = k · [ А]2 · [В], в 1867 году на основе этого открытия был сформулирован закон Гульдберга - Вааге:
при постоянной температуре скорость химической реакции прямопропорциональна произведению концентраций реагирующих веществ, где каждая концентрация стоит в степени, равной коэффициенту в уравнении реакции.
Например: 2NO + O2 = 2 NO2
V= k · [ NO]2 · [O2].
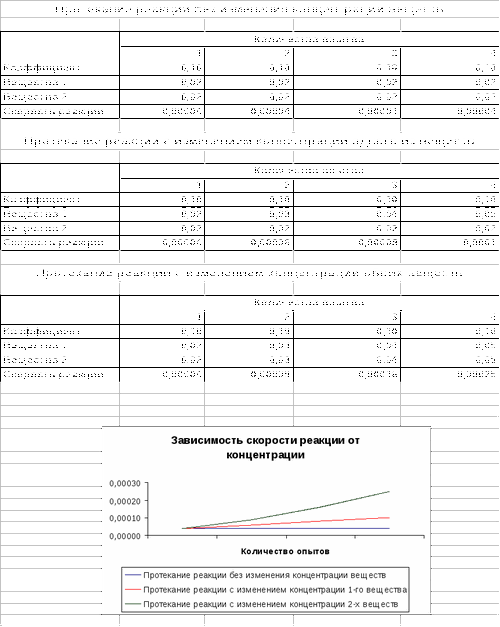
Учащиеся в течении 10 минут работают с программой Excel, выявляя закономерность «Зависимость скорости от концентрации».
В этой части урока учащиеся должны продемонстрировать знания автоматического заполнения ячеек при вводе значений и формул, используя маркер заполнения. Учащиеся анализируют данные с помощью диаграммы.
Карточка-инструкция.
-
Заполните таблицу, имея следующие данные: коэффициент данной реакции равен 0,1 и является величиной постоянной, а концентрация реагирующих веществ соответственно равна 0,02 моль/л и 0,02 моль/л.
-
Заполните таблицу, если по истечении некоторого времени концентрация одного из реагирующих веществ увеличилась на 0,01 моль/л, а второго компонента - не изменилась.
-
Заполните таблицу, если через некоторое время концентрация обоих реагирующих веществ увеличилась соответственно на 0,01 моль/л.
-
Постройте график «Зависимость скорости химической реакции от концентрации».
-
Сделайте выводы.
Слайд 9. Влияние поверхности соприкосновения.
Встречаются примеры реакций, в которых при добавлении каких-то веществ, скорость возрастает, а рассмотренные ранее факторы в этот момент не участвуют.
Вы догадались, о каких веществах идет речь? Это катализаторы.
5. Итак, последний фактор - катализатор.
С катализаторами мы встречались и раньше, вспомните примеры каталитических реакций: оксид ванадия (V) при производстве серной кислоты.
Слайд 10. действие катализаторов на реакцию.
Опыт: 2Н2О2 = 2Н2О +О2 кат МnО2 твердое вещество, гетерогенный катализ
По природе своей катализаторы различны: газообразные - NO, жидкие - серная кислота, твердые - Pt, FeO, V2O5.
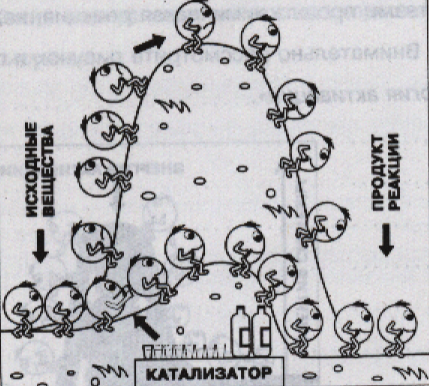
Вы никогда не задумывались, а как работает катализатор? Роль катализатора сводится к тому, что за счет образования промежуточных соединений (молекул, ионов), то есть благодаря изменению пути реакции, энергия активации может понизиться и скорость увеличится. На доске можно изобразить график.
Но всегда, если что-то ускоряет, то найдется то, что замедляет. Некоторые вещества, попав в реакционную среду обязательно замедлят её протекание. Это ингибиторы, например: уротропин замедляет взаимодействие металлов с кислотами. Где можно использовать эту способность? А вещества, содержащие хромат-ионы CrO42- замедляют коррозию металлов в растворах.
Слайд 11. Просмотр действия ингибиторов на реакцию.
Огромное значение катализа в живых системах. Большинство реакций в пищеварительной и дыхательной системах, в крови и в клетках человека идут при участи катализаторов. Биологические катализаторы называются … ферментами.
Так слюна содержит птиалин, расщепляющий крахмал до сахара. А пепсин желудка - расщепляет белки. В нашем организме около 30 000 ферментов и для каждого из них найдется соответствующая реакция.
Закрепление материала, работа в группах:
Рассчитайте Vх.р. получения боевого отравляющего вещества фосгена: СО + Cl2 = COCl2 если концентрация реагирующих веществ 0,002моль/л и 0,005 моль/л соответственно, а константа реакции k = 0,1.
V = k · [ СО] · [Cl2], V = 0,1 · 0,002 · 0,005 = 0,000001 или 1 · 10-4 моль/л
Подумайте, какие из перечисленных условий влияют на скорость реакции:
-
Реакция проводится в вытяжном шкафу - _________________, так как________________________________________________________.
-
Исходные вещества нагревают - ______________________, так как________________________________________________________.
-
Вещества предварительно измельчили в ступке - _____________, так как______________________________________________________.
-
До реакции вещества в течении трех дней хранили изолированно друг от друга - ___________, так как __________________________________________________.
Принцип (но не механизм) действия катализатора ясен из рисунка. Придумайте свой рисунок, поясняющий принцип действия ингибитора. Не забудьте сделать пояснительные подписи к рисункам.
Домашнее задание:
Стр. 132 - 139, упр. 7, 8, 9.
Рефлексия:
Скажите, какой момент урока вызвал затруднение: в выявлении проблемы или при её решении?
Сделайте резюме: я узнал…я научился… я понял.
Приложение.
Карточки выдаются для индивидуальной работы дома.

