- Учителю
- Тренажер по органической химии
Тренажер по органической химии
Алканы
(Предельные)
CnH2n+2
[sp³; 0,154нм; изомерия углеродного скелета, конформация]
П
 олучение
олучение
I.В промышленности II.В лаборатории
1)Выделение из природного Декарбоксилирование
сырья натриевых солей карбоновых
2)Гидрирование алкенов кислот
(+H2; кат.) СН3COONa+NaOH→
3) Изомеризация →Na2CO3+CH4
(450ºС, кат.)
4)карбидный (гидролиз)
Al4C3+12H2O→3CH4+4Al(OH)3
5) Синтез Вюрца
CH3I + 2Na→C2H6
C2H5I C3H8 + 2NaI
C4H10
6) Синтетический метан
-
С+ 2H2→CH4
-
Термокаталитическое восстановление
оксидов углерода
СО2+4Н2→СН4+2Н2О
СО+3Н2→СН4+Н2О
Химические свойства
1)Замещение (R∙)
а) галогенирование [F2(холод, инертный газ) ˃Cl2(hν)˃Br2(избирательно)]
Hν
CH3-CH2-CH3 + Cl2 → CH3-CH-CH3 + HCl
ǀ
Cl
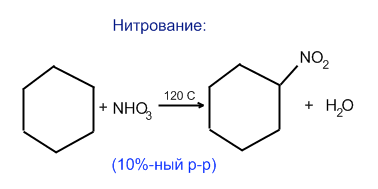
б) Нитрование (М.И.Коновалов(1889 год) HO-NO2 10% р-р)
CH4+HO-NO2→CH3NO2+H2O
2) Горение (R∙)
3)Дегидрирование(400-600ºС,кат.:Pt,Ni,Al2O3,Cr2O3)
4) Термическое расщепление (R∙)
а)крекинг(470-550ºC) б)пиролиз(1000ºС) в)Нагревание метана при 1500ºС
C16H34→C8H18+C8H16 СН4→С+Н2 2СН4→С2Н2+3Н2
5)Изомеризация(AlCl3,400ºC)
6)Ароматизация (катализатор, начиная с С6)
гексан→бензол
7)каталитическое окисление кислородом (до спиртов, альдегидов и кислот)
CH4+ [O] →CH3OH-метиловый спирт
O
ǀǀ
CH4+O2→H-C-H-формальдегид (муравьиный альдегид)
О
ǀǀ
СН4+О2→Н-С-ОН-муравьиная(метановая) кислота
8)получение синтез-Газа (800-900ºС; кат.-Ni,Mg,Al2O3)
а) СН4+Н2О→СО+Н2 б) СН4+СО2→2СО+2Н2
Применение
-
CH3Cl-хладагент
-
CHCl3-хлороформ-растворитель
-
СН4-промышленный и бытовой газ
-
Производство резины, красителей
-
Сварка металлов
-
Получение сажи
Циклоалканы СnH2n
(циклопарафины)
[sp³;изомерия размера цикла, размещения заместителей, строения заместителя]
[не все обладают предельным характером]
Получение
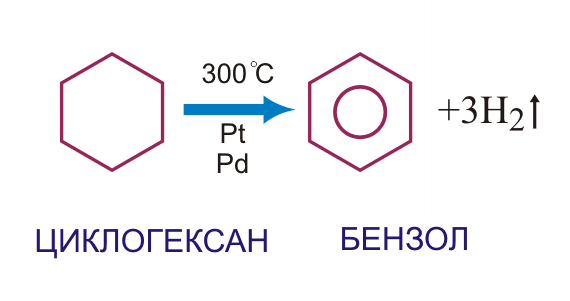
1)гидрирование бензола(а также его гомологов)
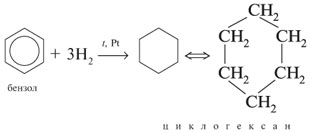
2)Дегалогенирование дигалогенпроизводных
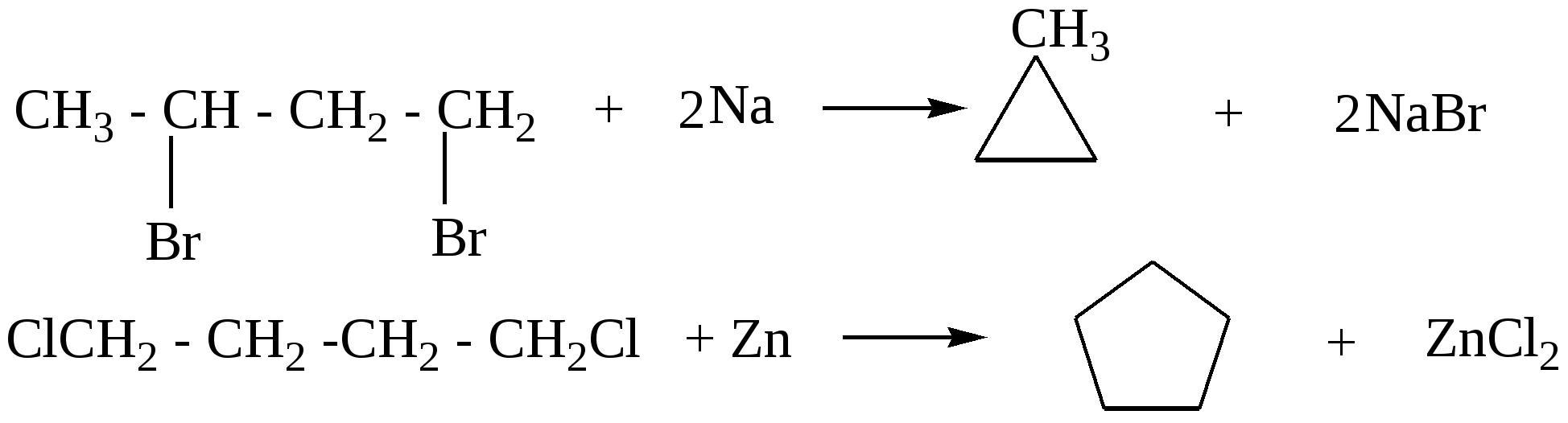
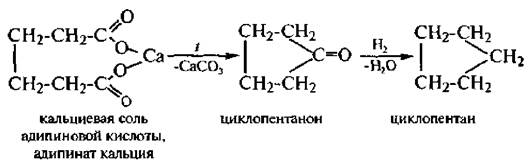
3)Пиролиз солей дикарбоновых кислот
![]()
Химические свойства
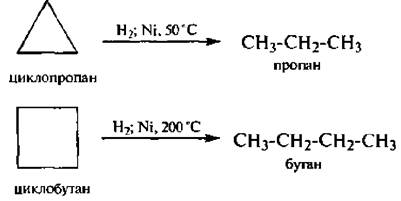
1)Гидрирование (при повышенной температуре) (+Н2)
циклопропан→пропан
2)галогенирование (бромирование) {к С3 t=50-70ºC}
{к С5 t=350ºC}
3)гидрогалогенирование
циклопропан→1-бромпропан
4)замещение с С5 и более
а) галогенирование
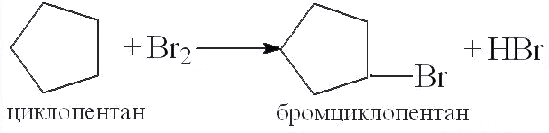
б)
5)Дегидрирование(300ºС)
С6Н12→С6Н6+3Н2↑
Применение
-
Циклопропан-наркоз
-
Получение ароматических углеводородов
Алканы
К арбидный Al4C3+H2O
арбидный Al4C3+H2O
109º28´
0,154 нм
CnH2n+2
sp³
изомерия углеродного скелета
C
 H3COONa+NaOH горение
H3COONa+NaOH горение
э
 лектролиз 1000ºС пиролиз C+H2
лектролиз 1000ºС пиролиз C+H2
C

 nH2n+H2 1500ºC крекинг C2H2+3H2
nH2n+H2 1500ºC крекинг C2H2+3H2
Н
 ефть
и прир.газ AlCl3 c C4 изомеризация
ефть
и прир.газ AlCl3 c C4 изомеризация
 Замещение (R)
Замещение (R)
C +H2 c HNO3 Коновалов
+H2 c HNO3 Коновалов
С интез Вюрца
интез Вюрца
Задания для проверки
1.Ученик дал название веществу-3-пропил пентан. Правильно ли он выполнил задание?
2.Составьте структурные формулы всех изомерных алканов:
а) молекулярная масса которых в 2,5 раза меньше молекулярной массы бромида марганца(II)
б) молекулярная масса которых равна молекулярной массе сульфида кальция
3.Напишите структурную формулу 2,4,5,5-тетраметил-3-этилоктана. Укажите все вторичные, третичные и четвертичные атомы углерода
4.Природный газ одного из месторождений содержит 92% метана,4% этана,1% пропана,2% углекислого газа и 1% азота. Какой объём кислорода потребуется для сжигания 200 л этого газа и какой объём воздуха?(406 л кислорода,1933 л воздуха)
5.Какая масса сажи образуется при термическом разложении этана массой 90 г, если массовая доля выхода сажи составляет 80%?(57,6 г)
6.При термическом разложении метана количеством вещества 14 моль получен ацетилен, объем которого 120,95 л. Вычислите объёмную долю выхода ацетилена (77,14%)
7.При нитровании гексана азотной кислотой при нагревании образуется нитрогексан и вода. Составьте уравнение этой реакции и рассчитайте, какую массу нитрогексана можно получить при нагревании гексана массой 43 г, если массовая доля выхода продукта равна 80%(52,4 г)
8.Какой объём метана можно получить при взаимодействии ацетата натрия массой 41 г с гидроксидом натрия массой 30 г(11,2 л)
9.При взаимодействии карбида алюминия с водой образуется газ (какой?), объёмом 11,2 л. Сколько карбида алюминия необходимо?(24 г)
10.В присутствии катализаторов(платины, палладия)водород присоединяется к циклопропану с образованием пропана. Составьте уравнение реакции и рассчитайте, какой объём пропана можно получить из 21 г циклопропана,приняв,что объёмная доля выхода пропана составляет 95%(10,64 л)
11.Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 81,8%.Относительная плотность вещества по азоту равна 1,57 (пропан)
12.Элементный состав фторпроизводного предельного углеводорода, имеющего плотность по водороду 33,составляет 36,36% С и 57,57% F.Определите молекулярную формулу этого соединения(C2H4F2)
13.При сжигании углеводорода массой 3,2 г образовалось 9,9 г оксида углерода (IV) и 4,5 г воды. Относительная плотность паров этого вещества по водороду равна 64.Найдите формулу(С9Н20)
14.Найдите молекулярную формулу гомолога метана, если известно, что масса 5,6 л этого вещества составляет 18 г (C5H12)
15.Какая масса воды образуется при сгорании в кислороде пяти парафиновых свечей массой 100 г каждая, если массовая доля углерода в образовавшемся парафине составляет 80%(900 г)
*На полное сгорание алкана 0,1 моль неизвестного строения израсходовано 11,2 л кислорода. Какова структурная формула алкана?
Допишите реакции до конца
hν
-
C
 H3-CH2-CH3+Cl2
H3-CH2-CH3+Cl2
AlCl3
-
C
 H3-(CH2)3-CH3
H3-(CH2)3-CH3
400-600ºC, Pt, Ni, Al2O3, Cr2O3
-
C
 H3-CH3
H3-CH3
Кат-р.
-
С
 Н4+О2
Н4+О2
Кат-р.,Р,480ºС
-
2
 СН4+О2
СН4+О2
Fe2O3,450ºC
-
C
 H4+H2O
H4+H2O
400-500ºC
-
C
 nH2n+2
nH2n+2
-
C
 H3I + 2Na
H3I + 2Na
C2H5I
Этан может вступать в реакции
1)замещения
2

 )присоединения
)присоединения
3)изомеризации
4)разложения
5)горения
6)полимеризации
Для проведения синтеза Вюрца взяли смесь двух галогенпроизводных C2H5I и CH3-CHI--CH3.Напишите уравнения реакций, которые будут при этом протекать и назовите вещества.
Цепочка
C


 H3Br
C2H6 H2 CH4 CO2
H3Br
C2H6 H2 CH4 CO2


 Бутан
изобутан 2 хлор-2-метилпропан
Бутан
изобутан 2 хлор-2-метилпропан
Алкены (этиленовые)
CnH2n
[sp²;0,132нм;изомерия угл.скелета,положения = связи,геометрическая,межклассовая]
Получение
1)крекинг нефтепродуктов (см.алканы)
2)дегидрирование алканов (400-600°С;кат.-Pt,Ni,Al2O3,Cr2O3)
3)дегидратация спиртов(внутримолекулярная, при t > 140°C)
![]()
4)дегидрогалогенирование галогеналканов (в спиртовом р-ре щёлочи)
Правило Зайцева
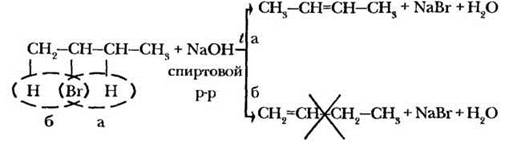
5)дегалогенирование дигалогеналканов(атомы галогенов расположены у соседних атомов С)
Н 2С-СН2 + Zn ZnCl2+H2C=CH2
2С-СН2 + Zn ZnCl2+H2C=CH2
| |
Cl Cl
6) Гидрирование алкинов (Ni,t)
Х
 имические свойства(Se)
имические свойства(Se)
I Присоединение II Окисление
1)гидрирование(Pt,Ni,Pd)+H2 1)горят коптящим пламенем
2) Галогенирование (Br2) 2)с KMnO4:
3) Гидрогалогенирование+НГал a)нейтральная или слабощелочная
4)гидратация + НОН (сильная кислота) среда-диолы
[искл.: если ввести галоген] 3СН2=СН2+2KMnO4+4H2O→
5)Полимеризация →3H2C-CH2 + 2MnO2↓+2KOH
nCH2=CH2→ (-СН2-СН2-) n полиэтилен | |
nCH2=CH→ (-СН2-СН-) n полипропилен OH OH
| | б) кислая среда(глубокое окисление)
СН3 СН3 5H3C-CH=CH-CH3+8KMnO4+
+H2SO4→10CH3-COOH+4K2SO4
+8MnSO4+12H2O
*Если двойная связь в конце мо-
лекулы,то 1 продукт-муравьиная
кислота
CH2=CH-CH2-CH3+2KMnO4+
+3H2SO4→CH3-CH2-COOH+CO2
+2MnSO4+K2SO4+4H2O
*Если при двойной связи 2 заместителя,
то 1 продукт-кетон
5(СН3)2С=СН-СН3+6KMnO4+
+9H2SO4→5 (CH3)2C=O+
+5CH3COOH+6MnSO4+3K2SO4
+9H2O
в)CH3-CH2-CH=CH-CH3+[O]→
→CH3-CH2-COOH+CH3-COOH
Ag
г)2CH2=CH2+O2 → 2CH2-CH2
\ O /
Cu
2СН2=СН2+О2→2CH3-COH
Алкадиены
СnH2n-2
C=C=C С=С-С=С С=С-С-С=С
кумулированные сопряжённые изолированные
(неустойчивые) длина сигма связи=0,146нм
длина двойной связи=0,137нм
Получение
1)дегидрирование алкенов,алканов (Al2O3,Cr2O3,MgO,ZnO) -H2
2)реакция Лебедева-из этанола
Al2O3, ZnO, t°
2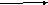 С2Н5ОН H2C=CH-CH=CH2+2H2O+H2↑
С2Н5ОН H2C=CH-CH=CH2+2H2O+H2↑
3) Дегидрогалогенирование дигалогеналканов
СH2-CH2-CH2-CH2 + NaOH(спирт.р-р)→2NaBr+2H2O+H2C=CH-CH=CH2
| |
Br Br
4)Дегидратация 2-х атомных спиртов
H2SO4,t°
H 2C-CH2-CH2-CH2 H2C=CH-CH=CH2+2H2O
2C-CH2-CH2-CH2 H2C=CH-CH=CH2+2H2O
| |
OH OH
Химические свойства
(Н2,Гал2,НГал)
1)Галогенирование зависит от условий реакции
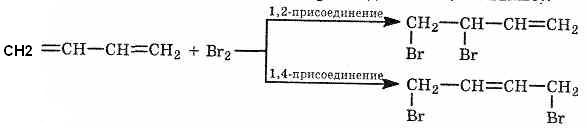
*При избытке брома образуется тетрабромид(1,2,3,4-тетрабромбутан)
2)Полимеризация(получение каучуков)
nH2C=CH-CH=CH2→ (…-CH2-CH=CH-CH2-…) n
3)Диеновый синтез(реакция Дильса-Альтера)
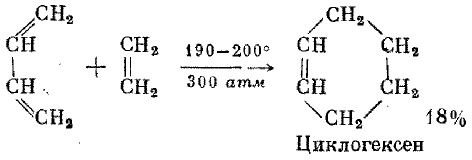
К
 аучук
аучук
Синтетический Натуральный
(бутадиеновый) (изопреновый)
nH2C=CH-CH=CH2→ nH2C=C-CH2=CH2→
(Бутадиен, дивинил) |
→ (-H2C-CH=CH-CH2-) n CH3
→ (-H2C-C=CH-CH2-) n
|
CH3
Алкены (Этиленовые)
C
CnH2n; sp²; 120°
Изомерия угл. скелета,
положения двойной связи,
геометрическая (цис-транс)
 2H6(-H2) R (-CH2-CH2)n
2H6(-H2) R (-CH2-CH2)n
C
 2H5OH
H2SO4 O2 оксид этилена
2H5OH
H2SO4 O2 оксид этилена
п риродный газ Н2
риродный газ Н2
м
 оноГпроизводные
оноГпроизводные
(NaOH спирт.р-р) Гал.,НГал


 KMnO4 (H2O)
KMnO4 (H2O)
H2C-CH2+KOH+MnO2
| |
OH OH
Задания для проверки
1.Напишите структурные формулы всех изомерных алкенов,молекулярная масса которых равна молекулярной массе гидроксида калия
2.Для в-ва, имеющего строение CH2=CH-CH2-CH3 составьте структурнурные формулы
а) изомера положения двойной связи
б) гомолога
в) изомера углеродной цепи
г) изомера из другого класса
Назовите эти вещества
3.Рассчитайте объём этилена, который можно получить из 500 мл этилового спирта (p=0,8г/мл), содержащего 96% этанола. Объемная доля выхода этилена составляет 80%(149,6 л)
4.Рассчитайте объём воздуха, который потребуется для полного сжигания смеси, состоящей из 6 л этилена и 4 л пропилена (171,4 л)
5.Сколько по объёму этилена потребуется для получения 126 кг оксида этилена, если производственные потери этилена составляют 10%? (74,5 м³)
6.Рассчитайте объём водорода, который потребуется для каталитического гидрирования 40 г смеси гексена и пентена. Массовая доля гексена в смеси составляет 42% (11,2 л)
7.Смесь этана и этилена, объемом 0,8 л обесцветила 200 г бромной воды с массовой долей брома 1,6% Определите объемную долю (в %) каждого газа в смеси.(56% этена и 44% этана)
8.Неизвестный алкен, массой 7 г присоединяет бромоводород, объём которого равен объёму метана, массой 2 г. Найдите молекулярную формулу алкена и напишите все возможные структурные формулы его изомеров.(бутен)
9. Алкен присоединяет 24,3 г бромоводорода. При взаимодействии продукта с водным раствором КОН получили с выходом 60% 10,8 г спирта. Какова формула алкена? (пропен)
10.Неизвестный алкен присоединяет 3,36 л хлора. При взаимодействии хлорпроизводного с водным раствором гидроксида натрия образовался двухатомный спирт, массой 9,12 г с выходом реакции 80%.Найдите формулу алкена.(пропен)
11.Найдите молекулярную формулу алкена,7 г которого присоединяют 16 г брома. (пентен)
12.Найдите формулу алкена, если известно, что массовая доля водорода в нем равна 14,3%;массовая доля углерода равна 85,7%;относительная плотность по водороду равна 21.(пропен)
13.При сгорании 11,2 г алкена образовалось 35,2 г углекислого газа и 14,4 г воды. Найдите формулу этого алкена, если известно, что относительная плотность его по воздуху равна 1,93(бутен)
14.Найдите формулу алкена,45,5 г которого присоединяют 14,56 л водорода, если известно, что он содержит двойную связь у второго атома углерода (пентен-2)
15.Диеновый углеводород массой 5,4 г полностью прореагировал с 4,48 л хлороводорода. Найдите молекулярную формулу углеводорода.
16.Рассчитайте массу дивинила, которую можно получить из 3 л этилового спирта (p=0,8 г/мл), содержащего 96% этанола. Массовая доля выхода дивинила составляет 75% (1014 г)
17.Рассчитайте объём воздуха, который расходуется при сжигании 16 л дивинила. Объемная доля кислорода в воздухе составляет 21% (419л)
18.Из этилового спирта массой 18,4 г по методу Лебедева получили 4 л бутадиена-1,3.Рассчитайте объёмную долю выхода продукта (89,3%)
*Каким образом можно узнать,содержатся ли в газе,используемом в быту алкены?
Допишите реакции до конца
1 ) n CH2=C-CH2=CH2
) n CH2=C-CH2=CH2
 2) n CH3-CH=CH2
2) n CH3-CH=CH2
|
CH3
3 ) CH2-CH2 + Zn
) CH2-CH2 + Zn
4 ) CH2=CH-CH=CH2 + HBr
) CH2=CH-CH=CH2 + HBr
| |
Cl Cl
5 ) CH2=CH-CH=CH2 + Br2
) CH2=CH-CH=CH2 + Br2
Решите цепочки
1) C3H8→CH3-CH-CH3→CH3-CH=CH2→CH3-CH-CH3→CH3-CH=CH2→C3H8
| |
Br OH
2) C2H6→C2H5Br→C2H4→C2H5OH→C2H5Br→C2H4→C2H4Br2
Алкины (ацетиленовые)
CnH2n-2
[sp;0,120 нм; изомерия угл. скелета, положения тройной связи, межклассовая,
специфический запах, лучше растворяются в воде, чем алканы и алкены]
Получение
1.Карбидный способ лабораторный (гидролиз карбида кальция)
CaCO3→CaO+CO2
CaO+3C→CaC2+CO
CaC2+2H2O→Ca(OH)2+C2H2↑
2.Метановый(пиролиз метана при t°=1500°C)
 1500°C
1500°C
2CH4 C2H2↑+3H2↑(эндотермическая реакция)
3.Дегидрирование алкенов и алканов(-Н2)
С2Н6→С2Н4→С2Н2
4.Дегидрогалогенирование дигалогеналканов
а) Атомы галогенов находятся у разных атомов дигалогеналканов
R-CH-CH2 + 2NaOH (спирт.р-р.)
 | | 2NaBr+2H2O+R-C≡CH
| | 2NaBr+2H2O+R-C≡CH
Br Br
б) Атомы галогенов находятся у одного атома дигалогеналканов
Cl
| C2H5OH
 CH3 -CH + 2NaOH 2NaCl+2H2O+HC≡CH
CH3 -CH + 2NaOH 2NaCl+2H2O+HC≡CH
|
Cl
5)Из ацетилена можно получать алкины с более длинной цепью
HC≡CH+NaNH2→HC≡CNa + NH3↑
HC≡CNa + R-Br→NaBr + HC≡C-R
Химические свойства
I Присоединение (Н2, Гал, НГал, Н2О)-электрофильное
1)Гидрирование (+H2;Pt,Ni,Pd)-алкены(1 моль H2)-алканы(2 моль H2)
2) Галогенирование (+2Cl2, 2Br2)-тетрагалогеналканы
3)Гидрогалогенирование (+НГал-правило Марковникова) - образуется дигалогенпроизводное, где оба галогена у одного углерода
4)гидратация(+Н2О-реакция Кучерова,кислая среда, соли ртути)
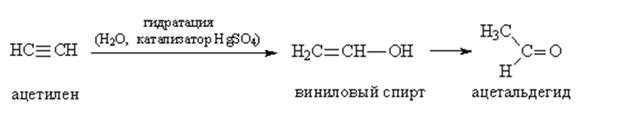
![]()
II Полимеризация
1)линейная-димеризация 2)Циклическая-тримеризация (Сакт.,400°С)
2С2Н2→НС≡С-СН=СН2 3С2Н2→С6Н6(бензол)
(+HCl→хлоропрен→хлоропрен. каучук)
III Окисление
1)горение
2)р-р KMnO4-оксалаты
Если окисляется ацетилен, то образуется щавелевая кислота, которая затем разлагается на муравьиную кислоту и углекислый газ)
IV Замещение (у sp-гибридного атома углерода)-металлические производные
а)с сильными основаниями амид натрия(см.в получение 5 способ)
б)аммиачный р-р нитрата серебра или хлорида меди
взаимодействие идёт только тогда, когда тройная связь в конце
молекулы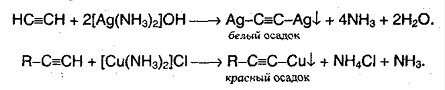
соли взрывоопасны
Применение:альдегиды,кетоны,растворители,синтетические каучуки,полимеры,ацетилен-горючее(2600кДж)
Алкины
CnH2n-2
sp
угл. скелета, положения связи, межклассовая +2Br2
+2Br2
C
 aC2+H2O +2H2
aC2+H2O +2H2
 HCl
HCl
2
 CH4
(1500°C) H2O Hg²+ (Кучеров)
CH4
(1500°C) H2O Hg²+ (Кучеров)
 KMnO4
KMnO4
Д игалогенпр.+NaOH (спирт.р-р) Ag2O
(Cu,Na) Ag-C≡C-Ag
игалогенпр.+NaOH (спирт.р-р) Ag2O
(Cu,Na) Ag-C≡C-Ag
 Тримеризация C6H6
Тримеризация C6H6

 Димеризация
Димеризация
Задания для проверки
1.Напишите структурные формулы соединений
а)4-метилпентин-2
б) бутин-2
в)3,3-диметилбутин-1
г)2,5-диметилгексин-3
2.Составьте структурные формулы трёх алкинов, которые изомерны 2-метилбутадиену-1,3.Дайте им названия
3.Рассчитайте объём ацетилена, который можно получить из 150 г карбида кальция, содержащего 24% примесей (39,9 л)
4.Рассчитайте объём ацетилена, который можно получить из 1 м³ природного газа, содержащего 92% метана. Объемная доля выхода ацетилена при пиролизе метана составляет 9% (41,4 л)
5.Алкин массой 13 г занимает объём 11,2 л. Массовая доля водорода в нём составляет 7,7%.Найдите его молекулярную формулу (ацетилен)
6.При сжигании алкина массой 5,2 г выделилось 8,96 л углекислого газа и 3,6 г воды, относительная плотность вещества по водороду равна 13.Найдите молекулярную формулу алкина (С2Н2)
7.Рассчитайте массу 1,1,2,2 тетрахлорэтана, который образуется при взаимодействии ацетилена объёмом 6 л и хлора объёмом 15 л (45 г)
8.Ацетилен,полученный из 200 г карбида кальция с массовой долей примесей 20%,вовлекли в реакцию гидратации. Какая масса уксусного альдегида образовалась, если массовая доля выхода ацетилена составляет 75% от теоретического (82,5 г)
9.Ацетиленовый углеводород может максимально присоединить 80 г брома с образованием продукта реакции массой 97 г. Установите молекулярную формулу этого углеводорода (С5Н8)
10.Определите молекулярную формулу ацетиленового углеводорода, если молярная масса продукта его реакции с избытком бромоводорода в 4 раза больше, чем молярная масса исходного углеводорода (С4Н6)
11.При сжигании 2,48 г смеси пропана,пропена и пропина образовалось 4,03 г углекислого газа. Сколько граммов воды получилось при этом? (2,89)
12.При пропускании смеси этилена и ацетилена в раствор брома образовалось 12,56 г смеси дибромэтана и тетрабромэтана ,а при пропускании такого же количества этой смеси в аммиачный раствор оксида серебра образовалось 4,8 г осадка. Определите массовую долю этилена в его смеси с ацетиленом (45%)
13.Термохимическое уравнение реакции горения ацетилена:
2C2H2+5O2=4CO2+2H2O+2610 кДж
Рассчитайте количество теплоты, которое выделится при сгорании 5,6 л ацетилена (326,25кДж)
14.Рассчитайте массу винилбромида, которая потребуется, чтобы действием на него спиртового раствора щёлочи получить 4,48 л ацетилена (21,4г)
15.Какой углеводород получится, если на 3,3-диметилбутен-1 подействовать бромом, а затем избытком спиртового раствора щёлочи при нагревании?
16.Из 11,2 л ацетилена в лаборатории было получено 8 г бензола. Какова массовая доля выхода бензола от теоретического (61,54%)
17.2,8 л смеси алкана,алкина и алкена,содержащих одинаковое число атомов углерода, могут прореагировать с 17,4 г оксида серебра(аммиачного раствора) или присоединить 28 г брома. Определить качественный и количественный состав (в % по объёму) исходной смеси углеводородов (20% С2Н6,20%С2Н4,60%С2Н2)
18.Ацетиленовый углеводород, содержащий пять углеродных атомов в главной цепи, присоединяет 80 г брома. При этом образуется 104 г продукта реакции. Определите строение ацетиленового углеводорода, если известно, что он не вступает в реакцию с аммиачным раствором оксида серебра.(4,4-диметилпентин-2)
*При пропускании смеси этана и ацетилена через склянку с бромной водой масса склянки увеличилась на 1,3 г.При полном сгорании исходной смеси углеводородов выделилось 14 л оксида углерода (IV).Определите состав исходной смеси углеводородов (в% по объёму)(1,12 л С2Н2;5,88 л этана)
*Какую массу брома может присоединить смесь этилена, ацетилена и метана(общий объём 5 л),содержащая 44,8%этилена и 32,8% метана(по объёму) (32 г брома)
*Как химическим путём выделить бутин-2 из смеси его с бутином-1?Напишите уравнение соответствующей реакции.
*Рассчитайте массы 10 л пентина-2,10 л бутина-1 и 10 л гексина-3.
*К 11,2 л бесцветного газа, полученного при действии воды на карбид кальция, присоединили хлороводород,образовавшийся при действии концентрированной серной кислоты на 2,925 г поваренной соли. Продукт присоединения хлороводорода полимеризовался с образованием 2,2 г полимера. Какой полимер был получен? Каков выход (в % от теоретического) при превращении мономера в полимер? Какая масса карбида кальция потребовалась? (3,2 г карбида кальция;70%)
Цепочки
H2 (2 моль), Pt Cl, hv KOH (спирт.р-р)
С

 3Н4 А
Б В
3Н4 А
Б В
![]()
H2O Сакт.
C

 aC2 A
CuCl2 Б
aC2 A
CuCl2 Б
В

CH≡C-CH=CH2
Арены
CnH2n-6
[sp²:0,139 нм]
![]()
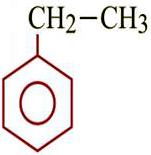
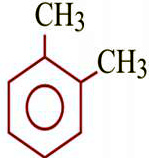
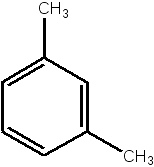
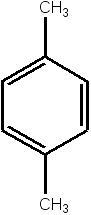
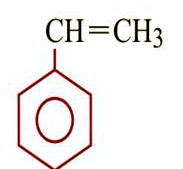
Бензол толуол этилбензол орто-ксилол мета-ксилол пара-ксилол стирол
(1,2) (1,3) (1,4) (винилбензол)
Получение
1.Нефть и каменноугольная смола
2.Дегидрирование циклогексана 4.Тримеризация ацетилена
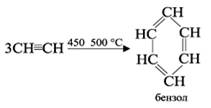
3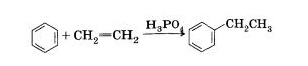 .ароматизация алканов
5.Алкилирование (дегидроциклизация)
.ароматизация алканов
5.Алкилирование (дегидроциклизация)
(способ Б.А.Казанского и А.Ф.Платэ) 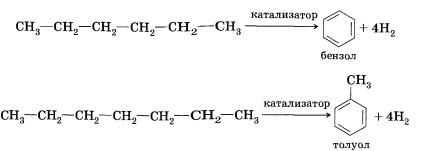
![]()
6.Синтез Вюрца-Фиттига
![]()
Химические свойства
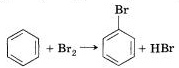
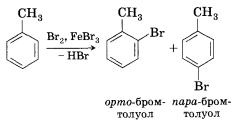
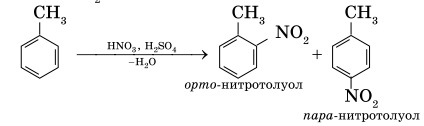
Бензол Гомологи(легче)
Замещение
а)бромирование а)бромирование
б)нитрование б)нитрование
![]()
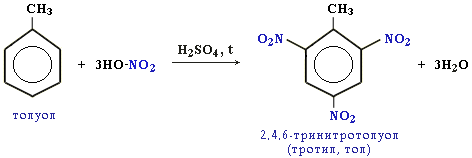
Присоединение
а![]()
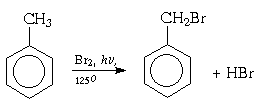 )хлорирование
)хлорирование
Окисление
![]()
О кисление
кисление
Только гомологи!
Задания для проверки
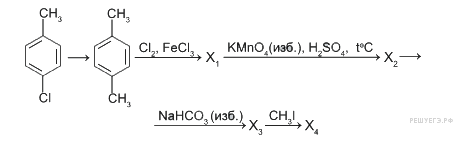
1.Сколько изомерных гомологов бензола может отвечать формуле С9Н12?Напишите структурные формулы изомеров и назовите их (8 изомеров)
2.Из ацетилена объёмом 3,36 л получили бензол объёмом 2,5 мл. Определите выход продукта, если плотность бензола равна 0,88 г/мл (56,4%)
3.Бензол, полученный дегидрированием циклогексана объёмом 151 мл и плотностью 0,779 г/мл, подвергли хлорированию при освещении. Образовалось хлорпроизводное массой 300 г. Определите выход продукта реакции(73,6%)
4.Какой объём водорода образуется при циклизации и дегидрировании н-гексана объёмом 200 мл и плотностью 0,66 г/мл? Реакция протекает с выходом реакции 65%(89,4 л)
5.При дегидрировании этилбензола массой 4,24 г получили стирол. Выход продукта реакции составил 75%.Какую массу раствора брома в тетрахлориде углерода может обесцветить полученный стирол, если массовая доля брома в растворе составляет 4%(120г)
6.Какие ароматические углеводороды могут образовываться при дегидроциклизации Н-октана? Напишите уравнения соответствующих реакций?
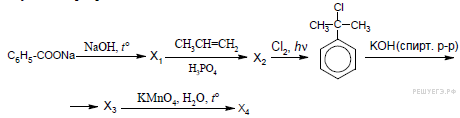
7.Напишите уравнение реакции, с помощью которых можно получить стирол, используя только неорганические соединения.
8.Как получают гомологи бензола? Составьте уравнения реакций получения этилбензола и пропилбензола.
9.Рассчитайте массу бромбензола, который можно получить из 39 г бензола. Выход бромбензола составляет 64%(50,24 г)
10.При бромировании толуола (при нагревании без катализатора на свету) образуется бромистый бензил C6H5-CH2Br и выделяется бромистый водород. Составьте уравнение этой реакции и рассчитайте массу бромистого бензила, образовавшегося при бромировании 138 г толуола. Массовая доля выхода продукта составляет 85%(218 г)
11.При хлорировании толуола в присутствии хлорида железа (III) получено 2 соединения с молекулярной формулой C7H7Cl.Хлорирование толуола на свету приводит также к соединению с молекулярной формулой C7H7Cl.Что это за соединение? Напишите уравнения соответствующих реакций.
12.При хлорировании бензола (в присутствии специального катализатора) можно все атомы водорода в нем заместить на атомы галогена. Составьте уравнение этой реакции и рассчитайте массовую долю хлора в образующемся веществе.
13.Определите массу дихромата калия, необходимого для получения газа, который превратит 19,5 г бензола в гексахлоран.
14.Рассчитайте массу бензола, который потребуется для получения нитробензола массой 393,6 г , если массовая доля его выхода составляет 80% (312 г)
15.Соединение А состава С7Н8 нитруется азотной кислотой в присутствии серной кислоты с образованием смеси соединения Б и В, имеющих общую формулу C7H7NO2.Окисление соединения А перманганатом калия в кислой среде приводит к соединению Г формулы С7Н6О2.Назовите соединения А,Б,В,Г.Напишите уравнения соответствующих реакций.
16.Сколько литров водорода могут присоединить в присутствии катализатора 100 г смеси, состоящей из 25 % бензола, 15% толуола ,25% гексена и 35% гексана?(48,6 л)
17.В реакции циклизации с одновременным дегидрированием гептана (образуется толуол) выделилось столько водорода, что его хватило на гидрирование 168 г смеси изомерных гексенов.Определите массу вступившего в первую реакцию алкана и объём (в мл) полученного арена (плотность 0,867 г/мл)
18.Рассчитайте объём воздуха, который потребуется для полного сгорания 1,3-диметилбензола массой 10,6 г.Объёмная доля кислорода в воздухе составляет 21% (11,2л)
19.Проведено полное сжигание на воздухе 5,24 кг смеси этанола и бензола (мольная доля бензола 20%)Найдите необходимый для этого объём (м³) воздуха (объёмная доля кислорода 20,94%)
20.Установите молекулярную формулу органического соединения, плотность паров которого по воздуху равна 2,69,если при сжигании 5,85 г этого вещества в избытке кислорода образовалось 19,8 г углекислого газа и 0,225 моль воды (бензол)
21.Арен,имеющий 8 атомов углерода в молекуле, при обработке бромной водой образует дибромпроизводное,плотность паров которого по воздуху составляет 9,103.Установите структурную формулу арена и его название(винилбензол)
22.При сжигании гомолога бензола массой 0,92 г в кислороде получили углекислый газ, который пропустили через избыток раствора гидроксида кальция. При этом образовался осадок массой 7 г. Определите формулу углеводорода и назовите его (С7Н8)
23.Ароматический углеводород, являющийся гомологом бензола, массой 5,3 г сожгли, получив углекислый газ объёмом 8,96 л. Определите формулу углеводорода. Сколько изомеров может иметь этот углеводород среди гомологов бензола. Напишите структурные формулы этих изомеров (С8Н10;4 изомерных гомолога)
24.Смесь бензола с циклогексеном массой 4,39 г обесцвечивает бромную воду массой 125 г с массовой долей брома 3,2%Какая масса воды образуется при сжигании в кислороде той же смеси массой 10 г (9,09 г)
25.При помощи каких реакций можно обнаружить в органических веществах наличие атомов галогенов (хлора, брома, иода) и наличие кратных связей. Приведите конкретные примеры.
26.Какие из следующих веществ: С2Н6,С3Н4,С4Н8,С5Н12-подвергаются гидрированию? Напишите уравнения соответствующих реакций.
Цепочки
нитробензол
↑
метан→ацетилен→бензол→циклогексан
↓
![]() Бромбензол
Бромбензол