- Учителю
- Конспект урока по химии для 8 класса « классы неорганических соединений»
Конспект урока по химии для 8 класса « классы неорганических соединений»
Тема «Классы неорганических соединений».
Цели урока.
1. Обобщить и систематизировать знания, полученные при изучении классов неорганических соединений; установить прямые и обратные связи (генетические) между классами веществ, проверить умения учащихся составлять уравнения химических реакций с участием представителей классов неорганических соединений;
2. Развивать логическое мышление, память, внимание, умение сравнивать и анализировать, умения применять полученные знания и навыки при выполнении практических упражнений;
3. Воспитывать трудолюбие, целеустремленность, культуру речи и общения.
Задачи урока.
1. создать психологически благоприятный микроклимат, подготовить учащихся к работе на уроке;
2. глубоко и всесторонне проверить знания учащихся, выявив причины появления обнаруженных пробелов знаниях и умениях;
3. установить, осмыслили ли учащиеся связи и отношения фактов, содержание новых понятий и закономерностей.
Формы работы: коллективно - групповая, парная, индивидуальная, дифференцированная.
Тип урока: обобщение и систематизация знаний.
Оборудование: Таблица растворимости, раздаточный материал, пробирки, образцы веществ, кроссворд
Реактивы: раствор соляной кислоты и гидроксида натрия, пипетка, универсальный индикатор.
Ход урока.
I. Организационный момент.
Приветствие, проверка посещаемости, готовность к уроку.
II. Актуализация знаний.
«Сами трудясь, вы многое сделаете для себя и для близких, а если при труде успеха не будет, будет неудача, не беда - попробуйте ещё» Д.И. Менделеев
Вступительное слово учителя.
Добрый день! Ребята, мы закончили изучение темы «Классы неорганических соединений». Сегодня на уроке нам предстоит закрепить знания, показать свои умения в определении класса веществ, названии формул веществ, написании уравнений реакций.
Девизом нашей совместной работы на уроке послужат следующие слова.
«…Мы будем работать по одному, в парах и группах.
Мы будем доказывать свою точку зрения.
Но мы не будем забывать, что могут быть и другие точки зрения.
Мы будем помнить, что «терпение - это ключ, открывающий все двери»
III. Обобщение, систематизация
1. Проверка знаний символов химических элементов.
Химические элементы…
Они основа вещества.
Весь мир из них на 100 %
Вплоть до живого существа,
Всё состоит из элементов,
Всё то, что окружает нас:
Вода, духи, стекло, пигменты,
И воздух, и угарный газ.
- Почему символы обозначены разным цветом?
(металлы и неметаллы) Составление схемы.
2. Химический диктант.
(один ученик записывает формулы веществ на обратной стороне доски, остальные - в тетрадях). CaO, CO2 , Mg, C, H2CO3, Ca, NaCl, Ca(OH)2, NaOH, CaCO3, H2SO4.
Al(OH)3, NaOH, HCl,HNO3. Fe2O3, MgCl2, ZnSO4, MgO, Al2S3, CuO, H3PO4, CaSiO3, Cr(OH)3, SO3, Mg (OH)2. S
Проверяем правильность написания химических формул.
3. Индивидуальные задания: Распределить данные вещества по классам.
1 учащийся - учащиеся выписывают формулы оксидов, называют их и дают им определение
Шарада (составить слово по слогам).
«Мы первым слогом позовём кота,
Вторым измерим толщу вод,
Союз как третий подойдёт,
А целым станет…». (Кислота)
2 учащийся - учащиеся выписывают формулы кислот, дают им названия, Т. Б. при работе с кислотами.
«Нас вы в руки не берите,
И в глаза не попадите,
А к кислотам добавляйте,
Соль и воду получайте»
3 учащийся - учащиеся выписывают формулы оснований, дают им названия и рассказывают о классификации
С М - единица, с Б - я в больнице,
С Р - я на сцене, а с С - на столе.
Кто мы такие? Скажите - ка, мне!
4 учащийся - учащиеся выписывают формулы солей, дают им названия и делают краткое сообщение о свойствах и применении солей (например хлорида натрия).
4. «Третий лишний».
а) CaO, NaCl, CO2 а) CO2, K2SO3, SO2
б) K2CO3, HCl, H2SO4 б) BaSO4, NaCl, CaCO3
в) Na2SO4, HNO3, BaCl2 в) RbOH, ZnCl2, LiOH
г) NaOH, CO2, Ca(OH)2 г) Fe(OH)2, KOH, Cu(OH)2
5. «Блиц - опрос»:
-
Общее название солей азотной кислоты.
-
Название оксида водорода.
-
Формула серной кислоты.
-
Валентность натрия.
-
Какой состав соляной кислоты?
-
Валентность кальция.
-
Соли угольной кислоты.
-
Химическая формула воды.
-
Валентность водорода.
-
Формула азотной кислоты.
-
Соли соляной кислоты.
-
Техническое название оксида кальция.
-
Формула снега.
-
Какой газ выделяется при дыхании? Его химическая формула.
-
Соли серной кислоты.
-
Формула гидроксида магния.
-
Валентность железа в соединениях. Создание проблемной ситуации.
«Химические превращения, химические реакции есть главный предмет химии» Н.Н. Семёнов
6. Задание для всего класса: 1. Из веществ, формулы которых были предложены на химическом диктанте, выберите те, которые можно объединить в две группы (варианты будут различные). Остановимся на том варианте, где учащиеся увидят формулы веществ, содержащих один и тот же элемент. 2. Попробуйте распределить их в два ряда по усложнению состава, начиная с простого вещества. Получили две цепи: Учитель: в каждой цепи есть общее - это химические элементы - Ca, Mg и S, они переходят от одного вещества к другому (как бы по наследству). Вопрос: как в биологии называется носитель наследственной информации? Ген. Как вы думаете, какой элемент будет являться «геном» для данной цепи. Как называются эти цепи? (генетическими) Учащиеся у доски составляют генетический ряд и уравнения реакций по генетическому ряду, называя полученные вещества, указывая тип реакции и расставляя коэффициенты. Сильные ученики на месте пишут уравнения реакций по всем трем рядам.
7. Эксперимент.
Один ученик у доски доказывает наличие кислоты и основания и протекание между ними реакции нейтрализации.
8. Решение задач.
Определите массу соли, образующуюся при нейтрализации раствора гидроксида кальция раствором серной кислоты массой 9,8 грамм.(13,6г)
Для сильных учащихся предложить еще 1-2 задачи. «Счастливый билет»
В конвертах Вы получаете задание: составить условие задачи и решить ее.
1) Mg + H2SO4 = MgSO4 + H2
Дано:
m (Mg ) =12г
Найти: m (MgSO4)
Ответ: m (MgSO4) = 60 г.
2) 40г. x моль
CuO + H2SO4 = CuSO4 + H2O
Ответ: 0,5 моль
9. Творческое задание 1 (Фронтальная работа с классом).
Проблемная ситуация. Можно ли составить «обратный» генетический ряд. Как вы думаете, с какого класса веществ нужно начать этот ряд? (варианты могут быть разные).
Выбираем соль (акцентируем внимание на том, чтобы растворимая соль была представлена металлом, гидроксид которого не растворяется в воде) или нерастворимое основание. Например: 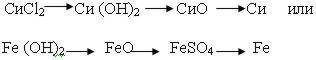
Составляем уравнения реакций для данных цепей, определяем типы реакций, называем вещества, определяем классы неорганических соединений.
IV. Подведение итогов урока. Рефлексия. Домашнее задание
Как бы вы, продолжили фразу, чтобы прозвучали ответы на постав-
ленные проблемные вопросы?
Сегодня на уроке…
Теперь я знаю…
Мне на уроке…
Делают самостоятельно вывод.
«Существует ряд генетических связей между отдельными классами неорганических соединений. Это доказывает прямую и обратную связь между классами веществ»
Кроссворд
1. Сложные вещества, состоящие из атомов металлов и гидроксогрупп
2. Единица измерения массовой доли растворённого вещества
3. Первый пункт в условии задачи
4. Хлорид натрия как класс соединений
4. Реактив для определении среды раствора
5. простейший прибор
6. Вода как класс соединений
«СПАСИБО»
Всем спасибо, кто помог,
Кто решал и отвечал,
Уравненье кто писал,
Кто пытался и не смог,
Всё равно он нам помог
А еще хочу сказать -
Нам Таблицу изучать,
И кто хочет суть познать,
Должен символы все знать!